Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Standart Klinik Tahliller Algılama Sınırı Aşağıda Viral Yükler HIV enfekte kişilerde kuvvetlendirme ve HIV-1 RNA miktarının
Bu Makalede
Özet
HIV-1 RNA düzeyi, plazma ve sıralama miktarının tek HIV-1 viral yük saptama sınırının altında (50-75 kopya / ml) bireylerin genomların zordur. Burada özü ve güvenilir bir şekilde HIV-1 RNA 0.3 kopya / ml tedbirler ve çok düşük viral yük örnekleri, tek bir genom sıralama viral genomların yükseltmek için nasıl bir gerçek zamanlı PCR kullanarak plazma viral RNA miktarını nasıl açıklar.
Özet
Viral genler yükseltme ve standart analizleri ile tespit sınırı altında (aşağıda 50-75 kopya / ml) viral yük ile HIV-1 enfekte kişilerde HIV-1 RNA miktarının belirlenmesi, hastada viral dinamikleri ve virüs konak etkileşimleri hakkında fikir edinmek için gerekli Kimdir enfeksiyon ve kombine antiretroviral tedaviye (CART) olanlar doğal olarak kontrol eder.
Burada viral genomların tek genetik dizilimini (SGS protokolü) 13, 19 ve ne kadar doğru, düşük viral yükü (tek kopya assay (SCA) protokolü) 12, 20 olan hastalarda HIV-1 RNA miktarını yükseltmek için nasıl açıklar .
Tek kopya testi duyarlılığı plazma test olmak hacmi bağlı olarak ile gerçek-zamanlı PCR testtir. , Tek bir virüs genomunun 7 ml plazma tespit edilirse, daha sonra RNA kopya sayısı 0.3 kopya / ml olarak bildirilmiştir. Testin RNA ekstraksiyon verimliliği için bir iç kontrol testleri ve olası DNA veya kirlenme amplifikasyonu için kontrol. Hasta örnekleri üç nüsha olarak ölçülür.
Tek genom sıralama assay (SGS), artık yaygın olarak kullanılan ve emek-yoğun olmayan 3, 7, 12, 14, 15 olarak kabul uç nokta cDNA ürün 96-iyi yayılmış seyreltilmiş hangi bir sınırlayıcı seyreltme testtir plakası. Poisson dağılımına göre, kuyuların en az 1 / 3 'ünden ürün vermek, bir, tek bir cDNA molekülden amplifikasyon PCR ürününün ortaya çıkan% 80 şansı vardır. SGS resampling maruz kalma ve PCR-tanıtıldı rekombinasyon 19 önyargılı olmayan klonlama üzerinde bir avantaja sahiptir. Ancak, SCA ve SGS amplifikasyon başarı astar tasarım bağlıdır. Her iki Testler, HIV-1 alt tip B için geliştirilmiş, ancak değişen astar, problar ve standartlarına göre diğer alt tiplerinin ve genomun diğer bölgeler için adapte edilebilir.
Protokol
1. Plazma büyük hacimli RNA çıkarımı
Tek bir kopya yöntemi (SCA) genel bir bakış ve tek genom sıralama (SGS) protokolü Şekil 1 ve 2 verilmiştir.
- 7 ml plazma elde etmek için, 15 dakika boyunca 2.600 xg'de fren olmadan (heparin) yaklaşık 14 ml, 15 ml EDTA toplanan kan toplama tüpleri döndürün. Pipet plazma (buffy coat tabakasının önlemek için emin olun), 15 ml tüpler içine.
- RNA tek bir kopya yöntemi (SCA), başak Rous Sarkoma Virüs iç virion kontrolü (RCAS) 30.000 kopya ile plazma ekstrakte ediliyorsa. RCAS virüsü SCA (20), daha önce açıklanan gerçekleştirmeden önce hazırlanır. Kısaca, hücre kültürü süpernatant RCAS virüs, RT aktivitesi ile sayısal RPMI doku kültür ortamı% 5 FBS ile seyreltilmiş 200 ul başına 30.000 virionlar son bir konsantrasyon, sulandırılmış ve -80 ° C tek kullanımlık alikotları saklanır. RCAS virüs dondurulmuş / tayininde kullanmadan önce çözülmüş olmamalıdır. RCAS RNA ekstraksiyon verimliliği ve PCR sayısallamasının doğruluğunu kontrol etmek için hastanın plazma içine çivili. : RCAS hakkında daha fazla bilgi için aşağıdaki bağlantıyı http://home.ncifcrf.gov/hivdrp/RCAS/ bulunabilir .
- "Pre-spin" plazma, 15 ml konik santrifüj tüpleri, 2600 15 dakika boyunca doğru RNA kantitasyonu engel olabilecek herhangi bir lipitleri ve hücresel enkaz, ayrı xg'de.
- Etiket Seton örnek numarası ve pelet tüp oluşturacak konum belirlemek için kalıcı bir kalem ile Easy-Seal santrifüj tüplerine. Ön-spin sonra, plazma pipetleme ve yüzeyde herhangi bir hücresel enkaz ve / veya lipidler kaçınarak bir Seton Easy-Seal santrifüj tüplerine plazma transfer. Plazma giriş hacmi kaydedin.
- Tris-tamponlu salin (TBS), dişli boyun altına kalan hacim Seton-Kolay Seal tüp doldurmak için. NO BUBBLES tüp veya tüp ultrasantrifüjdeki çökecek emin olun. Rotor tüpleri yerleştirirken tüpler işareti dışa karşı karşıya olduğunu emin olun.
- 170.000 xg (50.000 rpm), 4 ° C de 30 dakika süreyle Sorval 90SE ultrasantrifüjdeki önceden soğutulmuş bir Sorval T1270 rotor ve santrifüj yeniden kullanılabilir kapaklar ve yeri örnekleri ile Mühür.
- Santrifüj süpernatant kaldırmak ve viral pelet (bu görünmez) 90 ul moleküler sınıf su ve 10 ul proteinaz-K (20 mg / ml) ekledikten sonra.
- 30 dakika boyunca 55 ° C su banyosu ve inkübe yerleştirin borular. Tüpler pelet ile yan proteinaz-K ve su karışımı batırılır, böylece bir açıyla ayarlandığından emin olun.
- Inkübasyondan sonra, kısa bir süre tüp altındaki tüm sıvı toplamak için bir masa üstü santrifüj tüp spin (yaklaşık 5 saniye) ve 315 ul 6M guanidinium tiyosiyanat çözüm ve 20 mg / ml glikojen 10 ul (Not: Uygun izleyin Bu tehlikeli madde imha kılavuzları;) çamaşır suyu veya asitlerin karışımı ve ayrı bir kapta elden yoktur.
- Hafifçe Vortex ve kısa bir süre dönmeye (yaklaşık 5 saniye süreyle). Oda sıcaklığında 10 dakika inkübe edin ve sonra yeni etiketlenmiş 1,5 ml RNAse Ücretsiz santrifüj tüplerine her tüpün içeriğini aktarmak.
- 21.000 xg'de oda sıcaklığında 30 dakika 10 saniye ve santrifüj her tüp, girdap 495 ul moleküler dereceli izopropil alkol ekleyin.
- Süpernatant atın ve% 70 etanol 500 ul ekleyin.
- 21.000 xg'de oda sıcaklığında 15 dakika 10 saniye ve santrifüj Vortex. Bir transfer pipeti ile etanol çıkarın. Yeniden Spin ve bir pipet yardımıyla herhangi bir kalıntı etanol kaldırmak. Hava 10 dakika kurutun. (SGS protokolü 5 mM Tris-HCl pH: 8.0 40 ul RNA çözülür ve SGS protokol ile devam için).
- RNA tampon 55 ul pelet çözülür. 965 ul Tris-HCl (pH 8.0, 5 mM), RNA-tampon, 10 ul 100 mM DTT ve 40 U / ul Rnasin 25 ul ekleyerek elde edilir. Buz üzerine yerleştirin.
2. Tek Kopya deneyi
96-plaka, HIV ve RCAS standartlar ve kontroller de dahil olmak üzere 8 hasta numunelerinin tutar. Bu protokol tek bir plaka set-up anlatacağız.
- HIV-1 RNA ve RCAS RNA transkript RNA standart eğrileri seyreltilmiş olacağı 1 ml RNA-tampon 2 alikotları hazırlayarak başlayın. RNA tampon 1.13 altında açıklanmıştır.
- 2 ml santrifüj tüplerine buz üzerinde dilüsyonları hazırlayın. HIV-1 RNA stok (1x10 6 kopya / ul) 25 ul 54 ul RNA-tampon 3x10 5 kopya / ul veren ekleyerek RNA tampon HIV-1 RNA transkript yarım günlük dilüsyonları olun.
- Ardışık yarım günlük dilüsyonları (25 ul + 54 ul) 10 ul (Not başına 0,3 kopya yaparak devam edin: 0.3, 1, 3 dilüsyonları bu analiz sırasında standart eğri bir parçası olmayacaktır ekstrapolasyon değerler olarak kullanılır ve bilinmeyenli dur ayarlanmış olmalıdıring analizi). RCAS transkript 1x10 6 kopya / ul stoklanır. Benzer şekilde, RNA tampon RCAS transkript yarım günlük dilüsyonları hazırlamak ama aşağı 100 kopya 10 ul başına.
- Tablo 1'de yer alan cDNA sentezi için RT kokteyl hazırlayın. RT ve transferi sırasında meydana gelebilecek herhangi bir kayıp hesabı için ekstra bir miktar telafi etmek için göz önünde tutarak Tablo 1'de listelenen NRT reaksiyonlar hazırlayın. Not: NRT kokteyl, RT enzimi DNA amplifikasyon kontrol etmek için su ile değiştirilir.
Not: Bu adım yeni bir Qiagen Robot (orijinal Corbett) kurmak plaka ek olarak otomatik hale getirilmiştir. - Her bir kuyunun 20 ul RT reaksiyon karışımı ekleyerek, optik 96-plaka (Şekil 3'te görüldüğü gibi) ayarlayın. Etiketli 8 kuyu "NRT," ters transkriptaz (NRT reaksiyon karışımı) olmadan kokteyl ekleyin. Plaka kokteyller ekledikten sonra, kuyular etiketli "Hayır şablon kontrolleri (NTC)" 10 ul su ekleyin. Şekil 3'te gösterilen konsantrasyonlarda "HIV" etiketli kuyu HIV transkript 10 ul ekleyin. RCAS transkript 10 ul göre konsantrasyonlarda "RCAS" etiketli kuyu ekleyin. Plaka diyagramı "Örnek" etiketli 3 bitişik kuyularda 10 ul hasta numunesi ekleyin. Yıkandı, örnek etiketli kuyulardan 10 ul "NRT." "Iç kontrol aynı örnek 5 ul ve 5 etiketli kuyulardan su ul ekle."
- Plaka mühür ve PCR üzerinde çalıştırın: 25 ° C, 15 dakika boyunca 42 ° C de 40 dakika, 10 dakika için 85 ° C - 25 ° C de 30 dakika ve 5 ° C tutun.
- Tablo 2'ye göre hazırlayın PCR master karıştırır.
- CDNA sentezi tamamlandığında, cDNA kullanarak için belirlenmiş bir alana taşıyın. Bu alan, hem HIV ve RCAS için cDNA plakasının her bir kuyunun 20 ul PCR master karışımı ekleyin. Belirlenmiş bir alanda, bu adımı gerçekleştirmeniz olası kontaminasyonu önlemek için çok önemlidir.
- Spin plaka, optik battaniye (ABI 7700 için sadece gerekli battaniye) ile ABİ veya Roche Optik kapak ve kapak conta. Roche 480 veya ABI 7700 üzerinde çalıştırın. PCR Şartları: 95 ° C, 10 dakika sonra 45 döngüleri 95 ° C, 15 saniye boyunca 60 ° C 1 dak. Ayrı analiz RCAS ve HIV için gerekli. Sonuçlarının örnekleri Şekil 4'te gösterilmiştir. Standart eğrinin eğimi, kopya sayısı düşük transkript, normal bir Poisson dağılımı ile etkilenecektir. Standart eğri, bu düşük kopya sayısı standartları (0.3, 1 ve 3 nüsha) olarak belirlenmiştir için en doğru eğimi sağlamak amacıyla "bilinmeyenler." 17
3. Tek Genomu Sıralama
- cDNA sentezi. 10 mM dNTP 5 ul ve 96 PCR plate (Biorad) bir kuyu için 2 mM gen-spesifik primer (pol veya env) 5 ul ekleyin. Ayıklanan RNA 40 ul ekleyin. Sızdırmazlık plakası.
- 10 dakika 65 PCR RNA karışımı ° C doğasını.
- Tablo 3'te listelenen cDNA sentezi için reaktifler karıştırın. Denatüre adımdan sonra, buz üzerinde PCR plate her numune için 50 ul cDNA karışımı ekleyin.
- PCR PCR plate çalıştırın: 45 ° C 50 dakika, 85 ° C 10 dakika ve 4 ° C tutun.
- İlk PCR, 10 ul reaksiyonlar. Reaktif tepsisi ya p6-rt veya env (Tablo 3 listelenen Reaktifler, Tablo 5'te listelenen primerler) ilk turda amplifikasyonu için primerler kullanılarak PCR reaksiyon karışımı hazırlayın.
- 96 PCR plate (70 örnekleri ve 3 negatif kontroller), çok kanallı pipet kullanarak PCR karışımı 73 kuyu 8.0 ul vazgeçmek.
- CDNA sentezi tamamlandıktan sonra cDNA kullanarak için belirlenmiş bir alana PCR reaksiyon karışımı içeren cDNA ve PCR plaka taşımak. Belirlenmiş bir alanda, son hacmi 140 ul getiren her cDNA örnek Tris-HCl pH: 8.0 40 ul ekleyin. Negatif kontrollerin her biri için 70 kuyu ve su 2.0 ul her cDNA, 2.0 ul ekleyin. Seal PCR plate. PCR, Tablo 4 programı çalıştırın.
- Nested PCR 20ul reaksiyonlar. Reaktifler, reaktif tepsisi (Tablo 3'te listelenen reaktifler, Tablo 5'te listelenen primerler) PCR karıştırın.
- Çok kanallı pipet, 96 PCR plaka üzerinde 73 kuyu 18 ul nested PCR karışımı ekleyin
- Ilk PCR 01:05 sulandırınız 2 ul ilk turda PCR ve nested PCR ekleyin. Tablo 4'de belirtilen koşullar altında PCR PCR reaksiyonu, çalıştırın.
- % 1 agaroz jel üzerinde örnekleri çalıştırın. PCR ürünlerinin büyük çoğunluğu tek bir molekülün cDNA sonucu olduğundan emin olmak için, kuyuların en fazla% 30 pozitif olmalıdır. % 1 PCR plakaları içeriğini yüklemek için Beckman Coulter Biomek FM robot kullanarak süreci otomatik hale getirilmiştir, 96 kuyular E-jel (Invitrogen). E-jeller, E-baz 7 dakika çalıştırın. Tablo 5'te listelenen primerler kullanılarak Sıra ürünleri.
4. Temsilcisi sonuçları:
SCA:
Bütün kontroller, HIV-1 RNA ölçümü doğru alınabilmesi için geçmelidir. Bir negatif kontrol positive çalıştırmak mümkün kirlenme nedeniyle göz ardı edilmelidir. RNA ekstraksiyon adım sırasında kayıplar için kontrol etmek için en az% 50, plazma çivili RCAS telafi edilmelidir. Ortalama RCAS <15.000 kopya ise, örnek başarısız olur ve önemli bir miktarda RNA, çıkarma ya da protokol diğer adımları sırasında kaybolmuş olabilir, çünkü göz ardı edilmelidir. Bu muhtemelen nedeniyle yüksek lipidler plazma 6 test edilen tüm hasta numuneleri yaklaşık% 10 oluşur. Ekstraksiyonu ve cDNA sentezi ve PCR verimini kalitesini kontrol etmek için RCAS virüs kurtarma anlamına gelir. HIV olasılıkla immünoglobulin ve diğer insan proteinleri biraz farklı doku kültürü izole edilen virüs bağlı olduğundan, HIV kurtarma düzeltmek için kullanılmaz. 4057 kopya / reaksiyon karışımı, ya da yaklaşık% 95 + / -15% RCAS RNA 17 - laboratuarımızda RCAS kurtarma ortalama 25.716 + / . NRT (ters transkriptaz) kontrol DNA amplifikasyonu için test etmek için paralel olarak çalışır. NRT değeri, her üç HIV-1 RNA değerleri çıkarılır, daha sonra ortalama hesaplanır ve bu sayı sıfır (DNA amplifikasyon RNA'nın amplifikasyonu aşıyor) 'den az ise, sonuç başarısız olur ve göz ardı edilmelidir, çünkü DNA yerine RNA daha amplifikasyon riski. HIV-1 RNA, sadece 1 / 3 kuyulardan amplifiye ise yeniden test örnek amplifikasyon gerçek örnek olası bir kirletici nedeniyle test ve gerçek olduğundan emin olmak için tavsiye edilir.
Tüm kontrolleri başarılı olursa, ortalama plazma HIV-1 RNA kopya sayısı hesaplanabilir.
Örnek 1: ortalama HIV-1 kopya sayısı sıfır ise, algılama sınırı plazma hacmi test alınarak hesaplanır. Örnek olarak; 7 ml plazma test olduğunu söylüyorlar. Bu testi ile tespit edilmiştir RNA az miktarda bir ortalama ortalama 0.33 kopya veren diğer iki kuyu kuyu ve 0 kopya 1 kopya olurdu. Ortalama kopya sayısı 5.5 RNA elüsyon toplam kopya sayısı (her bir kuyunun 10 ul, ancak toplam elution hacminin 55 ul) almak için bir faktör ile çarpılır. Alt sınırı tespit: 5.5 x 0.33 kopya 7ml = 1.83 / 7 = 0.3 kopya / ml bölünmesiyle Bu örnekte plazma HIV-1 RNA konsantrasyonu <0,3 kopya / ml idi.
Örnek 2: HIV-1 RNA saptanabilir. RNA 7 ml plazma elde edildi. HIV-1 RNA başına ortalama kopya sayısı ve ortalama 2.0 adet olarak hesaplanmıştır. Daha sonra ortalama plazma ml başına kopya sayısı 5.5 x 2.0 kopya / 7 ml = 1.6, HIV-1 RNA / ml plazma.
Kopya sayıları hesaplamak için kullanılan bir şablon Excel sayfasını aşağı web sitesinden yüklenebilir.
SGS:
Negatif kontroller olumlu ise, çalıştırmak mümkün kirlenme nedeniyle göz ardı edilmelidir. Her çalışma ürün sayısı her numune viral yük ve numunenin durumuna bağlıdır. Bizim tecrübelerimize göre plazma lipidleri veya hücreleri bir çok ürün elde etme şansını azaltacaktır. Depolama koşulları ve önceki dondurma ve örnek çözülme RNA kurtarma da büyük ölçüde etkileyecektir. Genel olarak, viral yük ile 50 kopya / ml, ürün (jel bantlar) aşağıda örnekleri ile çalışırken işlenen örneklerin yaklaşık 1 / 3 -1 / 2 beklenebilir. Plaka başına 1-5 bantları, yukarıda belirtilen faktörlere bağlı bağlı olarak, bu hastalarda düşük viral yükü nedeniyle iyi bir sonuç olarak düşünülmelidir.
| cDNA sentezi (RT Kokteyl / cDNA tepki) | 1 tepki | Hayır ters transkriptaz (NRT) ve kokteyl / cDNA reaksiyon (1 reaksiyon) |
| Moleküler Biyoloji H 2 O | 8.1 ul | 8.2 ul |
| 25 mM MgCl 2 | 6 ul | 6 ul |
| 25 mM dNTP | 0.6 ul | 0.6 ul |
| 100 mM DTT | 0.2 ul | 0.2 ul |
| Rastgele hekzamer (0.1 ug / ul) | 1.5 ul | 1.5 ul |
| 10X TaqMan Tampon A | 3.0 ul | 3.0 ul |
| Rnasin (40 U / uL) | 0.5 ul | 0.5 ul |
| Strategene RT (200 U / ul) | 0.1 ul | Katmayın |
| Toplam | 20 ul | 20 ul |
| Örnek RNA | 10 ul | 10 ul |
| Toplam hacim | 30 ul | 30 ul |
Tablo 1: Reaksiyon mikstTek Kopya Testi cDNA sentezi için ures.
| PCR master miks | 1 tepki | Astarlar |
| H 2 O | 15.1 ul | HIV İleri Primer 5'-CATGTTTTCAGCATTATCAGAAGGA-3 ' |
| 10X PCR Altın Tampon | 2.0 ul | HIV Ters Primer 5'-TGCTTGATGTCCCCCCACT 3 ' |
| 25 mM MgCl 2 | 2.0 ul | HIV Probe5'FAM-CCACCCCACAAGATTTAAACACCATGCTAA-TAMRA 3 ' |
| * İleri Astar (100 um) | 0.3 ul | |
| * Ters Astar (100 um) | 0.3 ul | İleri RCAS Primer5'-GTCAATAGAGAGAGGGATGGACAAA-3 ' |
| * Probe (100 um) | 0.05 ul | RCAS Primer5'-TCCACAAGTGTAGCAGAGCCC-3 'değiştir |
| TaqGold (5 U / ul) | 0.25 ul | RCAS Probe 5'FAM-TGGGTCGGGTGGTCGTGCC-TAMRA 3 ' |
| Toplam | 20.0 ul |
Tablo 2. PCR master miks ve Tek Kopya Testi için primerler.
| cDNA kokteyl / cDNA reaksiyonlar | 1 RNA örnek | İlk PCR kokteyl | 1 tabak (75 reaksiyonlar) | Nested PCR kokteyl | 1 tabak (75 reaksiyonlar) |
| 10X RT Tampon (Invitrogen) | 10 ul | 10X PCR buffer (Invitrogen) | 75 ul | 10X PCR buffer | 150 ul |
| 25 mM MgCl 2 | 20 ul | 50 mM MgSO 4 | 30 ul | 50 mM MgSO 4 | 60 ul |
| 0.1M DTT | 1 ul | 10 mM dNTP | 15 ul | 10 mM dNTP | 30 ul |
| RNaz-bedava su | 17.5 ul | 50 UM primerler (adet) | 3 ul | 50 UM primerler (adet) | 6 ul |
| Rnase-Out (Invitrogen) | 1 ul | Platinum Taq Hi-Fi Enzim (Invitrogen) | 6 ul | Platinum Taq Hi-Fi Enzim (Invitrogen) | 12 ul |
| Üstsimge III (200 U / ul) (Invitrogen) | 0.5 ul | Molekül sınıf su | 468 ul | Molekül sınıf su | 1086 ul |
Tablo 1 cDNA ve Tek Genomu Sıralama için PCR karışımlar.
| 1 P6-RT PCR programı | Env 1 PCR programı |
| 1. 2 dakika 94 ° C | 1. 2 dakika 94 ° C |
| 2. 30 saniye boyunca 94 ° C | 30 saniye için 2 0,94 ° C |
| 30 saniye için 2 0,94 ° C | 3. 30 saniye boyunca 52 ° C |
| 4. 72 ° C 1 dakika 30 saniye | 4. 1 dakika boyunca 72 ° C |
| 5. 44 döngüleri, # 2 Mesajı göster | 5. 44 döngüleri, # 2 Mesajı göster |
| 6. 72 ° C, 3 dakika boyunca | 6. 72 ° C, 3 dakika boyunca |
| 7. 4 ° C tutun | 7. 4 ° C tutun |
| 2 P6-RT PCR programı | Env 2 PCR programı |
| 1. 2 dakika süreyle 94 ° C | 1. 2 dakika süreyle 94 ° C |
| 2. 30 saniye boyunca 94 ° C | 2. 30 saniye boyunca 94 ° C |
| 3. 30 saniye boyunca 55 ° C | 3. 30 saniye boyunca 56 ° C |
| 4. 1 dakika boyunca 72 ° C | 4. 72 ° C, 45 saniye |
| 5. # 1, 40 (toplam 41 döngüleri) | 5. # 1, 40 (toplam 41 döngüleri) |
| 6. 72 ° C, 3 dakika boyunca | 6. 72 ° C, 3 dakika boyunca |
| 7. 4 ° C tutun | 7. 4 ° C tutun |
Tek Genomu Sıralama Testi Tablo 4 PCR koşulları.
| Tepki | Astar boya | Dizi |
| P6-RT cDNA | 3500 - | 5 'CTATTAAGTATTTTGATGGGTCATAA 3' |
| cDNA env | E115- | 5'AGAAAAATTCCCCTCCACAATTAA 3 ' |
| P6-RT 1. PCR | 3500 - | 5 'CTATTAAGTATTTTGATGGGTCATAA 3' |
| P6-RT 1. PCR | 1849 + | 5 'GATGACAGCATGTCAGGGAG 3' |
| P6-RT2.PCR | 1870 + | 5 'GAGTTTTGGCTGAGGCAATGAG 3' |
| P6-RT 2.PCR | 3410 - | 5 'CAGTTAGTGGTATTACTTCTGTTAGTGCTT 3' |
| env 1. PCR | E115- | 5'AGAAAAATTCCCCTCCACAATTAA 3 ' |
| env 1. PCR | E20 + | 5'GGGCCACACATGCCTGTGTACCCACAG 3 ' |
| env 2. PCR | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3 ' |
| env 2. PCR | E125- | 5'CAATTTCTGGGTCCCCTCCTGAGG 3 ' |
| P6-RT sıralama | 2030 + | 5'TGTTGGAAATGTGGAAAGGAAGGAC 3 ' |
| P6-RT sıralama | 2600 + | 5'ATGGCCCAAAAGTTAAACAATGGC3 ' |
| P6-RT sıralama | 2610 - | 5'TTCTTCTGTCAATGGCCATTGTTTAAC3 ' |
| P6-RT sıralama | 3330 - | 5'TTGCCCAATTCAATTTTCCCACTAA 3 ' |
| env sıralama | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3 ' |
| env sıralama | E125- | 5'CAATTTCTGGGTCCCCTCCTGAGG 3 ' |
Tek Genomu Sıralama Testi Tablo 5 Astarlar.
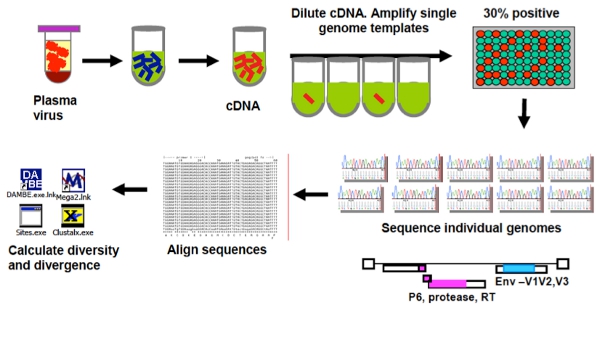
Şekil 1 Singe Genomu Sıralama Assay (SGS) genel bakış.
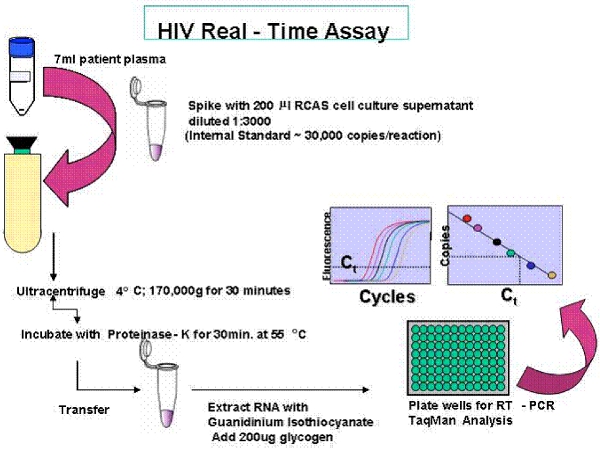
Şekil 2. Tek Kopya Assay (SCA) genel bakış.
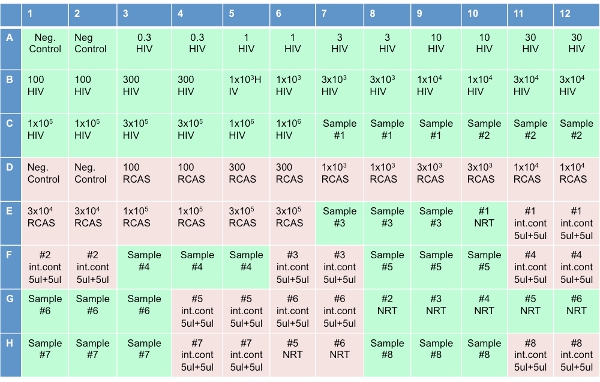
Şekil 3: Tek Kopya Testi için set-up Plate .
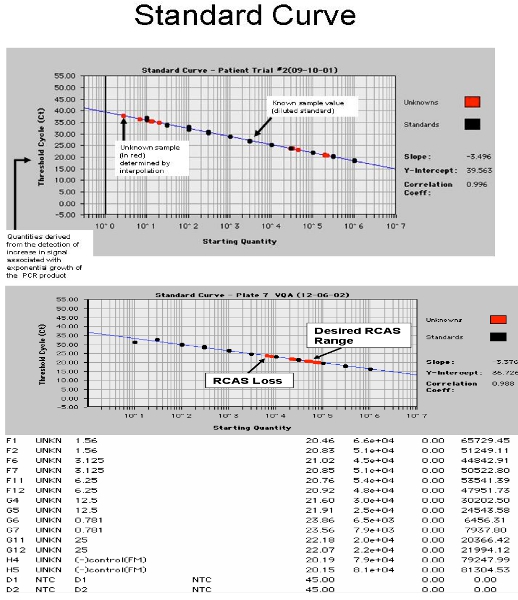
Şekil 4 ABİ 7700 vuruldu Ekran. A. RCAS çivili hasta örnekleri ile standart eğri gösteren hasta numunelerinin ve B, HIV-1 RNA standart eğri gösteriyor.
Tartışmalar
HIV-1 enfekte doğal enfeksiyon kontrol, kombine antiretroviral tedavi bireyler (CART) ya da çok düşük viral yük, plazma 4, 11, 12, 17, 18 ml başına tipik olarak yaklaşık 1 kopyalama var. Doğal kontrolü olan hastalarda viral yük, çoğu zaman ayrı bir set noktası 1, 2, 17 etrafında dalgalanma. Testlerin duyarlılığı burada plazma giriş hacmi son derece bağımlı nitelendirdi. Genellikle, 7 ml plazma ile çalışıyoruz, ancak olumlu sonuçlar, hem de gerçek plazma viral yük ba...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar pek çok çalışmada HIV-1 katılan hastaların kabul etmek istiyoruz.
JMC FM Kirby Vakfı desteği ile Amerikan Kanser Derneği, Araştırma Profesörü oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Rasgele hekzamer (500 ug / ml) | Promega | C118A | |
| Taqman tampon A | Applied Biosystems | 4304441 | |
| RNAsin (40 U / ul) | Promega | N211B | |
| RT enzim (200 U / ul) | Strategene | 600107-51 | |
| AmpliTaq Gold DNA Polimeraz | Applied Biosystems | 4311814 | 6-pack |
| AmpliTaq 10XGold PCR tampon II | Applied Biosystems | 4311814 | enzim ile geliyor |
| Magnesiumcloride 25 mm | Applied Biosystems | 4311814 | enzim ile geliyor |
| 1M Tris-HCl tamponu, pH 8.0, 5 mM | Invitrogen | AM9855G | |
| Üstsimge III ters transkriptaz enzim, 200 U / ul | Invitrogen | 18080-044 | |
| Üstsimge III 10X buffer | Invitrogen | enzim ile geliyor | |
| DTT 100 mm | Invitrogen | enzim ile geliyor | |
| Platinum Taq DNA polimeraz High Fidelity 5 U / ul | Invitrogen | 11304-102 | |
| 10X High Fidelity PCR Buffer | Invitrogen | 11304-102 | enzim ile geliyor |
| Proteinaz-K 20 mg / ml | Ambion | 2546 | |
| Guanidinium Tiyosiyanat çözüm 6M | FlukaBiochemica | 50983 | |
| Glikojen 20 mg / ml | Roche | 10901393001 | |
| Isopropanol | Sigma-Aldrich | 19516 | |
| Etanol 70% | Sigma-Aldrich | E702-3 | |
| Moleküler sınıf su | Gibco / Invitrogen | 10977-015 | |
| dNTP (her biri 25 mg) | BioLine | BIO-39.025 |
| Euipment, Adı | Şirket | Katalog numarası | Yorumlar |
| Kolay Seal Santrifüj Tüpleri (16x73mm) | Seaton Bilimsel | 6041 | |
| Beyaz Kemik kron | Seaton Bilimsel | 4020 | Kolay Mühür Tüpler için Kapaklar |
| Optiseal Bell-Top Tüpler Tüp Rack, 8,9 ml | Beckman | 361642 | |
| Hex sürücü ½ inc açılış | Seaton Bilimsel | 4013 | |
| Kapak kaldırma tüpü | Seaton Bilimsel | 4014 | |
| 5 ml serolojik pipetler | Costar | 4051 | |
| Pipetboy | herhangi | ||
| 15 ml Transferi pipetler | ISC Bioexpress | P-5005-7 | |
| 5.8 ml Dispossable transferi pipetler, ince uçlu | VWR | 14670-329 | |
| 15 ml santrifüj tüplerine | Şahin | ||
| 1 ml santrifüj tüplerine | herhangi | ||
| Tris tampon Tuzlu tablet | Sigma-Aldrich | T5030-100TAB | |
| Ultrasantrifüjdeki ve rotor | Sorval | 90SE ve T-1270 | |
| 96-PCR plakaları | Biorad | HSS-9601 | |
| 50 ml Reaktif rezervuar | Costar | 4870 | |
| Microamp optik 96-iyi reaksiyon plaka | Applied Biosystems | N801-0560 | |
| Optik plaka kapsar | Applied Biosystems | 4333183 | |
| MicroAmp Optik Sıkıştırma Pad | Applied Biosystems | 4312639 | |
| MicrosealBir film | Biorad | MSA-5001 | |
| 2 ml santrifüj tüplerine | Herhangi | ||
| % 1 agaroz jel (E-jel, Invitrogen) | Invitrogen | G-7008-01 | |
| E-baz (Invitrogen) | Invitrogen | EB-M03 |
EDTA Koleksiyonu tüpler herhangi bir marka
Referanslar
- Amara, R. R., Villinger, F., Altman, J. D., Lydy, S. L., O'Neil, S. P., Staprans, S. I., Montefiori, D. C., Xu, Y., Herndon, J. G., Wyatt, L. S. Control of a mucosal challenge and prevention of AIDS by a multiprotein DNA/MVA vaccine. Vaccine. 20, 1949-1955 (2002).
- Dinoso, J., Kim, S., Blankson, J., Siliciano, R. F. Viral Dynamics of Elite Suppressors in HIV-1 Infection. Conference on Retroviruses and Opportunistic Infections. , (2008).
- Dinoso, J. B., Kim, S. Y., Wiegand, A. M., Palmer, S. E., Gange, S. J., Cranmer, L., O'Shea, A., Callender, M., Spivak, A., Brennan, T., Kearney, . Treatment intensification does not reduce residual HIV-1 viremia in patients on highly active antiretroviral therapy. Proc. Natl. Acad. Sci. U.S.A. 106, 9403-9408 (2009).
- Doria-Rose, N. A., Klein, R. M., Manion, M. M., O'Dell, S., Phogat, A., Chakrabarti, B., Hallahan, C. W., Migueles, S. A., Wrammert, J., Ahmed, R., Nason, M., Wyatt, R. T., Mascola, J. R., Connors, M. Frequency and phenotype of human immunodeficiency virus envelope-specific B cells from patients with broadly cross-neutralizing antibodies. J. Virol. 83, 188-199 (2009).
- Dornadula, G., Zhang, H., Uitert, B. V. a. n., Stern, J., Livornese, L., Ingerman, M. J., Witek, J., Kedanis, R. J., Natkin, J., DeSimone, J., Pomerantz, R. J. Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy. JAMA. 282, 1627-1632 (1999).
- Gandhi, R. T., Zheng, L., Bosch, R. J., Chan, E. S., Margolis, D. M., Read, S., Kallungal, B., Palmer, S., Medvik, K., Lederman, M. M., Alatrakchi, N., Jacobson, J. M., Wiegand, A., Kearney, M., Coffin, J. M., Mellors, J. W., Eron, J. J. The effect of raltegravir intensification on low-level residual viremia in HIV-infected patients on antiretroviral therapy: a randomized controlled trial. PLoS medicine. 7, (2010).
- Gay, C., Dibben, O., Anderson, J. A., Stacey, A., Mayo, A. J., Norris, P. J., Kuruc, J. D., Salazar-Gonzalez, J. F., Li, H., Keele, B. F., Hicks, C., Margolis, D., Ferrari, G., Haynes, B., Swanstrom, R. Cross-sectional detection of acute HIV infection: timing of transmission, inflammation and antiretroviral therapy. PLoS One. 6, 19617-19617 (2011).
- Hatano, H., Delwart, E. L., Norris, P. J., Lee, T. H., Dunn-Williams, J., Hunt, P. W., Hoh, R., Stramer, S. L., Linnen, J. M., McCune, J. M., Martin, J. N., Busch, M. P., Deeks, S. G. Evidence for persistent low-level viremia in individuals who control human immunodeficiency virus in the absence of antiretroviral therapy. J. Virol. 83, 329-335 (2009).
- Havlir, D. V., Bassett, R., Levitan, D., Gilbert, P., Tebas, P., Collier, A. C., Hirsch, M. S., Ignacio, C., Condra, J., Gunthard, H. F., Richman, D. D., Wong, J. K. Prevalence and predictive value of intermittent viremia with combination hiv therapy. JAMA. 286, 171-179 (2001).
- Jordan, M. R., Kearney, M., Palmer, S., Shao, W., Maldarelli, F., Coakley, E. P., Chappey, C., Wanke, C., Coffin, J. M. Comparison of standard PCR/cloning to single genome sequencing for analysis of HIV-1 populations. J Virol Methods. 168, 114-120 (2010).
- Kaufmann, D. E., Kavanagh, D. G., Pereyra, F., Zaunders, J. J., Mackey, E. W., Miura, T., Palmer, S., Brockman, M., Rathod, A., Piechocka-Trocha, A., Baker, B., Zhu, B., Gall, S. L. e., Waring, M. T., Ahern, R., Moss, K., Kelleher, A. D. Upregulation of CTLA-4 by HIV-specific CD4+ T cells correlates with disease progression and defines a reversible immune dysfunction. Nat Immunol. 8, 1246-1254 (2007).
- Kearney, M., Maldarelli, F., Shao, W., Margolick, J. B., Daar, E. S., Mellors, J. W., Rao, V., Coffin, J. M., Palmer, S. HIV-1 Population Genetics and Adaptation in Newly Infected Individuals. J. Virol. 83, 2715-2727 (2008).
- Kearney, M., Palmer, S., Maldarelli, F., Shao, W., Polis, M. A., Mican, J., Rock-Kress, D., Margolick, J. B., Coffin, J. M., Mellors, J. W. Frequent polymorphism at drug resistance sites in HIV-1 protease and reverse transcriptase. AIDS. 22, 497-501 (2008).
- Kearney, M., Spindler, J., Shao, W., Maldarelli, F., Palmer, S., Hu, S. L., Lifson, J. D., Kewal Ramani, V. N., Mellors, J. W., Coffin, J. M., Ambrose, Z. Genetic diversity of simian immunodeficiency virus encoding HIV-1 reverse transcriptase persists in macaques despite antiretroviral therapy. Journal of Virology. 85, 1067-1076 (2011).
- Keele, B. F., Giorgi, E. E., Salazar-Gonzalez, J. F., Decker, J. M., Pham, K. T., Salazar, M. G., Sun, C., Grayson, T., Wang, S., Li, H., Wei, X., Jiang, C., Kirchherr, J. L., Gao, F., Anderson, J. A., Ping, L. H., Swanstrom, R. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection. Proc. Natl. Acad. Sci. U.S.A. , 105-7552 (2008).
- Liu, S. L., Rodrigo, A. G., Shankarappa, R. G., Learn, H., Hsu, L., Davidov, O., Zhao, L. P., Mullins, J. I. HIV quasispecies and resampling. Science. 273, 415-416 (1996).
- Mahalanabis, M., Jayaraman, P., Miura, T., Pereyra, F., Chester, E. M., Richardson, B., Walker, B., Haigwood, N. L. Continuous viral escape and selection by autologous neutralizing antibodies in drug-naive human immunodeficiency virus controllers. J. Virol. 83, 662-672 (2009).
- Migueles, S. A., Connors, M. The Role of CD4(+) and CD8(+) T Cells in Controlling HIV Infection. Curr. Infect. Dis. Rep. 4, 461-467 (2002).
- Palmer, S., Kearney, M., Maldarelli, F., Halvas, E. K., Bixby, C. J., Bazmi, H., Rock, D., Falloon, J., Davey, R. T., Dewar, R. L., Metcalf, J. A., Hammer, S., Mellors, J. W., Coffin, J. M. Multiple, linked human immunodeficiency virus type 1 drug resistance mutations in treatment-experienced patients are missed by standard genotype analysis. J. Clin. Microbiol. 43, 406-413 (2005).
- Palmer, S., Wiegand, A. P., Maldarelli, F., Bazmi, H., Mican, J. M., Polis, M., Dewar, R. L., Planta, A., Liu, S., Metcalf, J. A., Mellors, J. W., Coffin, J. M. New real-time reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma. J. Clin. Microbiol. 41, 4531-4536 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır