このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
標準的な臨床アッセイによる検出限界以下のウイルス量とHIV感染個体におけるHIV - 1 RNAを増幅して定量化
要約
検出限界(50〜75コピー/ ml)以下のウイルス量の個体から血漿とクエンシングにおけるHIV - 1 RNAのレベルを定量シングルHIV - 1ゲノムは困難です。ここでは、確実に0.3コピー/ mLにHIV - 1 RNAを測定すると非常に低いウイルス量の試料から、単一のゲノムの配列決定によってウイルスゲノムを増幅する方法を、リアルタイムPCRアッセイを用いて血漿中ウイルスRNAを抽出し、定量化する方法について説明します。
要約
ウイルス遺伝子を増幅し、標準的なアッセイによる検出の限界(下の50〜75コピー/ ml)以下のウイルス量とHIV - 1感染個体においてHIV - 1 RNAを定量する患者でウイルスの動態とウイルスの宿主の相互作用への洞察を得るために必要がある人自然に感染し、抗レトロウイルス併用療法(CART)にある人々を制御する。
ここでは、単一のゲノムシークエンシング(SGSプロトコル)13、19とどのように正確に、低ウイルス量(シングルコピーアッセイ(SCA)プロトコル)12、20の患者でHIV - 1 RNAを定量化することによりウイルスゲノムを増幅する方法について説明します。
シングルコピーのアッセイは、アッセイされる血漿の量に応じて感度のリアルタイムPCRアッセイである。単一のウイルスのゲノムはプラズマ7mlに検出された場合、その後のRNAコピー数が0.3コピー/ mLと報告されている。アッセイは、RNAの抽出、およびDNAや汚染から可能な限り増幅するためのコントロールの効率化のための内部統制のテストを持っています。患者試料は三連で測定されます。
単一ゲノムシークエンシングアッセイ(SGS)、現在広く使用されていると、非労働集約的な3、7、12、14、15とみなさは、エンドポイントは、cDNA産物を96ウェルに分散している希釈した、限界希釈アッセイです。プレート。ポアソン分布によると、井戸の1 / 3以下の生成物を得たときに、単一のcDNA分子から増幅のPCR産物という結果の80%のチャンスがある。 SGSは、リサンプリングにさらされていないとPCR -導入組換え19によってバイアスされていないのクローニング利点があります。しかし、SCAおよびSGSの増幅の成功は、プライマーの設計に依存する。両方のアッセイはHIV - 1サブタイプBのために開発されましたが、変更のプライマー、プローブ、および基準で他の亜型とゲノムの他の地域に適合させることができる。
プロトコル
1。プラズマの大ボリュームからRNAの抽出
シングルコピーアッセイ(SCA)と、単一のゲノムシークエンシング(SGS)プロトコルの概要を図1及び図2に提供されています。
- プラズマ7mlのを取得するには、ブレーキなしで15分間2600 × gで(ヘパリンではない)コレクションチューブを15ミリリットルEDTAで採血した血液の約14 mlをスピン。ピペットプラズマ(バフィーコート層を避けるために確認してください)15 mlチューブに。
- RNAは、単一コピーのアッセイ(SCA)、スパイクラウス肉腫ウイルス内部ビリオンの制御(RCAS)の3万部を持つプラズマのために抽出されている場合。 RCASウイルスは前述したように(20)SCAの実行前に用意されています。簡単に言えば、細胞培養上清からRCASウイルスは、RT活性により定量化5%FBSを含むRPMIの組織培養培地で希釈した200μlの3万ビリオンの最終濃度に希釈し、-80℃でシングルユースのアリコートに格納されています。 RCASウイルスは、アッセイで使用する前に凍結/解凍してはいけません。 RCASはRNA抽出の効率化のためにとPCR定量の精度を制御するために、患者血漿に添加される。 :RCASの詳細については、次のリンクで見つけることができますhttp://home.ncifcrf.gov/hivdrp/RCAS/ 。
- "プレスピン"血漿、15mlコニカル遠心チューブに、正確なRNAの定量を妨害することができる任意の脂質や細胞の破片を、分離するために15分間2600 × gで。
- サンプル番号とペレットがチューブから形成される場所を識別するための恒久的なマーカーとラベルシートンやすいシールの遠心管。事前にスピンした後、プラズマをピペッティングし、表面に任意の細胞残渣および/または脂質を避けることで、シートンやすいシールの遠心管にプラズマを転送する。プラズマの入力の音量を記録。
- スレッド首の底にシートン - 簡単なシールチューブの残りの量を埋めるためにトリス緩衝生理食塩水(TBS)を追加します。泡がチューブ内に存在していないか、チューブが超遠心機に崩壊することを確認してください。ローターにチューブを配置する際にチューブ上にマークが外側に向いていることを確認してください。
- 4で17万XG(50,000 rpm)で℃で30分間でSorval 90SE超遠心機で予冷Sorval T1270ローターと遠心機で再利用可能なキャップと場所のサンプルをシール。
- 遠心分離後上清を除去し、ウイルスのペレット(これは表示されません)を90 ulの分子グレードの水と10μlのプロテイナーゼK(20 mg / mL)を加える。
- 30分間55℃の水浴とインキュベートの場所チューブ。管はペレットとサイドがプロテイナーゼKと水混合物に浸漬されるように角度が設定されていることを確認します。
- インキュベーション後、すぐにチューブの底(約5秒)で、すべての液体を回収し、6Mグアニジンチオシアネート液315 ulと20 mg / mlのグリコーゲン(注 10 ULを追加するには、テーブルトップ遠心機でチューブをスピン:適切なフォローこの有害物質の廃棄のガイドライン、漂白剤や酸と混合し、別の容器に廃棄しないでください)。
- 軽くボルテックスし、(約5秒間)すぐにスピン。室温で10分間インキュベートしてから、新たにラベルの付いた1.5ミリリットルRNaseフリー遠心管に各チューブの内容を転送します。
- 各チューブに分子グレードイソプロピルアルコールの495 UL、室温で30分間21,000 xgで10秒、遠心するためのボルテックスを追加。
- 上清を捨て、70%エタノール500 ulを加える。
- 室温で15分間21,000 xgで10秒、遠心するための渦。トランスファーピペットでエタノールを除去します。再びスピンとピペットで任意の残留エタノールを除去します。 10分間空気乾燥した。 (SGSのプロトコルは、5mMのトリス- HCl pH 8.0に40 ulの中のRNAを溶解し、SGSプロトコルを続けるために)。
- RNA -バッファの55 ULでペレットを溶解する。 RNA -バッファは、965 ulのトリス - 塩酸(pH8.0、5mMの)に100mMのDTT10μlの、40 U / UL Rnasin 25 ulを加えることによって得られる。氷の上に置きます。
2。シングルコピーアッセイ
96ウェルプレートは、HIVとRCASの基準とコントロールの両方を含む8患者検体を保持しています。このプロトコルは、単板のセットアップを説明します。
- HIV - 1 RNAとRCASのRNA転写産物がRNAの標準曲線のために希釈されるには1ミリリットルRNA -緩衝液2アリコートを準備します。 RNA -バッファは1.13で説明されています。
- 2 mlの遠心管に氷の上に希釈液を調製する。 3 × 10 5コピー/ ulを与える54 UL RNA -バッファへのHIV - 1 RNA株(1 × 10 6コピー/ UL)25 ulを追加することにより、RNA - bufferのHIV - 1 RNA転写物のハーフログの希釈を行う。
- 0.3、1、3希釈これらのための分析中に検量線の一部とならないように外挿の値として使用されています:10 UL(注当たり0.3枚に連続したハーフログの希釈液(25 UL + 54 UL)をダウンすることによって継続するとは、未知数DURに設定する必要がありますINGの分析)。 RCASの転写産物は1 × 10 6コピー/ ULで貯蔵される。同様に、しかしダウン10μlを100枚にRNA -バッファにRCAS転写産物のハーフログの希釈液を調製する。
- 表1に示すように、cDNA合成のためのRTのカクテルを準備します。として転送中に発生する可能性のある損失を考慮するために少し余分を補うために心に留めながら、表1に記載されているRTとNRT反応を準備します。注:NRTのカクテルのために、RTの酵素は、DNAからの増幅のために制御するために水で置き換えられます。
注:この手順は、最近キアゲンロボット(もともとコルベット)に設定するプレートに加えて自動化されている。 - 各ウェルにRT反応液の20μlのを追加することで、光学96ウェルプレートを設定する(図3に示すように)。ラベルの付いた8ウェルで"NRT、"逆転写酵素(NRT反応混合物)なしでカクテルを追加してください。プレートにカクテルを追加した後、"いいえテンプレートのコントロール(NTC)"と表記さ井戸に水を10 ulを追加。図3に示す濃度の"HIV"というラベルの付いた井戸にHIVの転写産物10μlのを追加。よる濃度の"RCAS"というラベルのウェルにRCAS転写産物10μlのを追加。プレートの図の"サンプル"というラベルの隣接する3つの井戸の患者サンプル10μlのを追加。というラベルのウェルに溶出したサンプル10μlのを追加"NRT。"同じサンプルを5 ulとラベルの付いた井戸へ水5μlの追加"内部統制を。"
- プレートをシールしてからサーマルサイクラー上で動作:25℃で15分間、42℃40分、85は10分間℃、25℃で30分間、および5℃保持のためのC。
- PCRマスターは、表2によるとミックスの準備。
- cDNA合成が完了すると、cDNAを使用するために、指定されたエリアに移動する。この指定されたエリアでは、HIVとRCASの両方のcDNAをプレートの各ウェルにPCRマスターミックスの20μlのを追加。すべての可能な汚染を避けるために、指定されたエリアにこの手順を実行することが重要です。
- スピンプレート、光学毛布(ABI 7700用のみに必要な毛布)とABIまたはロシュ光学カバー及びカバー付きシール。ロシュ480またはABI 7700で実行。 PCR条件:95℃で10分間、次に95の45サイクルで15秒、60℃で1分間。別々の分析は、RCASとHIVのために必要です。成果の例を図4に示されています。検量線の傾きは、低コピー数の転写物の通常のポアソン分布の影響を受けます。標準曲線のための最も正確なスロープを確保するために、これらの低コピー数の基準(0.3、1、3部)は次のように設定されている"未知数。"17
3。単一のゲノムシーケンシング
- cDNA合成。 10 mMのdNTPおよび96ウェルPCRプレート(バイオラッド)で十分に2mMの遺伝子特異的プライマー(POLまたは env)の5μlの5μlのを追加。抽出したRNAを40 ulを追加します。シールプレート。
- 65℃サーモサイクラーでのRNA -混合物を変性℃で10分間。
- 表3に記載のcDNA合成用の試薬を混ぜる。変性ステップの後、氷上でPCRプレートを配置し、各サンプルにcDNA混合物の50μlのを追加。
- サーモサイクラー上でPCRプレートを実行します:45度50分、85℃で10分間、4℃で保持するためのCのCを。
- 最初のPCRは、10 ulの反応。 P6 - RTまたは env(表3に示されている試薬、表5に示されているプライマー)の最初のラウンド増幅用プライマーのいずれかを使用して、試薬トレイのPCR反応液を調製する。
- マルチチャンネルピペットを使用すると、96ウェルPCRプレート(70検体と3ネガティブコントロール)上の73ウェルにPCR混合物の8.0 ULを分注する。
- cDNA合成が完了した後、cDNAを使用するための指定領域にPCR反応ミックスを含むcDNAとPCRプレートを移動する。指定されたエリアでは、140 ulのために最終的なボリュームをもたらす各cDNAサンプルにトリス- HCl pH 8.0に40 ulを追加。陰性コントロールのそれぞれに70の井戸の水の2.0 ULの各cDNAの2.0 ULを追加。 PCRプレートをシール。 、サーモサイクラーの表4でプログラムを実行します。
- ネステッドPCR - 20ul反応。試薬トレイ(表3に示されている試薬は、表5に示されているプライマー)でネストされたPCR用試薬を混ぜる。
- マルチチャンネルピペットで、96ウェルPCRプレート上の73ウェルにネストされたPCR混合物18 ulを追加する
- 最初のPCR 1:5に希釈し、nested PCR法に最初のラウンドのPCRの2 ulのを追加。表4に示す条件の下で、サーモサイクラー上でPCR反応を実行します。
- 1%アガロースゲル上でサンプルを実行します。 PCR産物の大部分は、cDNAの単分子の結果であることを保証するために、井戸の30%を超えないは正でなければなりません。プロセスは、1%、96ウェルE -ゲル(Invitrogen社)にPCRプレートの内容をロードするベックマンコールター社分注FMロボットを使用して自動化されています。 E -ゲルは、E -ベースで7分間実行されています。表5に示されているプライマーを用いてシーケンスの製品。
4。代表的な結果:
SCA:
すべてのコントロールは、HIV - 1 RNAの測定は、正しい方法を考えるために渡す必要があります。ネガティブコントロールはpositiである場合VE、実行があるため可能な限り汚染の無視してください。抽出工程中にRNAの損失を制御するために、血漿中に添加したRCASの少なくとも50%を回収する必要があります。平均RCASは<15,000枚の場合、サンプルは失敗し、RNAのかなりの量の抽出やプロトコルの他のステップの間に失われてしまっているので、無視してください。これはおそらくによるプラズマ6の高脂質に試験したすべての患者検体の約10%で発生します。 RCASウイルスの回収を抽出し、cDNA合成とPCR増幅の効率の品質を制御するためのものです。それは、HIVの可能性が高い免疫グロブリンおよび組織培養から分離されたウイルスから、それがわずかに異なること、他のヒトタンパク質にバインドされているので、HIV回復のために修正するために使用されていません。私たちの研究室におけるRCASの回復平均25716で+ /いた- RCAS RNAの4057コピー/反応混合物、または約95%+ / -15%は17を追加しました。 NRT(ない逆転写酵素)の制御は、DNAからの増幅をテストするために、並列に実行されます。 NRTの値は、3つのHIV - 1 RNAのそれぞれの値から減算され、その後、平均値が計算され、この数値がゼロ(DNAの増幅は、RNAの増幅を超える)より小さい場合、結果は失敗し、無視する必要がありますので、むしろRNAよりDNAから増幅のリスク。 RNAはわずか1 / 3ウェルから増幅されているHIV - 1の場合、再テストのサンプルは、実際のサンプルをアッセイし、可能な汚染物質によるものではないされているために増幅が真であることを確認することをお勧めします。
すべてのコントロールが渡すと、血漿中の平均HIV - 1 RNAのコピー数を計算することができます。
例1:平均的なHIV - 1のコピー数がゼロの場合、検出限界は血漿の量をアッセイに基づいて計算されます。例として、のは、血漿の7 mlを分析したとしましょう。このアッセイで検出されている可能性RNAの最小量は、ウェルあたり0.33枚の平均値を与えられる2つの他の井戸の井戸と0コピーのいずれかのコピー1部になっていたはずだ。平均コピー数は、RNA溶出の総コピー数(そこに各ウェルに10μLのですが、全体の溶出量は55 ULあった)に到達するために5.5の係数で乗算する必要があります。検出の下限は、次のようになります:5.5 7ミリリットル= 1.83 / 7 = 0.3コピー/ mlで割った値× 0.33コピー。この例では血漿中のHIV - 1 RNAの濃度は<0.3のコピー/ mlであった。
例2:HIV - 1 RNAは検出可能です。 RNAは、血漿の7 mlから抽出した。 HIV - 1 RNA当たりの平均コピー数は井戸毎秒2.0枚と計算されます。その後、プラズマのmlあたりの平均コピー数は、プラズマの5.5 × 2.0コピー/ 7ミリリットル= 1.6 HIV - 1 RNA / mlである。
コピー数を計算するために使用されるテンプレートのExcelシートはダウンのWebサイトからロードすることができます。
SGS:
ネガティブコントロールのいずれかが正の場合、実行が可能な汚染のために無視されるべきである。それぞれのランからの製品の数は、各サンプル中のウイルス量と試料の状態に依存します。我々の経験では、血漿中の脂質や細胞の多くは、製品を入手する可能性が低くなります。保管条件やサンプルの凍結前および解凍も大幅にRNAの回収に影響を与えます。一般的には、50コピー/ mL以下のウイルス量の試料を扱う場合、製品(ゲル上のバンド)が処理されたサンプルの-1 / 2 1 / 3程度で予想される。上記の要因に応じて、プレートあたりの1から5までのバンドは、これらの患者における低ウイルス量のために良好な結果を考慮する必要があります。
| cDNA合成(RTのカクテル/ cDNA反応) | 1反応 | いいえ、逆転写酵素なし(NRT)カクテル/ cDNA反応(1反応) |
| 分子グレードH 2 O | 8.1 UL | 8.2 UL |
| 25 mMのMgCl 2の | 6 UL | 6 UL |
| 25 mMのdNTPsを | 0.6 UL | 0.6 UL |
| 100mMのDTT | 0.2 UL | 0.2 UL |
| ランダムヘキサマー(0.1 UG / UL) | 1.5 UL | 1.5 UL |
| 10XのTaqManバッファ | 3.0 UL | 3.0 UL |
| Rnasin(40 U / UL) | 0.5 UL | 0.5 UL |
| Strategene RT(200 U / UL) | 0.1 UL | 追加しないでください |
| 合計 | 20μlの | 20μlの |
| サンプルRNA | 10μlを | 10μlを |
| 合計ボリューム | 30 UL | 30 UL |
表1。反応mixtシングルコピーアッセイにおけるcDNA合成のためのURES。
| PCRマスターミックス | 1反応 | プライマー |
| H 2 O | 15.1 UL | HIVフォワードプライマー5' - CATGTTTTCAGCATTATCAGAAGGA - 3' |
| 10X PCRゴールドバッファ | 2.0 UL | HIV逆方向プライマー5' - TGCTTGATGTCCCCCCACT - 3' |
| 25 mMのMgCl 2の | 2.0 UL | HIV Probe5'FAM - CCACCCCACAAGATTTAAACACCATGCTAA - TAMRA 3' |
| *フォワードプライマー(100 UM) | 0.3 UL | |
| *逆方向プライマー(100 UM) | 0.3 UL | フォワードRCAS Primer5' - GTCAATAGAGAGAGGGATGGACAAA - 3' |
| *プローブ(100 UM) | UL 0.05 | RCASはPrimer5' - TCCACAAGTGTAGCAGAGCCC - 3'リバース |
| TaqGold(5 U / UL) | UL 0.25 | RCASプローブ5'FAM - TGGGTCGGGTGGTCGTGCC - TAMRA 3' |
| 合計 | 20.0 UL |
シングルコピーのアッセイについては、 表2。PCRマスターミックスとプライマー。
| cDNAのカクテル/ cDNAの反応 | 1 RNAサンプル | 最初のPCRのカクテル | 1プレート(75反応) | ネステッドPCRカクテル | 1プレート(75反応) |
| 10X RTバッファー(Invitrogen社) | 10μlを | 10 × PCR緩衝液(Invitrogen) | UL 75 | 10 × PCRバッファー | 150μlを |
| 25 mMのMgCl 2の | 20μlの | 50mMのMgSO 4を | 30 UL | 50mMのMgSO 4を | 60 UL |
| 0.1M DTT | 1μlの | の10mMのdNTP | 15 UL | の10mMのdNTP | 30 UL |
| RNaseフリー水 | 17.5 UL | 50μMのプライマー(EA) | 3 UL | 50μMのプライマー(EA) | 6 UL |
| のRNaseアウト(Invitrogen社) | 1μlの | プラチナTaqポリメラーゼハイファイ酵素(Invitrogen社) | 6 UL | プラチナTaqポリメラーゼハイファイ酵素(Invitrogen社) | UL 12 |
| 上付きIII(200 U / UL)(Invitrogen社) | 0.5 UL | 分子グレードの水 | 468 UL | 分子グレードの水 | 1086 UL |
表1:シングルゲノムシーケンシングのためのcDNAおよびPCR混合物。
| P6 - RT 1 PCRプログラム | ENV 1 PCRプログラム |
| 1。 2分94 ° C | 1。 2分94 ° C |
| 2。 30秒間94 ° C | 2 0.94℃30秒C |
| 2 0.94℃30秒C | 3。 30秒間52 ° C |
| 4。 72℃で1分間30秒 | 4。 1分間72℃ |
| 5。 44サイクル、#2に進みます | 5。 44サイクル、#2に進みます |
| 6。 72℃で3分間 | 6。 72℃で3分間 |
| 7。 4℃保持 | 7。 4℃保持 |
| P6 - RT 2 PCRプログラム | ENV 2 PCRプログラム |
| 1。 2分間94 ° C | 1。 2分間94 ° C |
| 2。 30秒間94 ° C | 2。 30秒間94 ° C |
| 3。 55℃で30秒C | 3。 30秒間56℃ |
| 4。 1分間72℃ | 4。 72℃45秒 |
| 5。 #1、40(41サイクル合計)にアクセスしてください | 5。 #1、40(41サイクル合計)にアクセスしてください |
| 6。 72℃で3分間 | 6。 72℃で3分間 |
| 7。 4℃保持 | 7。 4℃保持 |
シングルゲノムシーケンシングアッセイのための表4。サーモ条件。
| 反応 | プライマー | シーケンス |
| P6 - RTしたcDNA | 3500 - | 5'CTATTAAGTATTTTGATGGGTCATAA 3' |
| cDNAをENV | E115 - | 5'AGAAAAATTCCCCTCCACAATTAA 3' |
| P6 - RT 1。 PCR | 3500 - | 5'CTATTAAGTATTTTGATGGGTCATAA 3' |
| P6 - RT 1。 PCR | 1849 + | 5'GATGACAGCATGTCAGGGAG 3' |
| P6 - RT2.PCR | 1870 + | 5'GAGTTTTGGCTGAGGCAATGAG 3' |
| P6 - RT 2.PCR | 3410 - | 5'CAGTTAGTGGTATTACTTCTGTTAGTGCTT 3' |
| ENV 1。 PCR | E115 - | 5'AGAAAAATTCCCCTCCACAATTAA 3' |
| ENV 1。 PCR | E20 + | 5'GGGCCACACATGCCTGTGTACCCACAG 3' |
| ENV 2。 PCR | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3" |
| ENV 2。 PCR | E125 - | 5'CAATTTCTGGGTCCCCTCCTGAGG 3' |
| P6 - RTシーケンシング | 2030 + | 5'TGTTGGAAATGTGGAAAGGAAGGAC 3' |
| P6 - RTシーケンシング | 2600 + | 5'ATGGCCCAAAAGTTAAACAATGGC3" |
| P6 - RTシーケンシング | 2610 - | 5'TTCTTCTGTCAATGGCCATTGTTTAAC3" |
| P6 - RTシーケンシング | 3330 - | 5'TTGCCCAATTCAATTTTCCCACTAA 3' |
| ENVシークエンシング | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3" |
| ENVシークエンシング | E125 - | 5'CAATTTCTGGGTCCCCTCCTGAGG 3' |
シングルゲノムシーケンシングアッセイのための表5。プライマー。
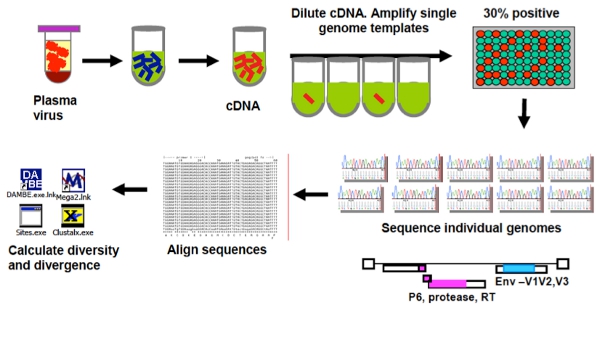
図1。単独のゲノムシーケンシングアッセイ(SGS)の概要。
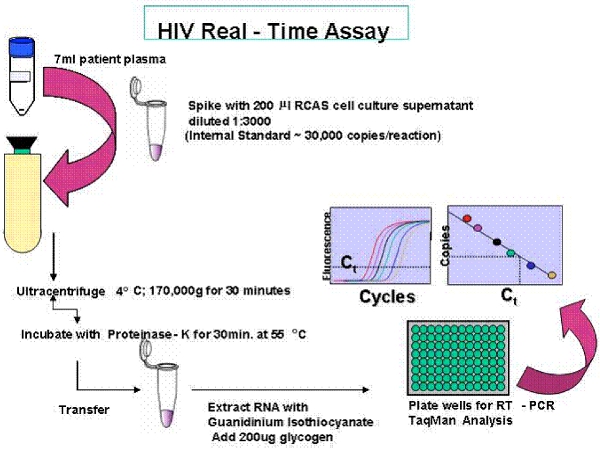
図2。シングルコピーアッセイ(SCA)の概要。
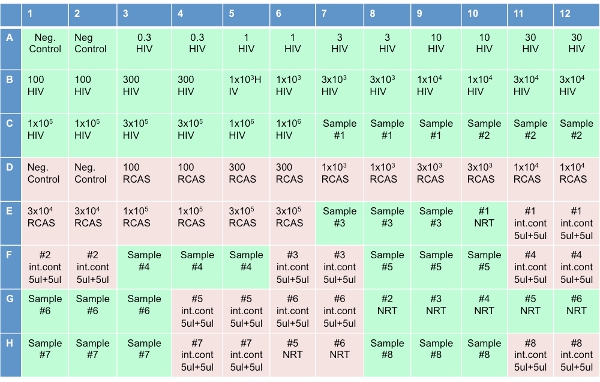
図3。シングルコピーアッセイのためのセットアッププレート。
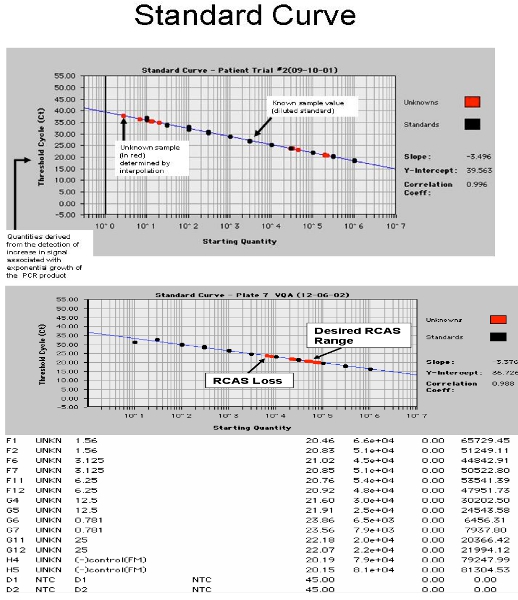
図4。ABI 7700からのスクリーンショット。 A.は、患者試料とスパイクの患者サンプルでRCAS標準曲線を示すBとHIV - 1 RNAの標準曲線を示す。
ディスカッション
HIV - 1自然に感染を制御し、感染した抗レトロウイルス治療の個人(CART)または非常に低いウイルス負荷、プラズマ4、11、12、17、18のmlあたり、通常、約1コピーを持っている。自然なコントロール患者のウイルス負荷は、しばしば、個々のセットポイント1、2、17日頃変動する。ここに記載のアッセイの感度は、プラズマの入力量に大きく依存しています。一般的に、我々は?...
開示事項
利害の衝突は宣言されません。
謝辞
著者らは、HIV - 1の多くの研究に参加した患者の認知を行う予定。
JMCは、FMカービー財団からの支援とアメリカ癌協会の研究教授を務めた。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ランダムヘキサマー(500 ug / mlと) | プロメガ | C118A | |
| タックマンバッファ | アプライドバイオシステムズ | 4304441 | |
| RNAsin(40 U / UL) | プロメガ | N211B | |
| RT酵素(200 U / UL) | Strategene | 600107〜51 | |
| のAmpliTaqゴールドのDNAポリメラーゼ | アプライドバイオシステムズ | 4311814 | 6パック |
| のAmpliTaq 10XGold PCR緩衝液II | アプライドバイオシステムズ | 4311814 | 酵素が付属しています |
| Magnesiumcloride 25mMの | アプライドバイオシステムズ | 4311814 | 酵素が付属しています |
| 1M Tris - HCl緩衝液、pH8.0、5mMの | インビトロジェン | AM9855G | |
| 上付き文字III逆転写酵素、200 U / UL | インビトロジェン | 18080-044 | |
| 上付き文字III 10 ×バッファー | インビトロジェン | 酵素が付属しています | |
| DTT 100mMの | インビトロジェン | 酵素が付属しています | |
| プラチナTaq DNAポリメラーゼハイフィデリティ5 U / UL | インビトロジェン | 11304-102 | |
| 10XハイフィデリティPCRバッファー | インビトロジェン | 11304-102 | 酵素が付属しています |
| プロテイナーゼK 20 mg / mlの | アンビオン | 2546 | |
| グアニジニウムチオシアネート溶液を6M | FlukaBiochemica | 50983 | |
| グリコーゲン20 mg / mlの | ロッシュ | 10901393001 | |
| イソプロパノール | シグマアルドリッチ | 19516 | |
| 70%エタノール | シグマアルドリッチ | E702 - 3 | |
| 分子グレードの水 | GIBCO / Invitrogen社 | 10977-015 | |
| のdNTP(25ミリモル各) | Bioline | BIO - 39025 |
| Euipmentの名前 | 会社 | カタログ番号 | コメント |
| 簡単なシールの遠心管(16x73mm) | シートンサイエンティフィック | 6041 | |
| ホワイトデルリン冠 | シートンサイエンティフィック | 4020 | 簡単なシールチューブ用キャップ |
| Optisealベルトップチューブ、8.9 mlのチューブのラック | ベックマン | 361642 | |
| 六角ドライバー½株式会社の開口部 | シートンサイエンティフィック | 4013 | |
| キャップ除去tupe | シートンサイエンティフィック | 4014 | |
| 5ミリリットル血清ピペット | 共演スター | 4051 | |
| Pipetboy | あらゆる | ||
| 15 mlの転送ピペット | ISC Bioexpress | P - 5005から7 | |
| 5.8ミリリットルDispossable転送ピペット、ファインチップ | VWR | 14670-329 | |
| 15ミリリットル遠心チューブ | ファルコン | ||
| 1 mlの遠心管 | あらゆる | ||
| トリス緩衝生理食塩水の錠剤 | シグマアルドリッチ | T5030 - 100錠 | |
| 超遠心機とローター | Sorval | 90SEとT - 1270 | |
| 96ウェルPCRプレート | バイオラッド | HSS - 9601 | |
| 50 mlの試薬リザーバー | 共演スター | 4870 | |
| マイクロアンペア光学96ウェル反応プレート | アプライドバイオシステムズ | N801 - 0560 | |
| 光学プレートカバー | アプライドバイオシステムズ | 4333183 | |
| マイクロアンペア光圧縮パッド | アプライドバイオシステムズ | 4312639 | |
| マイクロ薄膜 | バイオラッド | MSA - 5001 | |
| 2 mlの遠心管 | 任意の | ||
| 1%アガロースゲル(E -ゲル、Invitrogen社) | インビトロジェン | G - 7008〜01 | |
| E -ベース(Invitrogen社) | インビトロジェン | EB - M03 |
EDTA採血管の任意のブランド
参考文献
- Amara, R. R., Villinger, F., Altman, J. D., Lydy, S. L., O'Neil, S. P., Staprans, S. I., Montefiori, D. C., Xu, Y., Herndon, J. G., Wyatt, L. S. Control of a mucosal challenge and prevention of AIDS by a multiprotein DNA/MVA vaccine. Vaccine. 20, 1949-1955 (2002).
- Dinoso, J., Kim, S., Blankson, J., Siliciano, R. F. Viral Dynamics of Elite Suppressors in HIV-1 Infection. Conference on Retroviruses and Opportunistic Infections. , (2008).
- Dinoso, J. B., Kim, S. Y., Wiegand, A. M., Palmer, S. E., Gange, S. J., Cranmer, L., O'Shea, A., Callender, M., Spivak, A., Brennan, T., Kearney, . Treatment intensification does not reduce residual HIV-1 viremia in patients on highly active antiretroviral therapy. Proc. Natl. Acad. Sci. U.S.A. 106, 9403-9408 (2009).
- Doria-Rose, N. A., Klein, R. M., Manion, M. M., O'Dell, S., Phogat, A., Chakrabarti, B., Hallahan, C. W., Migueles, S. A., Wrammert, J., Ahmed, R., Nason, M., Wyatt, R. T., Mascola, J. R., Connors, M. Frequency and phenotype of human immunodeficiency virus envelope-specific B cells from patients with broadly cross-neutralizing antibodies. J. Virol. 83, 188-199 (2009).
- Dornadula, G., Zhang, H., Uitert, B. V. a. n., Stern, J., Livornese, L., Ingerman, M. J., Witek, J., Kedanis, R. J., Natkin, J., DeSimone, J., Pomerantz, R. J. Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy. JAMA. 282, 1627-1632 (1999).
- Gandhi, R. T., Zheng, L., Bosch, R. J., Chan, E. S., Margolis, D. M., Read, S., Kallungal, B., Palmer, S., Medvik, K., Lederman, M. M., Alatrakchi, N., Jacobson, J. M., Wiegand, A., Kearney, M., Coffin, J. M., Mellors, J. W., Eron, J. J. The effect of raltegravir intensification on low-level residual viremia in HIV-infected patients on antiretroviral therapy: a randomized controlled trial. PLoS medicine. 7, (2010).
- Gay, C., Dibben, O., Anderson, J. A., Stacey, A., Mayo, A. J., Norris, P. J., Kuruc, J. D., Salazar-Gonzalez, J. F., Li, H., Keele, B. F., Hicks, C., Margolis, D., Ferrari, G., Haynes, B., Swanstrom, R. Cross-sectional detection of acute HIV infection: timing of transmission, inflammation and antiretroviral therapy. PLoS One. 6, 19617-19617 (2011).
- Hatano, H., Delwart, E. L., Norris, P. J., Lee, T. H., Dunn-Williams, J., Hunt, P. W., Hoh, R., Stramer, S. L., Linnen, J. M., McCune, J. M., Martin, J. N., Busch, M. P., Deeks, S. G. Evidence for persistent low-level viremia in individuals who control human immunodeficiency virus in the absence of antiretroviral therapy. J. Virol. 83, 329-335 (2009).
- Havlir, D. V., Bassett, R., Levitan, D., Gilbert, P., Tebas, P., Collier, A. C., Hirsch, M. S., Ignacio, C., Condra, J., Gunthard, H. F., Richman, D. D., Wong, J. K. Prevalence and predictive value of intermittent viremia with combination hiv therapy. JAMA. 286, 171-179 (2001).
- Jordan, M. R., Kearney, M., Palmer, S., Shao, W., Maldarelli, F., Coakley, E. P., Chappey, C., Wanke, C., Coffin, J. M. Comparison of standard PCR/cloning to single genome sequencing for analysis of HIV-1 populations. J Virol Methods. 168, 114-120 (2010).
- Kaufmann, D. E., Kavanagh, D. G., Pereyra, F., Zaunders, J. J., Mackey, E. W., Miura, T., Palmer, S., Brockman, M., Rathod, A., Piechocka-Trocha, A., Baker, B., Zhu, B., Gall, S. L. e., Waring, M. T., Ahern, R., Moss, K., Kelleher, A. D. Upregulation of CTLA-4 by HIV-specific CD4+ T cells correlates with disease progression and defines a reversible immune dysfunction. Nat Immunol. 8, 1246-1254 (2007).
- Kearney, M., Maldarelli, F., Shao, W., Margolick, J. B., Daar, E. S., Mellors, J. W., Rao, V., Coffin, J. M., Palmer, S. HIV-1 Population Genetics and Adaptation in Newly Infected Individuals. J. Virol. 83, 2715-2727 (2008).
- Kearney, M., Palmer, S., Maldarelli, F., Shao, W., Polis, M. A., Mican, J., Rock-Kress, D., Margolick, J. B., Coffin, J. M., Mellors, J. W. Frequent polymorphism at drug resistance sites in HIV-1 protease and reverse transcriptase. AIDS. 22, 497-501 (2008).
- Kearney, M., Spindler, J., Shao, W., Maldarelli, F., Palmer, S., Hu, S. L., Lifson, J. D., Kewal Ramani, V. N., Mellors, J. W., Coffin, J. M., Ambrose, Z. Genetic diversity of simian immunodeficiency virus encoding HIV-1 reverse transcriptase persists in macaques despite antiretroviral therapy. Journal of Virology. 85, 1067-1076 (2011).
- Keele, B. F., Giorgi, E. E., Salazar-Gonzalez, J. F., Decker, J. M., Pham, K. T., Salazar, M. G., Sun, C., Grayson, T., Wang, S., Li, H., Wei, X., Jiang, C., Kirchherr, J. L., Gao, F., Anderson, J. A., Ping, L. H., Swanstrom, R. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection. Proc. Natl. Acad. Sci. U.S.A. , 105-7552 (2008).
- Liu, S. L., Rodrigo, A. G., Shankarappa, R. G., Learn, H., Hsu, L., Davidov, O., Zhao, L. P., Mullins, J. I. HIV quasispecies and resampling. Science. 273, 415-416 (1996).
- Mahalanabis, M., Jayaraman, P., Miura, T., Pereyra, F., Chester, E. M., Richardson, B., Walker, B., Haigwood, N. L. Continuous viral escape and selection by autologous neutralizing antibodies in drug-naive human immunodeficiency virus controllers. J. Virol. 83, 662-672 (2009).
- Migueles, S. A., Connors, M. The Role of CD4(+) and CD8(+) T Cells in Controlling HIV Infection. Curr. Infect. Dis. Rep. 4, 461-467 (2002).
- Palmer, S., Kearney, M., Maldarelli, F., Halvas, E. K., Bixby, C. J., Bazmi, H., Rock, D., Falloon, J., Davey, R. T., Dewar, R. L., Metcalf, J. A., Hammer, S., Mellors, J. W., Coffin, J. M. Multiple, linked human immunodeficiency virus type 1 drug resistance mutations in treatment-experienced patients are missed by standard genotype analysis. J. Clin. Microbiol. 43, 406-413 (2005).
- Palmer, S., Wiegand, A. P., Maldarelli, F., Bazmi, H., Mican, J. M., Polis, M., Dewar, R. L., Planta, A., Liu, S., Metcalf, J. A., Mellors, J. W., Coffin, J. M. New real-time reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma. J. Clin. Microbiol. 41, 4531-4536 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved