Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Organ Kültür bozulmamış Sığır Kuyruğu İntervertebral Disklerin Hazırlanması
Bu Makalede
Özet
Bu protokol, organ kültürü için coccygeal sığır intervertebral diskler için hasat tekniği göstermektedir. In vitro Organ kültürü.
Özet
Intervertebral disk (IVD) vertebra vertebra için bağlayan omurga ortak. Bu, omurga yükleme aktarmak ve omurga esnekliği sağlamak için fonksiyonlar. Üç bölmeden oluşur: anulus fibrosus (AF) ve her iki tarafta vertebral gövde NP ve AF bağlayan iki kıkırdak omurun kapsayan içteki düzeyde ayırır Nükleus pulpozusun (NP). Muhtemelen dejeneratif intervertebral disk hastalığı (DDH) ve disk hernileri nedeniyle Diskojenik ağrısı, modern toplumda önemli bir sorun olarak tespit edilmiştir. IVD yozlaşma olası mekanizmaları incelemek için, canlı disk hücreleri ile yapılan in vitro organ kültürü sistemleri son derece çekici. Sağlam sığır coccygeal IVD'ler in vitro kültürü, iyi kontrollü fizyolojik ve mekanik ortamda mekanik-biyolojik yönlerini çalışma sağlayan ilgili bir model sistem, ilerlemiştir . Sığır kuyruğu IVD'ler yüksek sayıda nispeten kolay elde edilebilird insan lomber IVD'ler hücre yoğunluğu, hücre popülasyonu ve boyutları bakımından çok benzer. Ancak, beslenme yollarının açıkça pıhtılaşmış kan tarafından bloke edildi yana, kıkırdak omurun ve kemik omurun istinat önceki sığır kaudal IVD hasat teknikleri, kültür 1-2 gün sonra başarısız oldu. IVD'ler büyük avasküler organları, böylece NP hücrelere besin, sadece komşu vertebral gövde kılcal tomurcukları aracılığıyla difüzyon bağımlı. Son plağın yüzeylerde kemik enkaz ve pıhtılaşmış kan varlığı, disk ve uzlaşma hücre canlılığı merkezi haline besin difüzyon engel teşkil edebilir. Grubumuz için düşük kontaminasyon riski ile kuyruk IVD'ler "crack" için görece hızlı bir protokoldür kurdu. Biz taze kesilmiş, kan pıhtılaşması ve kesim artıkları kaldırır ve son derece verimli beslenme difüzyon yolu yeniden açar bir cerrahi jet lavaj sistemi kullanarak kemik uç plakası yüzeyler permeabilize mümkünIVD merkezinde. Her iki tarafta vertebral kemik büyüme plaklarının varlığı kaçınılması gereken ve kültürüne önce kaldırılmalıdır. Bu video, hazırlanması sırasında çok önemli adımlar anahat ve yüksek hücre canlılığı sürdürmek için 14 gün ücretsiz şişme kültürün etkisi altında başarılı bir organ kültürü anahtarı göstermek. Uygun mekanik çevre mekanik yüklenme biyoreaktör kullanılarak korunabilir kültürü süresi uzatılabilir. Burada gösterilen tekniği, domuz, koyun ve tavşangillere kaudal ve lomber IVD izolasyon gibi diğer hayvan türlerinin uzatılabilir.
Protokol
1. İntervertebral Disk Hasat
- Tüm uzunluğu sığır kuyruğu, cilt varlığı kirlenme şansını artırır (Şekil 2), deri olmadan, mümkünse yerel bir mezbahaya elde edilir.
- Büyük kesme tahtası hazırlayın ve bir kesme tahtası (Şekil 2) üstüne steril çalışma istasyonu ve aletleri hazırlamak.
- 55mm sodyum sitrat içeren% 0.9 sodyum klorür ile nemlendirilmiş steril laminer akış kaputu steril gazlı bez altında hazırlanın ve 6-plaka her bir kuyunun içine koymak.
- Bir havza hazırlayın ve musluk suyu ile 1:100 Betadine çözeltinin.
- 5 dakika boyunca% 1'lik Betadine çözeltisi içeren bir havzada tüm sığır kuyruğu bırakın.
- Kısaca kuru steril gazlı bez ile kuyruk ve steril bir iş istasyonu üzerinde yerleştirin.
- # 22 neşter bıçağı ile dikkatlice kuyruk etrafındaki kas çıkarın.
- Gerekli değildir kuyruk parçaları, nispeten büyük ve çok küçük içeren kuyruk genellikle iki ucunda, uzak doğrayınIVD'ler (Şekil 3).
- IVD etrafında neşter bıçak kullanarak # 10 daha fazla kas ve tendonlar kesin. Disklerin dış anulus kesmek için dikkat edin.
- Mark cerrahi cilt markeri IVD anterior (Bu adım isteğe bağlıdır, bizim biyoreaktör aksiyel rotasyon için merkezi belirlemenize yardımcı olur).
- IVD ve vertebra bağlantı noktası kuyruk hafifçe hareket ettirerek bulun. Donuk bir neşter bıçak yüzü IVD ve kemik arasındaki sınır hissedin. Yarma site vertebra doğru IVD 1-2 mm olmalıdır. Yeri özel yarma sitesi (Şekil 4) endüstriyel bıçak tutucu.
- Cleave IVD ve vertebra ısmarlama endüstriyel bıçak tutucu (Şekil 3) üstüne çekiç ile.
- IVD-vertebranın bağlantısı, diğer tarafta tekrarlayın.
- Wrap 55mm sodyum sitrat içeren% 0.9 sodyum klorür ile ıslatılmış steril gazlı bez ile IVD izole.
- Istenen numune sayısı (genellikle 6 dolaşıp IVD'ler izolasyonu Devam10-20 mm arasında çapı ile hasat edilebilir).
- Jet steril Ringer solüsyonu ile lavaj sistemi (Zimmer, inc.) Bağlayın, 5L çanta (alternatif steril PBS veya% 0.9 salin solüsyonu) kullanışlı bir boyutta.
- IVD Zimmer Pulsavac jet-lavaj sistemi (Şekil 1C) kullanarak forseps ve uç plakası yüzeyinin jet-lavajı her iki tarafında tutun. Jet tabanca 30 arasında bir açıyla uç plakası yüzeyinde çekilmiş olmalıdır - 60 ° her tarafında 30s hakkında. (Şekil 1 ve 7)
- Jet başka bir disk örneği yıkarken IVD'ler ile 6-plaka ve şal geri koyun gazlı bezle temizleyin.
- IVD'ler organ kültür ve aşağı akım uygulamaları (örneğin, hücre canlılığı, mekanik yüklenme, organ kültürü) (Şekil 1D) için hazırız.
2. Temsilcisi Sonuçlar
Başarılı bir intervertebral disk hazırlık yargılamak için Sonuç ölçümleri difüzyon deneyi olabilir küçük bir molekül ağırlığı (örneğin procion kırmızı floresan boya)PBS 2% 1'lik bir çözüm olarak hazırlanır. IVD sonra en az 100 mL boya çözüm ve boya, daha sonra ücretsiz şişme altında 24 saat için IVD pasif diffüz izin verilir tutulur. IVD sonra, sıvı nitrojen içinde flash dondurulmuş ve oda sıcaklığı ve aseton transferlerin bir dizi (ilk -80 olarak ° C, -20 ° C, daha sonra 4 ° C ve sonunda oda sıcaklığına kadar önceden soğutulmuş susuz geri getirdi. .) Disk sonra poli-metil-akrilat (PMMA) gömülü ve 100 mikron kalınlığında kesitler üretmek için keskin bir bıçak ile kesilir. Bu bölümler daha sonra herhangi bir standart aydınlık mikroskop ama tercihen procion kırmızı kırmızı floresan yayar (Şekil 5-6) bu yana floresan mikroskopi kullanımı ile görülebilir. Kemik yüzeyi trabeculi jet lavaging adım (Şekil 7) sonra çok temiz görünür.
Başarılı bir organ kültürü parametreleri, kirlenme, hücre canlılığı muhafaza tüm yokluğu (Şekil 8-9), disk yüksekliği ilk vehistolojik kesitler ve safranin O / hızlı yeşil leke veya Meyer Hematoxilin 3 ile ölçülen genel "disk bütünlüğü". Biz canlı disk dokusu leke ve başka bir konfokal lazer tarama mikroskobu ve canlı / ölü boyama kiti (Moleküler Probları, Invitrogen, Basel, İsviçre) kullanılarak 3 boyutlu hücre canlılığı tarama 4,5 yayınlanan protokolleri ve makrolar geliştirdi. Biz 3D doku veya 4-6 NIH ImageJ platformu kullanarak 3D taşıyıcılar hücre canlılığı tahmin etmek için otomatik hücre sayımı gerçekleştirmek için bir makro ve rutin daha geliştirdi. Alternatif protokolleri disk hücreleri hücre canlılığı pronase ve kollajenaz tip kullanarak ekstraselüler matriks sıralı sindirim kullanarak ilk sindirim belirlemek için 2 ve daha sonra hücre süspansiyonu 7 leke ileri sürülmüştür. Protokolün bir önceki sürümü PBS önce diskler hasat organ cu sonra 10 dakika süreyle on kat daha konsantre penisilin / streptomisin konsantrasyon içeren bir inkübasyon adım söz konusulture. Bu adımı kültür amaçları için yararlı gibi görünüyor bu yana jet lavaj adım ile bu adımı geçersiz olur.

Şekil 1 metodolojik adımları bakış, sağlam omurun ve kemik ince bir tabaka halinde (1-2mm) ile sığır coccygeal İntervertebral Diskler hazırlamak için . A) intervertebral disk (IVD) ve besin yollar şematik görünümü. B) Usulü ile IVD bıçak tutucu, özelleştirilmiş ve endüstriyel bir keskin bıçak kesmek için. C) Jet lavaj adım yüksek hücre canlılığı sağlamak ve uç plakaları ve her iki tarafta bağlı kemik 1-2 mm tutmak besin alışverişini sağlamak için. D) Son olarak IVD biyoreaktör numune odasında kültüre olabilir veya herhangi aşağı akım bir uygulama için kullanılmalıdır.
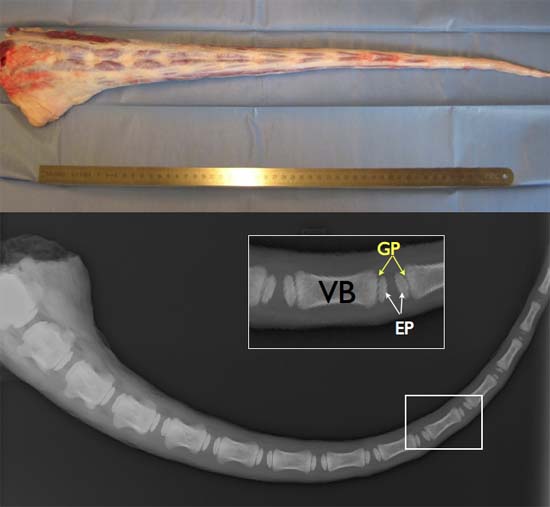
Şekil 2 TOP: Tam boy taze sığır kuyruğu (ideal obta2-3 saat içinde incelendiği yüksek hücre canlılığı sağlamak için post-mortem. Alt: kemik omurun (EP) ve vertebra gövdelerinin (VB) arasında büyüme plaklarının (GP), ikincil kemikleşme merkezi, varlığını gösteren yaklaşık 6 ay yaşlı bir sığır kuyruğu X-ray görüntü.
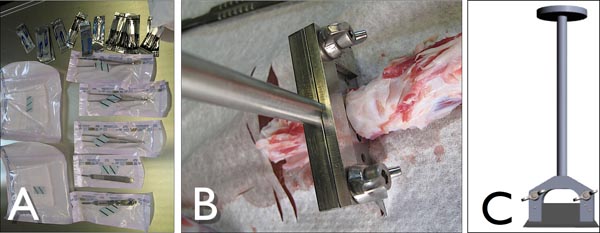
Şekil 3. A) Araçlar, steril koşullar altında sığır kuyruğu incelemek . B) Özelleştirilmiş bıçak tutucu, intervertebral disk kesim sırasında eylem sığır kuyruğu hareket segmentleri-out kesti. C) standart bir endüstriyel bıçak (Lutz, Almanya) ile özelleştirilmiş bıçak tutucu Yan görünümü.

Şekil 4 Çizim ve hareket segmentleri kesip yarma siteleri gösteren çevreleyen kas ve ligaman kaldırdıktan sonra sığır kuyruğu resmi. Kısmi vertebra wi "çatlak" olmalıdırısmarlama bıçak tutucu th ideal olarak 1-2 mm uzaklıkta, kıkırdak, omurun tam kemik yüzeyi sağlamak.
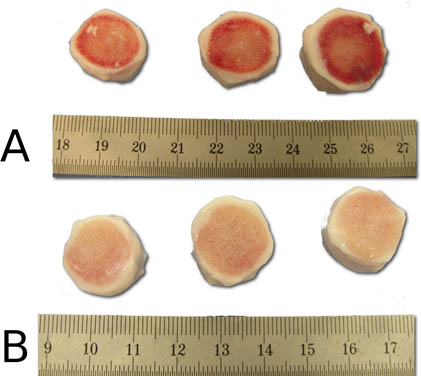
Şekil 5 önce jet-lavaj adım etkili temizlik Gösterme (A) ve sonrası (B). Püskürtme işlemi sonrasında intervertebral disk bölümleri temiz kemik yüzeylere dikkat edin.
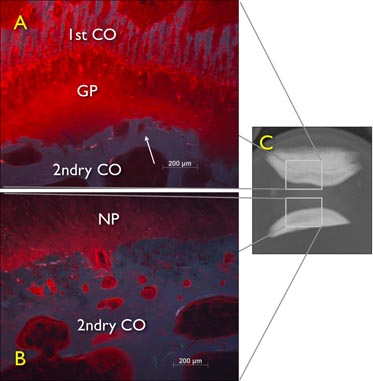
Şekil 6 büyüme plağı tarafından blokaj etkisi gösteren, 24 saat boyunca% 1 procion kırmızı çözümü sol taze hazırlanmış eksize sığır kuyruğu intervertebral diskler (IVD'ler) Serbest şişme difüzyon deneyi . Bir dijital X-ray sagital görünüm 2'den sonra hala kıkırdak ve kemik uç plakası ile coccygeal sığır intervertebral disk eksplant büyüme plağı ve sagital kesilmiş kemik floresan mikroskopi görüntü ikinci bir tabaka içeren IVD4h serbest difüzyon. GP: büyüme plağı, 2ndry CO: ikincil kemikleşme merkezi.

Şekil 7, taze hazırlanmış, 24 saat% 1 procion kırmızı çözüm için sol eksize sığır kuyruğu intervertebral diskler (IVD'ler) Serbest şişme deneyi, jet lavaj tedavi temizlik etkisi gösteren. (~ 100 mm), tedavi (Sağ) jet-lavaj tedavi olmadan jet lavaj tedavisi (Sol) Kontrol tarafında yapıldı ~ 1.5-mmthick kemik uç plakaları ile eksize sığır IVD'ler sagittal kalınlığında kesitler. Giriş sprey Zimmer yara debridman sistemi kullanılan desen, 24 saat ücretsiz difüzyon deneyleri,% 1 procion kırmızı sığır intervertebral disk eksplant. Gösterir.
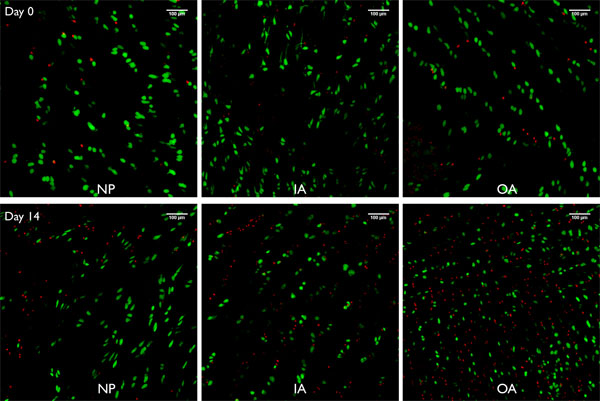
Şekil 8 konfokal Görüntüleme yığınları projeksiyonlar Live / Dead Görüntüler (250μm) bovin alınane intervertebral disk bölümleri düzeyde ayırır Nükleus pulpozusun (NP), iç anulus fibrosus (IA) ve dış anulus fibrosus (OA) için sırasıyla 0 ve 14 gün için serbest şişme altında tutulması bu jet-lavaj yöntemi ile hazırlanmıştır. Ethidium homodimer-1 tarafından boyanmış = Calcein AM (asetil metilester) ile boyanan canlı hücreler, kırmızı hücrelerin ölü hücreleri çekirdeği Yeşil hücreleri.
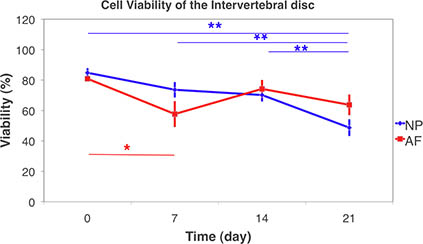
Şekil 9, canlı doku ve 3D yığın tarama konfokal lazer tarama mikroskobu kullanarak intervertebral disk hücre Canlılık . Hücre canlılığı düzeyde ayırır Nükleus pulpozusun (NP) ve annulus Fibrozis (AF), serbest-şişme koşul altında 21-gün-kültür üzerinde. (Ortalama ± SEM, N = 6) İstatistiksel farklılıklar non-parametrik Kruskal-Wallis rank sum testi gruplar arasında imzalanan kullanılarak test edildi. Gün 21 ve NP diğer tüm zaman noktaları arasında önemli farklılıklar tespit edilmiştir. AF önemli farklılıklar gün 7 arasında iken,gün 0. (* P <0.05, ** p <0.01).
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Başarılı organ kültürü için ilk adım eksplant kontamine olmaması gerektiğini emin olun. Prosedüre başlamadan önce kuyruk tenli olmalıdır. Herhangi bir hayvan kılı steril bir laboratuvar haline getirdiği kirlenme açısından sorunlu olabilir. Sığır kuyruğu ideal (bu ilk hücre canlılığı etkiler) mümkün olduğunca taze olmalıdır. Ayrıca, betadin yıkama adım daha kontaminasyon riskini azaltmak için önerilmektedir. IVD vertebra gövdesi ayrı bir ölçüye göre bıçak tutucu ve bir çek...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Bu proje, İsviçre Ulusal Bilim Vakfı (SNF # 310030-127586/1) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Yerel mezbahasında (ideal saat sonra otopsi içinde ve cilt) Taze sığır sığır kuyrukları intervertebral disk dokusu,. | |||
| Pulsavac Ayrıca AC Sistemi | Zimmer inc, İsviçre | 00-5150-486-01 | Hip-sprey başlığı ile ve AC güç kaynağı ile en iyi performans (8 adet AA pil ile çalışır ancak daha az uygundur.) |
| Yüksek Kapasiteli Fan Sprey w / Splash Kalkan, 12.7cm uzunluk | Zimmer inc, İsviçre | 00-5150-175-00 | Çeşitli sprey başları vardır, başarılı bir test |
| Neşter bıçaklar # 22 # 10 | Swann-Mortİngiltere, | # 10: 0201 # 22: 0208 | |
| Neşter bıçak tutucu # 3 ve # 4 | Hausmann, Almanya | # 3: 06.103.00 # 4: 06.104.00 | |
| Lutz endüstriyel bıçak | Lutz, Almanya | 1022.0884 | |
| Fosfat tamponlu salin (PBS) | Invitrogen, İsviçre | 10010-023 | |
| Dulbecco'nun Modifiye Kartal Medium (DMEM) | Gibco, İsviçre | 11960-044 | |
| Ringer solüsyonu (glikoz) | Bichsel, İsviçre | 133 0002 | |
| 6-çok-plaka | DYP, İsviçre | 92006 | |
| Betadine çözüm | Mundipharma, İsviçre | 10055025 | |
| Cerrahi cilt markeri | Porex Cerrahi, İsviçre | 9560 | |
| Büyük kesme tahtası | Herhangi bir marka mümkündür | ||
Referanslar
- Lee, C. R., Iatridis, J. C., Poveda, L., Alini, M. In vitro organ culture of the bovine intervertebral disc: effects of vertebral endplate and potential for mechanobiology studies. Spine (Phila Pa 1976). 31, 515-522 (1976).
- Chan, S. C. W., Gantenbein-Ritter, B., Leung, V. Y., Chan, D. Cryopreserved intervertebral disc with injected bone marrow-derived stromal cells: a feasibility study using organ culture. Spine. J. 10 (6), 486-496 (2010).
- Chan, S. C., Ferguson, S. J., Wuertz, K., Gantenbein-Ritter, B. Biological Response of the Intervertebral Disc to Repetitive Short Term Cyclic Torsion. Spine (Phila Pa 1976). , (2011).
- Gantenbein-Ritter, B., Sprecher, C. M., Chan, S., Illien-Jünger, S., Grad, S. Confocal imaging protocols for live/dead staining in three-dimensional carriers. Methods Mol. Biol. 740, 127-140 (2011).
- Gantenbein-Ritter, B., Potier, E., Zeiter, S., van der Werf, M. Accuracy of three techniques to determine cell viability in 3D tissues or scaffolds. Tissue Engineering Part C Methods. 14, 353-358 (2008).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. (1997).
- Haschtmann, D., Stoyanov, J. V., Ettinger, L., Nolte, L. P., Ferguson, S. J. Establishment of a novel intervertebral disc/endplate culture model: analysis of an ex vivo in vitro whole-organ rabbit culture system. Spine. 31, 2918-2925 (2006).
- Gantenbein, B., Grünhagen, T., Lee, C. R., van Donkelaar, C. C. An in vitro organ culturing system for intervertebral disc explants with vertebral endplates: a feasibility study with ovine caudal discs. Spine. 31, 2665-2673 (2006).
- Korecki, C. L., Kuo, C. K., Tuan, R. S., Iatridis, J. C. Intervertebral disc cell response to dynamic compression is age and frequency dependent. J. Orthop. Res. 27, 800-806 (2009).
- Korecki, C. L., MacLean, J. J., Iatridis, J. C. Dynamic compression effects on intervertebral disc mechanics and biology. Spine (Phila Pa 1976). 33, 1403-1409 (1976).
- Jim, B., Steffen, T., Moir, J., Roughley, P., Haglund, L. Development of an intact intervertebral disc organ culture system in which degeneration can be induced as a prelude to studying repair potential. European Spine Journal. , 1-11 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır