Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung von Intact Bovine Rute Bandscheiben für Orgel Kultur
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Erntetechnik für coccygeal Rinder Bandscheiben für Orgel Kultur In-vitro- Orgel Kultur.
Zusammenfassung
Die Bandscheibe (IVD) ist das Gelenk der Wirbelsäule verbinden Wirbel zu Wirbel. Es funktioniert nach Belastung der Wirbelsäule übertragen und bieten die Flexibilität, um die Wirbelsäule. Es komponiert aus drei Abteilungen: der innerste Kern pulposus (NP) umfasst von der Faserring (AF), und zwei knorpeligen Endplatten Anschluss der NP und AF auf die Wirbelkörper auf beiden Seiten. Bandscheibenbedingte Schmerzen möglicherweise durch degenerative Bandscheibenleiden (DDD) und Bandscheibenvorfälle verursacht hat, als ein großes Problem in unserer modernen Gesellschaft identifiziert worden. Zur Untersuchung möglicher Mechanismen der IVD-Degeneration, sind in vitro Orgelkultur Systeme mit Live-CD-Zellen sehr ansprechend. Die in vitro-Kultur von intakten Rinder coccygeal IVD hat einen entsprechenden Modell, das die Untersuchung der mechanisch-biologischen Aspekten in einer gut kontrollierten physiologischen und mechanischen Umgebung ermöglicht fortgeschritten. Bovine Schwanz IVD erhalten relativ leicht in höhere Zahlen Seien Sie eind sind sehr ähnlich wie das menschliche Lendenwirbelsäule IVD in Bezug auf die Zelldichte, Zell-Population und Dimensionen. Allerdings gelang früheren Rinder caudal IVD Erntetechniken Beibehaltung knorpeligen und knöchernen Endplatten Endplatten nach 1-2 Tagen der Kultur, da die Ernährung Wege waren offensichtlich durch geronnenes Blut blockiert. IVD sind die größten avaskuläre Organe, so sind die Nährstoffe zu den Zellen in der NP allein abhängig von der Diffusion über die Kapillare Knospen aus der benachbarten Wirbelkörper. Präsenz von Knochen Schutt und geronnenes Blut auf der Endplatte Oberflächen können Nährstoffdiffusion in die Mitte der Scheibe und des Kompromisses die Lebensfähigkeit der Zellen zu verhindern. Unsere Gruppe wurde eine relativ schnelle Protokoll-out "knacken" des IVD vom Schwanz mit einem geringen Risiko für Verunreinigungen. Wir sind in der Lage, den frisch geschnittenen knöchernen Endplatte Oberflächen mit Hilfe eines chirurgischen Jet-Lavage System, das die Bildung von Blutgerinnseln und Schneidabfall entfernt und sehr effizient öffnet die Ernährung Diffusionsweg permeabilisierenum die Mitte des IVD. Die Anwesenheit des Wachstums Platten auf beiden Seiten der Wirbelknochen muss vermieden werden und vor der Kultur entfernt werden. In diesem Video stellen wir die entscheidenden Schritte bei der Vorbereitung und Demonstration der Schlüssel zu einer erfolgreichen Orgelkultur Beibehaltung der hohen Lebensfähigkeit der Zellen für 14 Tage unter freiem Schwellungen Kultur. Die Kultur der Zeit könnte erweitert werden, wenn geeignete mechanische Umwelt durch mechanische Belastung Bioreaktor aufrechterhalten werden kann. Das kann die Methode auf andere Tierarten wie Schweine, Schafe und leporine caudal-und Lendenwirbelsäule IVD Isolation erweitert werden.
Protokoll
1. Bandscheiben-Harvesting
- Ganze Länge Rinder Schwanz ist von einem örtlichen Schlachthof erhalten, wenn möglich, ohne Haut, da die Anwesenheit der Haut erhöht sich die Wahrscheinlichkeit einer Kontamination (Abb. 2).
- Bereiten Sie große Schneidebrett und bereiten sterile Arbeitsplatz und Instrumente auf einem Schneidebrett (Abb. 2).
- Bereiten Sie unter der sterilen Laminarströmungshaube steriler Gaze angefeuchtet mit 0,9% Natriumchlorid enthalten, 55mm Natriumcitrat und in jedes Well der 6-Well-Platte.
- Bereiten Sie eine Schüssel und verdünnt 1:100 Betadine Lösung mit Leitungswasser.
- Tauchen Sie den gesamten Rinder-tail in einem Becken mit 1% Betadine Lösung für 5 min.
- Kurz trocknen Schwanz mit steriler Gaze und legen Sie sie auf sterile Arbeitsplatz.
- Entfernen Sie vorsichtig Muskeln rund um den Schwanz mit Skalpell Nr. 22.
- Hacken weg die Teile des Schwanzes, die nicht benötigt werden, in der Regel an beiden Enden des Schwanzes, die relativ große und sehr kleine enthaltenIVD (Abb. 3).
- Trim weiter die Muskeln und Sehnen auf der ganzen IVD mit Skalpell Nr. 10. Vorsicht nicht auf die äußeren Ring der Scheiben schneiden.
- Mark der vorderen des IVD mit einem chirurgischen Hautmarker (dieser Schritt ist optional, hilft es, das Zentrum für axiale Rotation in unsere Bioreaktor zu bestimmen).
- Suchen Sie den IVD und Wirbel Anschlusspunkt, indem Sie den Schwanz sanft. Spüren Sie die Grenze zwischen IVD und Knochen mit der stumpfen Seite eines Skalpell. Die Spaltung Website sollte 1-2 mm entfernt von der IVD in Richtung des Wirbels werden. Legen Sie maßgeschneiderte industrielle Messerhalter auf die Spaltung Website (Abb. 4).
- Cleave IVD und Wirbel durch Hämmern auf der Oberseite des maßgeschneiderten industriellen Messerhalter (Abb. 3).
- Wiederholen Sie auf der anderen Seite des IVD-Wirbel-Verbindung.
- Wrap isoliert IVD mit steriler Gaze angefeuchtet mit 0,9% Natriumchlorid enthalten, 55mm Natriumcitrat.
- Fahren Sie mit der Isolierung von IVD, um die gewünschte Sample-Nummer (in der Regel rund 6 könnengeerntet werden mit einem Durchmesser zwischen 10-20 mm).
- Schließen Sie das Jet-Lavage System (Zimmer, inkl..) Mit steriler Ringer-Laktat-Lösung werden 5L Beutel eine nützliche Größe (alternativ sterile PBS oder 0,9% iger Kochsalzlösung).
- Halten Sie die IVD mit einer Pinzette und Jet-Lavage beiden Seiten der Endplatte Oberfläche mit Zimmer Pulsavac Jet-Lavage System (Abb. 1C). Die Jet-Pistole sollte auf der Endplatte Oberfläche in einem Winkel zwischen 30 Schuss - 60 ° für ca. 30s auf jeder Seite. (Abb. 1 und 7)
- Setzen Sie den IVD zurück zu den 6-Well-Platte und wickeln mit angefeuchteten Mull, während Jet Waschen eine andere Disc Probe.
- IVD sind bereit für Orgel Kultur und down-stream-Applikationen (zB die Lebensfähigkeit der Zellen, mechanische Belastung, Orgelkultur) (Abb. 1D).
2. Repräsentative Ergebnisse
Outcome-Messungen zu einer erfolgreichen Bandscheiben-Vorbereitung Richter kann eine Diffusion Experiment sein, wo ein kleines Molekulargewicht Fluoreszenzfarbstoff (zB Procion Red)bereit ist, als eine 1% ige Lösung in PBS 2. Der IVD ist dann mit mindestens 100 ml Farbstofflösung und der Farbstoff wird dann erlaubt, passiv diffundieren in die IVD für 24 Stunden unter freiem Schwellung gehalten. Der IVD ist dann in flüssigem Stickstoff schockgefroren und brachte wieder auf Raumtemperatur und dehydrierte durch eine Reihe von Aceton Transfers (first in -80 ° C, dann -20 ° C, dann 4 ° C und schließlich auf Raumtemperatur vorgekühlt ). Die Disc kann dann in Poly-Methyl-Acrylat (PMMA) eingebettet und mit einem scharfen Messer bis 100 Mikrometer dicke Schnitte erzeugen. Diese Abschnitte können dann von jedem Standard-Hellfeld-Mikroskop, sondern vorzugsweise durch Verwendung von Fluoreszenz-Mikroskopie seit Procion Red emittiert eine rote Fluoreszenz (Abb. 5-6) eingesehen werden. Die trabeculi der knöchernen Oberfläche erscheinen sehr sauber nach dem jet lavaging Schritt (Abb. 7).
Parameter für eine erfolgreiche Orgelkultur sind in erster Linie das Fehlen von Verschmutzungen, erhalten die Lebensfähigkeit der Zellen (Abb. 8-9), Disc-Höhe undGesamt-Wertung "Disc Integrität", mit histologischen Schnitten und Safranin O / schnell grün färben oder Meyers Hämatoxilin 3 gemessen. Wir entwickelten Protokolle und Makros an anderer Stelle veröffentlicht 4,5 zu leben Bandscheibengewebe färben und die Lebensfähigkeit der Zellen in 3D mit einem konfokalen Laser-Scanning-Mikroskop und dem Live / Dead Färbekit (Molecular Probes, Invitrogen, Basel, Schweiz) zu scannen. Wir weiterentwickelt einem Makro und Routine, um automatisierte Zellzählung, um die Lebensfähigkeit der Zellen in 3D-Gewebe-oder 3D-Träger mit dem NIH ImageJ-Plattform 6.4 Schätzung durchzuführen. Alternate-Protokolle wurden vorgeschlagen, um die Lebensfähigkeit der Zellen des Disc-Zellen durch anfängliche Verdauung mit sequentiellen Verdau der extrazellulären Matrix mit Pronase und Kollagenase Typ zu bestimmen 2 und dann auf die Zelle Aufhängung 7 Fleck. Eine frühere Version des Protokolls beteiligt einem Inkubationsschritt in PBS, die zehn Mal stärker konzentriert Penicillin / Streptomycin-Konzentration für 10 Minuten nach der Ernte der Scheiben vor Organ culture. Mit dem Jet-Lavage Schritt dieser Schritt hinfällig, da dieser Schritt vorteilhaft erscheint für die Kultivierung Zwecke.

Abbildung 1. Überblick über die methodischen Schritte an Rinder coccygeal Bandscheiben mit intakten Endplatten und eine dünne Schicht (1-2mm) von Knochen vorzubereiten. A) Schematische Darstellung der Bandscheibe (IVD) und ihre ernährungsphysiologischen Wege. B) Verfahren zum Ausschneiden der IVD mit einer angepassten Klinge-Halter und ein industrielles scharfe Klinge. C) Jet Lavage Schritt, um eine hohe Lebensfähigkeit der Zellen und Stoffaustausch halten die Endplatten und 1-2 mm Knochen auf beiden Seiten angebracht zu ermöglichen. D) Schließlich wird die IVD kann in der Probenkammer eines Bioreaktors kultiviert werden oder für jede down-stream-Anwendung verwendet werden.
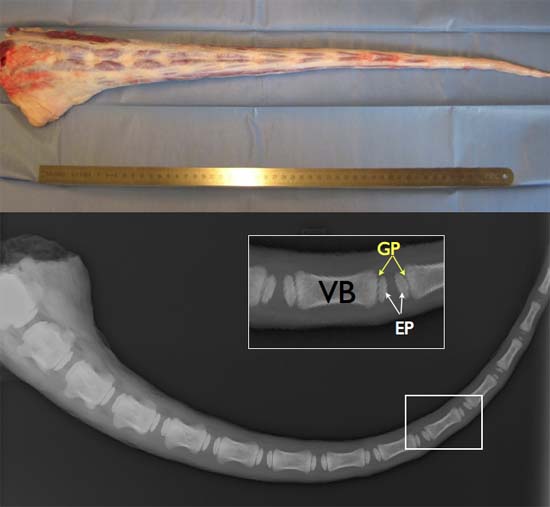
Abbildung 2 TOP:. Volle Länge frischem Rind Schwanz (idealerweise obtainiert innerhalb von 2-3 Stunden post mortem zu hohen Lebensfähigkeit der Zellen zu gewährleisten. Unten: Röntgenaufnahme eines Rinder-Schwanz um 6 Monate, welche die Existenz der Wachstumsfugen (GP), sekundäre Zentrum von Verknöcherung, zwischen den knöchernen Endplatten (EP) und der Wirbelkörpern (VB) im Alter.
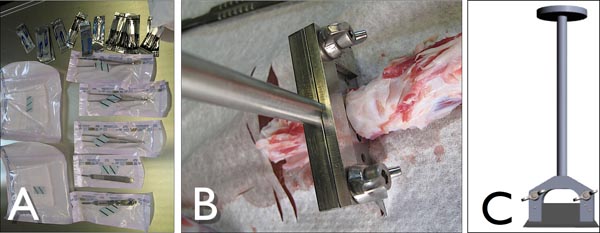
Abbildung 3. A) Tools, um die Rinder Schwanz unter sterilen Bedingungen zu sezieren. B) Customized Blade-Inhaber, cut-out Bewegungs-Segmente aus der Rinder-Schwanz in Aktion während des Schneidens der Bandscheibe. C) Side-Blick auf den kundenspezifischen Blade-Halter mit einem Standard-Industrie-Klinge (Lutz, Deutschland).

Abbildung 4. Zeichnen und Bild von der Rinder-tail nach dem Entfernen der umgebenden Muskeln und Bänder, welche die Spaltung von Websites zum Ausschneiden der Bewegungs-Segmente. Teilweise Wirbel sollte "geknackt" werden with die maßgeschneiderte Messerhalter idealerweise 1-2 mm entfernt von der knorpeligen Endplatten, um sicherzustellen, voller Knochenoberfläche.
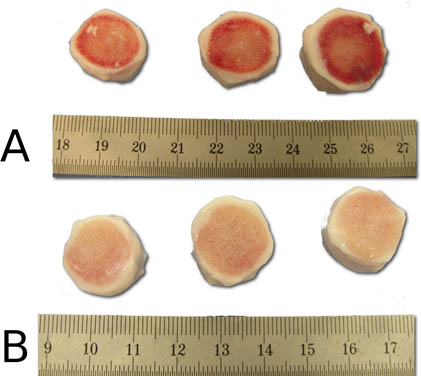
Abbildung 5. Demonstration der effektiven Reinigung des Jet-Lavage Schritt vor (A) und nach (B). Beachten Sie die saubere Knochenoberflächen der Bandscheibe Segmente nach dem Sprühverfahren.
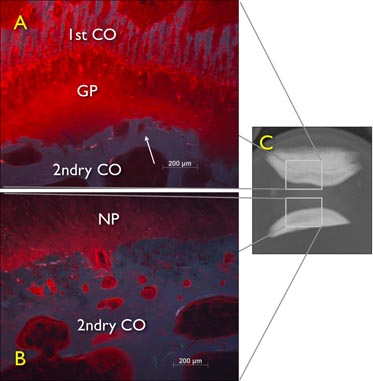
Abbildung 6. Free-Schwellungen Diffusionsversuch an frisch zubereiteten herausgeschnitten Rinder Schwanz Bandscheiben (IVD) für 24 Stunden in 1% Procion rote Lösung links, demonstriert Blockade-Effekt durch das Wachstum Platte. Ein digitales Röntgen sagittale Ansicht eines IVD noch mit dem Wachstum Platte und eine zweite Schicht von Knochen Fluoreszenzmikroskopie Bild sagittal durchschnitten des Steißbeins Rinder Bandscheibe Explantation mit knorpeligen und knöchernen Endplatte nach 24h freie Diffusion. GP: Epiphysenfuge, 2ndry CO: Mittelzentrum der Verknöcherung.

Abbildung 7. Free-Schwellungen Experiment an frisch zubereiteten herausgeschnitten Rinder Schwanz Bandscheiben (IVD) für 24 Stunden in 1% Procion rote Lösung links, zeigt reinigende Wirkung der Jet Lavage Behandlung. Sagittal dicke Abschnitte (~ 100 mm) von Rindern herausgeschnitten IVD mit ~ 1,5-mmthick knöchernen Endplatten, die Jet-Lavage Behandlung (links) Steuerseite ohne Behandlung (rechts) jet-gespült Behandlung unterzog. Inlet zeigt das Spritzbild, die aus dem Zimmer Wundreinigung verwendet wurde 24 Stunden freie Diffusion Experimente von Rindern Bandscheibe Explantate in 1% Procion rot.
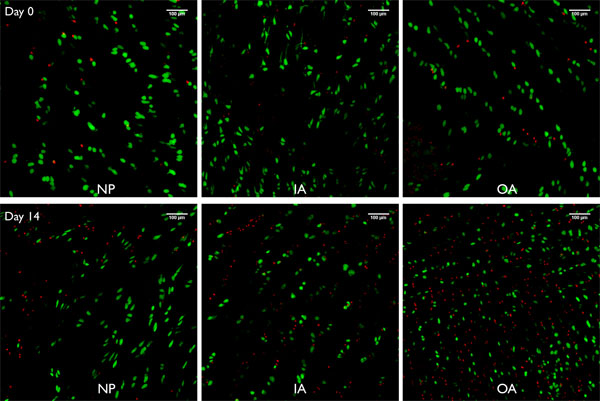
Abbildung 8. Live / Dead Bilder von Projektionen der konfokalen Imaging-Stacks (250μm) aus bovin genommene Bandscheibe Segmente mit diesem Jet-Lavage-Methode unter freien Schwellungen für 0 und 14 Tagen jeweils für den Nucleus pulposus (NP), der inneren Faserring (IA) und dem äußeren Faserring (OA) gehalten vorbereitet. Grüne Zellen = lebende Zellen von Calcein AM (Acetyl-Methylester) gefärbt, rote Blutkörperchen = tote Zellen Kern von Ethidium Homodimer-1 gefärbt.
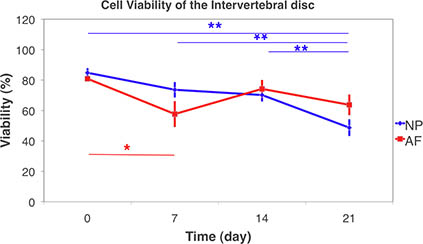
Abbildung 9. Zellviabilitätsmessungen der Bandscheibe mit Hilfe der konfokalen Laser-Scanning-Mikroskopie an lebenden Gewebe und 3D-Stapel scannen. Die Lebensfähigkeit der Zellen des Nucleus pulposus (NP) und Faserring (AF) über die 21-Tage-Kultur unter free-Schwellungen Zustand. (Mittelwert ± SEM, N = 6) Statistische Unterschiede wurden mit nicht-parametrischen Kruskal-Wallis unterzeichnet Rangsummentest zwischen den Gruppen. Signifikante Unterschiede wurden zwischen Tag 21 und allen anderen Zeitpunkten in NP gefunden. Während in AF signifikanten Unterschiede zwischen Tag 7 gefundenTag 0. (* P <0,05, ** p <0,01).
Diskussion
Der erste Schritt für eine erfolgreiche Orgelkultur ist, um sicherzustellen, dass die Explantation sollte nicht kontaminiert werden. Die Rute sollte gehäutet, bevor Sie mit dem Verfahren beginnen. Jedes Tier Haare in ein steriles Labor gebracht werden konnte in Bezug auf die Kontamination problematisch. Die Rinder Schwanz sollte idealerweise so frisch wie möglich (dies betrifft zunächst die Lebensfähigkeit der Zellen). Darüber hinaus ist die betadine Waschschritt empfohlen, das Risiko einer Kontamination weiter zu...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Dieses Projekt wurde vom Schweizerischen Nationalfonds (SNF # 310030-127586/1) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Frischem Rind Bandscheibengewebe aus Rinder-Tails aus den örtlichen Schlachthof (im Idealfall innerhalb weniger Stunden post mortem und ohne Haut). | |||
| Pulsavac Plus AC-System | Zimmer inkl.., Schweiz | 00-5150-486-01 | Beste Leistung mit dem Hip-Sprühkopf und mit AC-Netzteil (das mit der 8 AA Akkus hat auch, ist aber weniger komfortabel) |
| High Capacity Fan Spray w / Splash Shield, 12,7 cm Länge | Zimmer inkl.., Schweiz | 00-5150-175-00 | Es gibt mehrere Sprühköpfe zur Verfügung, testeten wir diese erfolgreich |
| Skalpellklingen Nr. 22 und Nr. 10 | Swann-Mortauf, England | Nr. 10: 0201 Nr. 22: 0208 | |
| Scalpel Messerhalter # 3 und # 4 | Hausmann, Deutschland | # 3: 06.103.00 # 4: 06.104.00 | |
| Lutz industriellen Klinge | Lutz, Deutschland | 1022.0884 | |
| Phosphat-gepufferte Saline (PBS) | Invitrogen, Schweiz | 10010-023 | |
| Dulbecco Modified Eagle Medium (DMEM) | Gibco, Schweiz | 11960-044 | |
| Ringer-Laktat-Lösung (ohne Glukose) | Bichsel, Schweiz | 133 0002 | |
| 6-well Multi-Well-Platte | TPP, Schweiz | 92006 | |
| Betadine Lösung | Mundipharma, Schweiz | 10055025 | |
| Chirurgische Hautmarker | Porex Surgical, Schweiz | 9560 | |
| Große Schneidebrett | Jede Marke ist möglich | ||
Referenzen
- Lee, C. R., Iatridis, J. C., Poveda, L., Alini, M. In vitro organ culture of the bovine intervertebral disc: effects of vertebral endplate and potential for mechanobiology studies. Spine (Phila Pa 1976). 31, 515-522 (1976).
- Chan, S. C. W., Gantenbein-Ritter, B., Leung, V. Y., Chan, D. Cryopreserved intervertebral disc with injected bone marrow-derived stromal cells: a feasibility study using organ culture. Spine. J. 10 (6), 486-496 (2010).
- Chan, S. C., Ferguson, S. J., Wuertz, K., Gantenbein-Ritter, B. Biological Response of the Intervertebral Disc to Repetitive Short Term Cyclic Torsion. Spine (Phila Pa 1976). , (2011).
- Gantenbein-Ritter, B., Sprecher, C. M., Chan, S., Illien-Jünger, S., Grad, S. Confocal imaging protocols for live/dead staining in three-dimensional carriers. Methods Mol. Biol. 740, 127-140 (2011).
- Gantenbein-Ritter, B., Potier, E., Zeiter, S., van der Werf, M. Accuracy of three techniques to determine cell viability in 3D tissues or scaffolds. Tissue Engineering Part C Methods. 14, 353-358 (2008).
- Rasband, W. S. . ImageJ. , (1997).
- Haschtmann, D., Stoyanov, J. V., Ettinger, L., Nolte, L. P., Ferguson, S. J. Establishment of a novel intervertebral disc/endplate culture model: analysis of an ex vivo in vitro whole-organ rabbit culture system. Spine. 31, 2918-2925 (2006).
- Gantenbein, B., Grünhagen, T., Lee, C. R., van Donkelaar, C. C. An in vitro organ culturing system for intervertebral disc explants with vertebral endplates: a feasibility study with ovine caudal discs. Spine. 31, 2665-2673 (2006).
- Korecki, C. L., Kuo, C. K., Tuan, R. S., Iatridis, J. C. Intervertebral disc cell response to dynamic compression is age and frequency dependent. J. Orthop. Res. 27, 800-806 (2009).
- Korecki, C. L., MacLean, J. J., Iatridis, J. C. Dynamic compression effects on intervertebral disc mechanics and biology. Spine (Phila Pa 1976). 33, 1403-1409 (1976).
- Jim, B., Steffen, T., Moir, J., Roughley, P., Haglund, L. Development of an intact intervertebral disc organ culture system in which degeneration can be induced as a prelude to studying repair potential. European Spine Journal. , 1-11 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten