Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation d'Intact disques intervertébraux Queue bovine pour la culture d'organe
Dans cet article
Résumé
Ce protocole illustre une technique de récolte pour les bovins coccygienne disques intervertébraux pour la culture d'organes pour In vitro.
Résumé
Le disque intervertébral (DIV) est l'articulation de la colonne vertébrale reliant vertèbre en vertèbre. Il fonctionne pour transmettre le chargement de la colonne vertébrale et donner de la flexibilité de la colonne vertébrale. Il compose de trois compartiments: le noyau pulpeux intime (NP) englobant l'annulus fibrosus (AF), et deux plateaux cartilagineux reliant les NP et AF pour le corps vertébral, des deux côtés. Douleur d'origine discale éventuellement causé par une maladie dégénérative du disque intervertébral (DDD) et les hernies discales a été identifié comme un problème majeur dans notre société moderne. Pour étudier les mécanismes possibles de la dégénérescence IVD, dans les systèmes de culture in vitro d'organes avec cellules du disque live sont très attrayante. La culture in vitro de bovins intacts les DIV coccygienne a avancé à un système de modèle pertinent, qui permet l'étude de la mécano-biologique des aspects dans un environnement bien contrôlé physiologiques et mécaniques. DIV de la queue bovine peut être obtenue assez facilement en plus grand nombre uneD sont très similaires aux humains les DIV lombaires à l'égard de la densité cellulaire, la population de cellules et de dimensions. Toutefois, avant bovins caudale techniques de récolte DIV conservant plateaux cartilagineux et osseux plateaux échoué après 1-2 jours de culture depuis les voies de la nutrition étaient évidemment bloqué par du sang coagulé. DIV sont les plus grands organes avasculaire, par conséquent, les nutriments aux cellules de la NP dépendent uniquement sur la diffusion via les bourgeons capillaires du corps vertébraux adjacents. Présence de débris d'os et de sang coagulé sur les surfaces des plateaux vertébraux peuvent entraver la diffusion des nutriments dans le centre du disque et la viabilité cellulaire compromis. Notre groupe a établi un protocole relativement rapide à "craquer" les DIV-le de la queue avec un faible risque de contamination. Nous sommes capables de perméabiliser les surfaces fraîchement coupées des plateaux vertébraux osseux en utilisant un système de jet de lavage chirurgical, ce qui élimine les caillots de sang et de débris de coupe et de façon très efficace rouvre la voie de la diffusion de nutritionau centre de la DIV. La présence de plaques de croissance des deux côtés de l'os vertébral doit être évitée et d'être enlevés avant la culture. Dans cette vidéo, nous décrivons les étapes cruciales lors de la préparation et de démontrer la clé d'une culture d'organe réussie maintien de la viabilité cellulaire élevée pendant 14 jours dans la culture gonflement libre. Le temps de la culture pourrait être prolongé le cas échéant environnement mécanique peut être maintenue en utilisant bioréacteur chargement mécanique. La technique démontrée ici peuvent être étendues à d'autres espèces animales comme les porcins, ovins et lépreux isolement caudale ou lombaire DIV.
Protocole
1. La récolte du disque intervertébral
- Whole queue bovins longueur est obtenue à partir d'un abattoir local, si possible sans la peau car la présence de la peau augmente le risque de contamination (figure 2).
- Préparer grande planche à découper et préparer la station de travail et des instruments stériles au sommet d'une planche à découper (Fig. 2).
- Préparer sous le capot de la gaze stérile à flux laminaire stérile humidifié avec du chlorure de sodium à 0,9% contenant du citrate de sodium 55mm et mis dans chaque puits de la plaque de 6 puits.
- Préparer un bassin et diluer 1:100 solution de Betadine avec de l'eau du robinet.
- Plonger la queue entière bovine dans un bassin contenant une solution de Bétadine 1% pendant 5 min.
- Brièvement la queue à sec avec une gaze stérile et le placer sur la station de travail stérile.
- Retirez délicatement les muscles autour de la queue avec lame de bistouri n ° 22.
- Hacher l'écart des pièces de la queue qui ne sont pas nécessaires, généralement les deux extrémités de la queue, qui contiennent relativement grandes et très petites entreprisesIVD (Fig. 3).
- Garniture davantage les muscles et les tendons autour de la DIV en utilisant lame de bistouri n ° 10. Attention à ne pas couper l'anneau externe des disques.
- Marquer la partie antérieure de l'IVD avec un marqueur de peau chirurgical (cette étape est facultative, elle permet de déterminer le centre de rotation axiale dans notre bioréacteur).
- Localisez le point de connexion IVD et vertèbres de la queue en se déplaçant doucement. Sentez-vous la frontière entre l'IVD et d'os avec le côté mat de la lame d'un scalpel. Le site de clivage devrait être de 1-2 mm de distance de l'IVD vers la vertèbre. Placez personnalisée fait le porte-lame industrielle sur le site de clivage (Fig. 4).
- Cleave IVD et vertèbre par martelage sur le dessus du support de lame sur-mesure industrielle (Fig. 3).
- Répétez de l'autre côté de la connexion IVD vertèbre.
- Enveloppez isolés DIV avec une gaze stérile humidifié avec du chlorure de sodium à 0,9% contenant du citrate de sodium 55mm.
- Continuer l'isolement des DIV à l'échantillon numéro désiré (généralement autour de 6 peutêtre récoltés avec un diamètre de 10-20 mm).
- Connectez le système de lavage à jet (Zimmer, Inc.) Avec une solution stérile de Ringer lactate, 5L sacs sont d'une taille utile (alternativement PBS stérile ou 0,9% de solution saline).
- Tenir la DIV avec une pince et le jet-lavage des deux côtés de la surface des plateaux vertébraux en utilisant Zimmer Pulsavac jet de lavage du système (Fig. 1C). Le pistolet à jet devrait être tourné sur la surface des plateaux vertébraux à un angle compris entre 30 - 60 ° pendant environ 30s de chaque côté. (Fig. 1 et 7)
- Mettez la DIV de revenir à la plaque de 6 puits et envelopper avec une gaze humidifiée tout jet de lave un autre échantillon du disque.
- DIV sont prêts pour la culture d'organes et en aval des applications (par exemple la viabilité cellulaire, le chargement mécanique, la culture d'organes) (Fig. 1D).
2. Les résultats représentatifs
Résultat des mesures pour juger une préparation réussie du disque intervertébral peut être une expérience de diffusion où un colorant fluorescent de faible poids moléculaire (Procion par exemple rouge)est préparée comme une solution à 1% dans PBS 2. L'IVD est alors maintenu avec au moins 100 ml de solution de colorant et le colorant est alors autorisé à diffuser passivement dans l'IVD pour 24h dans le gonflement libre. L'IVD est alors flash-congelés dans l'azote liquide et ramené à température ambiante et déshydraté par une série de transferts d'acétone (première pré-refroidi dans -80 ° C, puis à -20 ° C, puis 4 ° C et enfin à la température ambiante ). Le disque peut ensuite être intégrées dans le poly-méthyl-acrylate de méthyle (PMMA) et couper avec une lame tranchante pour produire 100 um d'épaisseur des sections. Ces sections peuvent ensuite être consultés par n'importe quel microscope fond clair standard, mais préférentiellement par l'utilisation de la microscopie à fluorescence, depuis Procion Red émet une fluorescence rouge (fig. 5-6). Le trabeculi de la surface osseuse apparaissent très propre après l'étape lavaging jet (Fig. 7).
Paramètres pour une culture d'organe réussie sont d'abord l'absence de contamination, la viabilité des cellules maintenues (fig. 8-9), la hauteur discale etglobale "de l'intégrité du disque", mesurée avec des coupes histologiques et de safranine O / vert rapide tache ou hématoxiline Meyer 3. Nous avons développé des protocoles et des macros publiés ailleurs 4,5 à tacher les tissus du disque en direct et de balayer la viabilité des cellules en 3D en utilisant un microscope confocal à balayage laser et le kit de coloration vivants / morts (Molecular Probes, Invitrogen, Bâle, Suisse). Nous avons également développé une macro et de routine à effectuer la cellule de comptage automatique pour estimer la viabilité des cellules dans les tissus 3D ou 3D transporteurs utilisant la plateforme NIH ImageJ 4-6. Protocoles de rechange ont été proposées pour déterminer la viabilité cellulaire des cellules du disque par digestion initiale à l'aide la digestion séquentielle de la matrice extracellulaire en utilisant la pronase et la collagénase de type 2 et ensuite de colorer la suspension cellulaire 7. Une version antérieure du protocole impliquait une étape d'incubation dans du PBS contenant dix fois plus concentrée de concentration de pénicilline / streptomycine pendant 10 minutes après la récolte des disques d'orgue avant la cuLTURE. Avec l'étape de lavage à jet cette étape devient obsolète puisque cette étape semble bénéfique à des fins de culture.

Figure 1. Vue d'ensemble des étapes méthodologiques pour préparer bovines coccygienne disques intervertébraux avec plateaux intact et une fine couche (1-2mm) de l'os. Vue schématique A) du disque intervertébral (DIV) et ses voies nutritionnelles. B) Procédure à découper la DIV avec un personnalisées porte-lame et une lame industrielle forte. C) étape de lavage Jet pour assurer la viabilité des cellules de haute et de permettre l'échange de nutriments gardant les plateaux et 1-2 mm d'os attachée sur les deux côtés. D) Enfin, la DIV peut être cultivé dans la chambre de spécimens d'un bioréacteur ou être utilisé pour toute application en aval.
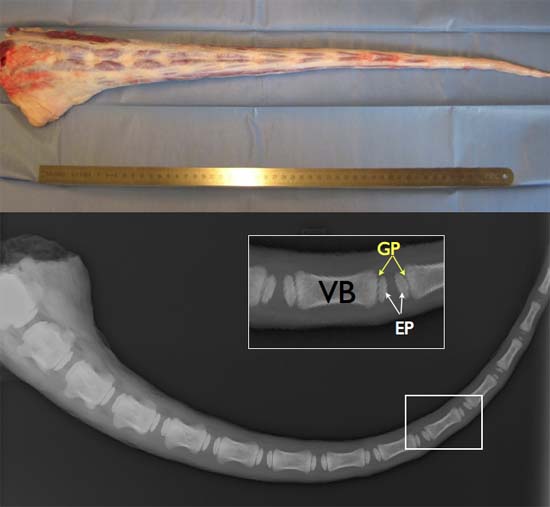
Figure 2 TOP:. Pleine longueur de la queue fraîches bovines (idéalement bénéficier du droit àINED dans les 2-3 heures post-mortem afin d'assurer la viabilité cellulaire élevée. En bas: X-ray image d'une queue de bovins âgés de 6 mois environ illustrant l'existence des plaques de croissance (GP), centre secondaire d'ossification, entre les plateaux osseux (PE) et les corps vertébral (VB).
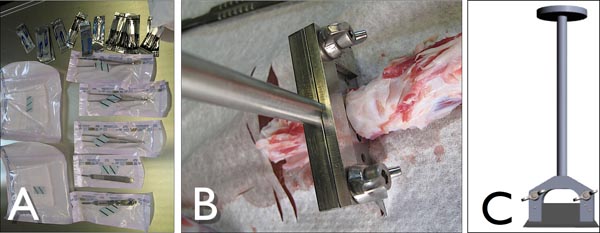
Figure 3. Un Tools) pour disséquer la queue bovins dans des conditions stériles. B) Customized porte-lame pour couper des segments-motionnelle de la queue de l'espèce bovine dans l'action tout en coupant le disque intervertébral. C) Vue latérale de l'personnalisées porte-lame avec une lame standard industriel (Lutz, Allemagne).

Figure 4. Dessin et de l'image de la queue bovins après avoir enlevé le muscle environnant et du ligament illustrant les sites de clivage de couper les segments promotionnelle. Partiel vertèbre doit être "craqué" wie le porte-lame sur-mesure, idéalement 1-2 mm loin de les plateaux cartilagineux pour assurer surface osseuse complète.
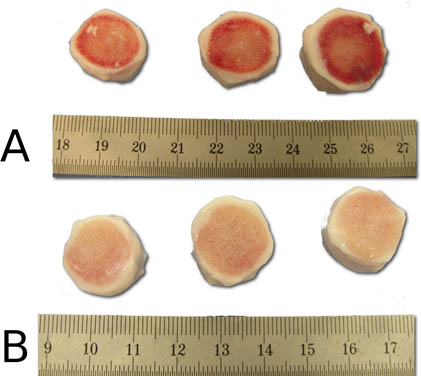
Figure 5. Démonstration de l'efficacité du nettoyage de l'étape de jet-lavage avant (A) et après (B). Avis des surfaces osseuses nettoyage des segments du disque intervertébral après la procédure de pulvérisation.
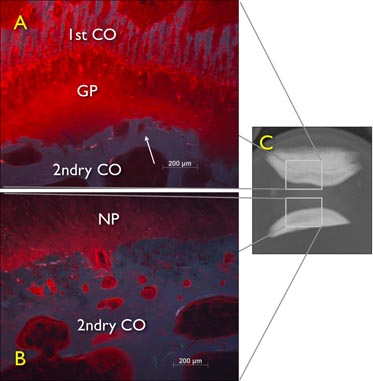
Figure 6. Expérimentation de diffusion gratuite de gonflement du fraîchement préparés excisée disques intervertébraux queue bovin (DIV) laissé pendant 24 heures dans une solution de 1% Procion rouge, démontrant l'effet de blocage par la plaque de croissance. Une radiographie numérique vue sagittale d'un DIV contenant encore la plaque de croissance et une seconde couche de l'image de microscopie à fluorescence de l'os à travers la coupe sagittale explant coccygienne disque intervertébral bovins des plateaux vertébraux cartilagineux et osseux après deux4h de diffusion gratuite. GP: plaque de croissance, 2ndry CO: centre secondaire d'ossification.

Figure 7. Gratuit-gonflement expérience de fraîchement préparés excisée disques intervertébraux queue bovin (DIV) laissé pendant 24 heures dans une solution de 1% Procion rouge, démontrant de nettoyage à jet d'effet du traitement de lavage. Sagittale sections épaisses (~ 100 mm) de diagnostic in vitro excisés bovins avec des plaques de ~ 1,5 mmthick fin osseuses qui ont subi un lavage à jet d'un traitement (à gauche) contrôle sans traitement (droite) un lavage de jet-traitement. Inlet montre le jet, qui a été utilisé par le système plaies Zimmer débridement expériences 24h diffusion libre des bovins explants disque intervertébral en rouge Procion 1%.
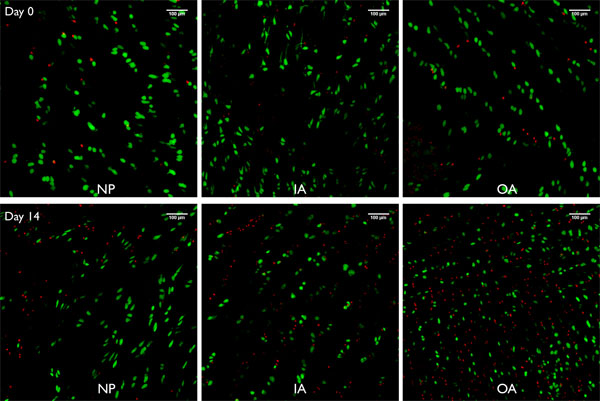
Figure 8. Images Live / Dead de projections de piles imagerie confocale (250μm) prélevés bovinsegments e disque intervertébral préparé avec cette méthode de lavage de jet-gardés sous-gonflement libre pour 0 et 14 jours respectivement pour le nucleus pulposus (NP), l'intérieur l'anneau fibreux (IA) et l'anneau fibreux externe (OA). Vert = cellules des cellules vivantes souillé par calcéine AM (acétyl méthylique), les globules rouges = noyau de cellules mortes colorées par éthidium homodimère-1.
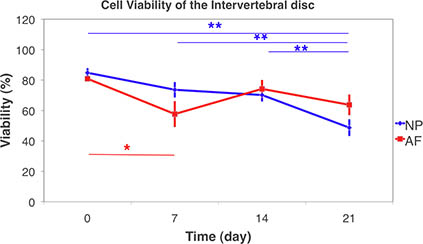
Figure 9. Viabilité cellulaire du disque intervertébral par laser microscopie confocale à balayage sur les tissus vivants et de numérisation 3D pile. La viabilité des cellules du noyau pulpeux (NP) et l'anneau de fibrose (AF) au cours des 21 jours-culture sous-gonflement sans condition. (Moyenne ± SEM, n = 6) Les différences statistiques ont été testés à l'aide non-paramétrique de Kruskal-Wallis signé test de la somme parmi les groupes. Des différences significatives ont été trouvées entre 21 jours et tous les autres moments dans NP. Alors que dans les différences significatives ont été trouvées AF entre le jour de 7 àjour 0. (* P <0,05, ** p <0,01).
Access restricted. Please log in or start a trial to view this content.
Discussion
La première étape pour la culture d'organe réussie est de faire en sorte que l'explant ne doivent pas être contaminés. La queue doit être dépecé avant de commencer la procédure. Toute poils amené dans un laboratoire stérile pourrait être problématique en termes de contamination. La queue bovins devraient idéalement être aussi frais que possible (ce qui affecte la viabilité des cellules initiales). Par ailleurs, l'étape de lavage bétadine est recommandée pour réduire le risque de contamina...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Ce projet a été soutenu par la Fondation nationale suisse (FNS # 310030-127586/1).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| Frais tissus bovins disque intervertébral de queues de bovins, d'abattoir local (idéalement dans les heures post-mortem et sans peau). | |||
| Pulsavac AC Plus Système | Zimmer Inc., Suisse | 00-5150-486-01 | Meilleure performance à la tête de pulvérisation et de hip-avec alimentation AC (celui avec le pack de 8 piles AA ne fonctionnera aussi mais c'est moins pratique) |
| Haute capacité de ventilateur pulvérisation W / Splash Bouclier, longueur 12,7 cm | Zimmer Inc., Suisse | 00-5150-175-00 | Il ya plusieurs têtes de pulvérisation disponibles, nous avons testé celui-ci avec succès |
| Les lames de bistouri n ° 22 et n ° 10 | Swann-Mort, l'Angleterre | # 10: 0201 # 22: 0208 | |
| Porte-lame de scalpel # 3 et # 4 | Hausmann, Allemagne | # 3: 06.103.00 # 4: 06.104.00 | |
| Lutz industriels lames | Lutz, de l'Allemagne | 1022.0884 | |
| Tampon phosphate salin (PBS) | Invitrogen, Suisse | 10010-023 | |
| Eagle modifié par Dulbecco (DMEM) | Gibco, Suisse | 11960-044 | |
| Solution de Ringer lactate (sans glucose) | Bichsel, Suisse | 133 0002 | |
| 6-même plaque multi-puits | TPP, Suisse | 92006 | |
| Solution de Betadine | Mundipharma, Suisse | 10055025 | |
| Marqueur de la peau chirurgicale | Porex Surgical, Suisse | 9560 | |
| Grande planche à découper | Toute marque est possible | ||
Références
- Lee, C. R., Iatridis, J. C., Poveda, L., Alini, M. In vitro organ culture of the bovine intervertebral disc: effects of vertebral endplate and potential for mechanobiology studies. Spine (Phila Pa 1976). 31, 515-522 (1976).
- Chan, S. C. W., Gantenbein-Ritter, B., Leung, V. Y., Chan, D. Cryopreserved intervertebral disc with injected bone marrow-derived stromal cells: a feasibility study using organ culture. Spine. J. 10 (6), 486-496 (2010).
- Chan, S. C., Ferguson, S. J., Wuertz, K., Gantenbein-Ritter, B. Biological Response of the Intervertebral Disc to Repetitive Short Term Cyclic Torsion. Spine (Phila Pa 1976). , (2011).
- Gantenbein-Ritter, B., Sprecher, C. M., Chan, S., Illien-Jünger, S., Grad, S. Confocal imaging protocols for live/dead staining in three-dimensional carriers. Methods Mol. Biol. 740, 127-140 (2011).
- Gantenbein-Ritter, B., Potier, E., Zeiter, S., van der Werf, M. Accuracy of three techniques to determine cell viability in 3D tissues or scaffolds. Tissue Engineering Part C Methods. 14, 353-358 (2008).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. (1997).
- Haschtmann, D., Stoyanov, J. V., Ettinger, L., Nolte, L. P., Ferguson, S. J. Establishment of a novel intervertebral disc/endplate culture model: analysis of an ex vivo in vitro whole-organ rabbit culture system. Spine. 31, 2918-2925 (2006).
- Gantenbein, B., Grünhagen, T., Lee, C. R., van Donkelaar, C. C. An in vitro organ culturing system for intervertebral disc explants with vertebral endplates: a feasibility study with ovine caudal discs. Spine. 31, 2665-2673 (2006).
- Korecki, C. L., Kuo, C. K., Tuan, R. S., Iatridis, J. C. Intervertebral disc cell response to dynamic compression is age and frequency dependent. J. Orthop. Res. 27, 800-806 (2009).
- Korecki, C. L., MacLean, J. J., Iatridis, J. C. Dynamic compression effects on intervertebral disc mechanics and biology. Spine (Phila Pa 1976). 33, 1403-1409 (1976).
- Jim, B., Steffen, T., Moir, J., Roughley, P., Haglund, L. Development of an intact intervertebral disc organ culture system in which degeneration can be induced as a prelude to studying repair potential. European Spine Journal. , 1-11 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon