A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد أقراص سليمة الذيل البقري الفقرية للثقافة الجهاز
In This Article
Summary
يوضح هذا البروتوكول تقنية حصاد للأقراص الفقرية العصعصية البقري للثقافة الجهاز لل في المختبر الجهاز الثقافة.
Abstract
القرص بين الفقرات (IVD) هو مشترك في العمود الفقري لربط فقرة فقرة. وهو يعمل على إحالة التحميل للعمود الفقري واعطاء المرونة للعمود الفقري. انه يؤلف من ثلاث مقصورات : النواة اللبية الأعمق (NP) التي تضم الحلقة الليفية (AF) ، واثنين endplates غضروفية تربط NP وAF الفقري للجسم على كلا الجانبين. وقد تم تحديد الألم قرصي المنشأ الذي ربما حدث بسبب الأمراض التنكسية القرص الفقرية (DDD) وفتوق القرص باعتباره مشكلة رئيسية في مجتمعنا الحديث. لدراسة الآليات الممكنة للانحطاط IVD ، في نظم المختبر مع خلايا الجهاز الثقافة قرص العيش وجذابة للغاية. تقدمت في المختبر من ثقافة سليمة IVDs العصعصية الأبقار إلى نظام النموذجية ذات الصلة ، والتي تسمح بدراسة الجوانب البيولوجية mechano في بيئة جيدة للرقابة الفسيولوجية والميكانيكية. ويمكن الحصول على IVDs ذيل الأبقار سهلة نسبيا في ارتفاع أعداد anد متشابهة الى حد بعيد في IVDs القطني الإنسان فيما يتعلق كثافة الخلية ، والسكان ، وأبعاد الخلية. ومع ذلك ، فشلت البقري الذيلية السابقة تقنيات حصاد IVD الاحتفاظ endplates الغضروفية العظمية وendplates بعد 1-2 أيام من الثقافة منذ سدت الواضح مسارات التغذية عن طريق الدم متخدر. IVDs هي أكبر الأجهزة اوعائي ، وبالتالي ، فإن المواد الغذائية إلى الخلايا في NP تعتمد فقط على نشر عبر البراعم الشعرية من جسم الفقري المتاخمة لها. يمكن وجود حطام العظام والدم المتجلط على السطوح endplate تعرقل نشر المواد الغذائية في مركز القرص وسطا بقاء الخلية. أنشئت مجموعتنا بروتوكول سريع نسبيا "الكراك" التدريجي للIVDs من الذيل مع مخاطر منخفضة للتلوث. ونحن قادرون على permeabilize وطازجة وقطع الأسطح endplate العظمية باستخدام طائرة غسيل جراحية النظام ، الذي يزيل الجلطات الدموية والحطام وقطع بكفاءة عالية تعيد فتح ممر نشر التغذيةللوسط IVD. وجود لوحات النمو على جانبي العمود الفقري والعظام التي ينبغي تجنبها ، ويمكن إزالتها قبل الثقافة. في هذا الفيديو ، ونحن الخطوط العريضة للخطوات حاسمة خلال إعداد وشرح المفتاح لنجاح الجهاز ثقافة الحفاظ على سلامة الخلية عالية لمدة 14 يوما في ظل ثقافة تورم الحرة. ويمكن تمديد الوقت الذي يمكن فيه ثقافة الحفاظ على البيئة المناسبة الميكانيكية باستخدام مفاعل حيوي ميكانيكية التحميل. ويمكن تمديد هذه التقنية أثبتت هنا لأنواع الحيوانات الأخرى مثل الخنزير والأغنام والعزلة جذامي IVD الذيلية والقطنية.
Protocol
1. حصاد القرص الفقرية
- يتم الحصول على كامل طول ذيل الأبقار من مسلخ المحلية ، إذا كان ذلك ممكنا من دون وجود منذ الجلد من الجلد يزيد من فرصة للتلوث (الشكل رقم 2).
- اعداد كبيرة لوح التقطيع والتحضير المعقمة محطة العمل والأدوات في أعلى لوحة القطع (الشكل 2).
- إعداد مبلل تحت شاش معقم غطاء تدفق الصفحي العقيمة مع كلوريد الصوديوم 0.9 ٪ تحتوي على 55mM سترات الصوديوم ووضعها في كل بئر من لوحة 6 - جيدا.
- يعد حوض وتمييع الحل 1:100 Betadine مع مياه الحنفية.
- تزج الذيل كله الأبقار في حوض يحتوي على 1 ٪ حل Betadine لمدة 5 دقائق.
- الذيل الجافة لفترة وجيزة مع شاش معقم ووضعه على محطة العمل العقيمة.
- إزالة بعناية العضلات حول الذيل مع شفرة مشرط رقم 22.
- ختم بعيدا أجزاء من الذيل والتي لا حاجة ، وعادة طرفي الذيل ، والتي تحتوي كبيرة نسبيا وصغيرة جداIVDs (الشكل 3).
- تقليم مزيد من العضلات والأوتار حول IVD باستخدام شفرة مشرط رقم 10. حذار لا لقطع الحلقة الخارجية للأقراص.
- بمناسبة الأمامي من IVD مع علامة الجلد الجراحية (هذه الخطوة اختيارية ، فإنه يساعد على تحديد مركز الدوران المحوري في مفاعل حيوي لدينا).
- تحديد فقرة وIVD نقطة اتصال عن طريق تحريك الذيل برفق. يشعر الحدود بين IVD والعظام مع الجانب مملة من شفرة المشرط. وينبغي أن يكون في موقع الشق 1-2 ملم بعيدا من IVD نحو فقرة. أدلى مكان مخصص الصناعية حامل شفرة على موقع الشق (الشكل 4).
- ويلتصق IVD فقرة التي يدق على رأس حامل شفرة مصنوعة خصيصا الصناعية (الشكل 3).
- كرر على الجانب الآخر من الاتصال IVD - فقرة.
- المعزولة التفاف IVD بشاش معقم مبلل مع كلوريد الصوديوم 0.9 ٪ تحتوي على 55mM سترات الصوديوم.
- مواصلة عزل IVDs لعدد العينة المطلوب (عادة حوالي 6 يمكنيمكن حصادها مع القطر بين 10-20 مم).
- توصيل نظام غسيل الطائرات (زيمر ، المؤتمر الوطني العراقي.) مع الحل رينغر Lactated العقيمة ، و5L الحقائب هي الحجم مفيدة (PBS العقيمة بدلا من محلول ملحي أو 0.9 ٪).
- عقد IVD مع ملقط غسيل والنفاثة كلا الجانبين من سطح endplate باستخدام زيمر Pulsavac النفاثة نظام غسيل (الشكل 1C). وينبغي أن أطلقوا النار على طائرة بندقية على سطح endplate بزاوية بين 30 -- 60 درجة لمدة 30S على كل جانب. (الشكلان 1 و 7)
- وضع IVDs إلى لوحة 6 جيدا والتفاف مع شاش مبلل أثناء الغسيل طائرة عينة أخرى القرص.
- IVDs مستعدون للثقافة وأسفل الجهاز دفق التطبيقات (على سبيل المثال بقاء الخلية ، وتحميل الميكانيكية والثقافة الجهاز) (الشكل 1D).
2. ممثل النتائج
ويمكن قياس نتائج ناجحة للحكم على إعداد القرص الفقرية تكون التجربة حيث نشر صغيرة الوزن الجزيئي صبغة الفلورسنت (مثل أحمر procion)مستعد كحل 1 ٪ في برنامج تلفزيوني 2. ثم يتم الاحتفاظ IVD مع ما لا يقل عن 100 مل من محلول الصبغة ، ويسمح بعد ذلك لنزع فتيل صبغة سلبية في IVD عن تورم تحت 24H الحرة. وIVD ومن ثم فلاش مجمدة في النيتروجين السائل واعادته الى درجة حرارة الغرفة والمجففة من خلال سلسلة من التحويلات الأسيتون (أول ما قبل تبريده في -80 درجة مئوية ، ثم -20 درجة مئوية ، ثم 4 درجات مئوية ، وأخيرا إلى درجة حرارة الغرفة ). ثم يمكن أن يكون جزءا لا يتجزأ من القرص في بولي ميثيل اكريليت (PMMA) وقطع مع شفرة حادة لانتاج 100 ميكرون سميكة المقاطع. ويمكن بعد ذلك أن ينظر إلى هذه المقاطع من قبل أي المجهر brightfield القياسية ولكن تفضيلي بواسطة استخدام المجهر مضان منذ procion الحمراء تنبعث مضان أحمر (الشكلان 5-6). وtrabeculi السطح العظمي تظهر نظيفة جدا بعد خطوة lavaging طائرة (الشكل 7).
المعلمات من أجل ثقافة الجهاز الناجحة هي الأولى من غياب كل من وتلوث بقاء الخلية حافظ (الشكلان 8-9) ، وارتفاع القرصعموما "وحدة القرص" ، ويقاس مع المقاطع النسيجية وsafranin O / أخضر سريع وصمة عار أو Hematoxilin ماير 3. طورنا بروتوكولات وحدات الماكرو نشرت 4،5 في أماكن أخرى لصبغ الأنسجة الحية لفحص القرص وبقاء الخلية في 3d باستخدام مجهر المسح الضوئي والليزر مبائر عدة تلطيخ العيش / الميت (المسابر الجزيئية ، Invitrogen ، بازل ، سويسرا). علينا مواصلة تطوير ماكرو وروتينية لأداء الخلية الفرز الآلي لتقدير جدوى الخلية في النسيج 3D أو الناقلين 3D باستخدام منصة ImageJ المعاهد الوطنية للصحة و 4-6. وقد اقترحت بروتوكولات بديلة لتحديد الجدوى خلية من خلايا القرص بواسطة الهضم الأولية باستخدام الهضم متتابعة من المصفوفة خارج الخلية باستخدام pronase كولاجيناز واكتب 2 ثم إلى وصمة عار على تعليق الخلية 7. إصدار سابق من البروتوكول المعنية خطوة الحضانة في برنامج تلفزيوني يحتوي على عشر مرات أكثر تركيزا تركيز البنسلين / الستربتومايسين ل10min بعد الحصاد من الأقراص قبل هيئة مكعبlture. مع الطائرة خطوة غسل هذه الخطوة يصبح عفا عليها الزمن منذ هذه الخطوة يبدو مفيدا لأغراض زراعة.

الشكل 1 لمحة عامة عن الخطوات المنهجية لإعداد الأقراص الفقرية العصعصية البقري مع endplates سليمة وطبقة رقيقة (1 - 2mm و) من العظام. أ) عرض تخطيطي للقرص الفقرية (IVD) وممراتها الغذائية. ب) إجراء لقطع IVD مع تخصيص شفرة حامل والصناعية شفرة حادة. C) جت الخطوة غسيل عالية لضمان بقاء الخلية ، وتمكين تبادل المغذيات حفظ endplates و 1-2 ملم من العظم يعلق على كلا الجانبين. D) وأخيرا يمكن أن يكون المثقف في IVD في غرفة عينة من مفاعل حيوي أو استخدامها لأي تطبيق أسفل النهر.
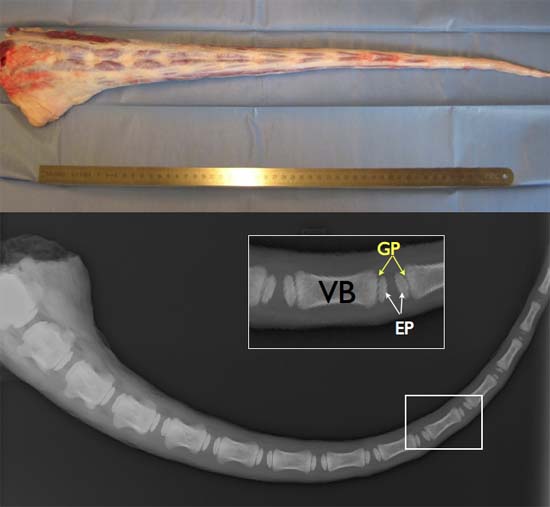
الشكل 2 TOP : طول الذيل البقري الطازج كامل (مثالي obtaINED ضمن 2-3 ساعات بعد الوفاة لضمان استمرارية ارتفاع الخلية. القاع : الأشعة السينية صورة ذيل الأبقار تتراوح اعمارهم بين 6 أشهر تبين وجود لوحات النمو (GP) ، ومركز التعظم الثانوي ، وبين endplates العظمية (EP) والهيئات فقرة (VB).
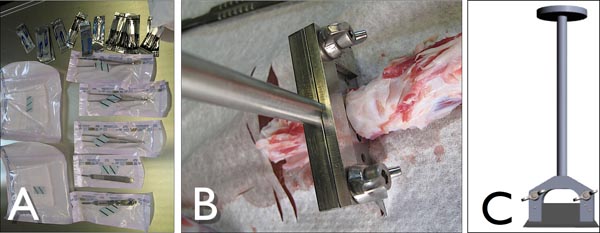
الشكل 3. وأدوات) لتشريح ذيل الأبقار تحت ظروف معقمة. ب) مخصص شفرة حامل لخفض التدريجي شرائح الحركي من الذيل البقري في العمل في حين خفض القرص الفقرية. C) الجانبية نظرا لتخصيص شفرة حامل بشفرة الصناعية القياسية (لوتز ، ألمانيا).

الشكل 4. رسم وصورة للذيل الأبقار بعد إزالة العضلات المحيطة بها والتي توضح مواقع الرباط الشق لقطع شرائح الحركي. وينبغي أن يكون جزئيا فقرة "تصدع" وايصاحب ال شفرة مصنوعة خصيصا مثالي 1-2 ملم بعيدا عن endplates الغضروفية لضمان كامل سطح العظام.
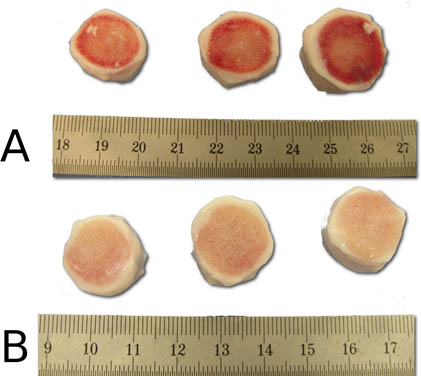
الشكل 5. تظاهرة للتنظيف الفعال للخطوة قبل غسل النفاثة (A) وبعد (B). لاحظ السطوح النظيفة العظمي من قطاعات القرص الفقري بعد إجراء الرش.
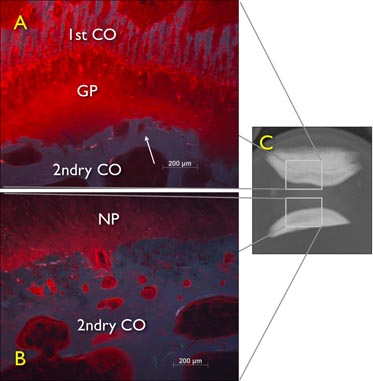
الشكل 6. الحرة تورم تجربة نشر الطازجة رفعه الأقراص الفقرية ذيل الأبقار (IVDs) ترك لمدة 24 ساعة في محلول 1 ٪ procion الحمراء ، مما يدل على تأثير الحصار عن لوحة النمو. IVD والأشعة السينية الرقمية نظرا لسهمي التي لا تزال تتضمن لوحة النمو ، وطبقة ثانية من العظام صورة المجهر الفلورسنت من خلال خفض السهمي العصعصية البقري يزدرع القرص الفقرية مع endplate الغضروفية العظمية وبعد 24H نشر مجانا. سباق الجائزة الكبرى : لوحة النمو ، 2ndry ثاني : مركز ثانوي من التحجر.

الرقم 7. الحرة تورم تجربة الطازجة رفعه الأقراص الفقرية ذيل الأبقار (IVDs) ترك لمدة 24 ساعة في محلول 1 ٪ procion الحمراء ، مما يدل على تأثير العلاج التنظيف غسل طائرة. سميكة المقاطع السهمي (~ 100 ملم) من الأبقار IVDs رفعه مع لوحات ~ 1.5 mmthick نهاية العظمية التي خضعت الطائرة غسل المعالجة (يسار) الجانب السيطرة من دون علاج (يمين) النفاثة lavaged العلاج. مدخل يظهر نمط الرش ، التي كانت تستخدم من نظام إنضار الجرح زيمر 24H التجارب نشرها خالية من الأبقار explants القرص الفقرية في أحمر procion 1 ٪.
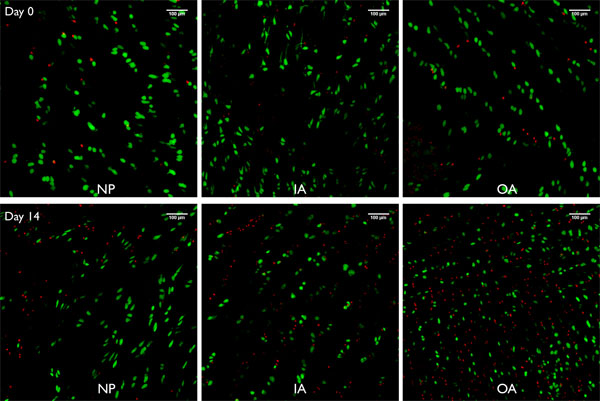
الرقم 8. الصور الحية / الميت من اسقاطات مداخن التصوير مبائر (250μm) مأخوذة من بوفينه قطاعات القرص الفقرية أعدت مع هذا الأسلوب النفاثة غسل قيد تورم خالية من 0 و 14 يوما على التوالي لالنواة اللبية (NP) ، والحلقة الليفية الداخلية (IA) والخارجي الحلقة الليفية (OA). أخضر = الخلايا خلايا حية ملطخة AM بواسطة calcein (methylester الاسيتيل) ، خلايا الدم الحمراء = نواة الخلايا الميتة التي اتسخت بسبب إيثيديوم homodimer - 1.
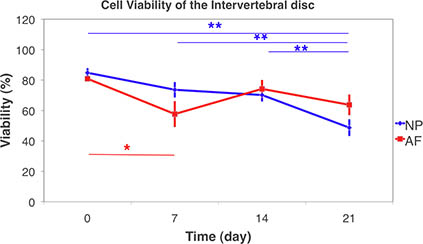
الرقم 9. بقاء الخلية من الأقراص الفقرية باستخدام الليزر مبائر المجهر على الأنسجة الحية و3D مسح المكدس. بقاء الخلية من النواة اللبية (NP) والتليف الحلقة (بالعربية) على مدى 21 يوما في إطار ثقافة حرة تورم الشرط. (متوسط ± SEM ، ن = 6) تم اختبار الفروق الإحصائية باستخدام غير المعلمية ، كروسكال واليس وقعت رتبة اختبار مبلغ بين الجماعات. تم العثور على اختلافات كبيرة بين يوم 21 و جميع النقاط مرة أخرى في NP. بينما في الخلافات AF كبيرة تم العثور على ما بين 7 إلى اليوماليوم 0. (* ع <0.05 ** ، ع <0.01).
Discussion
الخطوة الأولى للثقافة الجهاز الناجح هو للتأكد من أنه لا ينبغي أن تكون ملوثة يزدرع. وينبغي أن البشرة الذيل قبل البدء لهذا الإجراء. يمكن لأي وبر جلبت الى مختبر معقم يكون إشكاليا من حيث التلوث. وينبغي أن يكون الذيل البقري الطازج مثالي ممكن (وهذا يؤثر على بقاء الخلية الأو?...
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
وقد أيد هذا المشروع من قبل مؤسسة العلوم الوطنية السويسرية (SNF 310030-127586/1 #).
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليق (اختياري) |
| الأبقار الطازجة الأنسجة القرص الفقرية من ذيول البقر ، من المسلخ المحلي (مثالي في غضون ساعات بعد الوفاة وبدون الجلد). | |||
| Pulsavac بلاس نظام AC | زيمر المؤتمر الوطني العراقي. وسويسرا | 00-5150-486-01 | أفضل أداء مع رئيس الهيب مع الرش وتزويد طاقة التيار المتناوب (واحد مع حزمة بطارية AA 8 لا يعمل أيضا ولكنها أقل ملاءمة) |
| القدرات العالية فان الرذاذ ث / درع سبلاش ، وطول 12.7cm | زيمر المؤتمر الوطني العراقي. وسويسرا | 00-5150-175-00 | نحن اختبار هناك العديد من رؤساء الرش المتاحة ، وهذا واحد بنجاح |
| شفرات المشرط # 22 و # 10 | سوان ، مورتعلى وانكلترا | # 10 : 0201 # 22 : 0208 | |
| مشرط حامل شفرة # # 3 و 4 | هوسمان ، ألمانيا | # 3 : 06.103.00 # 4 : 06.104.00 | |
| لوتز الصناعية شفرة | لوتز ، ألمانيا | 1022.0884 | |
| الفوسفات مخزنة المالحة (PBS) | Invitrogen ، سويسرا | 10010-023 | |
| Dulbecco في التعديل النسر متوسطة (DMEM) | Gibco ، سويسرا | 11960-044 | |
| Lactated محلول رينغر (بدون سكر) | Bichsel ، سويسرا | 133 0002 | |
| 6 جيدا متعددة كذلك لوحة | TPP ، سويسرا | 92006 | |
| Betadine الحل | Mundipharma ، سويسرا | 10055025 | |
| الجلد الجراحية علامة | Porex الجراحية ، سويسرا | 9560 | |
| قطع كبيرة متنها | أي نوع من الممكن | ||
References
- Lee, C. R., Iatridis, J. C., Poveda, L., Alini, M. In vitro organ culture of the bovine intervertebral disc: effects of vertebral endplate and potential for mechanobiology studies. Spine (Phila Pa 1976). 31, 515-522 (1976).
- Chan, S. C. W., Gantenbein-Ritter, B., Leung, V. Y., Chan, D. Cryopreserved intervertebral disc with injected bone marrow-derived stromal cells: a feasibility study using organ culture. Spine. J. 10 (6), 486-496 (2010).
- Chan, S. C., Ferguson, S. J., Wuertz, K., Gantenbein-Ritter, B. Biological Response of the Intervertebral Disc to Repetitive Short Term Cyclic Torsion. Spine (Phila Pa 1976). , (2011).
- Gantenbein-Ritter, B., Sprecher, C. M., Chan, S., Illien-Jünger, S., Grad, S. Confocal imaging protocols for live/dead staining in three-dimensional carriers. Methods Mol. Biol. 740, 127-140 (2011).
- Gantenbein-Ritter, B., Potier, E., Zeiter, S., van der Werf, M. Accuracy of three techniques to determine cell viability in 3D tissues or scaffolds. Tissue Engineering Part C Methods. 14, 353-358 (2008).
- Rasband, W. S. . ImageJ. , (1997).
- Haschtmann, D., Stoyanov, J. V., Ettinger, L., Nolte, L. P., Ferguson, S. J. Establishment of a novel intervertebral disc/endplate culture model: analysis of an ex vivo in vitro whole-organ rabbit culture system. Spine. 31, 2918-2925 (2006).
- Gantenbein, B., Grünhagen, T., Lee, C. R., van Donkelaar, C. C. An in vitro organ culturing system for intervertebral disc explants with vertebral endplates: a feasibility study with ovine caudal discs. Spine. 31, 2665-2673 (2006).
- Korecki, C. L., Kuo, C. K., Tuan, R. S., Iatridis, J. C. Intervertebral disc cell response to dynamic compression is age and frequency dependent. J. Orthop. Res. 27, 800-806 (2009).
- Korecki, C. L., MacLean, J. J., Iatridis, J. C. Dynamic compression effects on intervertebral disc mechanics and biology. Spine (Phila Pa 1976). 33, 1403-1409 (1976).
- Jim, B., Steffen, T., Moir, J., Roughley, P., Haglund, L. Development of an intact intervertebral disc organ culture system in which degeneration can be induced as a prelude to studying repair potential. European Spine Journal. , 1-11 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved