Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kızılötesi Matriks destekli lazer desorpsiyon Elektrosprey İyonizasyon tarafından tüm vücut Kütle Spektrometre Görüntüleme (IR-MALDESI)
Bu Makalede
Özet
A mass spectrometry imaging (MSI) source operated at atmospheric pressure was developed by coupling mid-infrared laser desorption and electrospray post-ionization. Exogenous ice matrix was used as the energy-absorbing matrix to facilitate resonant desorption of tissue-related material. This manuscript provides a step-by-step protocol for performing IR-MALDESI MSI of whole-body neonatal mouse.
Özet
kütle spektrometresi (MS) için ortam iyonizasyon kaynakları, son on yıl içinde çok ilgi konusu olmuştur. Matris destekli lazer desorpsiyon elektrosprey iyonizasyon (MALDESI) bu tür yöntemler, örnek olarak burada matris destekli lazer desorpsiyon / iyonizasyon (MALDI) (ör desorpsiyonu darbeli) VE elektrosprey iyonizasyon (ESI) (örneğin, yumuşak iyonizasyon özellikleri ) birleştirilir. MALDESI önemli avantajlarından biri, kendine özgü çok yönlülük olduğunu. MALDESI deneylerde, bir ultraviyole (UV) ya da kızıl ötesi (IR), lazer rezonant bir endojen veya eksojen matris uyarmak için kullanılabilir. matrisin seçimi bağlıdır analit değildir ve uyarma için kullanılan lazer dalga boyu sadece bağlıdır. IR MALDESI deneylerde, buz ince bir tabaka, bir enerji emici matris numunenin yüzeyi üzerinde bırakılır. IR-MALDESI kaynak geometri, istatistiksel sıvı numunelerin analizi için deneyler (DOE) tasarımı yanı sıra biol kullanılarak optimize edilmiştirogical doku örnekleri. Ayrıca, güçlü bir IR MALDESI görüntüleme kaynağı ayarlanabilir bir orta-IR lazer bilgisayar kontrollü bir XY öteleme aşamasında ve yüksek çözme gücü kütle spektrometresi ile senkronize edilir burada geliştirilmiştir. Özel bir grafik kullanıcı arayüzü (GUI) lazer tekrarlama oranı kullanıcı seçimine izin verir, voksel başına çekim, örnek aşamasının adım büyüklüğü ve desorpsiyon arasındaki gecikme ve kaynak olayları tarama sayısı. IR MALDESI bir biyolojik doku bölümlerinin elyaflar ve boyalar ve MSI adli analizler gibi uygulamalar çeşitli kullanılmıştır. endojen metabolitlerin doku bölümlerinde eksojen ksenobiyotiklerin kadar farklı analitler dağılımı ölçüldü ve bu tekniği kullanılarak belirlenebilir. Bu yazıda sunulan protokol tüm vücut doku kesitlerinde IR-MALDESI MSI için gerekli önemli adımları açıklar.
Giriş
mikroprob modunda Kütle spektrometrisi görüntüleme (MSI) bir numunenin yüzeyi üzerinde ayrı ayrı konumlarda bir kiriş (lazer veya iyonlar) bir yüzeyinden numunenin geri çekilmesine içerir. Her bir tarama noktasında, bir kütle spektrumu oluşturulur ve elde edilen spektrum, toplandıkları olan uzamsal konumu ile birlikte, eş zamanlı olarak numune içinde çok sayıda analiti eşlemek için kullanılabilir. Duyarlılık ve kütle spektrometresi özgüllüğü bağlanmış görüntüleme Bu etiket serbest bir şekilde MSI kütle spektrometresi 1,2 en hızlı gelişen alanlarından biri haline gelmesine yardımcı oldu.
Matris destekli lazer desorpsiyon / iyonizasyon (MALDI) MSI, analizler için en yaygın olarak kullanılan iyonizasyon yöntemidir. Bununla birlikte, bir organik matris ihtiyacı ve MALDI vakum şartları tekrarlanabilirlik, örnek hacmi ve yöntemi kullanılarak analiz edilebilir numune türleri önemli sınırlamalar getirmektedir. atmosfer basıncı (AP) io bir dizizasyon yöntemleri, bu kısıtlamaları 3 aşmak için son yıllarda geliştirilmiştir. Bu ortam iyonizasyon yöntemleri doğal duruma daha yakındır ve analiz öncesinde örnek hazırlama adımları basitleştirmek bir ortamda biyolojik numunelerin analizi için izin verir. Matris destekli lazer desorpsiyon iyonizasyon elektrosprey (MALDESI) bu tür bir iyonizasyon yöntemi, 4,5 örneğidir.
IR MALDESI deneylerde, buz ince bir tabaka enerji emici matris olarak doku yüzeyi üzerine bırakılır. Bir orta-IR lazer darbeli buz matris tarafından emilir ve su modu uzanan rezonant verici OH ile yüzeyinden doğal malzemelerin geri çekilmesine kolaylaştırır. Bir dik elektropüskürtmeyle tahsil damlacıkları ve içine desorbe nötr bölümü sonrası iyonize bir ESI gibi moda 4-6 bulunmaktadır. eksojen buz matris eklenmesi bu ac yardımcı beri dokuda endojen su dayanmak tercih edilirfarklı doku bölümlerinde su miktarındaki değişimleri sayısı, ve • doku görüntüleme deneylerinde 7,8 15 misli iyon bolluğu desorpsiyon 6 geliştirmek ve iyileştirmek için gösterilmiştir.
Bu çalışmada, IR-MALDESI MSI yenidoğan fare bütün vücutta değişik organlarda genelinde metabolitleri dağılımını ortaya çıkarmak için kullanmaktadır. IR-MALDESI kaynağı ayarlanabilir parametreleri bir bakış verilir ve doku kesitlerinin başarılı görüntüleme için gerekli adımlar gösterilmektedir.
Protokol
Not: Aşağıdaki protokol IR-MALDESI MSI deneyler için gerekli tüm adımları açıklamaktadır. Derinlemesine optimize IR-MALDESI kaynağı geometrisi ve lazer sahnede ile senkronizasyon ve kütle spektrometresi ile ilgili ayrıntılar başka bir yerde 5,6 bulunabilir. Bu protokolde kullanılan hayvan doku örnekleri Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) ve North Carolina State University düzenlemelerine göre elde edilmiştir.
1. Doku Hazırlanması
- Bir çeker ocak içinde bir kuru buz sekonder kap içinde temiz bir beher içinde ~ izopentan 200 ml yerleştirerek izopentan / kuru buz banyosu hazırlayın. izopentan / kuru buz banyosu ve doku tutarken her zaman koruyucu eldiven ve koruyucu gözlük kullanın.
- Avertin aşırı doz 2 günlük bir bütün yenidoğan yavru fare (7.5 mg / g vücut ağırlığı) ile öldürülür ve doku yapısını korumak için izopentan / kuru buz banyosu içinde doku dondurma. Önceden temiz kullanınforseps ed çifti koyun ve izopentan / kuru buz banyosundan cryomold fare yavru çıkarmak için. analize kadar -80 ° C 'de yakma dondurulmuş doku saklayın.
- Koruyucu eldiven kullanarak, bir 40 mm kriyostat numune diske optimum kesim sıcaklığında (OKT) montaj orta bir tabaka uygulayın. Yavaşça kesit için istenen yönde diske fareyi uymak için Ekim kaplı numune tutucu üzerine dondurulmuş bütün fare yerleştirin.
Not: Ekim sadece kesit için örnek diske dokuyu yapıştırmak için kullanılır. OCT tamamen değil embed doku yapmak ve Ekim MSI analizi üzerinde zararlı etkileri olduğu bilinmektedir gibi aşırı kaçının. Jelatin gibi diğer medya, 9 o dilimleme önce doku-embed cryo için kullanılabilir. - kriyostat ve basın Peltier güç düğmesine Peltier numune tutucuya (OKT ve doku bölümlü) disk yerleştirin. Numune termal dengeye gelmesi için 10 dakika bekleyin.
- Doku üzerine monte edilmiş (numuneler disk yerleştirinDisk yuvasındaki o) ve analiz için istenen düzleme aşağı doku yüz. Kriyostat 10 içinde bulunan döner bir mikrotom kullanılarak -20 ° C 'de istenen kalınlıkta bölümler halinde doku dilim.
Not: Tüm vücut analizleri için, doku bütünlüğünü korumak için 25 mikron kalınlığında bölüme doku dilim. Küçük bölgeler (örneğin, karaciğer, beyin, böbrek) için, 10 mikron kalınlığında bölüme doku dilim.- yuvarlanmasını dilimlenmiş doku bölümü önlemek için anti-roll cam plakayı kullanın. İstenmeyen doku enkaz kaldırmak için kriyostat vakum hortumunu ve fırçalar kullanın. Doku kesitli sonra, kişisel yaralanmaları önlemek için keskin mikrotom bıçağı kapsayacak şekilde bıçak koruyucusu kullanın.
- Orient fare numune plakası bölümü ve 10 dokunmadan, doku kesiti mümkün olduğu kadar yakın bir slayt getiren ön temizlenmiş cam mikroskop lamı üzerine çözülme monte.
Not: Nicel MSI deney içinments, mont önce dokuyu montaj otomatik pnömatik püskürtücü kullanılarak bir iç standart slayt ve-çözülme montaj kaplı slayt 11 doku bölümü. - Bıçak çıkartıcısını kullanarak dokuyu kesit için kullanılan mikrotom bıçak çıkarın ve güvenli bir şekilde uygun "keskin atık" kapta bıçak atın.
- doku kriyopreservasyona korumak için Adım 3.2 kadar kriyostat içinde cam slayt tutun.
2. IR-MALDESI Hazırlık / Kalibrasyon
- orta-IR lazer açın ve bilgisayara lazer kontrol uygulamasını başlatmak. üretici tarafından sağlanan lazer kontrol uygulamasını kullanarak istenen dalga boyunu seçin. IR MALDESI deneyler tipik haliyle 2,940 nm gerçekleştirilir.
Not: Son deneyler orta-IR lazer dalga boylarında bağımlılığı ve 8 özel analit gibi görünen kaydetti farklılıklar buz matrisi araştırdık. - erkeklere açıne kontrolörü, özel kullanıcı kontrol programı (RASTIR) başlatmak ve ev düğmesini kullanarak sahne pozisyonunu kalibre.
- elektro çözüm hazırlayın. Tipik haliyle, pozitif iyon modunda elektrosprey çözücü% 0.2 formik asit ile 50:50 (h / h) metanol / su kullanın. deneye göre elektrosprey çözücü bileşimi seçin. Örneğin, negatif iyon modunda görüntüleme uygulamaları için elektrosprey modifiye edici olarak 5 mM amonyum hidroksit kullanmak.
IR-MALDESI MSI geçiş polaritesi için modifiye edici olarak 1 mM asetik asit kullanımı: edin. Bu değiştirici pozitif ve negatif iyon modlarında 12 hem de sabit ve tekrarlanabilir bir sinyal elde etmek için en uygun bulunmuştur. - elektrosprey çözücü ile 1 ml şırınga doldurun ve yeni bir çözücü ile silika kılcal yıkayın.
- Gibi ESI-nokta mesafesi olarak kaynak parametrelerini kullanarak MS girişi ile ekseninde ESI yayıcı hizalayın istatistiksel DO kullanılarak optimize edilmiş mesafeyi, örnek yüksekliği ve çözücü akış hızı-giriş nokta Doku bölümleri 6 analizi için e. Not: doku kesitlerinde MSI şematik resmeden bu parametreleri ve optimize edilmiş değerleri Şekil 1'e bakınız.
- elektrosprey başlatın ve bu noktada, sadece ortam bileşiklerden oluşur toplam iyon akımı (TIC) izleyerek istikrarını (> 10 dk) değerlendirir. Tipik olarak, <% 10 10-15 dakika bir TIC varyasyon istikrar iyi bir göstergesidir.
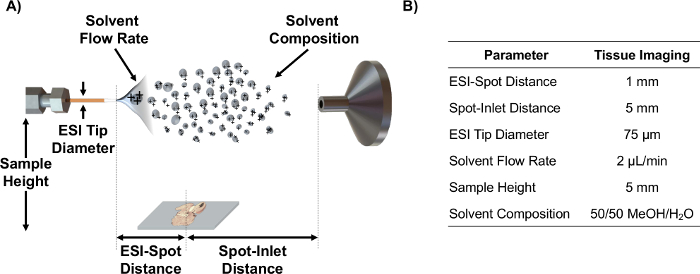
Şekil 1. IR-MALDESI şematik ve parametreler. IR-MALDESI kaynak kurulumu (ölçeksiz) ve ayarlanabilir parametreler (A) şematik. (B) Optimize parametre değerleri doku kesitlerinde görüntüleme için. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Dikkat: Sahnede örnek yerleştirmeden önce elektrosprey kapatın.
- kamera görüntüsü içinde IR-MALDESI örnek plaka üzerine çözülme monte doku yerleştirin.
- Emin Eller ESI yayıcı açık ve elektrosprey yeniden emin olun.
- doku yüzeyinde su yoğuşmayı önlemek için kuru azot IR-MALDESI Kaynak ve boşaltma muhafazanın erişim kapağını kapatın. muhafaza ulaşır içinde bağıl nem kez <% 3, örnek plaka serin olacak Peltier plakasına DC güç kaynağı (~ 12 V), açın. Not: Peltier soğutulmuş aşamasında soğutma işlemi başka, 13 ayrıntılı olarak ele alınmıştır.
- ° C -9 sahne soğutun ve monte doku termal dengede (~ 5-10 dk) gelmek için izin verir.
- Azot tasfiye durdurun ve kaynak erişim kapağını açarak ortam bağıl neme doku maruz bırakmaktadır. buz ince bir tabaka co üzerine yatırılırLD Peltier aşamasının yüzeyi ve havadaki su desüblimleştirilmesi doku bölümü monte edilebilir.
Not: Laboratuarda bağıl nem% 10-15 altında ise, buzlu matriks tabakasının oluşumunu kolaylaştırmak için mahfaza içinde sıcak su kabı yerleştirin. - Buz matriks tabakasının oluşmasından sonra, erişim kapağını kapatın ve 10 ±% 2 bağıl nemi düşürmek kuru nitrojen akışı yeniden. Bu düzeyde nispi nemi tutmak için azot akış hızını ayarlamak, ampirik deney 6 boyunca buz sabit bir tabaka korumak için buz oluşumu ve yüceltme denge bulundu.
4. Kütle Spektrometre Görüntüleme Veri Toplama
- RASTIR GUI (Şekil 2) kullanılarak, "LAZER pozisyonu" butonuna tıklayarak analiz konumuna sahneye taşımak. bir off-doku bölgesi kesilip olacak emin olmak için lazer ayar diyot kullanın. bir off-doku yeniden bir lazer atışıgion kamera görüntüsü ile ilgili ofset lazer kalibre etmek için. Lazer konumunu güncellemek için "Lazer Testi Ateş" düğmesini tıklayın.
- "KAMERA pozisyonuna" dönün ve lazer ablasyon nokta (Şekil 2-1) lazer hizalama reticle koyarak RASTIR lazer konumunu güncelleyin.
- (Şekil 2-2) faiz (ROI) düğmesinin bölgeyi tıklayın ve analiz edilen doku bölümü için ROI boyutunu ve konumunu ayarlayın. Girdi uygun deneysel gibi X ve (mm) Y yönlerinde (Şekil 2-3) adım büyüklüğü gibi parametreler ve "Proje Adı" kutusuna (Şekil 2-4) MSI dosya adı.
- Bir ROI çizerken, kontrol olarak hizmet veren kapalı dokusunun bir kısmını içermektedir. zirve toplama için bu off-dokuda bölümü (5.4 Adım) kullanın.
Not: doku üzerinde lazer desorpsiyon çapı (spot boyutu) yaklaşık 150 mikron olduğu; Bununla birlikte, daha yüksek uzamsal çözünürlük USI ile elde edilebilirörnekleme yöntemi 14,15 ng.
- Bir ROI çizerken, kontrol olarak hizmet veren kapalı dokusunun bir kısmını içermektedir. zirve toplama için bu off-dokuda bölümü (5.4 Adım) kullanın.
- Açılan kutu, voksel başına lazer darbeleri (tamsayı değerleri) sayısı ve lazer tetik ve kütle spektrometresi sinyal alımı (Şekil 2-5) arasındaki gecikme uygun lazer frekansını seçin. Tipik ölçüm 5 kütle analizörü ulaşmak için oluşturulan iyonları izin vermek için bir 10 msn gecikme süresi ile tamamen bir IR-MALDESI MSI deneylerinde malzemenin uzaklaştırılması için 20 Hz voksel başına iki lazer darbeleri kullanın.
Not: Lazer çalışabilen en yüksek tekrarlama oranı seçin. Son zamanlarda yüksek tekrarlama oranı kullanılarak analit bulgulanabilirliği 16 artıracağını gösterilmiştir.
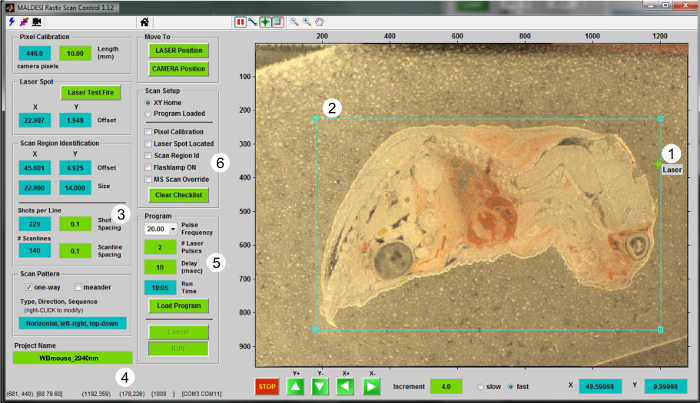
IR-MALDESI MSI işlemi için Şekil 2. Kullanıcı arayüzü. RASTIR Tarama Kontrol programı ekran görüntüsü sunulmuştur. perf için adımlar(5) doğru numarayı seçerek, (1), lazer nokta bulma (2) Bir ROI çizim, (3) (mm) aşama aşama boyutunu seçme, (4) dosyasına bir ad vererek vardır MSI deney oluşturmayan görüntüleme ve MS kurulum için listeyi kontrol istenen tekrarlama oranı ve (6) ile birlikte vokselin başına bakliyat. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Böyle iyonizasyon modunda elektrosprey gerilim, çözücü akış hızı, kılcal sıcaklık ve kütle spektrometresi yazılımı enjeksiyon süresi gibi kütle spektrometresi parametrelerini seçin. Tüm vücut IR-MALDESI MSI kullanılan parametrelerin bir örnek için Tablo 1'e bakınız.
Not: nedeniyle biyolojik örnekler MSI analizlerinde ayırma yöntemlerinin eksikliği karmaşıklığı, IR-MALDESI kaynağı, yüksek çözme gücü ve yüksek kütle hassasiyeti alete bağlanır. Bir satın alma yöntemi analizi kullanılmıştır için yüklenebilirBöyle MSI 12 anahtarlama paralel reaksiyon izleme (PRM) 7 veya polarite olarak es. - Tüm parametreler (lazer, sahne ve kütle spektrometresi) seçilmiştir, senkronizasyon için "el sıkışma" modunda MS yerleştirin ve MS alımı başlatabilirsiniz.
- Kutuları işaretleyerek tamamlanan tüm adımları kontrol listesinde (Şekil 2-6) doğrulamak ve program yüklemek, RASTIR görüntüleme yazılımı kullanarak. Program yüklendikten sonra, "Çalıştır" düğmesi kullanılabilir olacaktır. Basın Çalışma MSI sinyal alımını başlatmak için.
- görüntüleme deney tamamlandıktan sonra, kütle spektrometresi edinme durdurmak ve bekleme modunda aleti koyun. , Kasaya azot tasfiye kapatmak Peltier plakasına güç kaynağını kapatın ve sahne denetleyicisi ve lazer kapatın.
- Erişim kapağını açın kaynak muhafaza içinden elektrosprey yayıcı ucu çıkarın ve koruyucu eldiven kullanarak genişletilmiş ısıtılmış metal MS girişi kaldırmak. Dikkat: genişletilmiş Metal MS girişi çok sıcak olacak.
- eldiven ve koruyucu gözlükler takan 10 dakika için HPLC-grade metanol içinde son 10 dakika için HPLC-grade su içinde, daha sonra 10 dakika boyunca% 15 nitrik asit içinde ultrasonik banyo genişletilmiş metal kapiler giriş temizleyin ve. bir azot akımı altında metal kapiler giriş kurutun ve MS içine takın. Not: sonra uygun çöp konteynerleri solvent bertaraf edin.
| Parametre | değer |
| İyonizasyon modu | pozitif |
| Elektro Gerilim | |
| Solvent Akış Hızı | 2 ul / dakika |
| kılcal Sıcaklık | 275 ° C |
| tarama Aralığı | m / z 250-1,000 |
| Tarama tipi | Tam tarama |
| enjeksiyon süresi | 110 msn |
| çözümleniyor Güç |
Tüm vücut IR-MALDESI MSI kullanılan Tablo 1. Enstrüman parametreleri.
5. Veri Analizi
- Böyle MSConvert 17 ve imzML dönüştürücü 19 olarak özgür yazılım kullanarak bu tür mzXML 17 veya imzML 18 olarak veri formatları cihaz tarafından oluşturulan ham veri dosyalarını dönüştürün.
- MSiReader v1.0, özel bir işleme bilgisayarda, yüksek çözme gücü MSI veriler 20 analizi için geliştirilmiş bir açık kaynak yazılımını başlatın. MSiReader üzerine görüntüleme dosyasını yükleyin. Kullanıcı MSiReader arayüzü ve yerleşik bazı özellikleri için bakınız Şekil 3.
- Kendi m / z girerek bunlar analit iyon haritaları üretmek ve milyon başına kısım olarak uygun bir m / z pencere (ppm) ya da Thomson (Th) (Şekil 3-1) seçin. yüksek çözme gücü (RP) enstrümanlar içinDüşük ppm aralığında bir pencereyi seçin.
Not: Uygun m / z pencere IR MALDESI kaynak bağlanmış olduğu cihazın RP ve kütle ölçüm doğruluğu (MMA) bağlıdır. - Dahası bu tür enterpolasyon (Şekil 3-2), normalleşme (Şekil 3-3), optik görüntü bindirme (Şekil 3-4), ve tepe (Şekil 3-5) 20 toplama gibi yerleşik özellikleri kullanarak verileri yorumlamak.
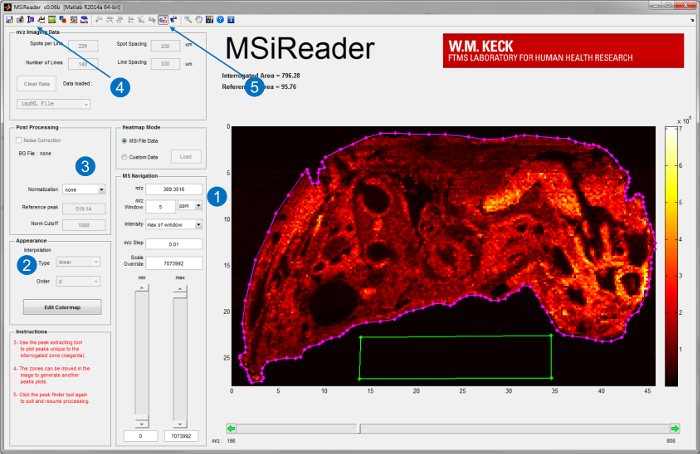
Şekil 3. MSiReader Kullanıcı arayüzü; v1.0 20. Bir dosya yazılımı yüklenir sonra, ilgilenilen analitlerin iyon haritaları (1) ppm veya Th m / z ve hoşgörüyü girerek görüntülenir. örneğin (2) birbirinden ayırmayı veya (3) normalleştirme gibi başka analizi de gerçekleştirilebilir. doku bir optik görüntü ithal ile bindirilebiliriyon haritaları (4) daha iyi görüntülenmesi için. Hedefsiz doku (mor çizgi) alanı ve referans alanı dışı doku (yeşil kutu) seçerek dokuya spesifik zirveleri ayıklamak için kullanılabilecek fonksiyonunu (5) toplama tepe analizleri için. Daha büyük bir versiyonunu görmek için buraya tıklayınız bu figür.
- Kullanıcı tanımlı kriterler kullanılarak doku-spesifik m / z değerleri listesini oluşturmak için zirve toplama işlevini kullanın. Not: PeakFinder algoritması iki bölgenin ortalama kütle spektrumunda farklarını kullanmaktadır. Bu m / z değerleri daha sonra METLIN 21 veya Lipid MAPS olarak metabolit veritabanlarına karşı aranabilir. 22
- Bir sorguya doku bölgesini (eflatun çokgen ROI) ve off-dokuda referans bölgesini (yeşil çokgen ROI) seçerek bir örnek için Şekil 3'e bakınız.
Sonuçlar
Şekil 4'te gösterilmiş görüntüler tüm vücut doku bölümünde farklı organlarda metabolitlerin dağılımını göstermektedir. Vücudun belirli bölgelerine benzersiz m / z değerleri bazı görüntü üretimi için toplu işlem, ardından MSiReader PeakFinder kullanılarak bulundu. Görüntü bindirme aracı (Şekil 3-4) elde edilen iyon haritaları ile buz matriks birikimi öncesi alınan optik görüntü hizalamak için kullanı...
Tartışmalar
protokol üzerinde bir IR-MALDESI MSI deneyi gerçekleştirmek için önemli adımlar açıklanır. Matris uygulama işlemi (bölüm 3), bir robot püskürtücü kullanarak kaplama sprey süblimasyon veya MALDI MSI deneyleri için tipik bir matris uygulaması işlemine benzer, yaklaşık 20 dakika alır. Ayrıca, IR-MALDESI matris kristalleri 6 içine analitlerin bölünmesi dayanmaz ve buz matrisi evrensel bakılmaksızın kitle, boyut, ya da kimyasal özelliklerinin tüm analitler için de kullanılabilir. ...
Açıklamalar
The authors declare no competing financial interests.
Teşekkürler
The authors thank Professor H. Troy Ghashghaei from NCSU Department of Molecular Biomedical Sciences for providing the whole mouse tissue. The authors also gratefully acknowledge the financial assistance received from National Institutes of Health (R01GM087964), the W.M. Keck foundation, and North Carolina State University.
Malzemeler
| Name | Company | Catalog Number | Comments |
| IR-MALDESI Source | Custom-made | N/A | Please refer to references 4 and 12 for an in-depth discussion of IR-MALDESI source development. |
| Q Exactive Plus | Thermo Scientific | Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer | |
| Water, HPLC Grade | Burdick & Jackson | AH365-4 | |
| Methanol, HPLC Grade | Burdick & Jackson | AH230-4 | |
| Formic Acid | Sigma Aldrich | 56302 | |
| Tunable mid-IR Laser | Opotek Inc. | IR Opolette | Tunable 2,700-3,100 nm IR OPO laser |
| Nitrogen Gas | Arc3 Gases | AG S-NI300-5.0 | Grade 5.0 high purity nitrogen gas cylinder (300) |
| Cryostat | Leica Biosystems | CM 1950 | Cryomicrotome |
| High Profile Microtome Blades | Leica Biosystems | 3802123 | Leica DB80HS |
| Mounting Medium (OCT) | Leica Biosystems | 3801480 | Surgipath FSC 22 mounting medium |
| Cryostat Specimen Disc | Leica Biosystems | 14047740045 | 40 mm diameter |
| Glass Microscope Slides | VWR | 48312-003 | Frosted, selected, pre-cleaned |
Referanslar
- Mcdonnell, L. A., Heeren, R. M. A. Imaging Mass Spectrometry. Mass Spectrom. Rev. 26, 606-643 (2007).
- Chughtai, K., Heeren, R. M. A. Mass spectrometric imaging for biomedical tissue analysis. Chem. Rev. 110 (5), 3237-3277 (2010).
- Robichaud, G., Barry, J. A., Muddiman, D. C. Atmospheric Pressure Mass Spectrometry Imaging. Encycl. Anal. Chem. , (2014).
- Sampson, J. S., Hawkridge, A. M., Muddiman, D. C. Generation and detection of multiply-charged peptides and proteins by matrix-assisted laser desorption electrospray ionization (MALDESI) Fourier transform ion cyclotron resonance mass spectrometry. J. Am. Soc. Mass Spectrom. 17 (12), 1712-1716 (2006).
- Robichaud, G., Barry, J. A., Garrard, K. P., Muddiman, D. C. Infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) imaging source coupled to a FT-ICR mass spectrometer. J. Am. Soc. Mass Spectrom. 24 (1), 92-100 (2013).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI Mass Spectrometry Imaging of Biological Tissue Sections Using Ice as a Matrix. J. Am. Soc. Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., et al. Mapping Antiretroviral Drugs in Tissue by IR-MALDESI MSI Coupled to the Q Exactive and Comparison with LC-MS/MS SRM Assay. J. Am. Soc. Mass Spectrom. 25 (12), 2038-2047 (2014).
- Rosen, E. P., Bokhart, M. T., Ghashghaei, H. T., Muddiman, D. C. Influence of Desorption Conditions on Analyte Sensitivity and Internal Energy in Discrete Tissue or Whole Body Imaging by IR-MALDESI. J. Am. Soc. Mass Spectrom. 26, 899-910 (2015).
- Nelson, K. A., Daniels, G. J., Fournie, J. W., Hemmer, M. J. Optimization of whole-body zebrafish sectioning methods for mass spectrometry imaging. J. Biomol. Tech. 24 (3), 119-127 (2013).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. J. Vis. Exp. (3), e194 (2007).
- Bokhart, M. T., Rosen, E., Thompson, C., Sykes, C., Kashuba, A. D. M., Muddiman, D. C. Quantitative mass spectrometry imaging of emtricitabine in cervical tissue model using infrared matrix-assisted laser desorption electrospray ionization. Anal. Bioanal. Chem. 407 (8), 2073-2084 (2015).
- Nazari, M., Muddiman, D. C. Polarity Switching Mass Spectrometry Imaging of Healthy and Cancerous Hen Ovarian Tissue Sections by Infrared Matrix-Assisted Laser Desorption Electrospray Ionization (IR-MALDESI). Analyst. 141, 595-605 (2016).
- Hsu, C. C., et al. Design and Application of a Low-Temperature Peltier-Cooling Microscope. J. Pharm. Sci. 85 (1), 70-74 (1996).
- Jurchen, J. C., Rubakhin, S. S., Sweedler, J. V. MALDI-MS imaging of features smaller than the size of the laser beam. J. Am. Soc.Mass Spectrom. 16 (10), 1654-1659 (2005).
- Nazari, M., Muddiman, D. C. Cellular-level mass spectrometry imaging using infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) by oversampling. Anal. Bioanal. Chem. 407 (8), 2265-2271 (2015).
- Rosen, E. P., Bokhart, M. T., Nazari, M., Muddiman, D. C. Influence of C-Trap Ion Accumulation Time on the Detectability of Analytes in IR-MALDESI MSI. Anal. Chem. 87, 10483-10490 (2015).
- Kessner, D., Chambers, M., Burke, R., Agus, D., Mallick, P. ProteoWizard: open source software for rapid proteomics tools development. Bioinformatics. 24 (21), 2534-2536 (2008).
- Schramm, T., et al. ImzML - A common data format for the flexible exchange and processing of mass spectrometry imaging data. J. Proteomics. 75 (16), 5106-5110 (2012).
- Race, A. M., Styles, I. B., Bunch, J. Inclusive sharing of mass spectrometry imaging data requires a converter for all. J. Proteomics. 75 (16), 5111-5112 (2012).
- Robichaud, G., Garrard, K. P., Barry, J. A., Muddiman, D. C. MSiReader: an open-source interface to view and analyze high resolving power MS imaging files on Matlab platform. J. Am. Soc. Mass Spectrom. 24 (5), 718-721 (2013).
- Smith, C. A., O'Maille, G., et al. METLIN: a metabolite mass spectral database. Ther. Drug. Monit. 27 (6), 747-751 (2005).
- Sud, M., et al. LMSD: LIPID MAPS structure database. Nucleic Acids Res. 35, D527-D532 (2007).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38 (7), 699-708 (2003).
- Takai, N., Tanaka, Y., Inazawa, K., Saji, H. Quantitative analysis of pharmaceutical drug distribution in multiple organs by imaging mass spectrometry. Rapid Commun. Mass Spectrom. 26 (13), 1549-1556 (2012).
- Liu, J., Gingras, J., Ganley, K. P., Vismeh, R., Teffera, Y., Zhao, Z. Whole-body tissue distribution study of drugs in neonate mice using desorption electrospray ionization mass spectrometry imaging. Rapid Commun. Mass Spectrom. 28 (2), 185-190 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır