Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Corps entier Spectrométrie de masse d'imagerie par infrarouge laser assistée par matrice désorption Electrospray Ionisation (IR-MALDESI)
Dans cet article
Résumé
A mass spectrometry imaging (MSI) source operated at atmospheric pressure was developed by coupling mid-infrared laser desorption and electrospray post-ionization. Exogenous ice matrix was used as the energy-absorbing matrix to facilitate resonant desorption of tissue-related material. This manuscript provides a step-by-step protocol for performing IR-MALDESI MSI of whole-body neonatal mouse.
Résumé
sources d'ionisation ambiantes pour la spectrométrie de masse (MS) ont fait l'objet d'un grand intérêt dans la dernière décennie. Laser assistée par matrice désorption ionisation par électronébulisation (MALDESI) est un exemple de ces méthodes, lorsque les caractéristiques de laser assistée par matrice de désorption / ionisation (MALDI) (par exemple, la nature puisée de désorption) et l' ionisation par électropulvérisation (ESI) (par exemple, soft-ionisation ) sont combinés. L'un des principaux avantages de MALDESI est sa polyvalence inhérente. Dans des expériences MALDESI, un rayonnement ultraviolet (UV) ou infrarouge (IR) laser peut être utilisé pour exciter de façon résonnante d'une matrice endogène ou exogène. Le choix de la matrice ne dépend pas de substance à analyser, et ne dépend que de la longueur d'onde du laser utilisé pour l'excitation. Dans les expériences IR MALDESI, une mince couche de glace se dépose sur la surface de l'échantillon comme matrice absorbant l'énergie. La géométrie de la source IR-MALDESI a été optimisé en utilisant la conception statistique des expériences (DOE) pour l'analyse d'échantillons liquides ainsi que bioldes échantillons de tissus ogique. En outre, une source solide d'imagerie infrarouge MALDESI a été mis au point, où un laser à infrarouge moyen accordable est synchronisé avec un étage XY de translation commandé par ordinateur et une résolution de spectromètre de masse élevée de puissance. Une interface utilisateur graphique personnalisée (GUI) permet la sélection de l'utilisateur du taux du laser de répétition, le nombre de coups par voxel, l'étape de taille de la scène de l'échantillon, et le délai entre la désorption et analyser les événements de la source. IR MALDESI a été utilisé dans diverses applications telles que l'analyse médico-légale des fibres et des colorants et des MSI des coupes de tissus biologiques. Répartition des différents analytes allant de métabolites endogènes aux xénobiotiques exogènes à l'intérieur des sections de tissu peut être mesurée et quantifiée en utilisant cette technique. Le protocole présenté dans ce manuscrit décrit les principales étapes nécessaires pour IR-MALDESI MSI des coupes de tissus du corps entier.
Introduction
Imagerie par spectrométrie de masse (MSI) en mode microsonde implique la désorption de l'échantillon à partir d'une surface par un faisceau (laser ou d'ions) à des emplacements discrets sur la surface d'un échantillon. A chaque point de trame, un spectre de masse est produit, et les spectres acquis, ainsi que la localisation spatiale à partir duquel ils ont été recueillis, peuvent être utilisés pour cartographier simultanément plusieurs analytes dans l'échantillon. Cette manière sans étiquette d'imagerie couplé à la sensibilité et la spécificité de la spectrométrie de masse ont aidé MSI devenir l' un des domaines en évolution le plus rapidement dans la spectrométrie de masse 1,2.
désorption laser assistée par matrice / ionisation (MALDI) est la méthode d'ionisation le plus couramment utilisé pour MSI analyse. Cependant, la nécessité d'une matrice organique et les conditions de vide de MALDI présentent des limitations significatives sur la reproductibilité, le débit d'échantillons et les types d'échantillons qui peuvent être analysés en utilisant la méthode. Un certain nombre de pression atmosphérique (AP) iométhodes d'organi- ont été développés ces dernières années pour contourner ces restrictions 3. Ces méthodes d'ionisation ambiantes permettent d'analyser des échantillons biologiques dans un environnement qui est beaucoup plus proche de leur état naturel et de simplifier la préparation des échantillons étapes préalables à l'analyse. Laser assistée par matrice désorption ionisation par électronébulisation (MALDESI) est un exemple d'un tel procédé d'ionisation de 4,5.
Dans les expériences IR MALDESI, une mince couche de glace se dépose sur la surface du tissu comme matrice absorbant l'énergie. Une impulsion laser infrarouge moyen est absorbée par la matrice de la glace, et facilite la désorption des matières neutres de la surface par excitation résonante OH mode d'étirement de l'eau. La neutres partition désorbé dans les gouttelettes chargées d'un électrospray orthogonale et sont post-ionisé dans un mode ESI-like 4-6. L'ajout de la matrice de glace exogène est préférée à compter uniquement sur l'eau endogène dans le tissu, car il aide accompte des variations de teneur en eau dans différents compartiments de tissus, et a été montré pour améliorer la désorption 6 et améliorer l' abondance des ions par ~ 15 fois 7,8 dans des expériences d'imagerie de tissus.
Dans ce travail, nous utilisons IR-MALDESI MSI pour susciter la distribution des métabolites dans les différents organes en tout un corps de souris néonatale. Un aperçu des paramètres réglables de la source IR-MALDESI est donnée, et les étapes nécessaires pour l'imagerie réussie des coupes de tissus sont démontrées.
Protocole
Remarque: Le protocole suivant décrit toutes les étapes nécessaires à la réalisation d'expériences IR-MALDESI MSI. En profondeur des détails sur la géométrie optimisée de la source IR-MALDESI et sa synchronisation avec le laser, le stade et le spectromètre de masse peuvent être trouvées ailleurs 5,6. des échantillons de tissus d'animaux utilisés dans ce protocole ont été obtenus selon Institutional Animal Care et utilisation Commission (IACUC) et règlements de l'Université d'État de Caroline du Nord.
1. Préparation des tissus
- Préparer un isopentane / bain de glace sèche en plaçant ~ 200 ml d'isopentane dans un bécher propre à l'intérieur d'un récipient secondaire de glace sèche dans une hotte. Utilisez des gants de protection et des lunettes de sécurité en tout temps lors de la manipulation du isopentane / bain de glace sèche et le tissu.
- Euthanasier 2-day-old chiot de la souris néonatale entier par overdose Avertin (7,5 mg / g de poids corporel), puis de geler le tissu dans le isopentane / bain de glace sèche pour préserver la structure des tissus. Utilisez un pré-nettoyageed paire de pinces pour placer et retirer le chiot de la souris dans cryomoule du isopentane / bain de glace sèche. Conservez le tissu flash-congelé à -80 ° C jusqu'à l'analyse.
- Utiliser des gants de protection, appliquer une couche de température de coupe optimale (OCT) milieu de montage sur un disque cryostat de l'échantillon de 40 mm. Placez délicatement l'ensemble souris congelée sur le porte-échantillon revêtu OPO pour respecter la souris sur le disque dans l'orientation souhaitée pour sectionner.
Remarque: octobre est utilisé uniquement pour faire adhérer le tissu à la platine pour sectionner. Ne pas le tissu complètement intégré dans l'OCT et éviter les excès que octobre est connu pour avoir des effets néfastes sur l'analyse MSI. D' autres médias, tels que la gélatine, peuvent être utilisés pour cryo-intégrer le tissu avant de le trancher 9. - Placez le disque (avec PTOM et section de tissu) sur le porte-échantillon Peltier en cryostat et appuyez sur Peltier bouton d'alimentation. Attendre 10 min pour l'échantillon à venir à l'équilibre thermique.
- Placez le disque d'échantillons (avec le tissu monté suril) à l'intérieur du porte-disque, et de faire face au tissu vers le plan souhaité pour l'analyse. Découper le tissu en tranches de l'épaisseur désirée à -20 ° C en utilisant un microtome rotatif logé à l' intérieur du cryostat 10.
Remarque: Pour les analyses du corps entier, trancher le tissu en sections de 25 um d'épaisseur pour maintenir l'intégrité des tissus. Pour les régions plus petites (par exemple, le foie, le cerveau, les reins), découper le tissu en sections de 10 um d'épaisseur.- Utiliser la plaque de verre anti-roulis pour empêcher la coupe de tissu coupé en tranches de rouler. Utiliser le tuyau et les brosses cryostat sous vide pour éliminer les débris tissulaires indésirables. Une fois que le tissu est sectionné, utilisez le protège-lame pour couvrir la lame de microtome pointu pour éviter les blessures personnelles.
- La section de souris orient sur la plaque d'échantillon et de dégel de fixation sur une lame de microscope préalablement nettoyé de verre en amenant le coulisseau le plus près possible de la section de tissu, sans le toucher 10.
Remarque: Pour quantitative expé MSIments, enduire la lame avec un étalon interne en utilisant un pulvérisateur pneumatique automatique avant le montage du tissu, et décongeler monter la section de tissu sur la lame revêtue 11. - Retirez la lame microtome utilisé pour sectionner le tissu à l'aide de l'éjecteur de lame, et jeter en toute sécurité la lame dans le conteneur "des déchets pointus" appropriée.
- Maintenir la lame de verre à l'intérieur du cryostat jusqu'à l'étape 3.2 pour maintenir la cryoconservation du tissu.
2. IR-MALDESI Préparation / Calibration
- Allumez le laser mi-IR et de lancer l'application de contrôle de laser sur l'ordinateur. Choisissez la longueur d'onde souhaitée à l'aide de l'application de commande de laser fourni par le fabricant. expériences IR-MALDESI sont généralement effectuées à 2940 nm.
Nota: Les expériences récentes ont étudié la dépendance de la mi-IR longueurs d'onde laser et la matrice de glace avec des différences relevées qui semblent être spécifique à l' analyte 8. - Allumez le cerfcontrôleur e, lancer le programme de contrôle utilisateur personnalisé (RASTIR), et étalonner la position de la scène à l'aide du bouton d'accueil.
- Préparer la solution électrospray. En règle générale, utiliser un 50:50 (v / v) méthanol / eau avec de l'acide formique à 0,2% pour le solvant électrospray en mode ions positifs. Sélectionner la composition de solvant d'électronébulisation selon l'expérience. Par exemple, utiliser 5 mM d'hydroxyde d'ammonium en tant que modificateur électrospray pour les applications d'imagerie en mode d'ions négatifs.
Remarque: Pour la polarité de commutation IR-MALDESI MSI, utiliser l'acide acétique 1 mM comme modificateur. Ce modificateur a été trouvé optimale pour obtenir le signal stable et reproductible dans les deux modes POSITIF et d'ions négatifs 12. - Remplir une seringue de 1 ml avec du solvant électrospray, et rincer le capillaire de silice avec un nouveau solvant.
- Alignez ESI émetteur sur l'axe avec MS entrée en utilisant les paramètres de source tels que la distance ESI-spot, spot-entrée distance, la hauteur de l'échantillon, et le débit de solvant qui ont été optimisés en utilisant DO statistiques E pour l' analyse des coupes de tissus 6. Note: Voir la Figure 1 pour un schéma dépeignant ces paramètres et des valeurs optimisées pour MSI des coupes de tissus.
- Démarrer le électropulvérisation et évaluer sa stabilité (> 10 min), en surveillant le courant ionique total (CIT) qui, à ce stade, est constitué uniquement de composés ambiantes. En règle générale, une variation TIC <10% par rapport à 10-15 min est une bonne indication de la stabilité.
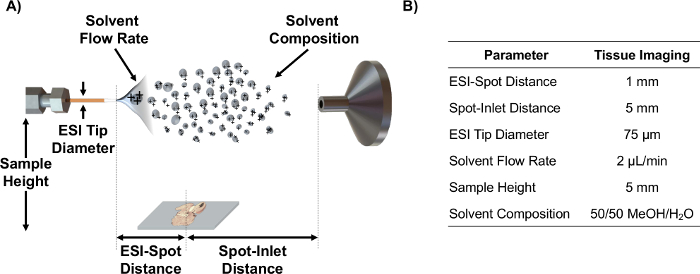
Figure 1. IR-MALDESI schématique et paramètres. (A) Schéma de configuration de la source IR-MALDESI (pas à l' échelle) et les paramètres réglables. (B) les valeurs des paramètres optimisés pour l' imagerie des coupes de tissus. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Attention: Éteignez le électrospray avant de placer l'échantillon sur la scène.
- Placez le tissu de dégel monté sur la plaque de l'échantillon IR-MALDESI dans la vue de la caméra.
- Assurez-vous que les mains sont claires de l'émetteur ESI et redémarrez le électrospray.
- Fermer la porte de la source et purge enceinte IR-MALDESI accès à l'azote sec pour éviter la condensation de l'eau sur la surface du tissu. Une fois que l'humidité relative à l'intérieur de l'enceinte atteint <3%, mettez l'alimentation en courant continu (~ 12 V) à la plaque Peltier, qui va refroidir la plaque d'échantillon. Remarque: Le processus de refroidissement dans le stade refroidi par effet Peltier est discuté en détail ailleurs 13.
- Refroidir la phase de -9 ° C, et laisser le tissu monté pour venir à l'équilibre thermique (~ 5 à 10 min).
- Arrêter la purge d'azote et d'exposer le tissu à l'humidité relative ambiante en ouvrant la porte d'accès source. Une mince couche de glace sera déposée sur la cosurface ld de la scène Peltier et monté coupe de tissu en raison de désublimation d'eau de l'air.
Remarque: Si l'humidité relative dans le laboratoire est en dessous de 10-15%, placer un bécher d'eau chaude à l'intérieur de l'enceinte afin de faciliter la formation de la couche de matrice de glace. - Après la couche de matrice de la glace se forme, fermer la porte d'accès et redémarrez le flux d'azote sec pour réduire l'humidité relative à 10 ± 2%. Régler le débit d'azote pour maintenir l'humidité relative à ce niveau, empiriquement constaté que l'équilibre de la formation de glace et de sublimation pour maintenir une couche constante de la glace tout au long de l'expérience 6.
4. Mass Spectrometry Imaging Acquisition de données
- Utilisation du RASTIR GUI (Figure 2), déplacer la scène à la position d'analyse en cliquant sur le bouton "position LASER". Utiliser la diode de réglage du laser pour garantir une zone hors du tissu sera soumis à une ablation. Incendie d'un tir laser dans un nouveau hors-tissugion pour étalonner le décalage par rapport à la vue de la caméra laser. Cliquez sur le bouton "Test Laser Fire" pour mettre à jour la position du laser.
- Retour à la position "CAMERA" et mettre à jour la position du laser dans RASTIR en plaçant le laser d' alignement réticule sur le spot d'ablation laser (Figure 2-1).
- Cliquez sur la région du bouton d'intérêt (ROI) et d' ajuster la taille et la position de retour sur investissement pour la coupe de tissu en cours d' analyse (Figure 2-2). Entrée paramètres expérimentaux appropriés , tels que la taille de pas en X et Y (en mm) (Figure 2-3), et le nom du fichier MSI dans la case "Nom du projet" (Figure 2-4).
- Lors de l'élaboration d'un retour sur investissement, y compris une partie de hors-tissu qui sert de témoin. Utilisez cette section hors-tissu pour le pic picking (étape 5.4).
Note: Le diamètre de désorption (taille du spot) du laser sur le tissu est d'environ 150 pm; Cependant, les résolutions spatiales plus élevées peuvent être obtenues par USIng la méthode de suréchantillonnage 14,15.
- Lors de l'élaboration d'un retour sur investissement, y compris une partie de hors-tissu qui sert de témoin. Utilisez cette section hors-tissu pour le pic picking (étape 5.4).
- Sélectionnez la fréquence du laser approprié dans la zone de liste déroulante, le nombre d'impulsions laser par voxel (valeurs entières), et le délai entre le déclenchement laser et l' acquisition du signal de spectromètre de masse (Figure 2-5). Typiquement utiliser deux impulsions laser par voxel à 20 Hz pour désorber complètement la matière dans un expériences IR-MALDESI MSI, avec un temps 10 de retard msec pour permettre des ions générés pour atteindre l'analyseur de masse pour la mesure 5.
Remarque: Choisissez le taux de redoublement le plus élevé que le laser est capable de fonctionner à. Il a été récemment montré que l' utilisation de taux de répétition plus élevé permettra d' améliorer la détectabilité analyte 16.
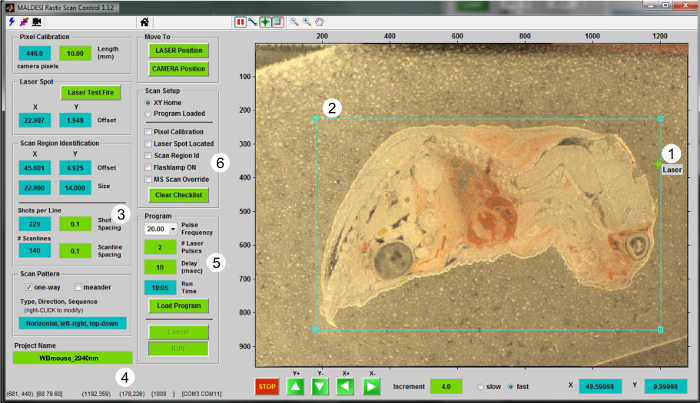
Figure 2. Interface utilisateur pour le fonctionnement IR-MALDESI MSI. Capture d' écran du programme Scan Control RASTIR est présenté. Les étapes de performer une expérience MSI sont (1) la localisation du spot laser, (2) l'élaboration d'un retour sur investissement, (3) le choix de la taille de l'étape de l'étape (en mm), (4) donner un nom au fichier, (5) en choisissant le bon numéro d'impulsions par voxel ainsi que le taux désiré de répétition, et (6) la vérification de la liste pour l' imagerie et la configuration MS. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Choisir des paramètres de spectrométrie de masse telles que le mode d'ionisation, une tension d'électronébulisation, la vitesse d'écoulement du solvant, la température du capillaire et le temps d'injection dans le logiciel du spectromètre de masse. Se reporter au Tableau 1 pour un exemple des paramètres utilisés dans l' ensemble du corps IR-MALDESI MSI.
Remarque: En raison de la complexité des échantillons biologiques et l'absence de méthodes de séparation dans MSI analyse, la source IR-MALDESI est couplé à un pouvoir de résolution élevé et instrument de précision de la masse élevée. Un procédé d'acquisition peut être chargée pour analyses tels que parallèles surveillance de la réaction (PRM) 7 ou commutation de polarité MSI 12. - Une fois tous les paramètres (laser, stade et spectromètre de masse) ont été choisis, placez le MS en mode "poignée de main" pour la synchronisation, et commencer à l'acquisition MS.
- En utilisant le logiciel d'imagerie RASTIR, vérifiez toutes les étapes de liste de contrôle (Figure 2-6) sont complétés par des boîtes de contrôle, et de charger le programme. Une fois que le programme a été chargé, le bouton "Exécuter" sera disponible. Appuyez sur Exécuter pour démarrer l'acquisition du signal MSI.
- À la fin de l'expérience d'imagerie, arrêter l'acquisition de spectromètre de masse et placez l'appareil en mode veille. Eteignez purge à l'azote dans l'enceinte, couper l'alimentation à la plaque Peltier, et éteindre le contrôleur de scène et laser.
- Ouvrez la porte d'accès, retirez la pointe d'émetteur électrospray à l'intérieur de l'enceinte de la source, et de supprimer l'entrée étendue métallique chauffée MS en utilisant des gants de protection. Attention: L'étendue métal MS entrée sera très chaud.
- Porter des gants et des lunettes de sécurité, nettoyer l'entrée capillaire métallique prolongée par bain à ultrasons dans l'acide nitrique à 15% pendant 10 min, puis dans l'eau de qualité HPLC pendant 10 min, et enfin dans le méthanol de qualité CLHP pendant 10 min. Sécher l'entrée capillaire métallique sous un courant d'azote, et réinsérez dans MS. Remarque: Jeter solvant dans les conteneurs de déchets appropriés après.
| Paramètre | Valeur |
| mode de ionisation | Positif |
| Electrospray tension | |
| Solvent Débit | 2 pl / min |
| capillaire Température | 275 ° C |
| Plage de numérisation | m / z 250-1,000 |
| type de numérisation | Scan complet |
| Temps d'injection | 110 msec |
| Pouvoir de résolution |
Tableau 1. Paramètres d'instruments utilisés dans l' ensemble du corps IR-MALDESI MSI.
Analyse 5. Données
- Convertir les fichiers de données brutes générées par l'instrument aux formats de données tels que mzXML 17 ou imzML 18 en utilisant des logiciels libres tels que MSConvert 17 et imzML convertisseur 19.
- Démarrez MSiReader v1.0, un logiciel open-source développé pour l' analyse de haute puissance de résolution de données MSI 20, sur un ordinateur de traitement dédié. Chargez le fichier image sur MSiReader. Pour l' interface utilisateur de MSiReader et certaines de ses fonctionnalités intégrées, voir la figure 3.
- Générer des cartes ion d'analytes d'intérêt en entrant leur m / z et choisissez une fenêtre m / z appropriée en parties par million (ppm) ou Thomson (Th) (Figure 3-1). Pour pouvoir (RP) instruments de résolution élevéchoisir une fenêtre dans la gamme basse ppm.
Remarque: La fenêtre m / z approprié dépend de la PR et la précision de la mesure de la masse (MMA) de l'instrument que la source infrarouge est couplé à MALDESI. - Interpréter davantage les données en utilisant les fonctionnalités intégrées telles que l' interpolation (Figure 3-2), la normalisation (Figure 3-3), superposition d' image optique (Figure 3-4), et le pic de la cueillette (Figure 3-5) 20.
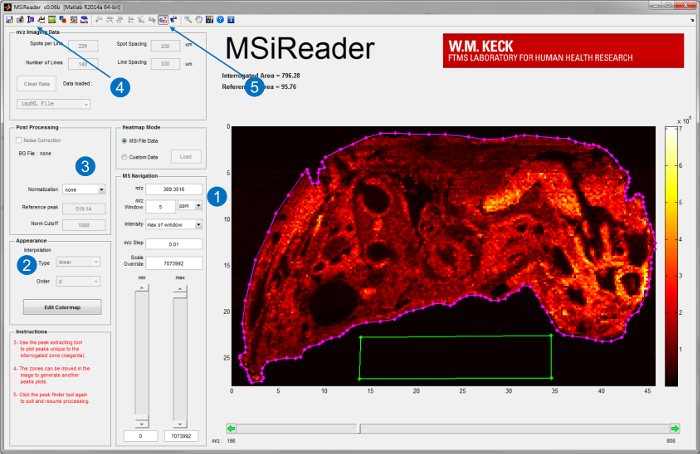
Figure 3. Interface utilisateur de MSiReader; v1.0 20. Une fois qu'un fichier est chargé dans le logiciel, cartes d'ions d'analytes d'intérêt sont affichés par (1) entrer le m / z et de la tolérance en ppm ou Th. Une analyse plus poussée tel que (2) l'interpolation ou (3) la normalisation peut également être effectuée. Une image optique du tissu peut également être importé et superposé avecles cartes d'ions (4) pour une meilleure visualisation. Pour untargeted analyse le pic de la fonction (5) la cueillette peut être utilisé pour extraire des pics spécifiques de tissus en choisissant la zone de tissu (ligne magenta) et une zone de référence hors tissu (boîte verte). S'il vous plaît cliquer ici pour voir une version plus grande ce chiffre.
- Utilisez la fonction de crête la cueillette pour générer une liste de valeurs m / z spécifiques de tissus à l' aide de critères définis par l' utilisateur. Remarque: L'algorithme de PeakFinder utilise des différences dans le spectre moyen de deux régions de masse. Ces valeurs m / z peuvent ensuite être recherchées contre les bases de données de métabolites tels que METLIN 21 ou LIPID MAPS. 22
- Reportez - vous à la figure 3 pour un exemple de choisir une région interrogée de tissu (magenta polygone de ROI) et la région hors tissu référence (vert polygone ROI).
Résultats
Les images présentées sur la figure 4 montrent la répartition spatiale des métabolites dans les différents organes de la section de tissu du corps entier. M Unique / z des valeurs à des régions spécifiques du corps ont été trouvés en utilisant MSiReader PeakFinder, suivie d' un traitement par lots pour la production d'image. L'outil image de superposition (figure 3-4) a été utilisé pour aligner l'image opti...
Discussion
Le protocole ci-dessus décrit les étapes clés pour réaliser une expérience IR-MALDESI MSI. Le processus d'application de la matrice (section 3) prend environ 20 min, ce qui est similaire à un processus d'application typique de la matrice pour des expériences MALDI MSI par sublimation ou de revêtement par pulvérisation à l'aide d'un pulvérisateur robotique. En outre, IR-MALDESI ne repose pas sur le partitionnement des analytes dans les cristaux de la matrice 6, et la matrice de la gl...
Déclarations de divulgation
The authors declare no competing financial interests.
Remerciements
The authors thank Professor H. Troy Ghashghaei from NCSU Department of Molecular Biomedical Sciences for providing the whole mouse tissue. The authors also gratefully acknowledge the financial assistance received from National Institutes of Health (R01GM087964), the W.M. Keck foundation, and North Carolina State University.
matériels
| Name | Company | Catalog Number | Comments |
| IR-MALDESI Source | Custom-made | N/A | Please refer to references 4 and 12 for an in-depth discussion of IR-MALDESI source development. |
| Q Exactive Plus | Thermo Scientific | Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer | |
| Water, HPLC Grade | Burdick & Jackson | AH365-4 | |
| Methanol, HPLC Grade | Burdick & Jackson | AH230-4 | |
| Formic Acid | Sigma Aldrich | 56302 | |
| Tunable mid-IR Laser | Opotek Inc. | IR Opolette | Tunable 2,700-3,100 nm IR OPO laser |
| Nitrogen Gas | Arc3 Gases | AG S-NI300-5.0 | Grade 5.0 high purity nitrogen gas cylinder (300) |
| Cryostat | Leica Biosystems | CM 1950 | Cryomicrotome |
| High Profile Microtome Blades | Leica Biosystems | 3802123 | Leica DB80HS |
| Mounting Medium (OCT) | Leica Biosystems | 3801480 | Surgipath FSC 22 mounting medium |
| Cryostat Specimen Disc | Leica Biosystems | 14047740045 | 40 mm diameter |
| Glass Microscope Slides | VWR | 48312-003 | Frosted, selected, pre-cleaned |
Références
- Mcdonnell, L. A., Heeren, R. M. A. Imaging Mass Spectrometry. Mass Spectrom. Rev. 26, 606-643 (2007).
- Chughtai, K., Heeren, R. M. A. Mass spectrometric imaging for biomedical tissue analysis. Chem. Rev. 110 (5), 3237-3277 (2010).
- Robichaud, G., Barry, J. A., Muddiman, D. C. Atmospheric Pressure Mass Spectrometry Imaging. Encycl. Anal. Chem. , (2014).
- Sampson, J. S., Hawkridge, A. M., Muddiman, D. C. Generation and detection of multiply-charged peptides and proteins by matrix-assisted laser desorption electrospray ionization (MALDESI) Fourier transform ion cyclotron resonance mass spectrometry. J. Am. Soc. Mass Spectrom. 17 (12), 1712-1716 (2006).
- Robichaud, G., Barry, J. A., Garrard, K. P., Muddiman, D. C. Infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) imaging source coupled to a FT-ICR mass spectrometer. J. Am. Soc. Mass Spectrom. 24 (1), 92-100 (2013).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI Mass Spectrometry Imaging of Biological Tissue Sections Using Ice as a Matrix. J. Am. Soc. Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., et al. Mapping Antiretroviral Drugs in Tissue by IR-MALDESI MSI Coupled to the Q Exactive and Comparison with LC-MS/MS SRM Assay. J. Am. Soc. Mass Spectrom. 25 (12), 2038-2047 (2014).
- Rosen, E. P., Bokhart, M. T., Ghashghaei, H. T., Muddiman, D. C. Influence of Desorption Conditions on Analyte Sensitivity and Internal Energy in Discrete Tissue or Whole Body Imaging by IR-MALDESI. J. Am. Soc. Mass Spectrom. 26, 899-910 (2015).
- Nelson, K. A., Daniels, G. J., Fournie, J. W., Hemmer, M. J. Optimization of whole-body zebrafish sectioning methods for mass spectrometry imaging. J. Biomol. Tech. 24 (3), 119-127 (2013).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. J. Vis. Exp. (3), e194 (2007).
- Bokhart, M. T., Rosen, E., Thompson, C., Sykes, C., Kashuba, A. D. M., Muddiman, D. C. Quantitative mass spectrometry imaging of emtricitabine in cervical tissue model using infrared matrix-assisted laser desorption electrospray ionization. Anal. Bioanal. Chem. 407 (8), 2073-2084 (2015).
- Nazari, M., Muddiman, D. C. Polarity Switching Mass Spectrometry Imaging of Healthy and Cancerous Hen Ovarian Tissue Sections by Infrared Matrix-Assisted Laser Desorption Electrospray Ionization (IR-MALDESI). Analyst. 141, 595-605 (2016).
- Hsu, C. C., et al. Design and Application of a Low-Temperature Peltier-Cooling Microscope. J. Pharm. Sci. 85 (1), 70-74 (1996).
- Jurchen, J. C., Rubakhin, S. S., Sweedler, J. V. MALDI-MS imaging of features smaller than the size of the laser beam. J. Am. Soc.Mass Spectrom. 16 (10), 1654-1659 (2005).
- Nazari, M., Muddiman, D. C. Cellular-level mass spectrometry imaging using infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) by oversampling. Anal. Bioanal. Chem. 407 (8), 2265-2271 (2015).
- Rosen, E. P., Bokhart, M. T., Nazari, M., Muddiman, D. C. Influence of C-Trap Ion Accumulation Time on the Detectability of Analytes in IR-MALDESI MSI. Anal. Chem. 87, 10483-10490 (2015).
- Kessner, D., Chambers, M., Burke, R., Agus, D., Mallick, P. ProteoWizard: open source software for rapid proteomics tools development. Bioinformatics. 24 (21), 2534-2536 (2008).
- Schramm, T., et al. ImzML - A common data format for the flexible exchange and processing of mass spectrometry imaging data. J. Proteomics. 75 (16), 5106-5110 (2012).
- Race, A. M., Styles, I. B., Bunch, J. Inclusive sharing of mass spectrometry imaging data requires a converter for all. J. Proteomics. 75 (16), 5111-5112 (2012).
- Robichaud, G., Garrard, K. P., Barry, J. A., Muddiman, D. C. MSiReader: an open-source interface to view and analyze high resolving power MS imaging files on Matlab platform. J. Am. Soc. Mass Spectrom. 24 (5), 718-721 (2013).
- Smith, C. A., O'Maille, G., et al. METLIN: a metabolite mass spectral database. Ther. Drug. Monit. 27 (6), 747-751 (2005).
- Sud, M., et al. LMSD: LIPID MAPS structure database. Nucleic Acids Res. 35, D527-D532 (2007).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38 (7), 699-708 (2003).
- Takai, N., Tanaka, Y., Inazawa, K., Saji, H. Quantitative analysis of pharmaceutical drug distribution in multiple organs by imaging mass spectrometry. Rapid Commun. Mass Spectrom. 26 (13), 1549-1556 (2012).
- Liu, J., Gingras, J., Ganley, K. P., Vismeh, R., Teffera, Y., Zhao, Z. Whole-body tissue distribution study of drugs in neonate mice using desorption electrospray ionization mass spectrometry imaging. Rapid Commun. Mass Spectrom. 28 (2), 185-190 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon