Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ganzkörper-Massenspektrometrie Imaging durch Infrarot-Matrix-assistierte Laser-Desorptions-Elektrospray-Ionisations (IR-MALDESI)
In diesem Artikel
Zusammenfassung
A mass spectrometry imaging (MSI) source operated at atmospheric pressure was developed by coupling mid-infrared laser desorption and electrospray post-ionization. Exogenous ice matrix was used as the energy-absorbing matrix to facilitate resonant desorption of tissue-related material. This manuscript provides a step-by-step protocol for performing IR-MALDESI MSI of whole-body neonatal mouse.
Zusammenfassung
Ambient Ionisierungsquellen für die Massenspektrometrie (MS) sind das Thema von großem Interesse in den letzten zehn Jahren. Matrix-unterstützte Laser - Desorption Elektrospray - Ionisation (MALDESI) ist ein Beispiel für solche Verfahren, in denen Merkmale der Matrix-unterstützte Laser - Desorption / Ionisation (MALDI) (zB gepulste Art der Desorption) und Elektrospray - Ionisation (ESI) (zB Soft Ionisierung ) kombiniert werden. Einer der wichtigsten Vorteile der MALDESI ist die inhärente Variabilität. In MALDESI Experimenten eine Ultraviolett (UV) oder Infrarot (IR) -Laser kann auf resonant eine endogene oder exogene Matrix erregt verwendet werden. Die Wahl der Matrix ist nicht Analyten abhängig und hängt allein von der Laserwellenlänge zur Anregung verwendet. In IR-MALDESI Experimenten wird eine dünne Eisschicht auf der Probenoberfläche als eine energieabsorbierende Matrix abgeschieden. Die IR-MALDESI Quellengeometrie wurde für die Analyse von flüssigen Proben sowie biol mittels statistischer Versuchsplanung (DOE) optimiertlogischen Gewebeproben. Weiterhin wurde eine robuste IR-MALDESI Abbildungsquelle entwickelt, bei denen ein abstimmbarer mid-IR-Laser wird mit einem computergesteuerten XY-Translationsstufe und ein hohes Auflösungsvermögen Massenspektrometers synchronisiert. Eine angepasste grafische Benutzeroberfläche (GUI) Benutzerauswahl der Repetitionsrate des Lasers, die Anzahl der Aufnahmen pro Voxel, Schrittgröße der Probe Bühne, und die Verzögerung zwischen der Desorption und Scan-Ereignisse für die Quelle erlaubt. IR-MALDESI wurde in einer Vielzahl von Anwendungen, wie forensische Analyse von Fasern und Farbstoffe und MSI von biologischen Gewebeschnitten verwendet. Verteilung verschiedener Analyten aus endogenen Metaboliten exogene Xenobiotika in Gewebeschnitten im Bereich kann mit dieser Technik gemessen und quantifiziert werden. Das Protokoll in diesem Manuskript präsentiert beschreibt wichtige Schritte, die für IR-MALDESI MSI von Ganzkörpergewebeschnitten.
Einleitung
Massenspektrometrie imaging (MSI) in Mikro Modus beinhaltet Desorption der Probe von einer Oberfläche durch einen Strahl (Laser oder Ionen) an diskreten Stellen über die Oberfläche einer Probe. An jedem Rasterpunkt wird ein Massenspektrum erzeugt, und die erfassten Spektren, zusammen mit den räumlichen Standort, von dem sie gesammelt wurden, können gleichzeitig verwendet werden, um zahlreiche Analyten in der Probe abzubilden. Diese markierungsfreie Art und Weise der Bildgebung auf die Sensitivität und Spezifität der Massenspektrometrie gekoppelt haben MSI einer der am schnellsten entwickelnden Felder in der Massenspektrometrie 1,2 verhalf.
Matrix-unterstützte Laser-Desorption / Ionisation (MALDI) ist die häufigste Ionisationsverfahren verwendet für MSI analysiert. Jedoch stellen die Notwendigkeit einer organischen Matrix und die Vakuumanforderungen von MALDI erhebliche Einschränkungen auf Reproduzierbarkeit, Probendurchsatz und die Arten von Proben, die unter Verwendung des Verfahrens analysiert werden kann. Eine Reihe von Atmosphärendruck (AP) iosation Verfahren wurden in den letzten Jahren entwickelt , um diese Beschränkungen 3 zu umgehen. Diese Umgebungs Ionisierungsmethoden ermöglichen die Analyse von biologischen Proben in einer Umgebung, die viel näher an ihrem natürlichen Zustand ist und Probenvorbereitungsschritte vor der Analyse zu vereinfachen. Matrix-unterstützte Laser - Desorption Elektrospray - Ionisation (MALDESI) ist ein Beispiel eines solchen Ionisationsverfahren 4,5.
In IR-MALDESI Experimenten wird eine dünne Eisschicht auf der Gewebeoberfläche als energieabsorbierende Matrix abgeschieden. A mid-IR-Laserpuls wird durch das Eis-Matrix absorbiert wird, und erleichtert die Desorption von neutralen Materialien von der Oberfläche durch resonant Erregen der OH-Streckschwingung von Wasser. Das desorbierte Neutralen Trennwand in die geladenen Tröpfchen eines orthogonalen Elektrospray- und sind post-ionisiert in einer ESI artig 4-6. Die Zugabe von exogenen Eismatrix wird bevorzugt über allein auf dem endogenen Wasser im Gewebe zu verlassen, da es ac hilftzählen für Variationen des Wassergehalts in verschiedenen Gewebekammern und gezeigt wurde von ~ 15-fach 7,8 in Gewebeabbildungsexperimenten Desorption 6 und verbessern Ionenabundanz zu verbessern.
In dieser Arbeit verwenden wir IR-MALDESI MSI die Verteilung von Metaboliten in den verschiedenen Organen in einem neugeborenen Maus ganzen Körper zu entlocken. Eine Übersicht der einstellbaren Parameter des IR-MALDESI Quelle gegeben ist, und die notwendigen Schritte für die erfolgreiche Bildgebung von Gewebeschnitten demonstriert.
Protokoll
Hinweis: Das folgende Protokoll, alle notwendigen Schritte zur Durchführung einer IR-MALDESI MSI Experimente beschreibt. In ausführlichen Details über die optimierte Geometrie der IR-MALDESI Quelle und deren Synchronisation mit dem Laser, Stadium und Massenspektrometer kann an anderer Stelle 5,6 gefunden werden. Tiergewebeproben in diesem Protokoll verwendet wurden nach Institutional Animal Care erhalten und Use Committee (IACUC) und North Carolina State University Vorschriften.
1. Gewebepräparation
- Bereiten Sie ein Isopentan / Trockeneis-Bad, indem ~ 200 ml Isopentan in einem sauberen Becher in einem zweiten Behälter von Trockeneis in einer Abzugshaube. Schutzhandschuhe und Schutzbrille zu allen Zeiten, in denen die Isopentan / Trockeneis-Bad und das Gewebe der Handhabung.
- Euthanize 2 Tage alten Neugeborenen ganze Maus pup von Avertin Überdosis (7,5 mg / g Körpergewicht), und dann gefrier das Gewebe in der Isopentan / Trockeneisbad Gewebestruktur zu erhalten. Verwenden Sie eine Vorreinigunged Zange mit der Maus pup in cryomold aus dem Isopentan / Trockeneis-Bad zu platzieren und zu entfernen. Bewahren Sie das schockgefroren Gewebe bei -80 ° C bis zur Analyse.
- Mit Schutzhandschuhe, tragen Sie eine Schicht von optimalen Schnitttemperatur (OAT) Montagemedium auf eine 40 mm Kryostaten Probenteller. Sanft legen Sie die gefrorene ganze Maus auf dem OCT-beschichteten Probenhalter Maus auf die Scheibe in der gewünschten Ausrichtung zum Schneiden zu halten.
Hinweis: Oktober verwendet wird ausschließlich das Gewebe der Probenscheibe haften für das Schneiden. Nicht vollständig einbetten Gewebe in OCT und vermeiden Überschuss als Oktober bekannt schädlichen Auswirkungen auf MSI-Analyse zu haben. Andere Medien, wie beispielsweise Gelatine, verwendet werden , um das Gewebe zu Cryo-einzubetten , bevor es 9 schneiden. - Legen Sie die Disc (OCT und Gewebeschnitt) auf Peltier-Probenhalter in Kryostaten und drücken Peltier-Taste. Warten Sie 10 min für die Probe um das thermische Gleichgewicht zu kommen.
- Legen Sie die Proben Scheibe (mit dem Gewebe angebracht aufit) im Inneren des Plattenhalters, und das Gesicht das Gewebe bis zur gewünschten Ebene für die Analyse. Schneiden das Gewebe in einzelne Abschnitte mit der gewünschten Dicke bei -20 ° C die Rotationsmikrotom innerhalb des Kryostaten untergebracht unter Verwendung von 10.
Hinweis: Für Ganzkörper-Analysen, in Scheiben schneiden das Gewebe in 25 um dicke Abschnitte der Gewebeintegrität aufrecht zu erhalten. Für kleinere Regionen (zB Leber, Gehirn, Niere), in Scheiben schneiden das Gewebe in 10 um dicke Abschnitte.- Verwenden Sie die Anti-Roll-Glasplatte, die in Scheiben geschnittenen Gewebeschnitt Wegrollen zu verhindern. Verwenden Sie den Kryostaten Vakuumschlauch und Bürsten unerwünschte Gewebereste zu entfernen. Sobald das Gewebe geschnitten ist, den Blattschutz verwenden, um die scharfen Mikrotom Klinge abzudecken persönliche Verletzungen zu vermeiden.
- Abschnitt Orient Maus auf dem Probenteller und auftauen Montage auf eine vorgereinigte Glasobjektträger durch die Folie so nahe wie möglich zu bringen , um den Gewebeschnitt, ohne es 10 zu berühren.
Hinweis: Für die quantitative MSI Erfahgen, mantel, der Schieber mit einem internen Standard eines automatisierten pneumatischen Sprayer vor der Montage des Gewebes unter Verwendung von und den Gewebeschnitt auf der beschichteten Schieber 11 aufzutauen-Mount. - Entfernen Sie die Mikrotom-Klinge verwendet, um das Gewebe sectioning die Spatelauswerfer verwenden und sicher die Klinge in der entsprechenden "scharfen Abfall" Behälter entsorgen.
- Halten Sie den Glasobjektträger im Inneren des Kryostaten bis Schritt 3.2 Kryokonservierung des Gewebes zu erhalten.
2. IR-MALDESI Vorbereitung / Kalibrierung
- Schalten Sie den mittleren IR-Laser und starten Sie die Laser-Steuerungsanwendung auf dem Computer. Wählen Sie die gewünschte Wellenlänge mit Hilfe der Laser-Steuerungsanwendung vom Hersteller geliefert. IR-MALDESI Experimente werden typischerweise bei 2940 nm durchgeführt wird.
Anmerkung: Jüngste Experimente haben die Abhängigkeit der mittleren IR - Laserwellenlängen und das Eis - Matrix mit festgestellten Unterschiede untersucht , die analytspezifische 8 erscheinen. - Schalten Sie den Hirsche-Controller, starten Sie das Steuer benutzerdefinierte Anwenderprogramm (RASTIR) und die Tischposition Taste mit dem nach Hause zu kalibrieren.
- Bereiten Elektro Lösung. Typischerweise verwenden eine 50:50 (v / v) Methanol / Wasser mit 0,2% Ameisensäure für die Elektrosprüh Lösungsmittel in Positivionenmodus. Wählen Sie die Elektrosprüh-Lösungsmittelzusammensetzung nach dem Experiment. Zum Beispiel verwenden 5 mM Ammoniumhydroxid als Elektrosprüh Modifikator für Imaging-Anwendungen in Negativ-Ionen-Modus.
Hinweis: Für die Polarität Schalt IR-MALDESI MSI, verwenden Sie 1 mM Essigsäure als Modifikator. Dieser Wert wurde Optimum gefunden für den Erhalt der stabilen und reproduzierbaren Signal sowohl Positiv- und Negativionen - Modi 12. - Füllen Sie eine 1-ml-Spritze mit Elektro Lösungsmittel und spülen Sie die Silica-Kapillare mit neuen Lösungsmittel.
- Richten Sie ESI Emitter auf der Achse mit MS Einlass die Quellparameter wie ESI-Spotabstand mit spot-Einlaufstrecke, Probenhöhe und Lösungsmittelflussrate, die optimiert wurden mit Hilfe statistischer DO E für die Analyse von Gewebeschnitten 6. Hinweis: Siehe Abbildung 1 für eine schematische Darstellungs diese Parameter und optimierte Werte für MSI von Gewebeschnitten.
- Starten Sie die Elektrospray- und bewerten ihre Stabilität (> 10 min), indem die Gesamtionenstromüberwachung (TIC), der an dieser Stelle nur aus Umgebungs Verbindungen besteht. Typischerweise ist eine TIC Variation von <10% gegenüber 10 bis 15 min ein guter Indikator für die Stabilität.
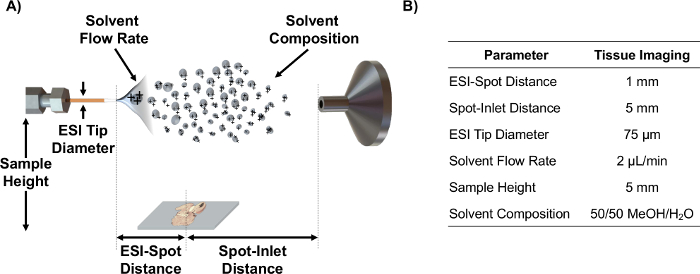
Abbildung 1. IR-MALDESI prinzipieller und Parameter. (A) Schematische Darstellung der IR-MALDESI Source Setup (nicht maßstäblich) und den einstellbaren Parametern. (B) Optimierte Parameterwerte für die Abbildung von Gewebeschnitten. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Achtung: Schalten Sie den Elektro, bevor die Probe auf der Bühne platzieren.
- Legen Sie das Tauwetter angebrachten Gewebe auf die IR-MALDESI Probenplatte innerhalb der Kameraansicht.
- Achten Sie darauf, Hände weg von der ESI Emitter sind und starten Sie den Elektro.
- Schließen der Zugangstür des IR-MALDESI Quelle und purge Gehäuse mit trockenem Stickstoff Kondensation von Wasser auf der Oberfläche des Gewebes zu verhindern. Sobald die relative Luftfeuchtigkeit im Inneren des Gehäuses erreicht <3%, schalten Sie die Stromversorgung (~ 12 V) an die Peltier-Platte, die die Probenplatte abkühlen wird. Hinweis: Der Kühlprozess im Peltier-Kühlstufe im Detail an anderer Stelle 13 diskutiert wird.
- Kühlen Sie die Bühne auf -9 ° C, und lassen Sie das montierte Gewebe um das thermische Gleichgewicht zu kommen (~ 5-10 min).
- Stoppen Stickstoffspülung und setzen das Gewebe von der relativen Luftfeuchtigkeit durch die Quelle Zugangstür zu öffnen. Eine dünne Schicht aus Eis wird auf die Co hinterlegtld Oberfläche des Peltier-Stufe und montiert durch Gewebeschnitt zu Desublimation von Wasser aus der Luft.
Hinweis: Wenn die relative Luftfeuchtigkeit im Labor unter 10-15% ist, legen Sie einen Becher mit warmem Wasser im Inneren des Gehäuses die Bildung der Eismatrix Schicht zu erleichtern. - Nachdem das Eis Matrixschicht gebildet wird, schließen Sie den Strom von trockenem Stickstoff die Zugangstür und starten Sie die relative Luftfeuchtigkeit auf 10 ± 2% zu reduzieren. Stellen Sie die Stickstoffflussrate der relativen Feuchte auf diesem Niveau zu halten, empirisch zu sein , das Gleichgewicht der Eisbildung und Sublimation fand eine konstante Schicht aus Eis während des gesamten Experiments 6 zu halten.
4. Mass Spectrometry Imaging Datenerfassung
- Mit Hilfe der RASTIR GUI (Abbildung 2), bewegen sich die Bühne in die Analyseposition durch die "LASER Position" klicken. Verwenden, um die Anpassungsdiode des Lasers ein Off-Geweberegion zu gewährleisten ablatiert werden. Feuer kam ein Laserschuss in einem Off-Gewebe region der Laser in Bezug auf Kamerasicht versetzt zu kalibrieren. Klicken Sie auf die "Laser-Test Fire" Taste, um die Laserposition zu aktualisieren.
- Zurück zu "CAMERA" und aktualisieren Sie die Laserposition in RASTIR , indem das Laserausrichtung Absehen auf der Laser - Ablation Stelle (Abbildung 2-1).
- Klicken Sie auf die Region of Interest (ROI) Taste und stellen Sie die Größe und Position des ROI für den Gewebeschnitt analysiert werden (Abbildung 2-2). Geben Sie geeignete Versuchsparameter wie die Schrittgröße in X und Y - Richtung (in mm) (Abbildung 2-3), und benennen Sie die MSI - Datei im "Projektname" ein (Bild 2-4).
- Wenn Sie einen ROI zeichnen, umfassen einen Teil der Off-Gewebe, das als Steuerung dient. Verwenden Sie diese Off-Gewebeschnitt für Spitzen Kommissionierung (Schritt 5.4).
Anmerkung: Die Desorption Durchmesser (spot size) des Lasers auf Gewebe ist etwa 150 & mgr; m; jedoch höhere räumliche Auflösungen von usi erhalten werdenng der Überabtastungsmethode 14,15.
- Wenn Sie einen ROI zeichnen, umfassen einen Teil der Off-Gewebe, das als Steuerung dient. Verwenden Sie diese Off-Gewebeschnitt für Spitzen Kommissionierung (Schritt 5.4).
- Wählen Sie die entsprechende Laserfrequenz aus dem Drop - Down - Box, die Anzahl der Laserpulse pro Voxel (Integer - Werte) und die Verzögerung zwischen dem Laser - Trigger und Massenspektrometer Signalerfassung (Bild 2-5). Typischerweise verwenden zwei Laserpulse pro Voxel bei 20 Hz Material vollständig zu desorbieren in einem IR-MALDESI MSI Experimenten mit einem 10 ms Verzögerungszeit - Ionen zu ermöglichen , erzeugt die Masse Analysator für die Messung 5 zu erreichen.
Hinweis: Wählen der höchsten Wiederholungsrate, die der Laser arbeiten kann. Es wurde vor kurzem gezeigt , dass eine höhere Wiederholungsrate unter Verwendung von 16 Analyten Nachweisbarkeit zu verbessern.
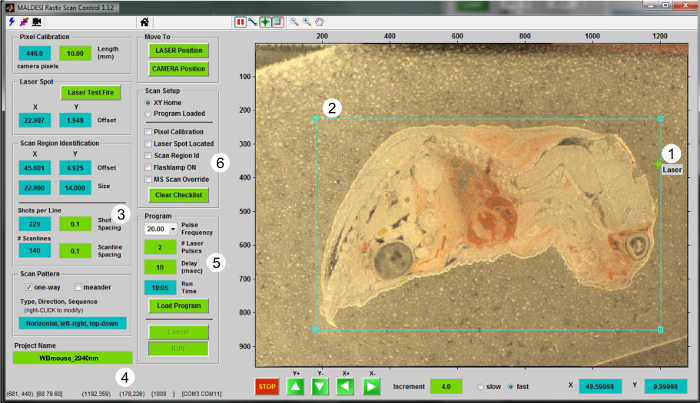
Abbildung 2. Benutzeroberfläche für IR-MALDESI MSI Betrieb. Screenshot des RASTIR Scan Control Programm vorgestellt. Die Schritte für die performing ein MSI-Experiment sind (1), den Laserpunkt Ortung (2) einen ROI zeichnen, (3) die Bühne Schrittgröße wählen (in mm), (4) einen Namen für die Datei zu geben, (5) die richtige Nummer wählen Impulse pro Voxel zusammen mit der Repetitionsrate gewünscht wird , und (6) , um die Liste für die Bildgebung und MS - Setup zu überprüfen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Wählen Massenspektrometers Parameter wie Ionisierungsmodus, Elektrosprüh-Spannung, Lösungsmittelflussrate, Kapillar Temperatur und die Einspritzzeit in dem Massenspektrometer Software. Siehe Tabelle 1 für ein Beispiel der verwendeten Parameter in Ganzkörper - IR-MALDESI MSI.
Hinweis: Wegen der Komplexität von biologischen Proben und das Fehlen von Trennverfahren in MSI-Analysen wird die IR-MALDESI Quelle gekoppelt mit einem hohen Auflösungsvermögen und eine hohe Massengenauigkeit Instrument. Ein Erfassungsverfahren kann für analys geladen werdenes wie parallele Reaktionsüberwachung (PRM) 7 oder Polarität Schalt MSI 12. - Sobald alle Parameter (Laser, Stadium und Massenspektrometer) ausgewählt wurden, legen Sie die MS in "Handshake" Modus für die Synchronisation und MS Erwerb starten.
- Mit RASTIR Imaging - Software, überprüfen Sie alle Schritte in - Checkliste (Bild 2-6) durch Überprüfung Boxen abgeschlossen und das Programm laden. Nachdem das Programm geladen wurde, wird die Schaltfläche "Ausführen" verfügbar sein. Drücken Sie Ausführen, um MSI-Signalerfassung zu starten.
- Nach Abschluss des Imaging-Experiments, stoppen Erwerb Massenspektrometer und legen Sie das Gerät im Standby-Modus. Schalten Sie Stickstoffspülung in das Gehäuse, schalten Sie die Stromversorgung zu Peltier-Platte, und drehen Sie den Stufenregler und Laser aus.
- Öffnen Sie die Zugangstür, entfernen Sie die Elektrosprüh Emitterspitze aus dem Inneren der Quelle-Gehäuse, und entfernen Sie die ausgedehnte erwärmte Metall MS Einlass Schutzhandschuhe verwenden. Achtung: Die erweiterte Metall MS Einlass wird sehr heiß sein.
- Das Tragen von Handschuhen und Schutzbrille, reinigen Sie die erweiterten Metall Kapillareinlass durch Ultraschallbad in 15% Salpetersäure für 10 Minuten, dann in HPLC-Qualität Wasser für 10 min und schließlich in HPLC-Qualität Methanol für 10 min. Trocknen Sie die Metall Kapillareinlass unter einem Strom von Stickstoff, und setzen Sie sie wieder in MS. Hinweis: Entsorgen Sie später in den entsprechenden Abfallbehältern Lösungsmittel.
| Parameter | Wert |
| Ionisierungsmodus | Positiv |
| Elektro Spannung | |
| Solvent Flussrate | 2 & mgr; l / min |
| Kapillare Temperatur | 275 ° C |
| Scanbereich | m / z 250-1,000 |
| Scan-Typ | Kompletter Suchlauf |
| Einspritzzeit | 110 ms |
| Auflösungsvermögen |
Tabelle 1. Geräteparameter verwendet in Ganzkörper - IR-MALDESI MSI.
5. Datenanalyse
- Konvertieren Sie die Rohdatendateien vom Gerät zu Datenformaten erzeugt wie mzXML 17 oder imzML 18 freie Software wie MSConvert 17 und imzML - Wandler mit 19.
- Starten Sie MSiReader v1.0, ein Open-Source - Software für die Analyse von Hochauflösungsvermögen MSI Daten 20, auf einem dedizierten Verarbeitungscomputer entwickelt. Legen Sie die Bilddatei auf MSiReader. Für Benutzeroberfläche von MSiReader und einige seiner integrierten Funktionen, siehe Abbildung 3.
- Generieren Ionen Karten von Analyten von Interesse durch ihre m / z Eingabe und wählen einen geeigneten m / z Fenster in Teilen pro Million (ppm) oder Thomson (Th) (Abbildung 3-1). Für hohe Auflösungsvermögen (RP) Instrumenteein Fenster im unteren ppm-Bereich wählen.
Hinweis: Die entsprechende m / z Fenster hängt von der RP und der Massenmessgenauigkeit (MMA) des Instruments , dass IR-MALDESI Quelle gekoppelt ist. - Mit den integrierten Funktionen wie Interpolation (Abbildung 3-2), die Normalisierung (Abbildung 3-3), optische Bildüberlagerung (Bild 3-4) und Spitzen Kommissionierung (Bild 3-5) 20 Weitere Daten zu interpretieren.
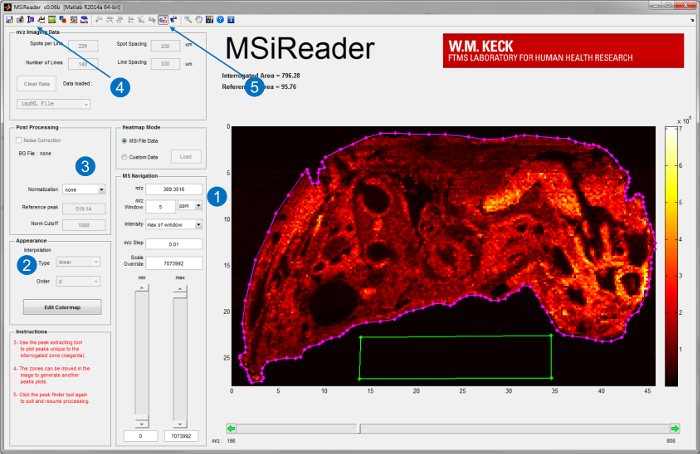
Abbildung 3. Benutzeroberfläche von MSiReader; v1.0 20. Sobald eine Datei in die Software, Ionenkarten von Analyten von Interesse angezeigt werden durch (1) Eingeben des m / z und Toleranz in ppm oder Th geladen wird. Eine weitere Analyse, wie beispielsweise (2) Interpolation oder (3) die Normalisierung kann auch durchgeführt werden. Ein optisches Bild des Gewebes kann auch mit importiert und überlagert werden,die Ionen Karten (4) für eine bessere Visualisierung. Für ungezielte die Spitzen Kommissionierung Funktion (5) analysiert werden können gewebespezifische Spitzen , die durch die Wahl der Gewebebereich (magentafarbene Linie) und eine Referenzfläche off-Gewebe (grüner Kasten). Zu extrahieren Bitte klicken hier , um eine größere Version diese Figur.
- Verwenden Sie die Peak - Picking - Funktion eine Liste der gewebespezifischen m / z - Werte unter Verwendung von benutzerdefinierten Kriterien zu generieren. Hinweis: Der Peakfinder Algorithmus verwendet Unterschiede in der durchschnittlichen Massenspektrum von zwei Regionen. Diese m / z - Werte können dann gegen Metabolit Datenbanken durchsucht werden wie METLIN 21 oder LIPID MAPS. 22
- Siehe 3 für ein Beispiel zu Figur eines abgefragten Gewebebereich (Magenta Polygon ROI) Auswahl und Off-Gewebe - Referenzbereich (grün Polygon ROI).
Ergebnisse
Die Bilder in Abbildung 4 zeigen die räumliche Verteilung der Metaboliten in verschiedenen Organen in der Ganzkörpergewebeabschnitt. Einzigartige m / z - Werte auf bestimmte Regionen des Körpers wurden unter Verwendung gefunden MSiReader Peakfinder, die von der Stapelverarbeitung zur Bilderzeugung folgt. Die Bildüberlagerungswerkzeug (Bild 3-4) wurde verwendet , um das optische Bild vor Eismatrix Abscheidung mit den resultierenden Ionenkarte...
Diskussion
Das Protokoll über beschreibt die wichtigsten Schritte zur Durchführung eines IR-MALDESI MSI Experiment. Die Matrix Bewerbungsverfahren (Abschnitt 3) dauert ca. 20 min, die für die MALDI-MSI-Experimente durch Sublimation oder Sprühbeschichten mit einem Roboter-Sprayer auf eine typische Matrix Bewerbungsverfahren ähnlich ist. Darüber hinaus IR-MALDESI beruht nicht auf Partitionierung von Analyten in die Matrixkristalle 6 und die Eis - Matrix kann universell für alle Analyten unabhängig von ihrer Masse,...
Offenlegungen
The authors declare no competing financial interests.
Danksagungen
The authors thank Professor H. Troy Ghashghaei from NCSU Department of Molecular Biomedical Sciences for providing the whole mouse tissue. The authors also gratefully acknowledge the financial assistance received from National Institutes of Health (R01GM087964), the W.M. Keck foundation, and North Carolina State University.
Materialien
| Name | Company | Catalog Number | Comments |
| IR-MALDESI Source | Custom-made | N/A | Please refer to references 4 and 12 for an in-depth discussion of IR-MALDESI source development. |
| Q Exactive Plus | Thermo Scientific | Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer | |
| Water, HPLC Grade | Burdick & Jackson | AH365-4 | |
| Methanol, HPLC Grade | Burdick & Jackson | AH230-4 | |
| Formic Acid | Sigma Aldrich | 56302 | |
| Tunable mid-IR Laser | Opotek Inc. | IR Opolette | Tunable 2,700-3,100 nm IR OPO laser |
| Nitrogen Gas | Arc3 Gases | AG S-NI300-5.0 | Grade 5.0 high purity nitrogen gas cylinder (300) |
| Cryostat | Leica Biosystems | CM 1950 | Cryomicrotome |
| High Profile Microtome Blades | Leica Biosystems | 3802123 | Leica DB80HS |
| Mounting Medium (OCT) | Leica Biosystems | 3801480 | Surgipath FSC 22 mounting medium |
| Cryostat Specimen Disc | Leica Biosystems | 14047740045 | 40 mm diameter |
| Glass Microscope Slides | VWR | 48312-003 | Frosted, selected, pre-cleaned |
Referenzen
- Mcdonnell, L. A., Heeren, R. M. A. Imaging Mass Spectrometry. Mass Spectrom. Rev. 26, 606-643 (2007).
- Chughtai, K., Heeren, R. M. A. Mass spectrometric imaging for biomedical tissue analysis. Chem. Rev. 110 (5), 3237-3277 (2010).
- Robichaud, G., Barry, J. A., Muddiman, D. C. Atmospheric Pressure Mass Spectrometry Imaging. Encycl. Anal. Chem. , (2014).
- Sampson, J. S., Hawkridge, A. M., Muddiman, D. C. Generation and detection of multiply-charged peptides and proteins by matrix-assisted laser desorption electrospray ionization (MALDESI) Fourier transform ion cyclotron resonance mass spectrometry. J. Am. Soc. Mass Spectrom. 17 (12), 1712-1716 (2006).
- Robichaud, G., Barry, J. A., Garrard, K. P., Muddiman, D. C. Infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) imaging source coupled to a FT-ICR mass spectrometer. J. Am. Soc. Mass Spectrom. 24 (1), 92-100 (2013).
- Robichaud, G., Barry, J. A., Muddiman, D. C. IR-MALDESI Mass Spectrometry Imaging of Biological Tissue Sections Using Ice as a Matrix. J. Am. Soc. Mass Spectrom. 25 (3), 319-328 (2014).
- Barry, J. A., et al. Mapping Antiretroviral Drugs in Tissue by IR-MALDESI MSI Coupled to the Q Exactive and Comparison with LC-MS/MS SRM Assay. J. Am. Soc. Mass Spectrom. 25 (12), 2038-2047 (2014).
- Rosen, E. P., Bokhart, M. T., Ghashghaei, H. T., Muddiman, D. C. Influence of Desorption Conditions on Analyte Sensitivity and Internal Energy in Discrete Tissue or Whole Body Imaging by IR-MALDESI. J. Am. Soc. Mass Spectrom. 26, 899-910 (2015).
- Nelson, K. A., Daniels, G. J., Fournie, J. W., Hemmer, M. J. Optimization of whole-body zebrafish sectioning methods for mass spectrometry imaging. J. Biomol. Tech. 24 (3), 119-127 (2013).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. J. Vis. Exp. (3), e194 (2007).
- Bokhart, M. T., Rosen, E., Thompson, C., Sykes, C., Kashuba, A. D. M., Muddiman, D. C. Quantitative mass spectrometry imaging of emtricitabine in cervical tissue model using infrared matrix-assisted laser desorption electrospray ionization. Anal. Bioanal. Chem. 407 (8), 2073-2084 (2015).
- Nazari, M., Muddiman, D. C. Polarity Switching Mass Spectrometry Imaging of Healthy and Cancerous Hen Ovarian Tissue Sections by Infrared Matrix-Assisted Laser Desorption Electrospray Ionization (IR-MALDESI). Analyst. 141, 595-605 (2016).
- Hsu, C. C., et al. Design and Application of a Low-Temperature Peltier-Cooling Microscope. J. Pharm. Sci. 85 (1), 70-74 (1996).
- Jurchen, J. C., Rubakhin, S. S., Sweedler, J. V. MALDI-MS imaging of features smaller than the size of the laser beam. J. Am. Soc.Mass Spectrom. 16 (10), 1654-1659 (2005).
- Nazari, M., Muddiman, D. C. Cellular-level mass spectrometry imaging using infrared matrix-assisted laser desorption electrospray ionization (IR-MALDESI) by oversampling. Anal. Bioanal. Chem. 407 (8), 2265-2271 (2015).
- Rosen, E. P., Bokhart, M. T., Nazari, M., Muddiman, D. C. Influence of C-Trap Ion Accumulation Time on the Detectability of Analytes in IR-MALDESI MSI. Anal. Chem. 87, 10483-10490 (2015).
- Kessner, D., Chambers, M., Burke, R., Agus, D., Mallick, P. ProteoWizard: open source software for rapid proteomics tools development. Bioinformatics. 24 (21), 2534-2536 (2008).
- Schramm, T., et al. ImzML - A common data format for the flexible exchange and processing of mass spectrometry imaging data. J. Proteomics. 75 (16), 5106-5110 (2012).
- Race, A. M., Styles, I. B., Bunch, J. Inclusive sharing of mass spectrometry imaging data requires a converter for all. J. Proteomics. 75 (16), 5111-5112 (2012).
- Robichaud, G., Garrard, K. P., Barry, J. A., Muddiman, D. C. MSiReader: an open-source interface to view and analyze high resolving power MS imaging files on Matlab platform. J. Am. Soc. Mass Spectrom. 24 (5), 718-721 (2013).
- Smith, C. A., O'Maille, G., et al. METLIN: a metabolite mass spectral database. Ther. Drug. Monit. 27 (6), 747-751 (2005).
- Sud, M., et al. LMSD: LIPID MAPS structure database. Nucleic Acids Res. 35, D527-D532 (2007).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38 (7), 699-708 (2003).
- Takai, N., Tanaka, Y., Inazawa, K., Saji, H. Quantitative analysis of pharmaceutical drug distribution in multiple organs by imaging mass spectrometry. Rapid Commun. Mass Spectrom. 26 (13), 1549-1556 (2012).
- Liu, J., Gingras, J., Ganley, K. P., Vismeh, R., Teffera, Y., Zhao, Z. Whole-body tissue distribution study of drugs in neonate mice using desorption electrospray ionization mass spectrometry imaging. Rapid Commun. Mass Spectrom. 28 (2), 185-190 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten