Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Için yüksek performanslı bir Kompakt Fotoakustik Tomografi Sistemi
Bu Makalede
Özet
Küçük hayvanlarda hızlı in vivo beyin görüntüleme için kompakt darbeli lazer diyot tabanlı bir fotoakustik tomografi (PLD-PAT) sistemi gösterilmiştir.
Özet
In vivo küçük hayvan görüntüleme, klinik öncesi araştırmalarda oynamak için önemli bir role sahiptir. Fotoakustik tomografi (PAT) hem preklinik hem de klinik uygulamalar için büyük potansiyel gösteren gelişmekte olan bir hibrid görüntüleme modalitesidir. Konvansiyonel optik parametrik osilatör tabanlı PAT (OPO-PAT) sistemleri hantal ve pahalıdır ve yüksek hızlı görüntüleme sağlayamaz. Kısa süre önce PAT için alternatif bir uyarma kaynağı olarak darbeli lazer diyotlar (PLD'ler) başarıyla gösterildi. Foto akustik fantomlar ve biyolojik dokulardaki yüksek hızlı görüntüleme için Darbeli Lazer Diyot PAT (PLD-PAT) başarıyla gösterildi. Bu çalışma PLD-PAT kullanılarak in vivo beyin görüntüleme için görselleştirilmiş bir deney protokolü sağlar. Protokol, kompakt PLD-PAT sistem konfigürasyonunu ve açıklamasını, beyin görüntüleme için hayvan hazırlığını ve 2D kesitsel sıçan beyin görüntüleme için tipik bir deneysel prosedürü içerir. PLD-PAT sistemi kompakt ve masrafsızFektif ve yüksek hızlı, yüksek kaliteli görüntüleme sağlayabilir. Çeşitli tarama hızlarında in vivo toplanan beyin görüntüleri sunulmuştur.
Giriş
Fotoakustik tomografi (PAT), klinik ve preklinik çalışmalarda 1 , 2 , 3 , 4 , 5 birçok uygulamaya sahip olan bir hibrid görüntüleme yöntemidir. PAT'de nanosaniye lazer darbeleri biyolojik dokuyu ışınlar. Olay ışığının doku kromoforları tarafından absorbe edilmesi lokal bir sıcaklık artışı ile sonuçlanır ve bu da daha sonra ses dalgaları şeklinde yayılan basınç dalgalarına yol açar. Bir ultrason dedektörü, fotoakustik sinyalleri numunenin etrafındaki çeşitli konumlarda toplar. Fotakustik (PA) sinyaller, fotoakustik görüntüyü üretmek için çeşitli algoritmalar (gecikmeli-ve-toplam algoritması gibi) kullanılarak yeniden oluşturulmuştur.
Bu hibrid görüntüleme modeli, yüksek çözünürlüklü, derin doku görüntüleme ve yüksek optik absorpsiyon kontrastı sunar 7 ,Class = "xref"> 8. Son zamanlarda, tavuk göğsü dokusunda ~ 12 cm'lik bir görüntüleme derinliği 9 daha uzun bir dalga boyu (~ 1.064 nm) ve fosfor ftalosiyanin denilen eksojen bir kontrast ajan yardımıyla elde edildi. Bu derinlik hassasiyeti, konfokal flüoresan mikroskopisi, iki fotonlu floresan mikroskopisi, 10 optik koherens tomografi, 11 vb. Gibi diğer optik yöntemlerin derinlik hassasiyetinden çok daha yüksektir. PAT birden fazla dalga boyunu kullanarak, organlarda yapısal ve işlevsel değişiklikler gösterebilir . Birçok insan hastalığı için, küçük hayvan modelleri iyi kurulmuş 12 , 13 , 14 , 15 . Küçük hayvanların görüntülenmesi için çeşitli yöntemler gösterilmiştir. Bütün bu yaklaşımlardan, yukarıda belirtilen avantajlar nedeniyle PA görüntüleme çok hızlı bir şekilde dikkat çekti. PAT 4 , 16 , 17 , 18 küçük hayvanların doku ve organlarında ( yani kalp, akciğerler, karaciğer, gözler, dalak, beyin, deri, omurilik, böbrek vb. ) Kan damarlarını görüntüleme potansiyelini göstermiştir. PAT küçük hayvanlarda beyin görüntülemede iyi kurulmuş bir yöntemdir. PA dalgaları, kromoforların ışığı absorbe etmesi nedeniyle üretildiğinden, çoklu dalga boyundaki PAT, toplam hemoglobin konsantrasyonunun (HbT) ve oksijen doyumunun (SO 2 ) 19 , 20 , 21 , 22 haritalamasına izin verir. Beyin nörovasküler görüntüleme, ekzojen kontrast madde 12 , 23 , 24 yardımıyla sağlandı. PA modalitesi, beyin sağlığını daha iyi anlamak için aşağıdaki yöntemlerle yardımcı olabilir:Moleküler ve genetik seviyelerde bilgi sağlama.
Küçük hayvansal görüntüleme için Nd: YAG / OPO lazerler PAT uyarma kaynakları olarak yaygın olarak kullanılmaktadır. Bu lazerler, ~ 10 Hz tekrarlama oranı 25 ile ~ 5 ns yakın kızılötesi darbeler (OPO çıkış penceresinde ~ 100 mJ) sağlarlar. Bu tür lazerlerle donatılmış PA sistemi pahalıdır ve hacimlidir ve lazer kaynağının düşük tekrarlama oranına bağlı olarak tek elemanlı ultrason transdüserleri (UST) ile düşük hızlı görüntüleme yapılmasına izin verir. Bu tür PA sistemlerinde tipik bir A hattı edinme süresi kesit başına ~ 5 dakika sürmektedir 25 . Böyle uzun bir ölçüm süresine sahip bir görüntüleme sistemi, küçük gövde görüntüleme için ideal değildir, çünkü tam vücut görüntüleme, zaman çözünür fonksiyonel görüntüleme vb . Fizyolojik parametrelerin kontrol edilmesi zordur. Birden çok tek elemanlı UST'leri kabul ederek dizi Tabanlı UST'ler veya yüksek tekrarlama hızı lazer ile PA görüntüleme hızını artırmak mümkündürsistemleri. Numunenin etrafındaki tüm PA sinyallerinin toplanması için yalnızca tek elemanlı bir UST kullanılması sistemin görüntüleme hızını sınırlar. Yüksek hızda, oldukça hassas görüntüleme teknikleri için dairesel veya yarı dairesel geometride düzenlenmiş çoklu tek elemanlı UST'ler gösterilmektedir. Doğrusal, yarı dairesel, dairesel ve hacimsel diziler gibi dizi tabanlı UST'ler 26 , gerçek zamanlı görüntüleme 1 için başarıyla kullanılmıştır. Bu dizi tabanlı UST'ler görüntüleme hızını artıracak ve ölçüm duyarlılığını düşürecek, ancak pahalı. Bununla birlikte, dizi tabanlı UST'leri kullanan PA sistemlerinin görüntüleme hızı hala lazer tekrar hızı yüzünden sınırlıdır.
Darbeli lazer teknolojisi, yüksek tekrarlama hızı darbeli lazer diyotları (PLD'ler) üretmek için geliştirildi. 7.000 kare / s Klinik bir ultrason platformu kullanan PLD'lerde B-tarama fotoakustiksel görüntüleme gösterildi 27 . Bu tür PLD'ler, görüntüleme hızını artırabilir.E PAT sistemi, tek elemanlı UST dairesel tarama geometrisi ile bile. Tek elemanlı UST'ler, dizi tabanlı UST'lerin aksine daha ucuz ve oldukça hassasdır. Son on yılda PA görüntüleme için uyarı kaynağı olarak yüksek tekrarlama hızı PLD'lerin kullanımı hakkında çok az araştırma yapıldı. Fantomların PA görüntülemesi için fiber tabanlı bir yakın kızılötesi PLD gösterildi 28 . İnsan cildinin ~ 1 mm derinliklerinde kan damarlarının in vivo görüntülemesi, düşük enerjili PLD'ler 29 kullanılarak gösterildi. Bir PLD tabanlı optik çözünürlüklü fotoakustiksel mikroskop (ORPAM) bildirildi. PLD'leri kullanarak 0.43 Hz'lik bir kare hızında ~ 1.5 cm'lik derin görüntüleme gösterildi 30 . Kısa süre önce ~ 3 s kadar kısa bir sürede ve biyolojik dokuda 25 cm görüntü derinliğinde görüntü sağladığı bildirilen bir PLD-PAT sistemi bildirildi. Bu çalışma, düşük maliyetli, kompakt bir sistemin yüksek kaliteyi sağlayabileceğini kanıtladı.Yüksek hızda bile görüntüler. PLD-PAT sistemi, yüksek kare hızı (7.000 fps) fotoakustik görüntüleme, yüzeysel kan damarı görüntüleme, parmak eklem görüntüleme, 2 cm derinliğinde doku görüntüleme, küçük hayvan beyin görüntüleme, vb. Için kullanılabilir. Tek dalga boyu ve PLD'den düşük darbeli enerji darbeleri, çoklu-spektral ve derin doku görüntüleme uygulamasını sınırlar. Deneyler, klinik öncesi uygulamalar için kullanılan aynı PLD-PAT sistemini kullanarak küçük hayvanlar üzerinde gerçekleştirildi. Bu çalışmanın amacı, küçük hayvanlarda in vivo 2D kesitsel beyin görüntülemesi için PLD-PAT sisteminin görselleştirilmiş deneysel gösterimini sağlamaktır.
Protokol
Tüm hayvan deneyleri, Nanyang Technological University, Singapur'da (Hayvan Protokol Numarası ARF-SBS / NIE-A0263) Kurumsal Hayvan Bakımı ve Kullanım Komitesi tarafından onaylanan yönergelere ve yönetmeliklere uygun olarak gerçekleştirildi.
1. Sistem Açıklamaları
- Şekil 1a'da gösterildiği gibi PLD'yi dairesel tarayıcı içine monte edin. PLD'yi lazer sürücü ünitesine (LDU) bağlayın.
NOT: PLD, ~ 1.42 mJ'lik bir maksimum darbe enerjisi ve 7 kHz'e kadar bir tekrarlama oranı ile ~ 803 nm'lik bir dalga boyunda ~ 136 ns darbeler sağlar. Lazer tahrik ünitesi (LDU) aşağıdakileri içerir: bir sıcaklık kontrolörü, değişken güç kaynağı, bir güç kaynağı (12 V) ve bir fonksiyon üreteci; Malzeme Tablosuna bakınız. Değişken güç kaynağı lazer gücünü kontrol etmek için kullanılır ve fonksiyon üreteci PLD'nin tekrar hızını değiştirmek için kullanılır. - PLD lazerini açın. PLD yineleme oranını "7000" H'ye ayarlayınZ LDU'daki fonksiyon üreteci kullanılarak. Değişken güç kaynağının voltajını "3.1" V'ye ayarlayarak darbe enerjisini 1.42 mJ'ye yükseltin.
- Şekil 1a'da gösterildiği gibi çıkış demetini homojen yapmak için optik difüzörü (OD) PLD çıkış penceresinin önüne monte edin.
NOT: İnce bir kum ile bir difüzör kullanın ( yani, 1.500 taş cila). - Odaklanmış UST'yi Şekil 1a'da gösterildiği gibi tarama alanının ortasına bakacak şekilde UST tutacağı üzerine monte edin.
NOT: UST'nin merkezi frekansı 2,25 MHz'dir ve odak uzaklığı 1,9 inçtir. - Ultrason dedektörünü Şekil 1a'da gösterildiği gibi akrilik tankın içine yerleştirin. UST tamamen dalmış olacak şekilde tankı suyla doldurun.
NOT: Beyinden (örnek) gelen fotoakustik sinyali UST'ye birleştirmek için bir su ortamı kullanılır. Bir akrilik su tankı (WT, Malzeme Tablosuna bakınız) özel idi- küçük hayvansal görüntüleme için tasarlanmıştır. Su tankı tasarımının şeması Şekil 1b'de gösterilmektedir. - Bir titreşim / alıcı ünitesi (PRU , Malzeme Tablosu'na bakın) kullanarak numunedeki PA sinyalini kontrol edin.
NOT: Bu sinyaller 100 MS / s'lik bir örnekleme hızında 12 bit DAQ kartı ile sayısallaştırılmıştır ( Tablo Tablosuna bakın) ve bir bilgisayara kaydedilmiştir.
2. Sıçan Beyin Görüntüleme için Hayvan Hazırlama
NOT: Yukarıda açıklanan PLD-PAT sistemi, küçük hayvan beyinlerini görüntülemek için gösterilmiştir. Bu deneyler için, sağlıklı dişi sıçanlar kullanılmıştır (Malzeme Tablosuna bakınız).
- 2 mL ketamin, 1 mL ksilazin ve 1 mL salin içeren bir kokteyl (0.2 mL / 100 g dozaj) intraperitoneal olarak enjekte ederek hayvana anestezi uygulayın.
- Bir saç kesme makinesi kullanarak kafa derisinin üzerindeki kürkü çıkarın. Tıraşlı tüylere hafifçe epilasyon kremi uygulayın.Kürkün daha da tükenmesi için alan.
- Pamuklu bir bezle 4-5 dakika sonra uygulanan kremi çıkartın.
- Anestezi ve lazer aydınlatması nedeniyle kuruluğu önlemek için hayvanın gözlerine suni gözyaşı merhemi uygulayın.
- Bir laboratuar soketi üzerinde bulunan solunum maskesiyle donatılmış ısmarlama hayvan taşıyıcıyı ( Malzeme Tablosuna bakın) monte edin ( Malzeme Tablosuna bakın).
- Hayvanı tutamağın üzerinde eğilimli konuma getirin. Görüntüleme sırasında hayvanın hareket etmesini önlemek için ameliyat bandını kullanarak tutucuyu sabitleyin.
- Solunum maskesi, inhale anestezi sağlamak için sıçanın burun ve ağzını kapladığından emin olun.
3. In Vivo Rat Beyin Görüntüleme
- Solunum maskesini anestezi makinesine takın. Anestezi makinesini açın ve% 0.75 izofluran ile 1.0 L / dakika oksijen verecek şekilde ayarlayın.
- Nabız oksimetresini ona sıkıştırınHayvan fizyolojik durumunu izlemek için kuyruk.
- Sıçanın kafa derisine renksiz bir ultrason jeli katın. Laboratuar krikosu konumunu tarayıcının ortasına getirin. Solunum maskesi görüntüleme penceresine uyacak şekilde uyarlanmıştır. Ticari olarak bulunan burun konisinin% 10'u kesilir ve bir eldivene bağlanır.
- Laboratuar kriko yüksekliğini, görüntüleme düzleminin UST'nin odak noktasında olduğu şekilde manüel olarak ayarlayın.
- Gerekirse veri toplama yazılımındaki parametreleri ayarlayın (Malzeme Tablosuna bakın). Edinimi başlatmak için veri toplama yazılımı programını çalıştırın ( yani, görüntüleme).
NOT: Program, UST'yi döndürmek ve A-line PA sinyalleri toplamak için kullanılır. Toplanan A-çizgileri bilgisayara kaydedilecektir. - Görüntüleme periyodu boyunca hayvana dikkat edin ve görüntüleme tamamlandıktan sonra PAT rekonstrüksiyonuna geçin.
- Veri toplama işlemi bittikten sonra,Yeniden yapılandırma yazılımı programını kullanarak A-çizgilerinden kesitsel beyin görüntüsünü yeniden oluşturun.
- Anestezi sistemini kapatın, hayvanı sahneden çıkarın, kafesine geri gönderin ve bilinçleninceye kadar onu izleyin.
NOT: Örneğin, UST 5 s boyunca döndürülürse, PLD 35.000 (= 5 x 7.000) darbe verir ve UST 35.000 A-çizgileri toplar. 35.000 A-satırı, 70 sinyali ortalamakla (A-çizgileri ortalaması = 35.000 / 70 = 500 sonra) 500'e düşürüldü. Şekil lc , lazer darbelerinin ve A-çizgi koleksiyonunun aydınlatılmasını göstermektedir. Gecikme-ve-toplam geri yansıtma algoritmasına dayanan bir yeniden yapılandırma programı kullanılmalıdır.
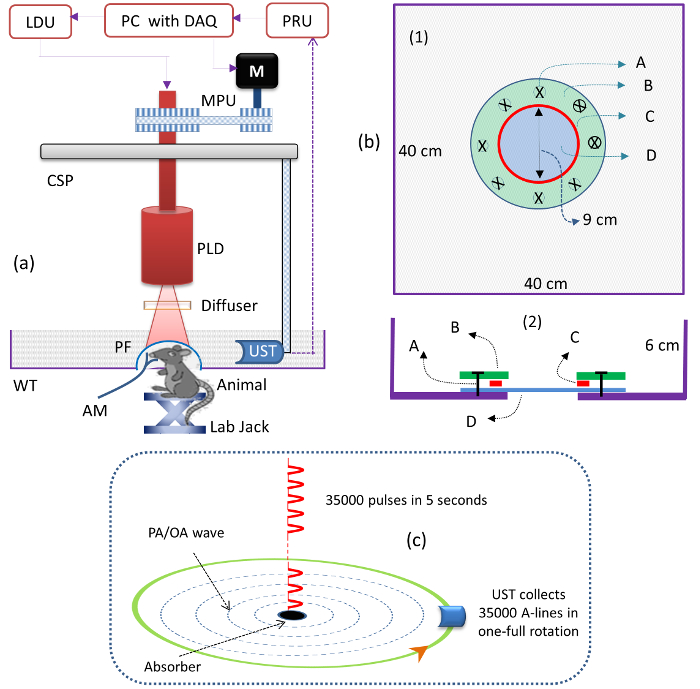
Şekil 1: PLD-PAT Sisteminin Şematiği. ( A ) PLD-PAT şeması. PLD: darbeli lazer diyodu, CSP: circuL: lazer sürücü ünitesi, PRU: pulser / alıcı ünitesi, UST: ultrason transdüseri, WT: su deposu, PF: polimer film ve DAQ: püskürtme tabancası / alıcı ünitesi, Veri toplama kartı. ( B ) İn vivo küçük hayvan beyin görüntülemesi için su haznesinin şeması, üstten görünüş (1) ve kesit görünümü (2). A: metrik vida, B: akrilik halka şeklinde levha, C: silikon "O" halka, D: 100 μm kalınlığında şeffaf polietilen kapak. Deponun tabanı 9 cm çapında bir delik vardı ve ultrasonik ve optik olarak şeffaf, 100 um kalınlığında bir polietilen membran ile kapatılmıştır. ( C ) Lazer darbelerinin PLD ve A-çizgilerinden aydınlatılması şeması, 5 saniyelik sürekli tarama süresi içinde toplanması. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Sonuçlar
Tarif edilen PLD-PAT sisteminin yeteneklerini gösteren in vivo beyin görüntüleme sonuçları bu bölümde sergilenmektedir. PLD-PAT sisteminin yüksek hızlı görüntüleme yeteneklerini göstermek için, iki farklı sağlıklı sıçanın in vivo beyin görüntülemesi yapıldı. Şekil 2 , çeşitli tarama hızlarında bir dişi sıçanın (93 g) beyin görüntülerini göstermektedir. Şekil 2a ve b, s?...
Tartışmalar
Bu çalışma, PLD-PAT sistemi kullanılarak sıçanlarda in vivo beyin görüntülemenin gerçekleştirilmesi için bir protokol sunmaktadır. Protokol, sıçanlar üzerinde beyin görüntülemesinin yanı sıra görüntüleme sisteminin ve hizalamasının ayrıntılı bir tasvirini de içerir. Mevcut OPO tabanlı PAT sistemleri pahalıdır ve hantaldır ve 5-10 dakikada bir kesitsel görüntü sağlayabilir. PLD-PAT sistemi kompakt, taşınabilir ve düşük maliyetlidir ve 3 s'de kaliteli görüntüler s...
Açıklamalar
Yazarların el yazmasıyla ilgili herhangi bir mali çıkarları yoktur ve açığa çıkacak diğer olası çıkar çatışmaları yoktur.
Teşekkürler
Araştırma, Singapur Eğitim Bakanlığı (ARC2 / 15: M4020238) ve Singapur Sağlık Bakanlığı Ulusal Tıbbi Araştırma Konseyi (NMRC / OFIRG / 0005/2016: M4062012) tarafından finanse edilen 2. Aşama hibe tarafından desteklenmektedir. Yazarlar, makine dükkanı yardımı için Bay Chow Wai Hoong Bobby'ye teşekkür etmek istiyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Pulsed laser diode | Quantel, France | QD-Q1910-SA-TEC | It is the excitation laser source with specifications 803 nm, 1.4mJ per pulse, 136 ns pulse, 7kHz maximum, dimentions : 11.0 x 6.0 x 3.6 cm, weight: ~150 gm |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718-01P, Gearbox: DPL64/1, I = 10 for NEMA 23; power supply PW100-48 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasonic pulser/receiver | Olympus | 5072PR | To receive, filter and ampligy the PA signal from UST. Its bandwidth is 35MHz, and gain is ±59 dB. |
| Ultrasound Transducer | Olympus | V306-SU-NK-CF1.9IN/Q4200069 | Ultrasonic sensors used for photoacoustic detection. Central freqency 2.25 MHz, 0.5 in, Cylindrical focus 1.9 inch |
| PCIe DAQ (Data acquisition) Card | GaGe | CSE4227/ A6000610/B0E00610 | 12 bit, 100 Ms/s, 2 channels, 1 Gs on board memory, PCIe x16 interface |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g |
| Acrylic water tank | NTU workshop | Custom-made | It contains the water that acts as an acoustic coupling medium between brain and detector |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of Alluminum |
| Anesthetic Machine | medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Pulse Oxymeter portable | Medtronic | PM10N with veterinary sensor | Monitors the pulse oxymetry of the animal |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Data acqusison software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 | LabVIEW based program was developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2012b | Matlab code for reconstruction of PA images was developed in our lab |
| Temperature controller | LaridTech, MO,USA | MTTC1410 | It will constantly control temperature of the PLD |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Variable power supply | BASETech | BT-153 | To change the laser output power |
| Funtion generator | Funktionsgenerator | FG250D | To change the repetetion rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose. | |
| Animal holder | NTU workshop | Custom-made | Used for holding the animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Pentobarbital sodium | Valabarb | Used for euthanizing the animal after the expeirment. | |
| Optical diffuser | Thorlabs | DG10-1500 | Used to to make the laser beam homogeneous |
Referanslar
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. J Biomed Opt. 22 (4), 041006 (2017).
- Strohm, E. M., Moore, M. J., Kolios, M. C. Single Cell Photoacoustic Microscopy: A Review. IEEE Sel Top Quantum Electron. 22 (3), 6801215 (2016).
- Valluru, K. S., Willmann, J. K. Clinical photoacoustic imaging of cancer. Ultrasonography. 35 (4), 267 (2016).
- Zhou, Y., Yao, J., Wang, L. V. Tutorial on photoacoustic tomography. J Biomed Opt. 21 (6), 061007 (2016).
- Yao, J., Wang, L. V. Photoacoustic Brain Imaging: from Microscopic to Macroscopic Scales. Neurophotonics. 1 (1), 011003 (2014).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. J Biomed Opt. 21 (8), 086011 (2016).
- Strohm, E. M., Moore, M. J., Kolios, M. C. High resolution ultrasound and photoacoustic imaging of single cells. Photoacoustics. 4 (1), 36-42 (2016).
- Upputuri, P. K., Wen, Z. -. B., Wu, Z., Pramanik, M. Super-resolution photoacoustic microscopy using photonic nanojets: a simulation study. J Biomed Opt. 19 (11), 116003 (2014).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Upputuri, P. K., Wu, Z., Gong, L., Ong, C. K., Wang, H. Super-resolution coherent anti-Stokes Raman scattering microscopy with photonic nanojets. Opt Express. 22 (11), 12890-12899 (2014).
- Raghunathan, R., Singh, M., Dickinson, M. E., Larin, K. V. Optical coherence tomography for embryonic imaging: a review. J Biomed Opt. 21 (5), 050902 (2016).
- Burton, N. C., et al. Multispectral opto-acoustic tomography (MSOT) of the brain and glioblastoma characterization. Neuroimage. 65 (2), 522-528 (2013).
- Su, R., Ermilov, S. A., Liopo, A. V., Oraevsky, A. A. Three-dimensional optoacoustic imaging as a new noninvasive technique to study long-term biodistribution of optical contrast agents in small animal models. J Biomed Opt. 17 (10), 101506 (2012).
- Hu, S., Maslov, K., Wang, L. V. In vivo functional chronic imaging of a small animal model using optical-resolution photoacoustic microscopy. Med Phys. 36 (6), 2320-2323 (2009).
- Zhang, E. Z., Laufer, J., Pedley, R. B., Beard, P. 3D photoacoustic imaging system for in vivo studies of small animal models. Proc SPIE. 6856, 68560 (2008).
- Deng, Z., Li, W., Li, C. Slip-ring-based multi-transducer photoacoustic tomography system. Opt Lett. 41 (12), 2859-2862 (2016).
- Tang, J., Coleman, J. E., Dai, X., Jiang, H. Wearable 3-D Photoacoustic Tomography for Functional Brain Imaging in Behaving Rats. Sci Rep. 6, 25470 (2016).
- Pramanik, M., et al. In vivo carbon nanotube-enhanced non-invasive photoacoustic mapping of the sentinel lymph node. Phys Med Biol. 54 (11), 3291-3301 (2009).
- Yao, J., Xia, J., Wang, L. V. Multiscale Functional and Molecular Photoacoustic Tomography. Ultrason Imaging. 38 (1), 44-62 (2016).
- Huang, S., Upputuri, P. K., Liu, H., Pramanik, M., Wang, M. A dual-functional benzobisthiadiazole derivative as an effective theranostic agent for near-infrared photoacoustic imaging and photothermal therapy. J Mat Chem B. 4 (9), 1696-1703 (2016).
- Olefir, I., Mercep, E., Burton, N. C., Ovsepian, S. V., Ntziachristos, V. Hybrid multispectral optoacoustic and ultrasound tomography for morphological and physiological brain imaging. J Biomed Opt. 21 (8), 086005 (2016).
- Hu, S., Maslov, K., Tsytsarev, V., Wang, L. V. Functional transcranial brain imaging by optical-resolution photoacoustic microscopy. J Biomed Opt. 14 (4), 040503 (2009).
- Yao, J. J., et al. Noninvasive photoacoustic computed tomography of mouse brain metabolism in vivo. Neuroimage. 64 (1), 257-266 (2013).
- Hu, S., Wang, L. V. Neurovascular photoacoustic tomography. Front Neuroenergetics. 2, 10 (2010).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Yang, X., et al. Photoacoustic tomography of small animal brain with a curved array transducer. J Biomed Opt. 14 (5), 054007 (2009).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomed Opt Express. 7 (2), 312-323 (2016).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Opt Lett. 31 (23), 3462-3464 (2006).
- Kolkman, R. G. M., Steenbergen, W., van Leeuwen, T. G. In vivo photoacoustic imaging of blood vessels with a pulsed laser diode. Lasers Med Sci. 21 (3), 134-139 (2006).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Opt Express. 22 (21), 26365-26374 (2014).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomed Phys Eng Express. 1 (4), 045010-045017 (2015).
- . . American National Standard for Safe Use of Lasers ANSI Z136.1-2000. , (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır