Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein leistungsstarkes kompaktes Fotoakustik-Tomographie-System für
In diesem Artikel
Zusammenfassung
Ein kompaktes Puls-Laser-Dioden-basiertes photoakustisches Tomographie-System (PLD-PAT) für die Hochgeschwindigkeits- In-vivo- Gehirn-Bildgebung bei kleinen Tieren wird gezeigt.
Zusammenfassung
In vivo spielt die Kleinbild-Bildgebung eine wichtige Rolle in präklinischen Studien. Photoakustische Tomographie (PAT) ist eine aufkommende Hybrid-Imaging-Modalität, die ein großes Potenzial für präklinische und klinische Anwendungen zeigt. Konventionelle optische parametrische Oszillator-basierte PAT (OPO-PAT) -Systeme sind sperrig und teuer und können keine Hochgeschwindigkeits-Bildgebung bereitstellen. In letzter Zeit wurden Pulslaserdioden (PLDs) als alternative Anregungsquelle für PAT erfolgreich nachgewiesen. Die Puls-Laserdiode PAT (PLD-PAT) wurde erfolgreich für die Hochgeschwindigkeits-Bildgebung auf photoakustischen Phantomen und biologischen Geweben demonstriert. Diese Arbeit liefert ein visualisiertes experimentelles Protokoll für die in vivo- Gehirn-Bildgebung mit PLD-PAT. Das Protokoll beinhaltet die kompakte PLD-PAT-Systemkonfiguration und deren Beschreibung, Tierpräparation für die Gehirn-Bildgebung und ein typisches experimentelles Verfahren für die 2D-Querschnittsrücken-Gehirn-Bildgebung. Das PLD-PAT-System ist kompakt und kostengünstigFective und kann High-Speed, qualitativ hochwertige Bildgebung. Gehirnbilder, die in vivo bei verschiedenen Scan-Geschwindigkeiten gesammelt wurden, werden präsentiert.
Einleitung
Photoakustische Tomographie (PAT) ist eine hybride bildgebende Methode, die sowohl in der klinischen als auch in der präklinischen Studie 1 , 2 , 3 , 4 , 5 viele Anwendungen hat. In PAT bestrahlen Nanosekunden-Laserpulse biologisches Gewebe. Die Absorption von einfallendem Licht durch die Gewebe-Chromophore führt zu einem lokalen Temperaturanstieg, der dann Druckwellen ergibt, die in Form von Schallwellen emittiert werden. Ein Ultraschalldetektor sammelt die photoakustischen Signale an verschiedenen Positionen um die Probe herum. Die photoakustischen (PA) Signale werden unter Verwendung verschiedener Algorithmen (wie z. B. eines Verzögerungs- und Summenalgorithmus) 6 rekonstruiert, um das photoakustische Bild zu erzeugen.
Diese Hybrid-Bildgebungsmodalität bietet eine hochauflösende, tiefgewebte Bildgebung und einen hohen optischen Absorptionskontrast 7 ,Class = "xref"> 8 Vor kurzem wurde in Hühnerbrustgewebe mit Hilfe einer längeren Wellenlänge (~ 1.064 nm) und einem exogenen Kontrastmittel, Phosphorphthalocyanin genannt, eine ~ 12-cm-Bildtiefe 9 erreicht. Diese Tiefenempfindlichkeit ist viel höher als die Tiefenempfindlichkeit anderer optischer Methoden wie konfokale Fluoreszenzmikroskopie, Zwei-Photonen-Fluoreszenzmikroskopie, 10 optische Kohärenztomographie, 11 etc. Mit mehr als einer Wellenlänge kann PAT strukturelle und funktionelle Veränderungen in den Organen nachweisen . Für viele menschliche Krankheiten sind Kleintiermodelle gut etabliert 12 , 13 , 14 , 15 . Für die Bildgebung von kleinen Tieren wurden mehrere Modalitäten nachgewiesen. Aus all diesen Ansätzen hat sich die PA-Bildgebung aufgrund der oben genannten Vorteile sehr schnell bemerkbar gemacht. PAT hat sein Potenzial für die Bildgebung von Blutgefäßen in den Geweben und Organen ( dh Herz, Lunge, Leber, Augen, Milz, Gehirn, Haut, Rückenmark, Niere usw. ) von kleinen Tieren 4 , 16 , 17 , 18 gezeigt . PAT ist eine etablierte Modalität für kleine Tier-Gehirn-Bildgebung. PA-Wellen werden aufgrund der Lichtabsorption durch die Chromophore erzeugt, so dass die Mehrfachwellenlänge PAT die Abbildung der Gesamt-Hämoglobinkonzentration (HbT) und der Sauerstoffsättigung (SO 2 ) 19 , 20 , 21 , 22 ermöglicht . Die Hirnneurovaskuläre Bildgebung wurde mit Hilfe exogener Kontrastmittel 12 , 23 , 24 erreicht . PA-Modalität kann dazu beitragen, ein besseres Verständnis der Gehirn Gesundheit durchBereitstellung von Informationen auf molekularer und genetischer Ebene.
Für die Kleintier-Bildgebung werden Nd: YAG / OPO-Laser weithin als PAT-Anregungsquellen verwendet. Diese Laser liefern ~ 5 ns Nah-Infrarot-Impulse mit Energie (~ 100 mJ am OPO-Ausgangsfenster) bei einer ~ 10-Hz-Wiederholrate 25 . Das mit solchen Lasern ausgestattete PA-System ist kostspielig und sperrig und ermöglicht aufgrund der geringen Wiederholrate der Laserquelle eine Low-Speed-Bildgebung mit Einzelelement-Ultraschallwandlern (UST). Eine typische A-line-Erfassungszeit in solchen PA-Systemen beträgt ~ 5 min pro Querschnitt 25 . Ein Abbildungssystem mit einer so langen Messzeit ist für die Kleintier-Bildgebung nicht ideal, da es schwierig ist, die physiologischen Parameter für die Ganzkörper-Bildgebung, die zeitaufgelöste Funktionsabbildung usw. zu kontrollieren . Durch die Einführung mehrerer Einzelelement-USTs, Array -basierte USTs oder ein Laser mit hoher Wiederholrate, ist es möglich, die Abbildungsgeschwindigkeit von PA zu erhöhenSysteme Mit nur einem Einzelelement UST, um alle PA-Signale um die Probe zu sammeln, wird die Abbildungsgeschwindigkeit des Systems begrenzt. Mehrere Einzelelement-USTs, die in kreisförmiger oder halbkreisförmiger Geometrie angeordnet sind, werden für hochgeschwindigkeits-hochempfindliche bildgebende Verfahren demonstriert. Array-basierte USTs 26 , wie lineare, halbkreisförmige, kreisförmige und volumetrische Arrays, wurden erfolgreich für die Echtzeit-Bildgebung verwendet 1 . Diese Array-basierten USTs erhöhen die Abbildungsgeschwindigkeit und reduzieren die Messempfindlichkeit, aber sie sind teuer. Jedoch ist die Abbildungsgeschwindigkeit von PA-Systemen, die Array-basierte USTs verwenden, immer noch durch die Wiederholungsrate des Lasers begrenzt.
Die gepulste Lasertechnologie wurde entwickelt, um hochauflösende gepulste Laserdioden (PLDs) herzustellen. 7.000 Frames / s B-scan photoacoustic Imaging wurde mit PLDs mit einer klinischen Ultraschallplattform 27 demonstriert. Solche PLDs können die Abbildungsgeschwindigkeit von th verbessernE PAT-System, auch mit Single-Element UST kreisförmigen Scan-Geometrie. Single-Element USTs sind weniger teuer und hochempfindlich, im Gegensatz zu Array-basierten USTs. Im Laufe des letzten Jahrzehnts wurde wenig Forschung über die Verwendung von hochauflösenden PLDs als Anregungsquelle für die PA-Bildgebung berichtet. Für die PA-Abbildung von Phantomen 28 wurde eine faserbasierte Nah-Infrarot-PLD nachgewiesen. Die in vivo- Bildgebung von Blutgefäßen in einer Tiefe von 1 mm unterhalb der menschlichen Haut wurde mit Niedrigenergie-PLDs 29 demonstriert. Es wurde ein PLD-basiertes optisches Auflösungs-Fotoakustikmikroskop (ORPAM) berichtet. Mit PLDs wurde eine 1,5 cm tiefe Bildgebung mit einer Bildrate von 0,43 Hz nachgewiesen. Vor kurzem wurde ein PLD-PAT-System berichtet, das Bilder in so kurz wie ~ 3 s und bei einer ~ 2 cm Bildtiefe im biologischen Gewebe 25 , 31 lieferte. Diese Studie zeigte, dass solch ein kostengünstiges, kompaktes System High-Qua liefern kannLity Bilder, auch bei hohen Geschwindigkeiten. Das PLD-PAT-System kann für hochauflösende (7000 fps) photoakustische Bildgebung, Surf-Blutgefäß-Bildgebung, Fingergelenk-Bildgebung, 2 cm tiefe Gewebe-Bildgebung, Klein-Tier-Gehirn-Bildgebung, etc. verwendet werden. Die Ein-Wellenlänge und Tiefpuls-Energie-Impulse von PLD begrenzen ihre Anwendung auf Multispektral- und Tiefgewebe-Bildgebung. Experimente wurden an kleinen Tieren mit demselben PLD-PAT-System durchgeführt, das für präklinische Anwendungen verwendet wurde. Der Zweck dieser Arbeit ist es, die visualisierte experimentelle Demonstration des PLD-PAT-Systems für die in vivo- 2D-Querschnitts-Gehirn-Bildgebung von kleinen Tieren bereitzustellen.
Protokoll
Alle Tierversuche wurden nach den Richtlinien und Vorschriften durchgeführt, die vom Institutional Animal Care and Use Committee der Nanyang Technological University, Singapur (Tierprotokoll Nr. ARF-SBS / NIE-A0263) genehmigt wurden.
1. Systembeschreibung
- Montieren Sie die PLD in den kreisförmigen Scanner, wie in Abbildung 1a gezeigt . Verbinden Sie die PLD mit der Lasertreibereinheit (LDU).
HINWEIS: Die PLD liefert ~ 136-ns-Impulse bei einer Wellenlänge von ~ 803 nm mit einer maximalen Pulsenergie von ~ 1,42 mJ und einer Wiederholrate bis zu 7 kHz. Die Laserantriebseinheit (LDU) umfasst: einen Temperaturregler, eine variable Stromversorgung, eine Stromversorgung (12 V) und einen Funktionsgenerator; Siehe die Tabelle der Materialien. Die variable Stromversorgung dient zur Steuerung der Laserleistung und der Funktionsgenerator dient zur Änderung der Wiederholrate der PLD. - Schalte den PLD-Laser ein. Setzen Sie die PLD-Wiederholrate auf "7.000" HZ mit dem Funktionsgenerator in der LDU. Erhöhen Sie die Pulsenergie auf 1,42 mJ, indem Sie die Spannung der variablen Stromversorgung auf "3.1" V einstellen.
- Montieren Sie den optischen Diffusor (OD) vor dem PLD-Austrittsfenster, um den Ausgangsstrahl homogen zu machen, wie in Abbildung 1a gezeigt .
HINWEIS: Verwenden Sie einen Diffusor mit einem feinen Korn ( dh 1,500-Korn-Polnisch). - Montieren Sie das fokussierte UST auf dem UST-Halter, so dass es dem Zentrum des Scanbereichs zugewandt ist, wie in Abbildung 1a gezeigt .
HINWEIS: Die Mittenfrequenz des UST beträgt 2,25 MHz und die Brennweite beträgt 1,9 Zoll. - Legen Sie den Ultraschall-Detektor in den Acryl-Tank, wie in Abbildung 1a gezeigt . Füllen Sie den Tank mit Wasser, so dass die UST ist völlig eingetaucht.
HINWEIS: Ein Wassermedium wird verwendet, um das photoakustische Signal vom Gehirn (Probe) an das UST zu koppeln. Ein Acryl-Wasser-Tank (WT, siehe die Tabelle der Materialien) war benutzerdefiniert-designed für kleine Tier-Bildgebung. Der Schaltplan des Wassertankentwurfs ist in Abbildung 1b dargestellt . - Überprüfen Sie das PA-Signal aus der Probe mit einer Pulser / Empfänger-Einheit (PRU, siehe Tabelle der Materialien ).
HINWEIS: Diese Signale wurden durch eine 12-Bit-DAQ-Karte (siehe Tabelle der Materialien ) mit einer 100 MS / s-Abtastrate digitalisiert und auf einem Computer gespeichert.
2. Tiervorbereitung für Rattenhirnbildgebung
HINWEIS: Das oben beschriebene PLD-PAT-System wurde für die Bildgebung von kleinen Tierhirn demonstriert. Für diese Experimente wurden gesunde weibliche Ratten (siehe Tabelle der Materialien ) verwendet.
- Anästhesieren des Tieres durch intraperitoneale Injektion eines Cocktails aus 2 ml Ketamin, 1 ml Xylazin und 1 ml Kochsalzlösung (Dosierung von 0,2 ml / 100 g).
- Entfernen Sie das Fell auf der Kopfhaut des Tieres mit einem Haarschneider. Tragen Sie sanft Haare Entfernung Creme auf die rasierteBereich zur weiteren Erschöpfung des Fells
- Entfernen Sie die aufgetragene Creme nach 4-5 min mit einem Wattestäbchen.
- Tragen Sie künstliche Tränensalbe auf die Augen des Tieres, um die Trockenheit durch Anästhesie und Laserbeleuchtung zu verhindern.
- Montieren Sie den maßgeschneiderten Tierhalter (siehe die Tabelle der Materialien ), der mit einer Atemmaske (siehe Tabelle der Materialien ) auf einer Laborbuchse ausgestattet ist.
- Legen Sie das Tier in die anfällige Position auf den Halter. Sichern Sie es mit dem chirurgischen Band an den Halter, um eine Bewegung des Tieres während der Bildgebung zu vermeiden.
- Stellen Sie sicher, dass die Atemmaske die Nase und den Mund der Ratte bedeckt, um inhalierte Anästhesie zu liefern.
3. In vivo Ratte Brain Imaging
- Verbinden Sie die Atemmaske mit der Narkosemaschine. Schalten Sie die Anästhesie-Maschine ein und stellen Sie sie ein, um 1,0 l / min Sauerstoff mit 0,75% Isofluran zu liefern.
- Klemmen Sie das Pulsoximeter dazuS Schwanz zur Überwachung der physiologischen Zustand des Tieres.
- Tragen Sie eine Schicht aus farblosem Ultraschallgel auf die Kopfhaut der Ratte auf. Stellen Sie die Position des Labors in die Mitte des Scanners ein. Die Atemmaske ist auf das Bildgebungsfenster abgestimmt. 10% des handelsüblichen Nasenkonus geschnitten und dann mit einem Handschuh verbunden.
- Stellen Sie die Höhe der Laborbuchse manuell ein, so dass die Abbildungsebene im Fokus des UST steht.
- Setzen Sie die Parameter in der Datenerfassungssoftware (siehe Tabelle der Materialien) nach Bedarf ein. Führen Sie das Datenerfassungs-Softwareprogramm aus, um die Erfassung zu starten ( dh die Bildgebung).
HINWEIS: Das Programm wird verwendet, um die UST zu drehen und A-line PA-Signale zu sammeln. Die gesammelten A-Linien werden auf dem Computer gespeichert. - Beobachten Sie das Tier während der gesamten Bildgebung und fahren Sie mit der PAT-Rekonstruktion fort, nachdem die Bildgebung abgeschlossen ist.
- Nachdem die Datenerfassung vorbei ist,Rekonstruieren Sie das Querschnitts-Hirnbild von den A-Linien mit dem Rekonstruktionssoftware-Programm.
- Schalten Sie das Anästhesiesystem aus, entfernen Sie das Tier von der Bühne, bringen Sie es in den Käfig zurück und überwachen Sie es, bis es das Bewusstsein wiedererlangt.
HINWEIS: Wenn zum Beispiel der UST für 5 s gedreht wird, liefert der PLD 35.000 (= 5 x 7.000) Impulse und der UST sammelt 35.000 A-Linien. Die 35.000 A-Linien werden durch Mittelwertbildung über 70 Signale auf 500 reduziert (nach Mittelung von A-Linien = 35.000 / 70 = 500). Abbildung 1c zeigt die Beleuchtung der Laserpulse und der A-Zeilen-Sammlung. Es sollte ein Rekonstruktionsprogramm verwendet werden, das auf dem Verzögerungs-und-Summen-Rückprojektionsalgorithmus basiert.
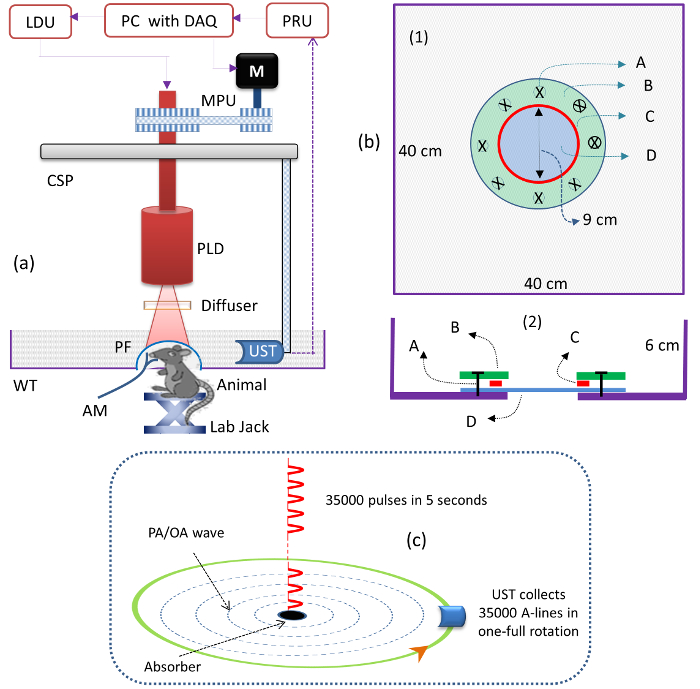
Abbildung 1: Schematik des PLD-PAT-Systems. ( A ) Schema des PLD-PAT. PLD: gepulste Laserdiode, CSP: circuLDU: Lasertreiber-Einheit, PRU: Pulser / Empfänger-Einheit, UST: Ultraschall-Messumformer, WT: Wassertank, PF: Polymerfolie und DAQ: Datenerfassungskarte. ( B ) Schematik des Wassertanks, Draufsicht (1) und Querschnittsansicht (2) für in vivo kleine Tierhirnbildgebung. A: metrisch Schraube, B: Acryl Ringplatte, C: Silikon "O" Ring, D: 100 μm dicke, transparente Polyethylenabdeckung. Der Tank hatte an seinem Boden ein Loch von 9 cm Durchmesser und wurde mit einer ultraschall- und optisch transparenten 100 μm dicken Polyethylenmembran versiegelt. ( C ) Schema der Beleuchtung von Laserpulsen aus der PLD und A-Linie, Sammlung in einer 5 s kontinuierlichen Scan-Zeit. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ergebnisse
Die in vivo- Gehirn-Imaging-Ergebnisse, die die Fähigkeiten des beschriebenen PLD-PAT-Systems zeigen, werden in diesem Abschnitt gezeigt. Um die High-Speed-Imaging-Fähigkeiten des PLD-PAT-Systems zu demonstrieren, wurde die in vivo- Gehirn-Bildgebung von zwei verschiedenen gesunden Ratten durchgeführt. Fig. 2 zeigt die Gehirnbilder einer weiblichen Ratte (93 g) bei verschiedenen Abtastgeschwindigkeiten. Abbildung 2a<...
Diskussion
Diese Arbeit stellt ein Protokoll für die Durchführung in vivo Gehirn-Bildgebung auf Ratten mit einem PLD-PAT-System. Das Protokoll enthält eine detaillierte Beschreibung des Bildgebungssystems und dessen Ausrichtung sowie eine Darstellung der Gehirnabbildung an Ratten. Die vorhandenen OPO-basierten PAT-Systeme sind teuer und sperrig und können in 5-10 min ein Querschnittsbild liefern. Das PLD-PAT-System ist kompakt, portabel und kostengünstig und kann in 3 s qualitativ hochwertige Bilder liefern. Die Leis...
Offenlegungen
Die Autoren haben keine relevanten finanziellen Interessen im Manuskript und keine anderen potenziellen Interessenkonflikte zu offenbaren.
Danksagungen
Die Forschung wird unterstützt durch die Tier-2-Förderung durch das Ministerium für Bildung in Singapur (ARC2 / 15: M4020238) und der Singapur Ministerium für Gesundheit National Medical Research Council (NMRC / OFIRG / 0005/2016: M4062012) gefördert. Die Autoren danken Herrn Chow Wai Hoong Bobby für den Maschinenladen helfen.
Materialien
| Name | Company | Catalog Number | Comments |
| Pulsed laser diode | Quantel, France | QD-Q1910-SA-TEC | It is the excitation laser source with specifications 803 nm, 1.4mJ per pulse, 136 ns pulse, 7kHz maximum, dimentions : 11.0 x 6.0 x 3.6 cm, weight: ~150 gm |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718-01P, Gearbox: DPL64/1, I = 10 for NEMA 23; power supply PW100-48 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasonic pulser/receiver | Olympus | 5072PR | To receive, filter and ampligy the PA signal from UST. Its bandwidth is 35MHz, and gain is ±59 dB. |
| Ultrasound Transducer | Olympus | V306-SU-NK-CF1.9IN/Q4200069 | Ultrasonic sensors used for photoacoustic detection. Central freqency 2.25 MHz, 0.5 in, Cylindrical focus 1.9 inch |
| PCIe DAQ (Data acquisition) Card | GaGe | CSE4227/ A6000610/B0E00610 | 12 bit, 100 Ms/s, 2 channels, 1 Gs on board memory, PCIe x16 interface |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g |
| Acrylic water tank | NTU workshop | Custom-made | It contains the water that acts as an acoustic coupling medium between brain and detector |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of Alluminum |
| Anesthetic Machine | medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Pulse Oxymeter portable | Medtronic | PM10N with veterinary sensor | Monitors the pulse oxymetry of the animal |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Data acqusison software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 | LabVIEW based program was developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2012b | Matlab code for reconstruction of PA images was developed in our lab |
| Temperature controller | LaridTech, MO,USA | MTTC1410 | It will constantly control temperature of the PLD |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Variable power supply | BASETech | BT-153 | To change the laser output power |
| Funtion generator | Funktionsgenerator | FG250D | To change the repetetion rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose. | |
| Animal holder | NTU workshop | Custom-made | Used for holding the animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Pentobarbital sodium | Valabarb | Used for euthanizing the animal after the expeirment. | |
| Optical diffuser | Thorlabs | DG10-1500 | Used to to make the laser beam homogeneous |
Referenzen
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. J Biomed Opt. 22 (4), 041006 (2017).
- Strohm, E. M., Moore, M. J., Kolios, M. C. Single Cell Photoacoustic Microscopy: A Review. IEEE Sel Top Quantum Electron. 22 (3), 6801215 (2016).
- Valluru, K. S., Willmann, J. K. Clinical photoacoustic imaging of cancer. Ultrasonography. 35 (4), 267 (2016).
- Zhou, Y., Yao, J., Wang, L. V. Tutorial on photoacoustic tomography. J Biomed Opt. 21 (6), 061007 (2016).
- Yao, J., Wang, L. V. Photoacoustic Brain Imaging: from Microscopic to Macroscopic Scales. Neurophotonics. 1 (1), 011003 (2014).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. J Biomed Opt. 21 (8), 086011 (2016).
- Strohm, E. M., Moore, M. J., Kolios, M. C. High resolution ultrasound and photoacoustic imaging of single cells. Photoacoustics. 4 (1), 36-42 (2016).
- Upputuri, P. K., Wen, Z. -. B., Wu, Z., Pramanik, M. Super-resolution photoacoustic microscopy using photonic nanojets: a simulation study. J Biomed Opt. 19 (11), 116003 (2014).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Upputuri, P. K., Wu, Z., Gong, L., Ong, C. K., Wang, H. Super-resolution coherent anti-Stokes Raman scattering microscopy with photonic nanojets. Opt Express. 22 (11), 12890-12899 (2014).
- Raghunathan, R., Singh, M., Dickinson, M. E., Larin, K. V. Optical coherence tomography for embryonic imaging: a review. J Biomed Opt. 21 (5), 050902 (2016).
- Burton, N. C., et al. Multispectral opto-acoustic tomography (MSOT) of the brain and glioblastoma characterization. Neuroimage. 65 (2), 522-528 (2013).
- Su, R., Ermilov, S. A., Liopo, A. V., Oraevsky, A. A. Three-dimensional optoacoustic imaging as a new noninvasive technique to study long-term biodistribution of optical contrast agents in small animal models. J Biomed Opt. 17 (10), 101506 (2012).
- Hu, S., Maslov, K., Wang, L. V. In vivo functional chronic imaging of a small animal model using optical-resolution photoacoustic microscopy. Med Phys. 36 (6), 2320-2323 (2009).
- Zhang, E. Z., Laufer, J., Pedley, R. B., Beard, P. 3D photoacoustic imaging system for in vivo studies of small animal models. Proc SPIE. 6856, 68560 (2008).
- Deng, Z., Li, W., Li, C. Slip-ring-based multi-transducer photoacoustic tomography system. Opt Lett. 41 (12), 2859-2862 (2016).
- Tang, J., Coleman, J. E., Dai, X., Jiang, H. Wearable 3-D Photoacoustic Tomography for Functional Brain Imaging in Behaving Rats. Sci Rep. 6, 25470 (2016).
- Pramanik, M., et al. In vivo carbon nanotube-enhanced non-invasive photoacoustic mapping of the sentinel lymph node. Phys Med Biol. 54 (11), 3291-3301 (2009).
- Yao, J., Xia, J., Wang, L. V. Multiscale Functional and Molecular Photoacoustic Tomography. Ultrason Imaging. 38 (1), 44-62 (2016).
- Huang, S., Upputuri, P. K., Liu, H., Pramanik, M., Wang, M. A dual-functional benzobisthiadiazole derivative as an effective theranostic agent for near-infrared photoacoustic imaging and photothermal therapy. J Mat Chem B. 4 (9), 1696-1703 (2016).
- Olefir, I., Mercep, E., Burton, N. C., Ovsepian, S. V., Ntziachristos, V. Hybrid multispectral optoacoustic and ultrasound tomography for morphological and physiological brain imaging. J Biomed Opt. 21 (8), 086005 (2016).
- Hu, S., Maslov, K., Tsytsarev, V., Wang, L. V. Functional transcranial brain imaging by optical-resolution photoacoustic microscopy. J Biomed Opt. 14 (4), 040503 (2009).
- Yao, J. J., et al. Noninvasive photoacoustic computed tomography of mouse brain metabolism in vivo. Neuroimage. 64 (1), 257-266 (2013).
- Hu, S., Wang, L. V. Neurovascular photoacoustic tomography. Front Neuroenergetics. 2, 10 (2010).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Yang, X., et al. Photoacoustic tomography of small animal brain with a curved array transducer. J Biomed Opt. 14 (5), 054007 (2009).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomed Opt Express. 7 (2), 312-323 (2016).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Opt Lett. 31 (23), 3462-3464 (2006).
- Kolkman, R. G. M., Steenbergen, W., van Leeuwen, T. G. In vivo photoacoustic imaging of blood vessels with a pulsed laser diode. Lasers Med Sci. 21 (3), 134-139 (2006).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Opt Express. 22 (21), 26365-26374 (2014).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomed Phys Eng Express. 1 (4), 045010-045017 (2015).
- . . American National Standard for Safe Use of Lasers ANSI Z136.1-2000. , (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten