É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um sistema de tomografia fotoacústica compacta de alto desempenho para
Neste Artigo
Resumo
É demonstrado um sistema compacto de tomografia fotoacústica baseada em diodos a laser pulsado (PLD-PAT) para imagens cerebrais in vivo de alta velocidade em pequenos animais.
Resumo
A imagem in vivo de animais pequenos tem um papel importante a desempenhar em estudos pré-clínicos. A tomografia fotoacústica (PAT) é uma modalidade de imagem híbrida emergente que mostra grande potencial para aplicações clínicas e pré-clínicas. Os sistemas convencionais PAT (OPO-PAT) baseados em osciladores paramétricos convencionais são volumosos e caros e não podem fornecer imagens de alta velocidade. Recentemente, os díodos a laser pulsado (PLDs) foram demonstrados com sucesso como uma fonte de excitação alternativa para PAT. O DIP de laser pulsado PAT (PLD-PAT) foi demonstrado com sucesso para imagens de alta velocidade em fantasmas fotoacústicos e tecidos biológicos. Este trabalho fornece um protocolo experimental visualizado para imagens cerebrais in vivo usando PLD-PAT. O protocolo inclui a configuração compacta do sistema PLD-PAT e sua descrição, preparação animal para imagens cerebrais e um procedimento experimental típico para imagens cerebrais de ratos 2D de seção transversal. O sistema PLD-PAT é compacto e custo-efeEficaz e pode fornecer imagens de alta velocidade e alta qualidade. Imagens de cérebro coletadas in vivo a várias velocidades de varredura são apresentadas.
Introdução
A tomografia fotoacústica (PAT) é uma modalidade de imagem híbrida que tem muitas aplicações em estudos clínicos e pré-clínicos 1 , 2 , 3 , 4 , 5 . Em PAT, pulsos de laser de nanosegundo irradiam tecido biológico. A absorção de luz incidente pelos cromóforos de tecido leva a um aumento de temperatura local, que então produz ondas de pressão emitidas sob a forma de ondas sonoras. Um detector de ultra-som coleta os sinais fotoacústicos em várias posições ao redor da amostra. Os sinais fotoacústicos (PA) são reconstruídos usando vários algoritmos (como um algoritmo de atraso e soma) 6 para gerar a imagem fotoacústica.
Esta modalidade de imagem híbrida oferece imagens de alta resolução e de tecido profundo e alto contraste de absorção óptica 7 ,Class = "xref"> 8. Recentemente, uma profundidade de imagem de ~ 12 cm 9 foi alcançada no tecido mamário de frango com o auxílio de um comprimento de onda mais longo (~ 1,064 nm) e um agente de contraste exógeno chamado ftalocianina de fósforo. Essa sensibilidade de profundidade é muito maior do que a sensibilidade de profundidade de outros métodos ópticos, como a microscopia de fluorescência confocal, a microscopia de fluorescência de dois fótons, a tomografia de coerência 10 , 11 , etc. Usando mais de um comprimento de onda, PAT pode demonstrar mudanças estruturais e funcionais nos órgãos . Para muitas doenças humanas, modelos de animais pequenos foram bem estabelecidos 12 , 13 , 14 , 15 . Para a imagem de animais pequenos, várias modalidades foram demonstradas. Fora de todas essas abordagens, a imagem em PA ganhou atenção com bastante rapidez devido às vantagens mencionadas acima. PAT mostrou seu potencial para imaginar vasos sanguíneos nos tecidos e órgãos ( ie coração, pulmões, fígado, olhos, baço, cérebro, pele, medula espinhal, rim, etc. ) de pequenos animais 4 , 16 , 17 , 18 . O PAT é uma modalidade bem estabelecida para imagens cerebrais de animais pequenos. As ondas PA são produzidas devido à absorção de luz pelos cromóforos, portanto, PAT de múltiplas ondas permite o mapeamento da concentração total de hemoglobina (HbT) e saturação de oxigênio (SO 2 ) 19 , 20 , 21 , 22 . A imagem neurovascular do cérebro foi conseguida com a ajuda de agentes de contraste exógenos 12 , 23 , 24 . A modalidade de PA pode ajudar a melhorar a compreensão da saúde do cérebroFornecendo informações nos níveis molecular e genético.
Para imagens de animais pequenos, os láseres Nd: YAG / OPO são amplamente utilizados como fontes de excitação PAT. Esses laser fornecem pulsos de infravermelho próximo do ~ 5 ns com energia (~ 100 mJ na janela de saída OPO) com uma taxa de repetição de ~ 10 Hz 25 . O sistema de PA equipado com tais láser é caro e volumoso e permite imagens de baixa velocidade com transdutores de ultra-som de um elemento (UST) devido à baixa taxa de repetição da fonte do laser. Um tempo típico de aquisição da linha A em tais sistemas de PA é ~ 5 min por seção transversal 25 . Um sistema de imagem com um tempo de medição tão longo não é ideal para imagens de animais pequenos, pois é difícil controlar os parâmetros fisiológicos para a imagem completa do corpo, imagens funcionais resolvidas no tempo, etc. Ao adotar vários USTs de um único elemento, matriz Com base em USTs, ou um laser de alta taxa de repetição, é possível aumentar a velocidade de imagem da PASistemas. Usar apenas um UST de um único elemento para coletar todos os sinais de PA em torno da amostra irá limitar a velocidade de imagem do sistema. Múltiplos UST de um único elemento dispostos em geometria circular ou semi-circular são demonstrados para técnicas de imagem de alta velocidade e altamente sensíveis. Os USTs 26 baseados em matriz, como matrizes lineares, semi-circulares, circulares e volumétricas, foram utilizados com sucesso na imagem em tempo real 1 . Esses USTs baseados em matriz aumentarão a velocidade de imagem e reduzirão a sensibilidade de medição, mas são caros. No entanto, a velocidade de imagem dos sistemas de PA que usam USTs baseados em matriz ainda está limitada pela taxa de repetição do laser.
Tecnologia de laser pulsado avançada para fazer diodos de laser pulsado de alta taxa de repetição (PLDs). 7,000 quadros / s A imagem fotoacústica B-scan foi demonstrada com PLDs usando uma plataforma de ultra-som clínica 27 . Tais PLDs podem melhorar a velocidade de imagem daE sistema PAT, mesmo com geometria de varredura circular UST de um elemento. Os UST de elemento único são menos caros e altamente sensíveis, ao contrário dos USTs baseados em matrizes. Ao longo da última década, poucas pesquisas foram relatadas sobre o uso de PLD de alta taxa de repetição como fonte de excitação para imagens de PA. Foi demonstrado um PLD de infravermelho próximo a fibra para imagem PA de fantasmas 28 . A imagem in vivo de vasos sanguíneos a uma profundidade de ~ 1 mm abaixo da pele humana foi demonstrada usando PLD de baixa energia 29 . Foi relatado um microscópio fotoacústico de resolução óptica baseado em PLD (ORPAM). Usando PLDs, foi demonstrada uma imagem de imagem de 1,5 cm de profundidade a uma taxa de quadros de 0,43 Hz 30 . Muito recentemente, um sistema PLD-PAT foi relatado que forneceu imagens em tão curto quanto ~ 3 s e a uma profundidade de imagem de ~ 2 cm em tecido biológico 25 , 31 . Este estudo revelou que um sistema tão baixo e compacto pode fornecer alta qualidadeImagens, mesmo em altas velocidades. O sistema PLD-PAT pode ser usado para imagens fotoacústicas de alta taxa de quadros (7.000 fps), imagem de vasos sanguíneos superficiais, imagem de junção de dedos, imagem de tecido de 2 cm de profundidade, imagens de cérebro de animais pequenos, etc. O único comprimento de onda e Os impulsos de pouca pulsação de energia da PLD limitam sua aplicação a imagens multi-espectrales e de tecidos profundos. Experimentos foram realizados em pequenos animais usando o mesmo sistema PLD-PAT usado para aplicações pré-clínicas. O objetivo deste trabalho é fornecer a demonstração experimental visualizada do sistema PLD-PAT para imagens cerebrais transversais 2D in vivo de animais pequenos.
Protocolo
Todas as experiências com animais foram realizadas de acordo com as diretrizes e regulamentos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Tecnológica de Nanyang, em Cingapura (Número de Protocolo Animal ARF-SBS / NIE-A0263).
1. Descrição do sistema
- Monte o PLD dentro do scanner circular, como mostrado na Figura 1a . Conecte o PLD à unidade de driver a laser (LDU).
NOTA: O PLD fornece pulsos ~ 136-ns a um comprimento de onda de ~ 803 nm, com uma energia de pulso máxima de ~ 1,42 mJ e uma taxa de repetição de até 7 kHz. A unidade de condução a laser (LDU) inclui: um controlador de temperatura, uma fonte de alimentação variável, uma fonte de alimentação (12 V) e um gerador de função; Veja a Tabela de Materiais. A fonte de alimentação variável é usada para controlar a potência do laser e o gerador de função é usado para alterar a taxa de repetição do PLD. - Ligue o laser PLD. Defina a taxa de repetição PLD para "7.000" HZ usando o gerador de função no LDU. Aumente a energia de pulso para 1,42 mJ ajustando a tensão da fonte de alimentação variável para "3.1" V.
- Monte o difusor óptico (OD) na frente da janela de saída PLD para tornar o feixe de saída homogêneo, como mostrado na Figura 1a .
NOTA: Use um difusor com um grão fino ( ou seja, um polimento de 1.500 grãos). - Monte o UST focado no suporte do UST, de modo que ele enfrente o centro da área de digitalização, como mostrado na Figura 1a .
NOTA: A freqüência central do UST é 2,25 MHz e a distância focal é de 1,9 pol. - Coloque o detector de ultra-som dentro do tanque de acrílico, como mostrado na Figura 1a . Encha o tanque com água de modo que o UST esteja totalmente imerso.
NOTA: Um meio de água é usado para acoplar o sinal fotoacústico do cérebro (amostra) ao UST. Um tanque de água acrílica (WT, veja a Tabela de Materiais) foi personalizado- projetado para imagens de animais pequenos. O esquema do desenho do tanque de água é mostrado na Figura 1b . - Verifique o sinal de PA da amostra usando uma unidade de pulsador / receptor (PRU, veja a Tabela de Materiais ).
NOTA: esses sinais foram digitalizados por um cartão DAQ de 12 bits (veja a Tabela de Materiais ) a uma taxa de amostragem de 100 MS / s e foram salvos em um computador.
2. Preparação de animais para imagens de cérebro de ratos
NOTA: O sistema PLD-PAT descrito acima foi demonstrado para imaginar cérebros de pequenos animais. Para estas experiências, foram utilizadas ratos fêmeas saudáveis (ver Tabela de Materiais ).
- Anestesiar o animal por injeção intraperitoneal de um coquetel de 2 mL de cetamina, 1 mL de xilazina e 1 mL de solução salina (dose de 0,2 mL / 100 g).
- Remova a pele no couro cabeludo do animal usando uma cortadora de cabelo. Aplique suavemente o creme de depilação ao raspadoÁrea para maior depleção do pêlo.
- Retire o creme aplicado após 4-5 min usando um cotonete de algodão.
- Aplique pomada de lágrima artificial aos olhos do animal para evitar a secura devido à anestesia e à iluminação a laser.
- Monte o suporte para animais feito sob medida (veja a Tabela de Materiais ) equipado com uma máscara de respiração (veja a Tabela de Materiais ) em um laboratório.
- Coloque o animal em posição inclinada no suporte. Fixe-o ao suporte usando fita cirúrgica para evitar o movimento do animal durante a imagem.
- Certifique-se de que a máscara de respiração cobre o nariz e a boca do rato para administrar anestesia inalada.
3. In Vivo Rat Brain Imaging
- Conecte a máscara de respiração à máquina de anestesia. Ligue a máquina de anestesia e ajuste-a para fornecer 1,0 L / min de oxigênio com 0,75% de isoflurano.
- Aperte o oxímetro de pulsoS tail para monitorar a condição fisiológica do animal.
- Aplique uma camada de gel ultra-som incolor ao couro cabeludo do rato. Ajuste a posição lab-jack no centro do scanner. A máscara de respiração é personalizada para se adequar à janela de imagem. 10% do cone do nariz comercialmente disponível é cortado e conectado a um pedaço de luva.
- Ajuste a altura do lab-jack manualmente para que o plano de imagem esteja no foco da UST.
- Defina os parâmetros no software de aquisição de dados (consulte a Tabela de Materiais) conforme necessário. Execute o programa de software de aquisição de dados para iniciar a aquisição ( ou seja, imagens).
NOTA: O programa é usado para girar o UST e coletar os sinais de A-line PA. As linhas A coletadas serão salvas no computador. - Observe o animal durante todo o período de imagem e proceda à reconstrução do PAT após a conclusão da imagem.
- Após a conclusão da aquisição de dados,Reconstruir a imagem do cérebro transversal das linhas A usando o programa de software de reconstrução.
- Desligue o sistema de anestesia, remova o animal do palco, entregue-o à sua gaiola e monitore-o até recuperar a consciência.
NOTA: Por exemplo, se o UST for girado por 5 s, o PLD entrega 35.000 (= 5 x 7.000) pulsos e a UST coleta 35.000 linhas A. As 35.000 linhas A são reduzidas para 500 por média de mais de 70 sinais (após a média de linhas A = 35,000 / 70 = 500). A Figura 1c ilustra a iluminação dos pulsos de laser e da coleção de linhas A. Um programa de reconstrução baseado em algoritmo de retroprojeção de atraso e soma deve ser usado.
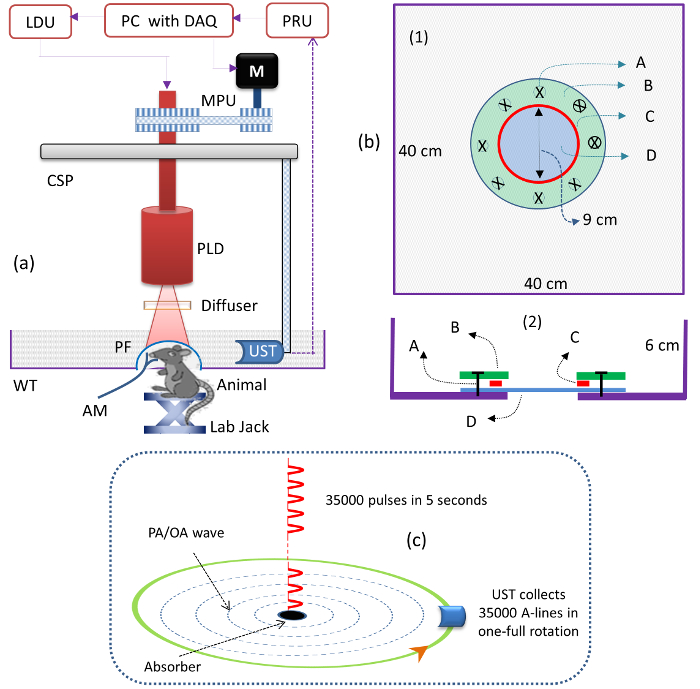
Figura 1: Esquemas do sistema PLD-PAT. (A) Esquema do PLD-PAT. PLD: diodo laser pulsado, CSP: circuPlaca de varredura, AM: máquina de anestesia, M: motor, MPU: unidade de polia do motor, LDU: unidade de driver a laser, PRU: unidade de pulsador / receptor, UST: transdutor de ultra-som, WT: tanque de água, PF: filme de polímero e DAQ: Cartão de aquisição de dados. ( B ) Esquema do tanque de água, vista superior (1) e vista em corte transversal (2) para imagens cerebrais de animais pequenos in vivo . A: métrico Parafuso, B: placa anular acrílica, C: anel "O" de silicone, D: tampa de polietileno transparente de 100 μm de espessura. O tanque tinha um orifício de 9 cm de diâmetro na parte inferior e foi selado com uma membrana de polietileno 100 μm de espessura ultra-sônica e opticamente transparente. ( C ) Esquema da iluminação de pulsos a laser das linhas PLD e A, coleta em um tempo de varredura contínua de 5 s. Clique aqui para ver uma versão maior desta figura.
Resultados
Os resultados de imagens cerebrais in vivo que demonstram as capacidades do sistema PLD-PAT descrito são exibidos nesta seção. Para demonstrar as capacidades de imagem de alta velocidade do sistema PLD-PAT, realizou-se a imagem cerebral in vivo de dois ratos saudáveis diferentes. A Figura 2 mostra as imagens cerebrais de um rato fêmea (93 g) a várias velocidades de varredura. As figuras 2a e b mostr...
Discussão
Este trabalho apresenta um protocolo para realização de imagens cerebrais in vivo em ratos usando um sistema PLD-PAT. O protocolo inclui uma descrição detalhada do sistema de imagem e seu alinhamento, bem como uma ilustração da imagem cerebral em ratos. Os sistemas de PAT baseados em OPO existentes são caros e volumosos e podem fornecer uma imagem transversal em 5-10 min. O sistema PLD-PAT é compacto, portátil e de baixo custo e pode fornecer imagens de boa qualidade em 3 s. O desempenho do sistema foi...
Divulgações
Os autores não têm interesses financeiros relevantes no manuscrito e nenhum outro potencial conflito de interesse para divulgar.
Agradecimentos
A pesquisa é apoiada pelo subsídio de Nível 2 financiado pelo Ministério da Educação em Cingapura (ARC2 / 15: M4020238) e pelo Conselho Nacional de Pesquisa Médica do Ministério da Saúde de Singapura (NMRC / OFIRG / 0005/2016: M4062012). Os autores agradecem ao Sr. Chow Wai Hoong Bobby pela ajuda da maquina.
Materiais
| Name | Company | Catalog Number | Comments |
| Pulsed laser diode | Quantel, France | QD-Q1910-SA-TEC | It is the excitation laser source with specifications 803 nm, 1.4mJ per pulse, 136 ns pulse, 7kHz maximum, dimentions : 11.0 x 6.0 x 3.6 cm, weight: ~150 gm |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718-01P, Gearbox: DPL64/1, I = 10 for NEMA 23; power supply PW100-48 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasonic pulser/receiver | Olympus | 5072PR | To receive, filter and ampligy the PA signal from UST. Its bandwidth is 35MHz, and gain is ±59 dB. |
| Ultrasound Transducer | Olympus | V306-SU-NK-CF1.9IN/Q4200069 | Ultrasonic sensors used for photoacoustic detection. Central freqency 2.25 MHz, 0.5 in, Cylindrical focus 1.9 inch |
| PCIe DAQ (Data acquisition) Card | GaGe | CSE4227/ A6000610/B0E00610 | 12 bit, 100 Ms/s, 2 channels, 1 Gs on board memory, PCIe x16 interface |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g |
| Acrylic water tank | NTU workshop | Custom-made | It contains the water that acts as an acoustic coupling medium between brain and detector |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of Alluminum |
| Anesthetic Machine | medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Pulse Oxymeter portable | Medtronic | PM10N with veterinary sensor | Monitors the pulse oxymetry of the animal |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Data acqusison software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 | LabVIEW based program was developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2012b | Matlab code for reconstruction of PA images was developed in our lab |
| Temperature controller | LaridTech, MO,USA | MTTC1410 | It will constantly control temperature of the PLD |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Variable power supply | BASETech | BT-153 | To change the laser output power |
| Funtion generator | Funktionsgenerator | FG250D | To change the repetetion rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose. | |
| Animal holder | NTU workshop | Custom-made | Used for holding the animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Pentobarbital sodium | Valabarb | Used for euthanizing the animal after the expeirment. | |
| Optical diffuser | Thorlabs | DG10-1500 | Used to to make the laser beam homogeneous |
Referências
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. J Biomed Opt. 22 (4), 041006 (2017).
- Strohm, E. M., Moore, M. J., Kolios, M. C. Single Cell Photoacoustic Microscopy: A Review. IEEE Sel Top Quantum Electron. 22 (3), 6801215 (2016).
- Valluru, K. S., Willmann, J. K. Clinical photoacoustic imaging of cancer. Ultrasonography. 35 (4), 267 (2016).
- Zhou, Y., Yao, J., Wang, L. V. Tutorial on photoacoustic tomography. J Biomed Opt. 21 (6), 061007 (2016).
- Yao, J., Wang, L. V. Photoacoustic Brain Imaging: from Microscopic to Macroscopic Scales. Neurophotonics. 1 (1), 011003 (2014).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. J Biomed Opt. 21 (8), 086011 (2016).
- Strohm, E. M., Moore, M. J., Kolios, M. C. High resolution ultrasound and photoacoustic imaging of single cells. Photoacoustics. 4 (1), 36-42 (2016).
- Upputuri, P. K., Wen, Z. -. B., Wu, Z., Pramanik, M. Super-resolution photoacoustic microscopy using photonic nanojets: a simulation study. J Biomed Opt. 19 (11), 116003 (2014).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Upputuri, P. K., Wu, Z., Gong, L., Ong, C. K., Wang, H. Super-resolution coherent anti-Stokes Raman scattering microscopy with photonic nanojets. Opt Express. 22 (11), 12890-12899 (2014).
- Raghunathan, R., Singh, M., Dickinson, M. E., Larin, K. V. Optical coherence tomography for embryonic imaging: a review. J Biomed Opt. 21 (5), 050902 (2016).
- Burton, N. C., et al. Multispectral opto-acoustic tomography (MSOT) of the brain and glioblastoma characterization. Neuroimage. 65 (2), 522-528 (2013).
- Su, R., Ermilov, S. A., Liopo, A. V., Oraevsky, A. A. Three-dimensional optoacoustic imaging as a new noninvasive technique to study long-term biodistribution of optical contrast agents in small animal models. J Biomed Opt. 17 (10), 101506 (2012).
- Hu, S., Maslov, K., Wang, L. V. In vivo functional chronic imaging of a small animal model using optical-resolution photoacoustic microscopy. Med Phys. 36 (6), 2320-2323 (2009).
- Zhang, E. Z., Laufer, J., Pedley, R. B., Beard, P. 3D photoacoustic imaging system for in vivo studies of small animal models. Proc SPIE. 6856, 68560 (2008).
- Deng, Z., Li, W., Li, C. Slip-ring-based multi-transducer photoacoustic tomography system. Opt Lett. 41 (12), 2859-2862 (2016).
- Tang, J., Coleman, J. E., Dai, X., Jiang, H. Wearable 3-D Photoacoustic Tomography for Functional Brain Imaging in Behaving Rats. Sci Rep. 6, 25470 (2016).
- Pramanik, M., et al. In vivo carbon nanotube-enhanced non-invasive photoacoustic mapping of the sentinel lymph node. Phys Med Biol. 54 (11), 3291-3301 (2009).
- Yao, J., Xia, J., Wang, L. V. Multiscale Functional and Molecular Photoacoustic Tomography. Ultrason Imaging. 38 (1), 44-62 (2016).
- Huang, S., Upputuri, P. K., Liu, H., Pramanik, M., Wang, M. A dual-functional benzobisthiadiazole derivative as an effective theranostic agent for near-infrared photoacoustic imaging and photothermal therapy. J Mat Chem B. 4 (9), 1696-1703 (2016).
- Olefir, I., Mercep, E., Burton, N. C., Ovsepian, S. V., Ntziachristos, V. Hybrid multispectral optoacoustic and ultrasound tomography for morphological and physiological brain imaging. J Biomed Opt. 21 (8), 086005 (2016).
- Hu, S., Maslov, K., Tsytsarev, V., Wang, L. V. Functional transcranial brain imaging by optical-resolution photoacoustic microscopy. J Biomed Opt. 14 (4), 040503 (2009).
- Yao, J. J., et al. Noninvasive photoacoustic computed tomography of mouse brain metabolism in vivo. Neuroimage. 64 (1), 257-266 (2013).
- Hu, S., Wang, L. V. Neurovascular photoacoustic tomography. Front Neuroenergetics. 2, 10 (2010).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Yang, X., et al. Photoacoustic tomography of small animal brain with a curved array transducer. J Biomed Opt. 14 (5), 054007 (2009).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomed Opt Express. 7 (2), 312-323 (2016).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Opt Lett. 31 (23), 3462-3464 (2006).
- Kolkman, R. G. M., Steenbergen, W., van Leeuwen, T. G. In vivo photoacoustic imaging of blood vessels with a pulsed laser diode. Lasers Med Sci. 21 (3), 134-139 (2006).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Opt Express. 22 (21), 26365-26374 (2014).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomed Phys Eng Express. 1 (4), 045010-045017 (2015).
- . . American National Standard for Safe Use of Lasers ANSI Z136.1-2000. , (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados