È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un sistema compatto di Tomografia Photoacoustico ad alte prestazioni per
In questo articolo
Riepilogo
È stato dimostrato un sistema compatto di tomografia fotoacoustica (PLD-PAT) basato su diodi laser a pulsazione per immagini ad alta velocità in cervello in vivo in piccoli animali.
Abstract
L' imaging in animale in vivo ha un ruolo importante da svolgere negli studi preclinici. La tomografia fotoacoustica (PAT) è una modalità di imaging ibrida emergente che presenta un grande potenziale sia per applicazioni precliniche che cliniche. I sistemi PAT (OPO-PAT) basati su oscillatori ottici convenzionali sono ingombranti e costosi e non possono fornire immagini ad alta velocità. Recentemente, i diodi pulsati (PLD) sono stati dimostrati con successo come sorgente di eccitazione alternativa per PAT. Il diodo a pulsazione laser PAT (PLD-PAT) è stato dimostrato con successo per l'imaging ad alta velocità su fantasmi fotoacustici e tessuti biologici. Questo lavoro fornisce un protocollo sperimentale visualizzato per l'imaging cerebrale in vivo usando PLD-PAT. Il protocollo comprende la configurazione compatta del sistema PLD-PAT e la sua descrizione, la preparazione degli animali per l'imaging del cervello e una tipica procedura sperimentale per l'imaging cerebrale a sezione trasversale 2D. Il sistema PLD-PAT è compatto e cost-efIn grado di fornire immagini ad alta velocità e di alta qualità. Le immagini del cervello raccolte in vivo a diverse velocità di scansione sono presentate.
Introduzione
La tomografia fotoacustica (PAT) è una modalità di imaging ibrida che ha molte applicazioni in studi clinici e preclinici 1 , 2 , 3 , 4 , 5 . In PAT, gli impulsi laser nanosecondi irradiano il tessuto biologico. L'assorbimento della luce incidente dai cromofori tessuti porta ad un aumento locale della temperatura, che produce quindi onde di pressione emesse sotto forma di onde sonore. Un rilevatore ad ultrasuoni raccoglie i segnali fotoacustici in varie posizioni attorno al campione. I segnali fotoacustici (PA) vengono ricostruiti utilizzando vari algoritmi (come un algoritmo di ritardo e somma) 6 per generare l'immagine fotoacustica.
Questa modalità di imaging ibrida offre immagini ad alta risoluzione, tessuto profondo e elevato contrasto di assorbimento ottico 7 ,Class = "xref"> 8. Recentemente, una profondità di imaging di ~ 12 cm è stata raggiunta nel tessuto del petto di pollo con l'aiuto di una lunghezza d'onda più lunga (~ 1.064 nm) e un agente di contrasto esogeno chiamato fosforoftalocyanina. Questa sensibilità di profondità è molto più alta della sensibilità della profondità di altri metodi ottici, come la microscopia a fluorescenza confocale, la microscopia a fluorescenza a due fotoni, la tomografia a 10 coerenza ottica, 11 ecc. Utilizzando più di una lunghezza d'onda, il PAT può dimostrare cambiamenti strutturali e funzionali negli organi . Per molte malattie umane, i modelli di piccoli animali sono stati ben consolidati 12 , 13 , 14 , 15 . Per l'imaging di piccoli animali sono state dimostrate diverse modalità. Su tutti questi approcci, l'imaging PA ha guadagnato l'attenzione piuttosto rapidamente a causa dei vantaggi di cui sopra. PAPÀT ha mostrato il suo potenziale di imaging dei vasi sanguigni nei tessuti e negli organi ( cioè cuore, polmoni, fegato, occhi, milza, cervello, pelle, midollo spinale, rene, ecc. ) Dei piccoli animali 4 , 16 , 17 , 18 . PAT è una modalità ben consolidata per l'imaging cerebrale di piccoli animali. Le onde PA vengono prodotte a causa dell'assorbimento di luce dai cromofori, quindi la PAT a lunghezza d'onda multipla consente la mappatura della concentrazione totale di emoglobina (HbT) e della saturazione dell'ossigeno (SO 2 ) 19 , 20 , 21 , 22 . L'imaging neurovascolare cerebrale è stato ottenuto con l'aiuto di agenti di contrasto esogeni 12 , 23 , 24 . La modalità PA può contribuire a dare una migliore comprensione della salute del cervelloFornendo informazioni a livello molecolare e genetico.
Per l'imaging di piccole animali, i laser Nd: YAG / OPO sono ampiamente utilizzati come sorgenti di eccitazione PAT. Questi laser erogano ~ 5 ns impulsi a infrarossi vicino ad energia (~ 100 mJ alla finestra di uscita OPO) ad una frequenza di ripetizione ~ 10 Hz. Il sistema PA dotato di tali laser è costoso e ingombrante e consente l'imaging a bassa velocità con trasduttori ad ultrasuoni a singolo elemento (UST) a causa della bassa frequenza di ripetizione della sorgente laser. Un tipico tempo di acquisizione A-line in tali sistemi PA è ~ 5 min per sezione 25 . Un sistema di imaging con un così lungo tempo di misurazione non è l'ideale per l'imaging di piccole animali, perché è difficile controllare i parametri fisiologici per l'imaging a tutto il corpo, l'imaging funzionale risolti in tempo, ecc. Adottando più UST di un singolo elemento, array O un laser ad alta repetizione, è possibile aumentare la velocità di imaging di PAsistemi. Utilizzando solo un UST a un singolo elemento per raccogliere tutti i segnali PA intorno al campione limiterà la velocità di imaging del sistema. Sono stati dimostrati più UST di un singolo elemento disposti in geometria circolare o semicircolare per tecniche di imaging ad alta velocità e altamente sensibili. Gli UST 26 basati sugli array, come gli array array lineari, semicircolari, circolari e volumetrici, sono stati utilizzati con successo per l'imaging in tempo reale 1 . Questi UST basati su matrici aumenteranno la velocità di imaging e riducono la sensibilità di misura, ma sono costosi. Tuttavia, la velocità di imaging dei sistemi PA che utilizzano UST a matrice è ancora limitata dalla velocità di ripetizione del laser.
La tecnologia laser a pulsazione avanzata per produrre diodi ad impulsi ad alta reputazione (PLD). 7.000 fotogrammi / s di imaging fotoacustico B-scansione è stata dimostrata con PLD utilizzando una piattaforma clinica a ultrasuoni 27 . Tali PLD possono migliorare la velocità di imaging di thE PAT, anche con la geometria di scansione circolare UST a singolo elemento. Gli UST a singolo elemento sono meno costosi e molto sensibili, a differenza degli UST basati su matrici. Negli ultimi dieci anni, sono stati riportati scarsi risultati sull'utilizzo di PLD ad alta ripetizione come fonte di eccitazione per l'imaging PA. È stata dimostrata una PLD vicino a infrarossi a fibra per l'imaging PA di fantasmi 28 . L'imaging in vivo dei vasi sanguigni ad una profondità di 1 mm sotto la pelle umana è stato dimostrato utilizzando PLD a basso consumo energetico 29 . È stato riportato un microscopio fotoacustico a risoluzione ottica (ORPAM) basato su PLD. Utilizzando PLD, è stata dimostrata un'immagine profonda di 1,5 cm ad una velocità di fotogramma di 0,43 Hz. Recentemente, un sistema PLD-PAT è stato riferito che ha fornito immagini in breve come ~ 3 s e ad una ~ 2 cm profondità di imaging nel tessuto biologico 25 , 31 . Questo studio ha dimostrato che un tale sistema a basso costo e compatto può offrire un alto quaAnche a velocità elevate. Il sistema PLD-PAT può essere utilizzato per l'imaging fotoacoustico ad alta velocità (7.000 fps), l'imaging surgelico dei vasi sanguigni, l'imaging delle dita, l'imaging dei tessuti a due centimetri, l'immagine cerebrale a piccole animali, ecc. La lunghezza singola e Impulsi a basso impulso di energia da PLD limitano la sua applicazione a immagini multi-spettrali e profonde. Sono stati condotti esperimenti su piccoli animali che utilizzano lo stesso sistema PLD-PAT usato per applicazioni pre-cliniche. Lo scopo di questo lavoro è quello di fornire la dimostrazione sperimentale visualizzata del sistema PLD-PAT per l'imaging cerebrale a sezione trasversale 2D in animali vivi.
Protocollo
Tutti gli esperimenti su animali sono stati eseguiti secondo le linee guida ei regolamenti approvati dal Comitato istituzionale per la cura e l'uso degli animali della Nanyang Technological University di Singapore (numero di protocollo animale ARF-SBS / NIE-A0263).
1. Descrizione del sistema
- Montare il PLD all'interno dello scanner circolare, come mostrato nella Figura 1a . Collegare il PLD all'unità laser driver (LDU).
NOTA: Il PLD fornisce impulsi ~ 136 ns ad una lunghezza d'onda di ~ 803 nm, con un'energia di impulso massima di ~ 1,42 mJ e una velocità di ripetizione fino a 7 kHz. L'unità di azionamento laser (LDU) comprende: un regolatore di temperatura, un'alimentazione variabile, un alimentatore (12 V) e un generatore di funzioni; Vedere la tabella dei materiali. L'alimentatore variabile viene utilizzato per controllare l'energia laser e il generatore di funzioni viene utilizzato per modificare la frequenza di ripetizione del PLD. - Accendere il laser PLD. Impostare la frequenza di ripetizione PLD su "7.000" HZ utilizzando il generatore di funzioni nella LDU. Aumenta l'energia di impulso a 1,42 mJ impostando la tensione dell'alimentazione variabile a "3.1" V.
- Montare il diffusore ottico (OD) davanti alla finestra di uscita PLD per rendere omogeneo il fascio di uscita, come mostrato nella Figura 1a .
NOTA: Utilizzare un diffusore con una grana fine ( cioè 1.500 polvere di graniglia). - Montare l'UST focalizzato sul supporto UST, in modo tale che si affaccia al centro dell'area di scansione, come mostrato nella Figura 1a .
NOTA: La frequenza centrale dell'UST è di 2,25 MHz e la lunghezza focale è di 1,9 pollici. - Posizionare il rivelatore ad ultrasuoni all'interno del serbatoio acrilico, come mostrato nella Figura 1a . Riempire il serbatoio con acqua in modo che l'UST sia completamente immersa.
NOTA: Un mezzo d'acqua è usato per abbinare il segnale fotoacustico dal cervello (campione) all'UST. Un serbatoio acrilico d'acqua (WT; vedi la tabella dei materiali) è stato personalizzato-designed per l'imaging di piccole animali. Lo schema del disegno del serbatoio dell'acqua è mostrato in figura 1b . - Controllare il segnale PA dal campione usando un impianto pulser / ricevitore (PRU, vedere la tabella dei materiali ).
NOTA: Questi segnali sono stati digitalizzati da una scheda DAQ a 12 bit (vedere la tabella dei materiali ) ad una velocità di campionamento di 100 MS / s e sono stati salvati in un computer.
2. Preparazione degli animali per la formazione del cervello del cervello
NOTA: Il sistema PLD-PAT sopra descritto è stato dimostrato per l'imaging di cervelli animali piccoli. Per questi esperimenti sono stati utilizzati ratti femmine sani (vedi tabella dei materiali ).
- Anestetizza l'animale mediante iniezione di un cocktail di 2 ml di ketamina, 1 ml di xilazina e 1 ml di soluzione salina (dosaggio di 0,2 ml / 100 g).
- Rimuovere la pelliccia sul cuoio capelluto dell'animale usando un tagliatore di capelli. Applicare delicatamente la crema di rimozione dei capelli alla rasataZona per ulteriore esaurimento della pelliccia.
- Rimuovere la crema applicata dopo 4-5 minuti utilizzando un tampone di cotone.
- Applicare unguento artificiale di lacrima agli occhi dell'animale per evitare la secchezza dovuta all'anestesia e all'illuminazione laser.
- Montare il supporto animale su misura (vedi tabella dei materiali ) dotato di una maschera di respirazione (vedere la tabella dei materiali ) su una presa di laboratorio.
- Posizionare l'animale in posizione predisposta sul supporto. Fissarlo al supporto usando un nastro chirurgico per evitare il movimento dell'animale durante l'imaging.
- Assicurarsi che la maschera respiratoria copre il naso e la bocca del ratto per fornire l'anestetico inalato.
3. In Vivo Rat Brain Imaging
- Collegare la maschera di respirazione alla macchina di anestesia. Accendere la macchina anestesia e impostarla per fornire 1,0 L / min di ossigeno con 0,75% isoflurano.
- Bloccare l'ossimetro ad impulsi ad essoPer controllare la condizione fisiologica dell'animale.
- Applicare uno strato di gel ecografico incolore al cuoio capelluto del ratto. Regolare la posizione del jack del laboratorio al centro dello scanner. La maschera di respirazione è personalizzata in base alla finestra di imaging. Il 10% del cono a cono commercialmente disponibile viene tagliato poi collegato ad un pezzo di guanto.
- Regolare manualmente l'altezza del jack di laboratorio in modo che il piano di imaging sia al centro dell'UST.
- Impostare i parametri nel software di acquisizione dati (vedere la tabella dei materiali) come richiesto. Esegui il programma software di acquisizione dati per avviare l'acquisizione ( ossia, l' imaging).
NOTA: il programma viene utilizzato per ruotare l'UST e raccogliere segnali A-line PA. Le linee A raccolte verranno salvate sul computer. - Osservare l'animale durante l'intero periodo di imaging e procedere alla ricostruzione PAT dopo che l'imaging è completo.
- Dopo l'acquisizione dei dati è finita,Ricostruire l'immagine del cervello trasversale dalle linee A utilizzando il programma software di ricostruzione.
- Spegnere il sistema di anestesia, rimuovere l'animale dal palco, riportarlo nella sua gabbia e controllarlo fino a quando non ricupera la coscienza.
NOTA: Ad esempio, se l'UST è ruotato per 5 s, il PLD fornisce 35.000 (= 5 x 7.000) impulsi e l'UST raccoglie 35.000 linee A. Le 35.000 linee A vengono ridotte a 500 con una media di oltre 70 segnali (dopo aver effettuato la mediazione di linee A = 35.000 / 70 = 500). La figura 1c illustra l'illuminazione degli impulsi laser e della collezione A-line. Dovrebbe essere utilizzato un programma di ricostruzione basato sull'algoritmo di proiezione di ritardo e somma.
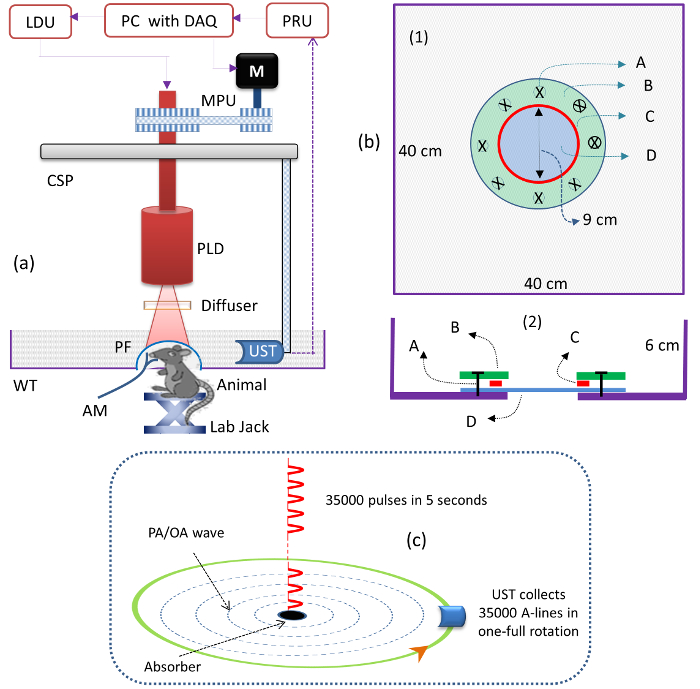
Figura 1: Schemi del sistema PLD-PAT. (A) Schema del PLD-PAT. PLD: diodo pulsato-laser, CSP: circuitoUnità di pulser / ricevitore, UST: trasduttore ad ultrasuoni, WT: serbatoio d'acqua, PF: film polimerici e DAQ: unità di controllo laser, AM: anestesia, M: motore, MPU: Scheda di acquisizione dati. ( B ) Schema del serbatoio dell'acqua, vista dall'alto (1) e vista in sezione trasversale (2) per l'imaging cerebrale in animale in vivo . A: metrico Vite, B: piastra anulare acrilica, C: anello "O" in silicone, D: copertura in polietilene trasparente di 100 μm. Il serbatoio aveva un foro di diametro di 9 cm al suo fondo ed è stato sigillato con una membrana in polietilene ad ultrasuoni e otticamente trasparente di 100 μm. ( C ) Schema dell'illuminazione degli impulsi laser dalle linee PLD e A, raccolta in un tempo di scansione continuo di 5 s. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
I risultati in vivo di immagini cerebrali che dimostrano le capacità del sistema PLD-PAT descritto sono mostrate in questa sezione. Per dimostrare le capacità di imaging ad alta velocità del sistema PLD-PAT, è stata eseguita l'imaging cerebrale in vivo di due diversi ratti sani. La Figura 2 mostra le immagini del cervello di un ratto femminile (93 g) a diverse velocità di scansione. Figura 2a e b mostr...
Discussione
Questo lavoro presenta un protocollo per eseguire un'immagine cerebrale in vivo su ratti utilizzando un sistema PLD-PAT. Il protocollo include una descrizione dettagliata del sistema di imaging e del suo allineamento, nonché un'illustrazione dell'immagine cerebrale sui ratti. I sistemi PAT esistenti basati su OPO sono costosi e ingombranti e possono fornire un'immagine trasversale in 5-10 min. Il sistema PLD-PAT è compatto, portatile e a basso costo e può fornire immagini di buona qualità in...
Divulgazioni
Gli autori non hanno alcun interesse finanziario rilevante nel manoscritto e nessun altro potenziale conflitto di interessi da divulgare.
Riconoscimenti
La ricerca è sostenuta dalla borsa di Tier 2 finanziata dal Ministero dell'Istruzione di Singapore (ARC2 / 15: M4020238) e dal Consiglio Nazionale di Ricerca Medica del Ministero della Salute di Singapore (NMRC / OFIRG / 0005/2016: M4062012). Gli autori vorrebbero ringraziare il signor Chow Wai Hoong Bobby per l'aiuto della macchina.
Materiali
| Name | Company | Catalog Number | Comments |
| Pulsed laser diode | Quantel, France | QD-Q1910-SA-TEC | It is the excitation laser source with specifications 803 nm, 1.4mJ per pulse, 136 ns pulse, 7kHz maximum, dimentions : 11.0 x 6.0 x 3.6 cm, weight: ~150 gm |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718-01P, Gearbox: DPL64/1, I = 10 for NEMA 23; power supply PW100-48 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasonic pulser/receiver | Olympus | 5072PR | To receive, filter and ampligy the PA signal from UST. Its bandwidth is 35MHz, and gain is ±59 dB. |
| Ultrasound Transducer | Olympus | V306-SU-NK-CF1.9IN/Q4200069 | Ultrasonic sensors used for photoacoustic detection. Central freqency 2.25 MHz, 0.5 in, Cylindrical focus 1.9 inch |
| PCIe DAQ (Data acquisition) Card | GaGe | CSE4227/ A6000610/B0E00610 | 12 bit, 100 Ms/s, 2 channels, 1 Gs on board memory, PCIe x16 interface |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g |
| Acrylic water tank | NTU workshop | Custom-made | It contains the water that acts as an acoustic coupling medium between brain and detector |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of Alluminum |
| Anesthetic Machine | medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Pulse Oxymeter portable | Medtronic | PM10N with veterinary sensor | Monitors the pulse oxymetry of the animal |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Data acqusison software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 | LabVIEW based program was developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2012b | Matlab code for reconstruction of PA images was developed in our lab |
| Temperature controller | LaridTech, MO,USA | MTTC1410 | It will constantly control temperature of the PLD |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Variable power supply | BASETech | BT-153 | To change the laser output power |
| Funtion generator | Funktionsgenerator | FG250D | To change the repetetion rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose. | |
| Animal holder | NTU workshop | Custom-made | Used for holding the animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Pentobarbital sodium | Valabarb | Used for euthanizing the animal after the expeirment. | |
| Optical diffuser | Thorlabs | DG10-1500 | Used to to make the laser beam homogeneous |
Riferimenti
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. J Biomed Opt. 22 (4), 041006 (2017).
- Strohm, E. M., Moore, M. J., Kolios, M. C. Single Cell Photoacoustic Microscopy: A Review. IEEE Sel Top Quantum Electron. 22 (3), 6801215 (2016).
- Valluru, K. S., Willmann, J. K. Clinical photoacoustic imaging of cancer. Ultrasonography. 35 (4), 267 (2016).
- Zhou, Y., Yao, J., Wang, L. V. Tutorial on photoacoustic tomography. J Biomed Opt. 21 (6), 061007 (2016).
- Yao, J., Wang, L. V. Photoacoustic Brain Imaging: from Microscopic to Macroscopic Scales. Neurophotonics. 1 (1), 011003 (2014).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. J Biomed Opt. 21 (8), 086011 (2016).
- Strohm, E. M., Moore, M. J., Kolios, M. C. High resolution ultrasound and photoacoustic imaging of single cells. Photoacoustics. 4 (1), 36-42 (2016).
- Upputuri, P. K., Wen, Z. -. B., Wu, Z., Pramanik, M. Super-resolution photoacoustic microscopy using photonic nanojets: a simulation study. J Biomed Opt. 19 (11), 116003 (2014).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Upputuri, P. K., Wu, Z., Gong, L., Ong, C. K., Wang, H. Super-resolution coherent anti-Stokes Raman scattering microscopy with photonic nanojets. Opt Express. 22 (11), 12890-12899 (2014).
- Raghunathan, R., Singh, M., Dickinson, M. E., Larin, K. V. Optical coherence tomography for embryonic imaging: a review. J Biomed Opt. 21 (5), 050902 (2016).
- Burton, N. C., et al. Multispectral opto-acoustic tomography (MSOT) of the brain and glioblastoma characterization. Neuroimage. 65 (2), 522-528 (2013).
- Su, R., Ermilov, S. A., Liopo, A. V., Oraevsky, A. A. Three-dimensional optoacoustic imaging as a new noninvasive technique to study long-term biodistribution of optical contrast agents in small animal models. J Biomed Opt. 17 (10), 101506 (2012).
- Hu, S., Maslov, K., Wang, L. V. In vivo functional chronic imaging of a small animal model using optical-resolution photoacoustic microscopy. Med Phys. 36 (6), 2320-2323 (2009).
- Zhang, E. Z., Laufer, J., Pedley, R. B., Beard, P. 3D photoacoustic imaging system for in vivo studies of small animal models. Proc SPIE. 6856, 68560 (2008).
- Deng, Z., Li, W., Li, C. Slip-ring-based multi-transducer photoacoustic tomography system. Opt Lett. 41 (12), 2859-2862 (2016).
- Tang, J., Coleman, J. E., Dai, X., Jiang, H. Wearable 3-D Photoacoustic Tomography for Functional Brain Imaging in Behaving Rats. Sci Rep. 6, 25470 (2016).
- Pramanik, M., et al. In vivo carbon nanotube-enhanced non-invasive photoacoustic mapping of the sentinel lymph node. Phys Med Biol. 54 (11), 3291-3301 (2009).
- Yao, J., Xia, J., Wang, L. V. Multiscale Functional and Molecular Photoacoustic Tomography. Ultrason Imaging. 38 (1), 44-62 (2016).
- Huang, S., Upputuri, P. K., Liu, H., Pramanik, M., Wang, M. A dual-functional benzobisthiadiazole derivative as an effective theranostic agent for near-infrared photoacoustic imaging and photothermal therapy. J Mat Chem B. 4 (9), 1696-1703 (2016).
- Olefir, I., Mercep, E., Burton, N. C., Ovsepian, S. V., Ntziachristos, V. Hybrid multispectral optoacoustic and ultrasound tomography for morphological and physiological brain imaging. J Biomed Opt. 21 (8), 086005 (2016).
- Hu, S., Maslov, K., Tsytsarev, V., Wang, L. V. Functional transcranial brain imaging by optical-resolution photoacoustic microscopy. J Biomed Opt. 14 (4), 040503 (2009).
- Yao, J. J., et al. Noninvasive photoacoustic computed tomography of mouse brain metabolism in vivo. Neuroimage. 64 (1), 257-266 (2013).
- Hu, S., Wang, L. V. Neurovascular photoacoustic tomography. Front Neuroenergetics. 2, 10 (2010).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Yang, X., et al. Photoacoustic tomography of small animal brain with a curved array transducer. J Biomed Opt. 14 (5), 054007 (2009).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomed Opt Express. 7 (2), 312-323 (2016).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Opt Lett. 31 (23), 3462-3464 (2006).
- Kolkman, R. G. M., Steenbergen, W., van Leeuwen, T. G. In vivo photoacoustic imaging of blood vessels with a pulsed laser diode. Lasers Med Sci. 21 (3), 134-139 (2006).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Opt Express. 22 (21), 26365-26374 (2014).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomed Phys Eng Express. 1 (4), 045010-045017 (2015).
- . . American National Standard for Safe Use of Lasers ANSI Z136.1-2000. , (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon