Method Article
Postnatal (P1−3) Fare Nörojenik Nişlerden Nörosferlerin İzolasyon ve Genişlemesi
Bu Makalede
Özet
Bu makalede, ayrıntılı olarak, postnatal fare nöral kök hücrelerinden nörosfer kültürlerin üretimi için bir protokol ana fare nörojenik nişler türetilmiştir açıklar. Nörosferler öncühücre sayılarının tahmin ine izin beyin dokusundan nöral kök hücreleri tanımlamak için kullanılır. Ayrıca, bu 3D yapılar farklıkoşullarda kaplanmış olabilir, nöronlar neden, oligodendrositler ve astrositler, hücre kaderini çalışma sağlayan.
Özet
Nörosfer tsay nöral kök / progenitor hücrelerinin doğal özelliklerini incelemek için son derece yararlı bir in vitro tekniktir (NSPCs) çoğalma dahil, kendini yenileme ve multipotency. Postnatal ve yetişkin beyinde, NSPC'ler başlıca iki nörojenik nişlerde bulunur: lateral ventrikülleri ve hipokampal dentat girusunun subgranular zonu (DG) subventriküler zon (SVZ). Nörojenik nişlerin postnatal beyinden izolasyonu, kültürde daha yüksek verim avantajı ile daha yüksek miktarda NSPC elde edilmesine olanak sağlar. Her nörosfer içindeki hücreler arasındaki yakın temas nörojenik nişler benzer bir mikroortam oluşturur. Burada, 1−3 günlük (P1−3) farelerden SVZ ve DG kaynaklı nörosfer kültürlerinin nasıl üretilmeye ve nörosfer genişlemesi için nasıl geçiş yapılacağını ayrıntılı olarak anlatıyoruz. Nörosfer tetki, hızlı bir NSPC klonu üretimine (6−12 gün) izin verdiği nden ve hayvan kullanımının önemli ölçüde azalmasına katkıda bulunmasından bu yana avantajlı bir yaklaşımdır. Farklılaştırıcı koşullarda nörosferleri kaplamak, NSPC'lerden oluşan bir hücre pseudomonolayer ve farklı nöral soyların farklılaştırılmış hücreleri elde edebilirsiniz (nöronlar, astrositler ve oligodendrositler) NSPC proliferasyonu, farklılaşma, hücre sağkalım ve neuritogenez üzerinde içsel veya dışsal faktörlerin eylemlerinin incelenmesine olanak sağlar.
Giriş
Nörosfer tsay (NSA) ilk olarak 1992yılında1,2 ve hala nöral kök hücre (NSC) araştırma benzersiz ve güçlü bir araç kalır tanımlanmıştır. NSC'lerin ana nörojenik bölgelerden izole edilmesi zorlu sorunlara sahiptir, çünkü fizyolojik koşullarda bu hücreleri koruma gereksinimleri tam olarak anlaşılamamıştır. NSA'de hücreler, epidermal büyüme faktörü (EGF) ve temel fibroblast büyüme faktörü (bFGF)1,2,3gibi büyüme faktörlerinin varlığı ile kimyasal olarak tanımlanmış serumsuz bir ortamda kültürlenir. Nöral öncül hücreler (kök ve atalar) bu hücreler EGF ve FGF duyarlı aktif çoğalma dönemine girerken diğer hücreler, yani farklılaştırılmış hücreler, ölmek4çünkü bu mitojenler kullanılarak seçilir . Nöral öncül hücreler nörosferler olarak büyür, daha sonra daha fazla bu hücrelerin havuzu genişletmek için geçit edilebilir5. Daha da önemlisi, bu nöral kök progenitor hücreleri (NSPcCs) onlar merkezi sinir sisteminin üç ana hücre tipleri (CNS) içine ayırt edebiliyoruz multipotent olduğundan: nöronlar, oligodendrocytes ve astrositler5.
NSA, NSC proliferasyonu ve kendini yenileme, nöronal ve glial diferansiyasyon gibi çeşitli süreçleri hem fizyolojik hem de hastalık bağlamında incelemek için kullanılabilecek farklılaşmamış CNS öncüllerinin yenilenebilir bir kaynağını sağlar. Ayrıca, in vitro çalışmalar geliştirme sırasında nöral öncüllerde mevcut içsel özelliklerin derecesini değerlendirmek için kullanılabilir, hem de hücrelerin tam potansiyelini incelemek için, normal çevre ile ilişkili ekstrensek ipuçları kaldırarak6. Nörosfer modeli serum yoksun bir ortamda hücreleri koruyarak beri putatif düzenleyicileri değerlendirmek için değerlidir, çevresel ipuçları sadece çevreleyen hücreler tarafından sağlanır6. Ayrıca, NSA, NSPCs kolayca kültür genişletilir, alan başına hücrelerin yoğunluğu yüksek ve nörosferlerin heterojen bileşimi in vivo nişler bazı benzerlik vardır6. Bu köklü avantajlar, bu metodolojinin birçok araştırmacı tarafından yaygın olarak kullanılmasının nedenidir.
Aşağıdaki protokol, postnatal NSPC popülasyonunun iki ana nörojenik bölgeden, subventriküler zonun (SVZ) ve hipokampal dentat girustan (DG) izolasyonundan, bu hücrelerin nörosfer olarak genişlemesine ve nöronlar, astrositler ve oligodendrositlere ayrıştırılmasına kadar tüm süreçleri ayrıntılı olarak açıklamaktadır. Son olarak, farklı tahliller de SVZ köklük ve multipotency özellikleri erişmek için açıklanmıştır- ve DG türetilmiş NSPCs.
Protokol
Tüm deneyler, bilimsel amaçlarla kullanılan hayvanların korunması için Avrupa Topluluğu (86/609/EEC; 2010/63/EU; 2012/707/EU) ve Portekizce (DL 113/2013) mevzuatına uygun olarak gerçekleştirilmiştir. Protokol "iMM kurumsal Hayvan Refahı Kurumu - ORBEA-iMM ve Ulusal yetkili otorite - DGAV (Direcção Geral de Alimentação e Veterinária) tarafından onaylandı."
1. Kültür ortamının temel kurulumu ve hazırlanması
- Diseksiyon gününde, Dulbecco'nun modifiye kartal ortamı [(DMEM)/L-glutaminli F12](Malzeme Tablosu)ile 100 U/mL penisilin ve 100 μg/mL streptomisin (kalem/strep), %1 B27'den oluşan serumsuz ortama (SFM) karşılık gelen uygun miktarda büyüme ortamı nı hazırlayın, ayrıca 10 ng/mL EGF ve 5 ng/mL bFGF ile. Bir su banyosunda kültür ortamını 37 °C'ye ısıtın.
NOT: Büyüme ortamının hacmi yavru sayısına bağlıdır, çünkü 5 yavru ~100 mL (SVZ için 50 mL ve DG için 50 mL); ancak, hücre sayısını (adım 5.1) sayıldıktan sonra tam hacmin ayarlanması gerekir. - SVZ ve DG mikrodiseksiyoniçin, kalsiyum ve magnezyumsuz Hanks'in dengeli tuzlu solüsyonu (HBSS) diseksiyon ortamını 100 U/mL kalem/strep ile destekleyin.
NOT: 50−100 mL diseksiyon ortamı hazırlayın. - Bir diseksiyon mikroskobu ayarlayın ve beyin kaldırmak için gerekli araçları hazırlamak (makas ve küçük spatula) ve SVZ ve DG mikrodiskes (Dumont küçük makas, #7 forseps, #5 forseps, #5S forseps) için% 70 etanol ıslatma tarafından.
2. Postnatal (P1−3) fare beyinlerinin ve SVZ/DG mikrodiskeslerinin hasat
- 60 mm Petri tabakları (büyüme alanı 21 cm2)kalem/strep ve 2 numune tüpü (biri SVZ ve diğeri DG için) ve her biri 500 μL'lık ilave HBSS ile desteklenmiş HBSS ile hazırlayın.
- Kurumsal Hayvan Bakım tesisi/yönergeleri tarafından onaylanan protokole göre fare yavrularına (P1−3) ötenazi yapmak. Beyin sapının tabanında keskin makas ile tek bir kesi ile decapitation gerçekleştirin.
- Başın tabanında vücudun ventral kısmını tutarak ve küçük sivri makas kullanarak, başın tüm uzunluğu boyunca deride bir orta hat kesi yapmak, böylece kafatası yüzeyini ortaya.
- Kafatasının tabanında uzunlamasına bir kesi yapın ve beyin yapılarına zarar vermemek için mümkün olduğunca sığ bir açıile küçük makas kullanarak sagittal sütür boyunca kesmeye devam edin.
- Kavisli forceps kullanarak yanlara kafatası soyma ve beyin ortaya çıkarmak.
DİkKAT: Beyne dokunmadan önce diseksiyon aletlerinin etanolsüz olduğundan emin olun. - Küçük bir spatula kullanarak kafatasından beyin izole, beynin tabanına bağlı kranial sinirler ve kan damarları kesmek için beynin tabanının altında kayarak, ve soğuk takviyeLI HBSS çözüm içeren bir Petri kabına beyin transferi.
- Düşük büyütme bir diseksiyon mikroskobu altında beyin içeren Petri çanak yerleştirin ve sırt yüzeyinde beyin konumlandırmak.
- Ince forceps kullanarak, beyincik tarafından pozisyonda beyin tutarken, beynin ventral tarafında menenjler ve koku ampuller kaldırın. Ventral yönü üzerine beyin döndürün ve menenjler geri kalanı soyma.
NOT: Dorsal menenjlerin çıkarılması doğru beyin dilimleme sağlamak için çok önemli bir adımdır. - Forceps kullanarak bir kesim yapma beyincik atın. Bir doku helikopteri(Malzeme Tablosu)üzerine 11 μm gözenek boyutunda bir filtre kağıdı yerleştirin ve kavisli sivri forceps kullanarak filtre kağıdı üzerine beyin ayarlayın. 450 μm koronal kesitler içine beyin doğrayın ve soğuk takviyeLI HBSS ile dolu yeni bir Petri çanak içine kesitli beyin toplamak için ıslak bir lamina kullanın.
- SVZ'yi incelemek için, koronal dilimleri anterior-posterior bir şekilde ayırmak için, diseksiyon mikroskobu altında lateral ventriküllerle dilimlere ulaşana kadar forseps kullanın.
- Striatal parankim ve korpus callosum hariç ince forseps ile ventriküllerin lateral duvarÇevreleyen doku ince tabaka kesin (SVZ karşılık gelir). Lateral ventrikül lateral köşelerinde forseps ucu yerleştirerek SVZ izole: bir hemen korpus callosum altında ve diğer doku içine hemen lateral ventrikül ventrikül ventral alana bitişik. Sonra, lateral ventrikül çevreleyen doku küçük bir çizgi kesti.
- Daha önce SVZ olarak tanımlanan ek HBSS çözeltisi ile bir örnek tüp içine parçalanmış doku toplamak.
NOT: SVZ'yi hem lateral ventriküllerin hem de hipokampal formasyonun görünmeye başladığı dilimler halinde dışleyin. - Bir ön-posterior moda SVZ mikrodiziseksiyon sonra tüm dilimleri geçmesi ve hipokampal oluşumuulaşmak. Forceps kullanarak DG hala tanınmaz hipokampus ile ilk dilim atın.
- DG kaldırmak için, ilk dilimlerden hipokampus izole. DG'nin etrafındaki sınırları görselleştirmek için mikroskobu yeniden odakla.
- DG ve CA1 bölgesi arasında bir kesik gerçekleştirerek DG kısmını inceleyin ve ardından forseps kullanarak DG ve CA3 bölgesi arasında dikey bir kesim. Fimbria ve herhangi bir komşu doku çıkarın.
NOT: P1−3 hayvanlarda, DG Ammon boynuzneredeyse ayırt edilemez ama küçük bir ipucu görüntüler. - Daha önce DG olarak tanımlanan ek HBSS çözümleri içeren bir örnek tüp içine parçalanmış doku toplamak.
NOT: Hipokampus veya çevresinde genel yaralanma daha zor DG izole yapacaktır. Kullanıcı koronal kesitlerden SVZ ve DG dokusunun izolasyonu aşina olmadığında postnatal fare beyin bir atlas kullanarak esastır.
3. Doku dissociasyonu
- Kendi tüplerinde bulunan SVZ ve DG dokusunu ayırmak için, HBSS'de Tripsin-EDTA'nın %5−10'u kadar son konsantrasyona sahip olmak için tripsin-EDTA %0.05 ekleyin. Doku bir araya gelene kadar 37 °C'de yaklaşık 15 dakika kuluçkaya yatırın.
- Ortamı çıkararak ve 1 mL yeni HBSS takviyesi çözeltisi ekleyerek 4 kez tripsinden dokuyı yıkayın.
- HBSS'yi çıkarın ve 10 ng/mL EGF ve 5 ng/mL bFGF ile takviye edilmiş 1 mL SFM'de sindirilmiş dokuyu yeniden askıya alın. P1000 pipetkullanarak yaklaşık 7−10x'i hafifçe borulandırarak, homojen bir hücre çözeltisi elde edene kadar peleti mekanik olarak ayrıştırın.
DİkKAT: Aşırı mekanik ayrışma hücre ölümünün artmasına yol açabilir ve sonraki hücre büyümesini olumsuz yönde etkileyebilir.
4. Hücre kaderini incelemek için hücre çifti teşbesi
- Deneyden önce, 8-10.
- Kaplanacak SVZ veya DG hücrelerinin sayısını (bölüm 3'te elde edilen) saymak için % 0,2 Trypan mavisi içeren bir çözelti kullanın ve hematositometre kullanarak hücreleri sayın.
- 5 ng/mL EGF ve 2.5 ng/mL bFGF (düşük EGF/bFGF) ile takviye edilen SFM'deki ayrıştırılmış hücre süspansiyonu 11.300 hücre/cm2 yoğunlukta seyreltin ve kaplamalı cam kapaklara yerleştirin.
- 24 saat sonra, cinsiyet belirleme bölgesi Y-box 2 (Sox2) ve nestin gibi NSC belirteçlerine karşı immünositokimya için hücreleri düzeltmek yanı sıra nöronal soy bir belirteç ile (yani doublecortin [DCX], olgunlaşmamış nöronlar için) (bölüm 14 bakınız).
NOT: Sox2 mitoz geçiren NSC'lerin bir belirtecidir. Tek bir ata hücre bölünmesinden kaynaklanan Sox2+/+ hücre çiftleri kök hücregenişlemesiniyansıtır 7 .
5. Postnatal nöral kök hücrelerin nörosfer olarak genişlemesi
- Ayrıştırılmış SVZ veya DG hücre süspansiyonunun yoğunluğunu belirlemek için (bölüm 3'te elde edilen), hücreleri hematositometre kullanarak sayın.
- SFM'de 2 x 104 hücre/mL yoğunlukta seyreltilmiş SVZ ve DG tek hücreli süspansiyon 10 ng/mL EGF ve 5 ng/mL bFGF ile desteklenmiştir. Son hacmi 5 mL/Petri kabı olan 60 mm Petri kaplanmış tohum Luz ve DG hücreleri.
- SVZ ve DG hücrelerini sırasıyla 6−8 gün ve 10−12 gün boyunca inkübülye etmek için sırasıyla primer nörosferler oluşturmak için 37 °C'de %5 CO2.
NOT: Bahsedilenlerden daha fazla kuluçka gün nörosferlerin toplanması ve nörosferin merkezinde hücre ölümü yüksek düzeyde teşvik edebilir. - Nörosferlerin büyük bir kısmı 150−200 m çapa sahip olduğunda, nörosfer geçişini gerçekleştirin.
NOT: Uygun bir çapa sahip olmadıklarında pas ören nörosferler sonraki tüm adımları tehlikeye atar.
6. Nörosferlerin geçişi
NOT: SVZ ve DG nörosferlerinin genişletilmesi için aşağıdaki protokol uygulanabilir.
- Nörosferleri geçiş için, 60 mm Petri çanak (es) ve 300 x g5 dakika için santrifüj nörosferler içeren büyüme faktörleri ile SFM toplamak .
- Üreticinin talimatlarına göre bir kimyasal dissosiasyon kiti (fare) kullanarak supernatant atın ve nörosfer pelet resuspend(Malzeme Tablosu).
NOT: Kuluçka sürelerini performans açısından çok önemli olduğu için tam olarak gözlemleyin. - 300 x g5 dakika santrifüj , supernatant kaldırmak ve 10 ng / mL EGF ve 5 ng / mL bFGF ile desteklenen SFM 1 mL ekleyin.
- Nörosferleri ayrıştırmak için P1000 pipetiyle yaklaşık 10 x yukarı ve aşağı triturate.
- %0,2 Trypan mavisi ve hematositometre içeren bir çözelti kullanan hücre sayısını sayın.
- Kaplamasız 60 mm Petri kaplarında 2 x 104 hücre/mL yoğunlukta reseed hücreleri.
- SVZ ve DG hücrelerini sırasıyla %5 CO2ile 37 °C'de ikincil nörosferelde etmek için sırasıyla 6−8 gün ve 10−12 gün kuluçkaya yatırın.
NOT: SVZ ve DG kaynaklı NSPC'lerin kendi kendini yenileme kapasitesine 5 ve 6 no'lu protokol bölümlerini izleyerek ulaşılabilir. Bunun için, 5 ng/mL EGF ve 2,5 ng/mL bFGF (düşük EGF/bFGF) içeren büyüme SFM ortamda 1.0 x 104 hücre/mL (kaplamasız 24 kuyu plakalı) yoğunlukta tohum SVZ ve DG hücreleri. Ortaya çıkan primer ve sekonder nörosfer sayısını sayın.
7. Nörosferlerin depolanması
- 60 mm Petri kaplarından nörosferleri (5.3 ve 6.7 adımlarından elde edilen) içeren ortamı toplayın.
- 300 x g 5 dakika santrifüj ve supernatant atın.
- Hücreleri 1 mL HBSS (300 x g'de5 dk) ile yıkayın.
- 300 x g5 dakika santrifüj, supernatant atın ve moleküler biyoloji analizi için -20 °C nörosferlerin pelet saklayın.
8. PDL kaplama plakası prosedürü
- Çözelti 1 (0,1 M borat tampon) hazırlamak için, tartMak 3.92 g borik asit ve seyreltmek 400 mL yüksek saflıkta su. PH'ı 8,2'ye ayarlayın ve yüksek saflıkta su yla 500 mL'ye kadar yapın.
- Çözelti hazırlamak için 2 (0.167 M borat tampon), tartmak 10.3 g borik asit ve seyreltmek 900 mL yüksek saflıkta su. PH'ı 8,2'ye ayarlayın ve yüksek saflıkta su yla 1000 mL'ye kadar yapın.
- Poli-D-lizin (PDL) (0,1 M borat tamponunda 1 mg/mL), 100 mL çözelti100 mL'de 100 mg PDL seyreltin.
- Hemen kullanmak veya -20 °C'de donup saklayın.
- Laminar akış altında, kuyu başına 1 coverslip ekleyin ve 15 dakika UV ışığı altında sterilize.
- Yeniden oluşturulmuş PDL'yi veya çözülmüş dondurulmuş PDL'yi kullanın.
- 100 μg/mL PDL'nin 0,167 M borat tamponunda 10 mL yeniden oluşturulmuş PDL'yi 90 mL çözeltiye ekleyerek nihai çözeltisini hazırlayın 2.
- Kuyulara en az 2 saat ila 37 °C'de son çözeltiyi ekleyin.
NOT: 24 kuyulu plakalar için her kuyuya 500°L hacim ekleyin. - Çözeltiyi çıkarın ve 3x yüksek saflıkta suyla yıkayın.
- Laminar akış kaputunda kapakları kurutun.
- Çok kuyulu kültür plakalarını 4 °C'de bırakın.
9. PDL/Laminin kaplama plakası prosedürü
- Birinci günde, 8.
- 2. günde, PDL çözeltisini çıkarın ve 3x yüksek saflıkta suyla yıkayın. Kurusun.
- Büyüme faktörlerinden yoksun soğuk SFM'de 5 μg/mL laminin hazırlayın.
- Kapaklara çözünmüş laminin ekleyin ve bir gecede 37 °C'de kuluçkaya yatırın.
NOT: 24 kuyulu plakalar için her kuyuya 500°L hacim ekleyin. - Pipet kullanarak laminini çıkarın.
NOT: Kapakları lamininden yıkamayın. - Hemen kullanın veya -20 °C'de saklayın.
10. Poli-L-ornitin (PLO) /laminin kaplama prosedürü
- Laminar akış altında, iyi başına bir coverslip ekleyin ve 15 dakika UV ışığı altında sterilize.
- Oda sıcaklığında 20 dakika (RT) için her kuyuya %0,01 FKÖ çözeltisi ekleyin.
NOT: 24 kuyulu plakalar için her kuyuya 500°L hacim ekleyin. - Çözeltiyi çıkarın ve sterilize edilmiş 1x PBS ile 3x yıkayın. Kurusun.
- Steril 1x PBS içinde 5 μg/mL laminin hazırlayın.
- 37 °C'de 2 saat kuluçka.
- Laminin'i çıkarın.
NOT: Kapakları lamininden yıkamayın. - Hemen kullanın.
NOT: Coverslip'in bir pipet ucuyla kapak fişi hafifçe dokunarak FKÖ çözeltisi tarafından tamamen kaplandığından emin olun. Sarsıldığında, çok kuyulu plakalar ses vermemelidir.
11. Hücrenin farklılaşmış monotabakası oluşturarak neuritogenezin değerlendirilmesi
- RT'de 60 mm Petri kaplarından (bölüm 5'ten elde edilen) nörosferleri içeren g ortamları ve 5 dk 5 dakika santrifüj içeren ortamları toplayın.
- Supernatant atın ve ayrışma PBS 1 mL nörosferlerin pelet ayrıştırın (yani, Mg2+/Ca2+ ve EDTA'lı PBS [2.7 mM KCl, 1.5 mM KH2PO4, 137 mM NaCl, 8.1 mM Na2HPO4 ve 0.5 mM EDTA 4Na, pH = 7.40]) 15 dk boyunca inkübe edilerek mekanik dissosiyasasyon. Alternatif olarak, bir kimyasal ayrışma kiti (fare)(Malzeme Tablosu)kullanarak nörosferleri ayrıştırın.
- RT'de 300 x g'da 5 dk santrifüj ve supernatant atın.
- Büyüme faktörlerinden yoksun 1 mL'lik sFM hücre peletini yeniden askıya alın.
- Hematositometre kullanarak hücre yoğunluğunu belirleyin.
- 3.766 hücre/cm2 ve 24 kuyulu plakalarda kaplanmış cam kapaklar üzerindeki plaka hücrelerinin yoğunluğunda büyüme faktörlerinden yoksun SFM'deki ayrıştırılmış hücre süspansiyonu seyreltin.
- 1−3 gün sonra, sitoiskeletin bir proteinine karşı immünositokimya için hücreleri sabitler (bkz. bölüm 14).
12. Nörosfer kültürlerinin farklılaşması
NOT: Hücre genişlemesinden elde edilen nörosferler, primer veya geçitli nörosferlerden (bölüm 5 veya 6'da elde edilen) farklı nöral soylardan hücrelere ayrıştırılabilir.
- Nörosferlerin çapı 150−200 m olduğunda, 24 kuyulu plakalarda kaplanmış cam kapaklar üzerinde 25°L nörosfer süspansiyon orta ve plaka toplayın.
NOT: Daha fazla nörosfer toplamak için, yavaşça merkezinde nörosferler konsantre Petri çanak döndürün. Sonra, merkezden pipet. - Plakaları 37 °C'de 15 dakika boyunca bir kuvöze koyun, böylece nörosferler substrata yapışır. Daha sonra, büyüme faktörlerinden yoksun 500 μL SFM ekleyin (farklısal koşullar).
- 24 saat sonra, büyüme faktörlerinden yoksun taze SFM ile orta değiştirin.
- 37 °C'de %5 CO2 ve %95 atmosferik hava ile farklı zaman noktaları (sırasıyla 2 ve 7 gün in vitro, DIV2 ve DIV7) için ayırt edin.
NOT: Hücre sağkalım, çoğalma ve farklılaşma farklı hücre tahlilleri kullanılarak analiz edilebilir.
13. Hücre biyolojisi tahlilleri
- Hücre sağkalım tonu
- Kaplamalı nörosferleri 37 °C'de kuvözdeki hücre fiksasyonundan önce 30 dakika boyunca 3 μg/mL propidium iyodüre (PI) maruz bırakın.
NOT: PI sadece bozulmuş membranbütünlüğü8 ile hücrelere girmek mümkün bir otofloresan ajandır. Hücre sağkalımını analiz etmek için caspase 3 boyama veya terminal deoksinükleotidyl transferaz dUTP nick-end etiketleme (TUNEL) analizi gibi diğer yöntemler kullanılabilir.
- Kaplamalı nörosferleri 37 °C'de kuvözdeki hücre fiksasyonundan önce 30 dakika boyunca 3 μg/mL propidium iyodüre (PI) maruz bırakın.
- Hücre çoğalması tsay
- Kaplamalı nörosferleri 37 °C'de kuvözde fiksasyondan önce 4 saat boyunca 10 μM 5-bromo-2'-deoksiuridine (BrdU) maruz bırakın.
NOT: BrdU, 9noluhücrelerde DNA sentezi sırasında dahil edilebilen sentetik bir timidin analogudur.
- Kaplamalı nörosferleri 37 °C'de kuvözde fiksasyondan önce 4 saat boyunca 10 μM 5-bromo-2'-deoksiuridine (BrdU) maruz bırakın.
- Hücre farklılaşması tsası
- 7 günlük kaplama nörosferleri ilk 24 saat içinde 10 μM BrdU'ya, 37 °C'de kuvözde teşrin.
- Büyüme faktörlerinden yoksun SFM'yi (farklısal koşullar) yenileyin ve fiksasyona kadar 6 gün boyunca BrdU'nun yokluğunda hücrelerin gelişmesine izin verin.
NOT: Bu nabız takip deneyleri, olgun nöral hücrelerin belirteçleri ile birlikte etiketleyerek, protokol sırasında olgun hücrelere farklılaşan ata hücrelerinin değerlendirilmesine olanak sağlar.
14. Nörosfer kültürlerinin immünboyamı
- Hücre fiksasyonu
- 1x PBS'de %4 paraformaldehit (PFA) hazırlayın ve 4 °C veya -20 °C'de saklayın.
- Kuyulardan büyüme faktörlerinden yoksun SFM'yi çıkarın ve her kuyuya 4 °C'de 500°L 4 PfA ekleyin ve RT'de 20 dakika boyunca.
- 1x PBS ile 3x yıkayın, 5 dakika her zaman için, farklılaştırılmış nörosferler içeren kapakları.
- 4 °C'de 500 μL 1x PBS'de kullanıma kadar kapakları saklayın.
NOT: Denemede BrdU yoksa, adım 14.3'e atlayın.
- Denatürasyon yöntemi (yalnızca BrdU deneyleri için)
- 37 °C'de 1 M HCl hazırlayın.
- 1x PBS'de 3x kapakları durular.
- PBS'de %1 noniyonik yüzey aktif madde içeren 30 dk için permeabilize hücreleri (örneğin, Triton X-100).
- 37 °C'de (~300 μL/well) 30−40 dk için 37 °C'ye kadar önceden ısıtılan 1 M HCl'lik denature dsDNA.
- 1x PBS ile kuyuları 4x yıkayın.
- Permeabilizasyon ve engelleme
- 5 dakika boyunca 1x PBS'de durula.
- 1x PBS 'de (~300 μL/well) %0,5 nonik yüzey aktif madde ve %3 sığır serum albumini (BSA) ile 1,5 saat kuluçka.
NOT: NeuN için 1x PBS'de %6 BSA kullanın.
- Kuluçka ve montaj
- 1. gün, yıkamadan, kuluçka odasında %0,1 nonik yüzey aktif maddede primer antikorlu(Malzeme Tablosu)ve 1x PBS'de %0,3 BSA içeren hücreleri kuluçkaya yatırın (24 kuyulu plakalar için 20 μL/iyi kullanın). Antikorlar bir florofora konjuge ise 4 °C ışık korumalı gecede kuluçka kapakları bırakın.
- 2. günde, kapakları kendi kuyularına geri dönün ve 1x PBS'de 5 dakika boyunca 3x durula.
- Uygun floresan konjuge sekonder antikorlar (seyreltme 1:200) ve 12 μg/mL Hoechst 33342 ile 1x PBS'de 2 saat RT ve inkübasyon odasında ışık korumalı (20 μL/coverslip) ile karşı lekesi.
- 5 dakika boyunca 1x PBS 3x kapakları yıkayın.
- Floresan montaj ortamının 5 μL/coverslip'ini kullanarak kapakları mikroskop slaytlarına monte edin.
- Rt'de kapaklar havayı kurutun, ışıktan korunsun, 1 gün boyunca.
- Mikroskopi
- Floresan mikroskobu kullanarak görüntüleri görüntüleyin ve edinin.
- Her koşul için üç çoğaltma kullanın. Her coverslip'te 40x hedefiyle (alan başına~100 hücre) beş bağımsız mikroskobik alanda hücre sayımlarını gerçekleştirin.
15. EGF ve bFGF stok çözümlerinin hazırlanması
- EGF stok çözümü
- Liyofilize egf'yi yeniden oluşturmak için ürünü yüksek saflıkta seyreltin ve 20 g/mL'lik son konsantrasyona ulaşın.
- Aliquot ve mikrotüplerde -5 ila -20 °C'de saklayın.
- bFGF stok çözümü
NOT: bFGF 10 mM Tris, pH 7.6 çözeltisi ile yeniden oluşturulmalıdır.- İçeriği en alta getirmek için açmadan önce şişeyi kısa bir süre santrifüj edin.
- 10 mM Tris 50 mL, pH 7.6 hazırlayın. Bunun için 60,57 mg Tris ((HOCH2)3CNH2) ağırlığında ve 40 mL yüksek saflıkta su ile seyreltin. PH'ı 7,6'ya ayarlayın ve yüksek saflıkta su yla 50 mL'ye kadar yapın.
- 10 mM Tris'te 10 mL %0.1 BSA, pH 7.6 hazırlayın. Bunun için 10 mg BSA ağırlığında ve 10 mM Tris 10 mL seyreltin.
- 15.2.2 ve 15.2.3 adımlarında laminar akış kaputunun altında 0,22 m filtre ile hazırlanan filtre çözümleri.
- 10 μg bFGF'yi 10 μG/mL'lik son konsantrasyona ulaşmak için 10 mM Tris'te %0,1 BSA'da pH 7,6 ile yeniden oluşturun. Aliquot mikrotüpler içine -20 °C en fazla 6 ay.
Sonuçlar
NSA kullanılarak elde edilen SVZ ve DG nörosferleri, farklılaşmamış hücrelerden oluşur, Sox2 pozitif, kendi kendini yenileme kapasitesinde rol oynayan bir transkripsiyon faktörü ve NSPC'lerde ifade edilen bir ara filament proteini olan nestin için pozitiftir (Şekil 1A). Buna ek olarak, SVZ kaynaklı nörosferler DG muadillerine göre daha büyük boyutlara sahiptir (Şekil 1A). Daha da önemlisi, farklısal koşullarda, SVZ- ve DG kaynaklı NSPC'ler hücrelerin psödomonotabakasını oluşturan nörosferlerden göç eder(Şekil 1B).
Kendi kendini yenileme kapasitesine erişmek için, hücre çifti teşrisi Sox2 ve nestin ifadesine göre gerçekleştirilir ve bu da farklılaşma işlemini başlatan hücrelerin bölünmesinde kaybolma eğilimindedir, yani nöronal soyundan bir belirteç ile dcx. Her iki nörojenik bölgede de, Sox2+/+/nestin+/+/DCX-/- simetrik bölünmelerin (kendini yenileme)(Şekil 2A1,B1), Sox2-/+/nestin-/+/////DCX+/- asimetrik bölünmeler (Şekil 2A1,B2) ve Sox2-/-/nestin-/-/DCX+/+ simetrik bölünmeler (farklılaşma) (Şekil 2A2,B1).
Nörosferlerin geçişi NSPC'lerin verimini artırır; ancak DIV2'de hücre ölümü geçişle birlikte değişir. Aslında SVZ'de hücre geçişi ile PI-pozitif hücrelerin yüzdesi arttırılır (P0: %15.6 ± %1.2 % p1: %19.2 ± %2.7 vs P2: %32.35 ± %0.14 vs P3: %39.6 ± % 4.0) ve DG'de (P0: %16,31 ± %0,95 % p1: %32,1 ± %1,7 vs P2: %27,42 vs P3: %32,2 ± % 3,1) (Şekil 3).
Neuritogenez, farklılaşmanın başlangıcında SVZ ve DG NSPC'lerinin farklılaşmasından elde edilen nöronlarda değerlendirilebilir: DIV1 (Şekil 4A,D), DIV2 (Şekil 4B,E) ve DIV3 (Şekil 4C,F). Aslında Şekil 4'tede görüldüğü gibi, nöritlerin uzunluğu ve sonucu farklılaşma ile artar.
Hücre proliferasyonu SVZ ve DG kaynaklı nörosferlerde değerlendirilebilir. DIV1'deki primer farklılaştırılmış nörosferlerin SVZ(Şekil 5A1)ve DG(Şekil 5A2)ile karşılaştırılması, BrdU pozitif hücrelerin yüzdesi SVZ'de DG'ye göre daha yüksektir (SVZ: %6.15 ± %0.64 vs DG: %3.27 ± 0.13% ; p < 0.05; n = 4; Şekil 5A3). Ayrıca, hücre farklılaşması da olgun nöronlar tanımlar nöronal çekirdekleri (NeuN) gibi olgun bir yapıcı ile BrdU boyama birleştirerek erişilebilir(Şekil 5B1,B2). Şekil 5B3, olgun nöronların farklılaşmasını sağlayan çoğalan ataların yüzdesinin SVZ ve DG'de benzer olduğunu göstermektedir (SVZ: %12.04 ± %1.58 vs DG: %13.56 ± 0.48%; p > 0.05; n = 4).
SVZ ve DG kaynaklı NSPC'lerin saplığı ve çok yönlülüğü, farklı farklılaşma günlerinde (DIV2 ve DIV7) farklı belirteçlerin ekspresyonunu değerlendirerek NSA kullanılarak erişilebilir. Nitekim NSC'ler (nestin- ve glial fibrillary asidik protein [GFAP]-çift pozitif hücreler) her iki nörojenik bölgede de mevcuttur(Şekil 6A,G). Bu hücreler olgunlaşmamış nöronlar (DCX-pozitif hücreler)(Şekil 6B,H),olgun nöronlar (NeuN-pozitif hücreler) (Şekil 6F,L), oligodendrosit öncül hücreleri (nöron-glial antijen 2 [NG2] ve trombosit--- türetilmiş büyüme faktörü reseptörü α [PDGFRα]- pozitif hücreler) (Şekil 6C,I), olgun oligodendrositler (miyelin temel protein [MBP]-pozitif hücreler) (Şekil 6E,K) ve astrositler (GFAP-pozitif hücreler) (Şekil 6D,J).
Farklı substratlar, farklıkoşullar altında hücrelerin psödomonotabakasını oluşturmak için kapakları kaplamak için kullanılabilir. Ek Şekil 1'degösterildiği gibi, örtüler fKÖ veya PDL ile birlikte lamina ekstra kaplamaya sahip olduklarında DG hücreleri sadece PDL'ye göre daha fazla göç eder(Ek Şekil 1B−H). Aslında, PDL ve laminin substrat olarak birlikte kullanıldığında(Ek Şekil 1C,G),DG hücreleri TEK Başına kullanıldığı SVZ hücrelerinden daha etkili bir psödomonolayer oluştururlar (Ek Şekil 1A,E).
Daha da önemlisi, bu sonuçlar NSA'nın iki ana nörojenik nişten elde edilen NSC'lerin kökve çok yönlülük özelliklerini değerlendirme potansiyelini göstermektedir.
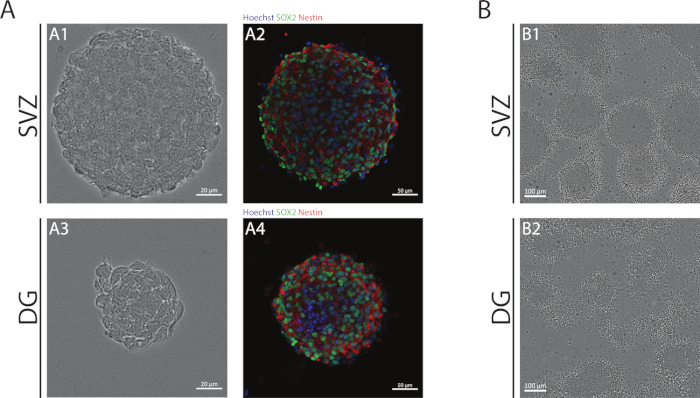
Şekil 1: Subventriküler zon ve dentat girus türetilmiş NSPC nörosfer ler veya psödomonolayers olarak kültürlü. (A) Temsilcisi brightfield (A1,A3) ve floresan(A2,A4) SVZ görüntüleri- ve DG kaynaklı nörosferler, çekirdekleri Hoechst 33342 ile boyanmış nerede (mavi) ve NSCs Sox2 (yeşil) ve nestin (kırmızı). (B) Farklısal koşullar altında SVZ ve DG kaynaklı nörosferlerden üretilen psödomonolayers'ın temsili parlak alan görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
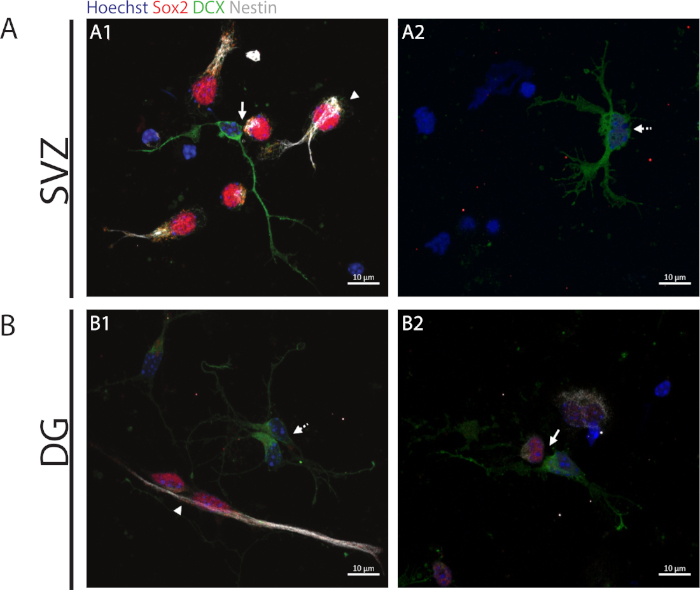
Şekil 2: Hücre çifti teşp. Bir ata hücre bölünmesinden elde edilen hücre çiftlerinin temsili floresan görüntüleri. SVZ ve DG çekirdekleri Hoechst 33342 (mavi), Sox2 (kırmızı) ve nestin (beyaz) için kök benzeri hücrelerin yanı sıra DCX (yeşil) ile olgunlaşmamış nöronlar ile boyandı. A1 ve B1 panellerinde ok uçları Sox2+/+/nestin+/+/DCX-/- simetrik kendi kendini yenileyen bölmeleri gösterir, A1 ve B2 panellerinde oklar Sox2+/-/nestin+/-/DCX-/+ asimetrik bölmeleri, A2 ve B1 panellerinde kesik çizgi oklarını Gösterir Sox2-/-/nestin-/-/DCX+/+ simetrik ayırıcı bölümler gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
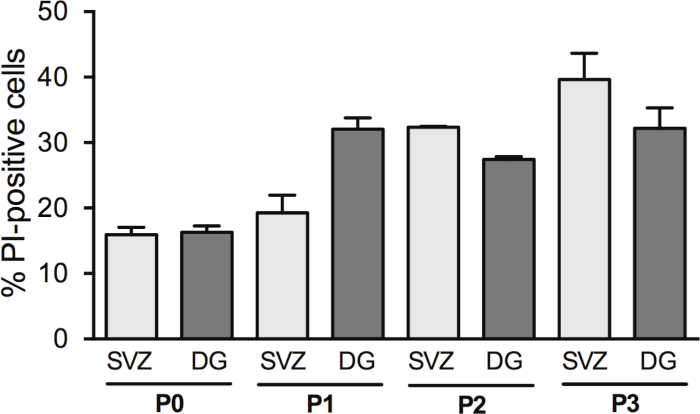
Şekil 3: Hücre geçişi ile hücre sağkalım analizi. 0, 1, 2 ve 3 pasajdan (P0−P3) sonra, SVZ ve DG kaynaklı farklılaştırılmış nörosfer kültüründe DIV2'deki PI-pozitif hücrelerin kantitatif analizi. Veriler ortalama ± SEM, n = 1−8 olarak ifade edilir. PI = propidium Iodide. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
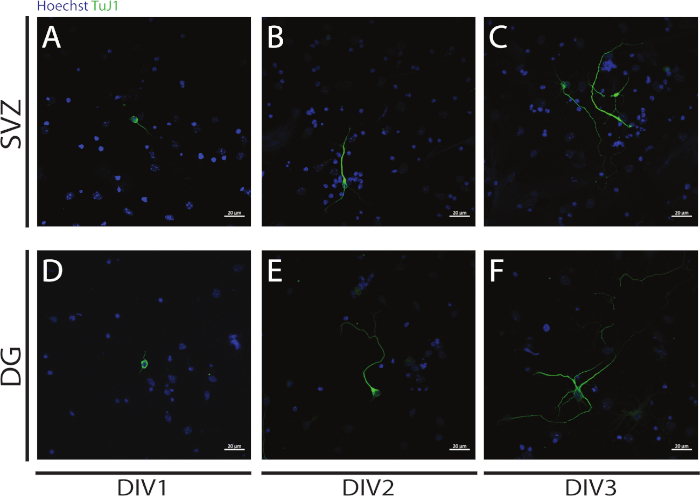
Şekil 4: DIV 1, 2 ve 3'te neuritogenez analizi. ΒIII-tubulin sinyali ile tanımlanan nöritlerin temsili konfokal floresan görüntüleri, SVZ ve DG nöronlarında (A,D) DIV1, (B,E) DIV2, ve (C,F) DIV3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
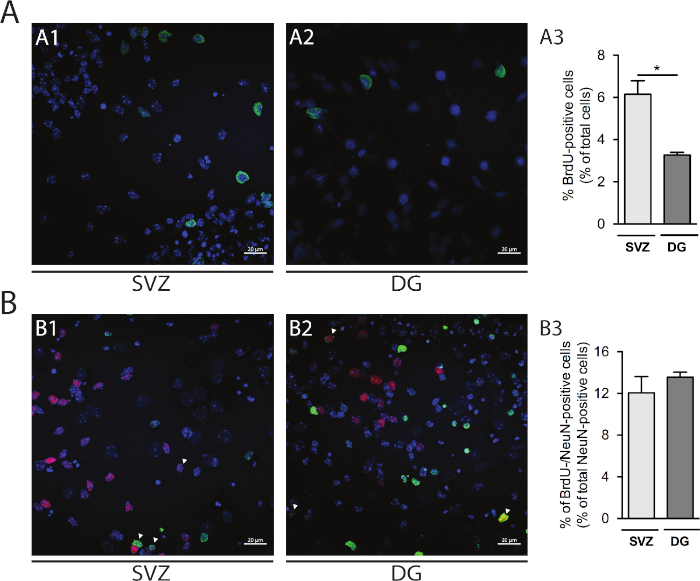
Şekil 5: Hücre çoğalması tsay. DIV1 in (A1) SVZ ve (A2) DG'deki BrdU-pozitif hücrelerin temsili konfokal görüntüleri. (A3) DG ve SVZ kaynaklı farklılaştırılmış nörosfer kültüründe DIV1'deki BrdU-pozitif hücrelerin kantitatif analizi. Veriler ortalama ± SEM, n = 4 olarak ifade edilir. *p < 0.05 t-testi ile. (B1) SVZ ve (B2) DG'de DIV7'de BrdU ve NeuN-pozitif hücrelerin temsili floresan görüntüleri. Ok uçları BrdU-/NeuN-pozitif hücreleri gösterir. (B3) Her iki nişte de DIV7'deki BrdU-/NeuN-pozitif hücrelerin kantitatif analizi. Veriler ortalama ± SEM, n = 4 olarak ifade edilir. BrdU: 5-bromo-2'-deoksiuridin, sentetik timidin analogu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
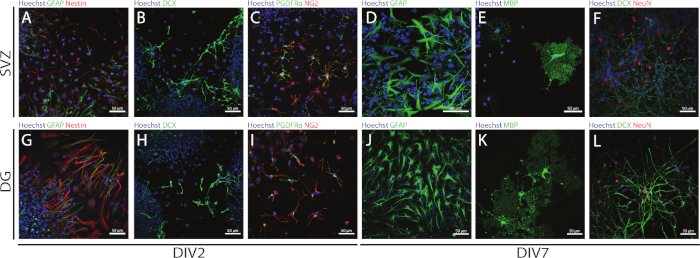
Şekil 6: SVZ ve DG kaynaklı farklılaştırılmış nörosfer kültüründe bulunan nöral hücre tipleri. Hücre çekirdeklerinin Hoechst 33342 (mavi) ve: (A,G) GFAP (yeşil) ve nestin (kırmızı),(B,H)olgunlaşmamış nöronlar için NSC'ler ile boyandığı 2 ve 7 günlük nörosfer farklılaşmasından (DIV2 ve DIV7) sonra SVZ ve DG kaynaklı hücre tiplerinin temsili floresan görüntüleri DCX (yeşil),(C,I) için oligodendrocyte öncül hücreleri PDGFRα (yeşil) ve NG2 (kırmızı), (D,J)GFAP (yeşil), (E,K) MBP için olgun oligodendrocytes (yeşil) ve(F,L)neuN (kırmızı) için olgun nöronlar için. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
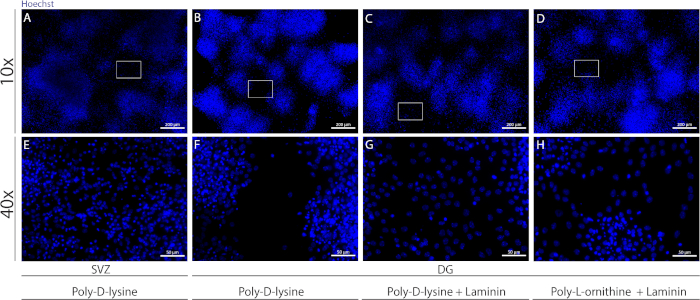
Ek Şekil 1: Nörosfer ekivesi ve göçü için farklı yüzeylerin test edilip psödomonolayer oluşturması. (A,E) SVZ türetilmiş psödomonolayer'ın poli-D-lizin ilerlizini substrat olarak kullanmasının temsili floresan görüntüleri, (B,F) DG-türetilmiş psödomonolayer bir substrat olarak poli-D-lizin kullanarak poli-D-lizin kullanarak, (C,G) Bir substrat olarak laminin ile poli-D-lizin kullanarak DG-türetilmiş psödomonolayer, ve (DGkaynaklı psödomonolayer astrat olarak poli-L-ornithine kullanarak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
NSPCs in vitro sistemleri hücresel ve moleküler mekanizmaların daha iyi anlaşılmasını sağlar, hangi daha fazla in vivo doğrulanabilir. NSA, üç boyutlu yapısı nedeniyle fizyolojik koşulları taklit etmek için çok güçlü bir yöntemdir. Ayrıca, bu kültür sistemi de teknik olarak kültür10daha kolaydır , monolayer kültür sistemi gibi diğer in vitro sistemleri ile karşılaştırıldığında. Nitekim, NSA ile, hücre gelişimi sırasında maruz kalan dışsal ipuçlarını kontrol etmek kolaydır, genişleme veya farklılaşma aşamasında, medya ilgi faktörlerinin hassas ve değişken miktarlarda ekleyerek yanı sıra diğer hücre tipleri ile nörosferler culturing tarafından6. Ayrıca, nsa monolayer kültürleri ile karşılaştırıldığında, bu doku küçük bir miktar veya hücrelerin az sayıda daha yüksek bir hücre yoğunluğu elde etmek mümkündür, paralel çalışmalar yapılmasına izin, böylece hayvan sayısını azaltmak1.
NSA izole etmek ve NSCs genişletmek için en yaygınyöntemdir 11,12,13, belirli bir doku örneği mevcut öncül hücrelerin sayısını tahmin etmek için kullanılabilir5 ve farklı koşullar arasında öncü hücre frekansı. Ancak, hem nörosferler ve monolayer kültürler quiescence NSCs14için hesap yok. Ayrıca, NSA bazı sınırlamalar vardır11,12,13 ve ortaya çıkan nörosfer frekansı orta bileşenleri de dahil olmak üzere birçok faktöre bağlıdır, diseksiyon prosedürü, ayrıştırma işlemi11,12,13, ve nörosfer toplama5. Gerçekten de, yüksek yoğunluklu bir kültürde, nörosferler toplama eğilimindedir. Sonuç olarak, bir örnekteki öncül hücrelerin sayısını tahmin ederken dikkatli olunmalıdır. Yukarıdaki sınırlamaları aşmak için, yalıtılmış NSPC'ler de genişletilebilir ve tek katmanlı5,,15. Daha da önemlisi, öncül hücre frekansını farklı koşullar arasında karşılaştırmak için NSA kullanmak çok yararlı ve doğrudur, çünkü tüm bu sınırlamalar aynı denemede gerçekleştirilen tüm koşullar arasında örtülü ve benzerdir.
Nörosfer kültüründe dikkat gerektiren kritik adımlar vardır. Beyin hasat adım, menenjler ve nörojenik nişler iyi izolasyon tam kaldırılması nsPCs saflık ve verimi maksimize etmek için gereklidir. Doku ayrışması sırasında, tripsinin proteolitik aktivitesi nedeniyle, tripsin aşırı kullanımı veya daha uzun kuluçka süreleri hücre lisise yol açabilir. Ayrıca, geçiş günü nörosferlerin sağlıklı bir nüfus elde etmek için önemlidir. Çapı 200 μm'den yüksek olan passaging nörosferler NSPC'lerin canlılığını, proliferatif ve farklıcı kapasitesini büyük ölçüde etkiler.6 Ayrıca, SVZ ve DG hücreleri için PDL ve PLD/laminin ile kaplama, sırasıyla, farklılaşma sürecinden ödün vermeden nörosferlerden iyi hücre göçünün sağlanması için gereklidir. İmmünositokimya analizi açısından, PFA ile daha uzun kuluçka süreleri antijenleri maskeleyerek ve arka planı artırarak boyamayı tehlikeye atabilir.
NSA nöral gelişim ve farklılaşma in vitro çalışmalar yanı sıra terapötik amaçlar için nspcs tutarlı ve sınırsız bir kaynak sağlamak için güçlü bir araçtır16,17. Nitekim, bu tetki kullanabilirsiniz genetik ve davranışsal modeller daha fazla NSPC proliferasyon ve farklılaşma dahil moleküler ve hücresel mekanizmaları anlamak için18,19. Bu test aynı zamanda farklı ilaç ve bileşikler i test etmek için yararlıdır20,21,22 yanı sıra genetik manipülasyonlar gerçekleştirmek için19,23 NSC özellikleri modüle etmek. İmmünositokimyaya ek olarak, ters transkripsiyon polimeraz zincir reaksiyonu ve Batı leke analizi RNA ve protein ekspresyonuna erişmek için yapılabilirken, elektrofizyolojik çalışmalar ve kalsiyum görüntüleme yeni doğan nöronların işlevini değerlendirmek için kullanılabilir21.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma IF/01227/2015 ve UID/BIM/50005/2019, projeto financiado pela Fundação para a Ciência e a Tecnologia (FCT)/ Ministério da Ciência, Tecnologia e Ensino (Superior MCTES) através de Fundos do Orçamenesta tarafından desteklenmiştir. R.S. (SFRH/BD/128280/2017, F.F.R. (İBB/CT/35-2018), D.M.L. (PD/BD/141784/2018) ve R.S.R. (SFRH/BD/129710/2017) FCT'den burs almıştır. Yazarlar mikroskop yardımı için Instituto de Medicina Moleküler João Lobo Antunes de biyogörüntüleme tesisi üyelerine teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Referanslar
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır