Method Article
Isolamento ed espansione delle neurosfere dalle nicchie neurogeniche del topo postnatali (P1-3)
In questo articolo
Riepilogo
In questo articolo, descriviamo, in dettaglio, un protocollo per la generazione di colture della neurosfera da cellule staminali neurali del topo postnatali derivate dalle principali nicchie neurogeniche del topo. Le neurosfere sono utilizzate per identificare le cellule staminali neurali dal tessuto cerebrale permettendo la stima dei numeri di cellule precursori. Inoltre, queste strutture 3D possono essere placcate in condizioni differenzianti, dando origine a neuroni, oligodendrociti e astrociti, permettendo lo studio del destino cellulare.
Abstract
L'analisi della neurosfera è una tecnica in vitro estremamente utile per studiare le proprietà intrinseche delle cellule staminali/progenitrici neurali (NPG) tra cui la proliferazione, l'auto-rinnovamento e la multipotenza. Nel cervello postnatale e adulto, gli NSPC sono presenti principalmente in due nicchie neurogeniche: la zona subventricolare (SV) che riveste i ventricoli laterali e la zona subgranulare del giro dentato ippocampale (DG). L'isolamento delle nicchie neurogeniche dal cervello postnatale permette di ottenere una maggiore quantità di NSPC in coltura con un conseguente vantaggio di rese più elevate. Lo stretto contatto tra le cellule all'interno di ogni neurosfera crea un microambiente che può assomigliare a nicchie neurogeniche. Qui, descriviamo, in dettaglio, come generare colture della neurosfera derivate da topi di 1-3 giorni (P1-3), oltre a passare, per l'espansione della neurosfera. Questo è un approccio vantaggioso poiché l'espressione della neurosfera consente una generazione veloce di cloni NSPC (6-12 giorni) e contribuisce a una significativa riduzione del numero di animali. Placcando le neurosfere in condizioni differenzianti, possiamo ottenere uno pseudomonostrato di cellule composte da NSPC e cellule differenziate di diversi lignaggi neurali (neuroni, astrociti e oligodendrociti) permettendo lo studio delle azioni di fattori intrinseci o estrinseci sulla proliferazione della NSPC, la differenziazione, la sopravvivenza delle cellule e la neuritogenesi.
Introduzione
Il test della neurosfera (NSA) è stato descritto per la prima volta nel 19921,2 e rimane ancora uno strumento unico e potente nella ricerca sulle cellule staminali neurali (NSC). L'isolamento delle NSC dalle principali regioni neurogeniche presenta problemi impegnativi perché i requisiti per mantenere queste cellule in condizioni fisiologiche rimangono poco compresi. Nella NSA, le cellule sono coltivate in un mezzo senza siero definito chimicamente con la presenza di fattori di crescita tra cui il fattore di crescita epidermico (EGF) e il fattore di crescita fibroblasto di base (bFGF)1,2,3.3 Le cellule precursori neurali (gambo e progenitori) vengono selezionate utilizzando questi mitogeni poiché queste cellule sono EGF e FGF-responsive entrando in un periodo di proliferazione attiva, mentre altre cellule, vale a dire le cellule differenziate, muoiono4. Le cellule precursori neurali crescono come neurosfere, che possono poi essere passaggiate per espandere ulteriormente il pool di queste cellule5. È importante sottolineare che, poiché queste cellule progenitrici di stilo neurale (NPG) sono multipotenti sono in grado di differenziarsi nei tre principali tipi di cellule del sistema nervoso centrale (SNC): neuroni, oligodendrociti e astrociti5.
La NSA fornisce una fonte rinnovabile di precursori del SNC indifferenziati, che possono essere utilizzati per studiare diversi processi tra cui la proliferazione e l'auto-rinnovamento di NSC, e la differenziazione neuronale e gliale, sia nel contesto fisiologico che in quello della malattia. Inoltre, gli studi in vitro possono essere utilizzati per valutare il grado di specifica intrinseca presente nei precursori neurali durante lo sviluppo, nonché per studiare il pieno potenziale delle cellule, rimuovendo i segnali estrinseci associati al loro ambiente normale6. Il modello della neurosfera è prezioso per valutare i regolatori putativi poiché mantenendo le cellule in un mezzo privo di siero, i segnali ambientali sono forniti solo dalle cellule circostanti6. Inoltre, nella NSA, gli NSPC sono facilmente ampliati nella coltura, la densità delle cellule per area è alta e la composizione eterogenea delle neurosfere ha una certa somiglianza con le nicchie in vivo6. Questi vantaggi consolidati sono il motivo per cui questa metodologia è stata ampiamente utilizzata da molti ricercatori.
Il seguente protocollo descrive in dettaglio tutti i processi dall'isolamento della popolazione di NSPC postnatale dalle due principali regioni neurogeniche, la zona subventricolare (SV) e il giro dentato ippocampale (DG), all'espansione di tali cellule come neurosfere, nonché alla differenziazione in neuroni, astrociti e oligodendrociti. Infine, vengono descritti anche diversi saggi per accedere alle proprietà di stelo e multipotenza delle NSPC derivate da SV e DG.
Protocollo
Tutti gli esperimenti sono stati effettuati in conformità con la legislazione della Comunità europea (86/609/CEE; 2010/63/EU; 2012/707/EU) e portoghese (DL 113/2013) per la protezione degli animali utilizzati a fini scientifici. Il protocollo è stato approvato dall'"IMM's institutional Animal Welfare Body - ORBEA-iMM and the National competent authority - DGAV (Direcèo Geral de Atoria e Veterin'ria)"
1. Configurazione di base e preparazione del mezzo di coltura
- Il giorno della dissezione, preparare la quantità appropriata di mezzo di crescita corrispondente al mezzo senza siero (SFM) composto da Dulbecco modificato aquila medio [(DMEM)/F12 con L-glutamine] (Tabella dei materiali) integrato con 100 U/mL penicillina e 100 g/mL streptomycin (1% Btrep), 1% B27, con anche 10 ng/mL EGF e 5 ng/mL bFGF. Riscaldare il mezzo di coltura a 37 gradi centigradi in un bagno d'acqua.
NOTA: Il volume del mezzo di crescita dipende dal numero di cuccioli, per 5 cuccioli preparare 100 mL (50 mL per SV e 50 mL per la DG); tuttavia, dopo aver contato il numero di celle (passaggio 5.1) il volume esatto dovrà essere regolato. - Per la microdisezione di SV e DG, preparare il mezzo di dissezione bilanciato (HBSS) di calcio e magnesio (HBSS) integrato con 100 U/mL pen/strep.
NOTA: Preparare i 50-100 mL del mezzo di dissezione. - Impostare un microscopio di dissezione e preparare gli strumenti necessari per rimuovere il cervello (forbici e piccole spatole) e per le microdissezioni SV e DG (Dumont piccole forbici, #7 pinze, #5 pinze, #5S pinze) immergendosi nel 70% di etanolo.
2. Raccolta di cervelli di topo postnatali (P1-3) e microdisezioni sV/DG
- Preparare piatti Petri da 60 mm (area di crescita 21 cm2)con HBSS integrati con penna/strepe e 2 tubi campione (uno per SV e uno per la DG) con 500 gradi l di HBSS integrati ciascuno.
- Eutanasia topi cuccioli (P1-3) secondo il protocollo approvato dalla struttura/linee guida di Institutional Animal Care. Eseguire la decapitazione con una singola incisione con forbici affilate alla base del tronco encefalico.
- Tenendo la parte ventrale del corpo alla base della testa e usando piccole forbici appuntite, fare un'incisione mediana nella pelle su tutta la lunghezza della testa, rivelando così la superficie del cranio.
- Fare un'incisione longitudinale alla base del cranio e continuare a tagliare lungo la sutura sagittale utilizzando piccole forbici con un angolo poco profondo possibile al fine di evitare di danneggiare le strutture cerebrali.
- Sbucciare il cranio ai lati con pinze curve ed esporre il cervello.
AVVISO: Assicurarsi che gli strumenti di dissezione siano privi di etanolo prima di toccare il cervello. - Isolare il cervello dal cranio utilizzando una piccola spatola, scivolando sotto la base del cervello per tagliare i nervi cranici e vasi sanguigni che sono collegati alla base del cervello, e trasferire il cervello in una piastra Petri contenente fredda completata soluzione HBSS.
- Posizionare il piatto Petri contenente il cervello sotto un microscopio sezionato a bassa ingrandimento e posizionare il cervello sulla sua superficie dorsale.
- Utilizzando pinze sottili, rimuovere le meningi dal lato ventrale del cervello e i bulbi olfattivi, tenendo il cervello in posizione dal cervelletto. Ruotare il cervello sull'aspetto ventrale e staccare il resto delle meningi.
NOTA: Rimuovere le meningi dorsali è un passo cruciale per garantire il corretto taglio del cervello. - Scartare il cervelletto facendo un taglio con pinze. Posizionare una carta da filtro con una dimensione dei pori di 11 m su un elicottero di tessuto (Tabella dei materiali) e impostare il cervello sulla carta da filtro utilizzando pinze a punta curva. Tritare il cervello in 450 sezioni coronale m e utilizzare una lamina bagnata per raccogliere il cervello sezionato in un nuovo piatto Petri pieno di HBSS integrato a freddo.
- Per sezionare la SVi, utilizzare le pinze per separare le fette coronali in modo anteriore-posteriore fino a raggiungere le fette con i ventricoli laterali, sotto un microscopio sezionante.
- Tagliare il sottile strato di tessuto che circonda la parete laterale dei ventricoli (che corrisponde alla SV) con pinze sottili, escludendo il parenchyma striato e il corpo calloso. Isolare la punta delle pinze negli angoli laterali del ventricolo laterale: una immediatamente sotto il corpo calloso e l'altro nel tessuto immediatamente adiacente alla zona ventrale del ventricolo laterale. Quindi, tagliare una piccola linea di tessuto che circonda il ventricolo laterale.
- Raccogliere il tessuto sezionato in un tubo campione con soluzione HBSS integrata precedentemente identificata come SV.
NOTA: Escludere l'SV in fette in cui iniziano a comparire sia i ventricoli laterali che la formazione dell'ippocampo. - Passare attraverso tutte le fette dopo microdissection SV in una moda anteriore-posteriore e raggiungere la formazione ippocampale. L'uso di pinze elimina la prima fetta con l'ippocampo dove la DG è ancora irriconoscibile.
- Per rimuovere la DG, prima isolare l'ippocampo dalle fette. Rifocalizzare il microscopio per visualizzare i bordi intorno alla DG.
- Dissezionare la parte DG eseguendo un taglio tra la DG e la regione CA1 seguito da un taglio verticale tra la DG e la regione CA3 utilizzando le pinze. Rimuovere la fimbria e qualsiasi tessuto adiacente.
NOTA: Negli animali P1/3, la DG è quasi indistinguibile dal corno di Ammon, ma mostra una piccola mancia. - Raccogliere il tessuto sezionato in un tubo campione contenente soluzioni HBSS integrate precedentemente identificate come DG.
NOTA: Le lesioni complessive all'ippocampo o all'area circostante renderanno più difficile isolare la DG. Utilizzando un atlante del cervello del topo postnatale è essenziale quando l'utente non ha familiarità con l'isolamento del tessuto SV e DG dalle sezioni coronali.
3. Dissociazione dei tessuti
- Per dissociare il tessuto SV e DG presente nei rispettivi tubi, aggiungere trypsin-EDTA 0.05% per avere una concentrazione finale di 5-10% di Trypsin-EDTA 0.05% in HBSS. Incubare per circa 15 min a 37 s, fino a quando il tessuto è aggregato insieme.
- Lavare il tessuto dalla trippsina rimuovendo il supporto e aggiungendo 1 mL di nuova soluzione integrata HBSS per 4 volte consecutive.
- Rimuovere l'HBSS e risospendere il tessuto digerito in 1 mL di SFM integrato con 10 ng/mL EGF e 5 ng/mL bFGF. Dissociare meccanicamente il pellet pipet con il tubo dolcesu e giù di circa 7-10 volte utilizzando una pipetta P1000, fino a ottenere una soluzione cellulare omogenea.
PRUDENTE: Un'eccessiva dissociazione meccanica può portare ad un aumento della morte cellulare e avrà un impatto negativo sulla successiva crescita cellulare.
4. Saggio di coppia di cellule per studiare il destino delle cellule
- Prima dell'esperimento, preparare piastre rivestite 24 pozze per le colture motrice aderenti secondo le sezioni 8-10.
- Per contare il numero di cellule SV o DG (ottenute nella sezione 3) da placcare, utilizzare una soluzione contenente 0,2% Trypan blu e contare le celle utilizzando un ematocitometro.
- Diluire la sospensione cellulare dissociata in SFM integrata con 5 ng/mL EGF e 2,5 ng/mL bFGF (eGFF basso/bFGF) ad una densità di 11.300 celle/cm2 e lastra su riccioli di vetro rivestiti.
- Dopo 24 h, fissare le cellule per l'immunocitochimica contro i marcatori NSC come la regione di determinazione del sesso Y-box 2 (Sox2) e nestin, nonché con un marcatore del lignaggio neuronale (vale a dire doublecortin [DCX], per i neuroni immaturi) (vedi sezione 14).
NOTA: Sox2 è un marcatore di NSC che subiscono la mitosi. Le coppie di cellule Sox2e / z risultanti da una singola divisione cellulare progenitore riflettono l'espansione delle cellule staminali7.
5. Espansione delle cellule staminali neurali postnatali come neurosfere
- Per determinare la densità delle sospensioni delle cellule SV o DG dissociate (ottenute nella sezione 3), contare le cellule utilizzando un ematocitometro.
- Diluire la sospensione a cella singola SV e DG ad una densità di 2 x 104 celle/mL in SFM integrata con 10 ng/mL EGF e 5 ng/mL bFGF. Cellule di semi E DG in piatti Petri da 60 mm non rivestiti con un volume finale di 5 mL/Petri.
- Incubare le cellule SV e DG per 6-8 giorni e 10-12 giorni, rispettivamente per formare le neurosfere primarie, a 37 sC con 5% CO2.
NOTA: I giorni di incubazione più di quelli menzionati possono promuovere l'aggregazione delle neurosfere e livelli più elevati di morte cellulare al centro della neurosfera. - Quando la maggior parte delle neurosfere ha un diametro di 150-200 m, eseguire il passaggio della neurosfera.
NOTA: Passaging neurosspheres quando non hanno un diametro appropriato compromette tutti i prossimi passi.
6. Passaggio delle neurosfere
NOTA: Il seguente protocollo può essere applicato per espandere le neurosfere SV e DG.
- Per passare le neurosfere, raccogliere la SFM con fattori di crescita contenenti neurosfere dalle parabole di Petri da 60 mm e centrifugare per 5 min a 300 x g.
- Eliminare il supernatante e risospendere il pellet della neurosfera utilizzando un kit di dissociazione chimico (mouse) secondo le istruzioni del produttore (Tabella dei materiali).
NOTA: Osservare i tempi di incubazione esattamente come sono cruciali per le prestazioni. - Centrifuga per 5 min a 300 x g, rimuovere il supernatante e aggiungere 1 mL di SFM integrato con 10 ng/mL EGF e 5 ng/mL bFGF.
- Triturare su e giù circa 10x con una pipetta P1000 per dissociare le neurosfere.
- Contare il numero di cellule utilizzando una soluzione contenente 0.2% Trypan blu e un ematocitometro.
- Cellule reseeding ad una densità di 2 x 104 cellule / mL in piatti Petri da 60 mm non rivestiti.
- Incubare le cellule SV e DG rispettivamente per 6,8 giorni e 10-12 giorni, per ottenere neurosfere secondarie, a 37 sC con 5% di CO2.
NOTA: la capacità di auto-rinnovamento dei NSPC basati su SV e DG è accessibile seguendo le sezioni di protocollo 5 e 6. Per questo, seme sV e DG cellule ad una densità di 1,0 x 104 cellule / mL (in piastre 24-pozze di crescita) in crescita Mezzo SFM contenente 5 ng/mL EGF e 2.5 ng/mL bFGF (basso EGF/bFGF). Contare il numero di neurosfere primarie e secondarie risultanti.
7. Stoccaggio di neurosfere
- Raccogliere il mezzo contenente neurosfere (ottenuto da gradini 5.3 e 6.7) dai piatti Petri da 60 mm.
- Centrifuga per 5 min a 300 x g e scartare il supernatante.
- Lavare le cellule 2x con 1 mL di HBSS (5 min a 300 x g).
- Centrifuga per 5 min a 300 x g, scartare il supernatale e conservare il pellet delle neurosfere a -20 gradi centigradi per l'analisi della biologia molecolare.
8. Procedura di piastra di rivestimento PDL
- Per preparare la soluzione 1 (0,1 M tampone di ricambio), pesare 3,92 g di acido borico e diluire in 400 mL di acqua ad alta purezza. Regolare il pH a 8,2 e fare fino a 500 mL con acqua ad alta purezza.
- Per preparare la soluzione 2 (0,167 M tampone di ricambio), pesare 10,3 g di acido borico e diluire in 900 mL di acqua ad alta purezza. Regolare il pH a 8,2 e fare fino a 1.000 mL con acqua ad alta purezza.
- Per ricostituire la poli-D-lysine (PDL) (1 mg/mL in buffer di riapunto da 0,1 M), diluire 100 mg di PDL in 100 mL della soluzione 1.
- Fare aliquote da 10 mL da utilizzare immediatamente o congelare e conservare a -20 gradi centigradi.
- Sotto il flusso laminare, aggiungere 1 coverslip per bene e sterilizzare sotto la luce UV per 15 min.
- Utilizzare il PDL ricostituito o scongelato ricostituito PDL.
- Preparare la soluzione finale di 100 g/mL PDL in buffer di ritassio da 0,167 M aggiungendo 10 mL di PDL ricostituito a 90 mL della soluzione 2.
- Aggiungere la soluzione finale ai pozze per un minimo di 2 h per una notte a 37 gradi centigradi.
NOTA: Per piastre 24 pozzetto, aggiungere un volume di 500 l in ogni pozzo. - Rimuovere la soluzione e lavare 3x con acqua ad alta purezza.
- Lasciare asciugare i coperchi nel cofano a flusso laminare.
- Lasciare le piastre di coltura multi-bene a 4 gradi centigradi.
9. Procedura di piastrina PDL/Laminin
- Il primo giorno ricoprire le targhe con PDL come descritto nella sezione 8.
- Il giorno 2, rimuovere la soluzione PDL e lavare 3x con acqua ad alta purezza. Lasciate asciugare.
- Preparare 5 laminin a freddo SFM privo di fattori di crescita.
- Aggiungere laminina disciolta ai coperchii e incubare a 37 gradi durante la notte.
NOTA: Per piastre 24 pozzetto, aggiungere un volume di 500 l in ogni pozzo. - Rimuovere lalaminina con una pipetta.
NOTA: Non lavare i copricopertine dalla laminina. - Utilizzare immediatamente o conservare a -20 gradi centigradi.
10. Procedura di rivestimento Poly-L-ornithine (PLO) /laminin
- Sotto il flusso laminare, aggiungere un coverslip per bene e sterilizzare sotto la luce UV per 15 min.
- Aggiungere 0,01% soluzione LLO ad ogni pozzo per 20 min a temperatura ambiente (RT).
NOTA: Per piastre 24 pozzetto, aggiungere un volume di 500 l in ogni pozzo. - Rimuovere la soluzione e lavare 3x con 1x PBS sterilizzato. Lasciate asciugare.
- Preparare 5 lamin in lamin in sterile 1x PBS.
- Incubare per 2 h a 37 .
- Rimuovere laminina.
NOTA: Non lavare i copricopertine dalla laminina. - Utilizzare immediatamente.
NOTA: Assicurarsi che il coperchio sia completamente coperto dalla soluzione PLO toccando delicatamente il coperchio con una punta di pipetta. Quando scosse, le piastre multi-bene non dovrebbero emettere alcun suono.
11. Valutazione della neuritogenesi generando un monostrato differenziato di cellule
- Raccogliere i supporti contenenti neurosfere da 60 mm piatti Petri (ottenuti dalla sezione 5) e centrifugare per 5 min a 300 x g a RT.
- Scartare il supernatante e dissociare il pellet delle neurosfere in 1 mL di PBS di dissociazione (cioè, PBS senza Mg2/ Ca2 e con EDTA [2,7 mM KCl, 1,5 mM KH2PO4, 137 mM NaCl, 8,1 mM Na2HPO4 e 0,5 mM EDTA 4Na, a pH 7,40]) incubando per 15 min seguito da dissociazione meccanica. In alternativa, dissociare le neurosfere utilizzando un kit di dissociazione chimica (mouse) (Tabella dei materiali).
- Centrifuga per 5 min a 300 x g a RT e scartare il supernatante.
- Risospendere il pellet cellulare in 1 mL di SFM privo di fattori di crescita.
- Determinare la densità cellulare utilizzando un ematocitometro.
- Diluire la sospensione cellulare dissociata in SFM priva di fattori di crescita ad una densità di 3.766 cellule /cm2 e le cellule della piastra su coperture in vetro rivestito in piastre di 24 pozzetti.
- Dopo 1/3 giorni, fissa le cellule per l'immunocitochimica contro una proteina del citoscheletro (vedi sezione 14).
12. Differenziazione delle culture della neurosfera
NOTA: Le neurosfere ottenute dall'espansione cellulare, da neurosfere primarie o di passaggio (ottenute nelle sezioni 5 o 6) possono essere differenziate in cellule da diverse linee neurali.
- Quando le neurosfere hanno un diametro di 150-200 m, raccogliere 25 L di mezzo sospensione della neurosfera e piastra su coperture in vetro rivestito, in 24 piani.
NOTA: Per raccogliere più neurosfere, ruotare delicatamente il piatto Petri per concentrare le neurosfere al centro. Poi, pipetta dal centro. - Mettere le piastre in un'incubatrice a 37 gradi centigradi per 15 min in modo che le neurosfere aderiscano al substrato. Successivamente, aggiungere 500 l di SFM privo di fattori di crescita (condizioni differenziative).
- Dopo 24 h, sostituire il mezzo con SFM fresco privo di fattori di crescita.
- Differenziare per diversi punti temporali (ad es. 2 e 7 giorni in vitro, rispettivamente DIV2 e DIV7) con 5% di CO2 e 95% aria atmosferica a 37 gradi centigradi.
NOTA: La sopravvivenza cellulare, la proliferazione e la differenziazione possono essere analizzate utilizzando diversi saggi cellulari.
13. Saggi di biologia cellulare
- Analisi della sopravvivenza cellulare
- Esporre le neurosfere placcate a 3 g/mL di ioduro propidio (PI) per 30 min prima della fissazione cellulare nell'incubatrice a 37 gradi centigradi.
NOTA: PI è un agente autofluorescente che è solo in grado di entrare cellule con integrità della membrana compromessa8. Altri metodi per analizzare la sopravvivenza delle cellule possono essere utilizzati come la colorazione caspase 3 o il saggio TUNEL (deoxynucleotidyl transferase dUTP) del deoxynucleotidyl.
- Esporre le neurosfere placcate a 3 g/mL di ioduro propidio (PI) per 30 min prima della fissazione cellulare nell'incubatrice a 37 gradi centigradi.
- Saggio di proliferazione cellulare
- Esporre le neurosfere placcate a 10 -M 5-bromo-2'-deossiuridina (BrdYuridina) per 4 h prima della fissazione nell'incubatrice a 37 gradi centigradi.
NOTA: BrdU è un analogo timinoso sintetico che può essere incorporato durante la sintesi del DNA nelle cellule che proliferano9.
- Esporre le neurosfere placcate a 10 -M 5-bromo-2'-deossiuridina (BrdYuridina) per 4 h prima della fissazione nell'incubatrice a 37 gradi centigradi.
- Saggio di differenziazione cellulare
- Esporre le neurosfere placcate di 7 giorni a 10 m di BrdU nelle prime 24 h, nell'incubatrice a 37 gradi centigradi.
- Rinnovare il SFM privo di fattori di crescita (condizioni differenziative) e consentire alle cellule di svilupparsi in assenza di BrdU per i successivi 6 giorni fino alla fissazione.
NOTA: Questi esperimenti di inseguimento del polso, mediante la co-etichettatura con marcatori di cellule neurali mature, consentono la valutazione delle cellule progenitrici che si differenziano in cellule mature durante il protocollo.
14. Immunostaining delle culture della neurosfera
- Fissazione delle celle
- Preparare il 4% di paraformaldeide (PFA) in 1x PBS e conservarlo a 4 o -20 gradi centigradi.
- Togliere la SFM priva di fattori di crescita dai pozze e aggiungere, ad ogni pozzo, 500 -L di 4% PFA a 4 gradi centigradi per 20 min a RT.
- Lavare 3x con 1x PBS, per 5 min ogni volta, i coprilabbra contenenti neurosfere differenziate.
- Conservare i coprilabbra fino all'uso in 500 - L di 1x PBS a 4 gradi centigradi.
NOTA: se l'esperimento non dispone di BrdU, andare al passaggio 14.3.
- Metodo di denaturazione (solo per esperimenti BrdU)
- Preparare 1 M HCl a 37 gradi centigradi.
- Risciacquare le coverlips 3x in 1x PBS.
- Permeabilizzare le celle per 30 min in PBS contenenti 1% di sovraffattore nonionico (ad esempio, Triton X-100).
- Denatura dsDNA con 1 M HCl preriscaldato a 37 gradi centigradi per 30-40 min a 37 gradi centigradi.
- Lavare i pozzi 4x con 1x PBS.
- Permeabilizzazione e blocco
- Risciacquare i coperchi in 1x PBS per 5 min.
- Incubare per 1,5 h con 0,5% di surfactant nonionico e 3% di albumina di siero bovino (BSA) in 1x PBS (300 dollari l/po).
NOTA: per NeuN, utilizzare 6% BSA in 1x PBS.
- Incubazione e montaggio
- Il primo giorno, senza lavaggio, incubare le cellule con anticorpi primari (Tabella dei Materiali) in un surfactant nonionico dello 0,1% e nello 0,3% di BSA in 1x PBS nella camera di incubazione (per le lastre di 24 pozze consumo di 20 l/well). Lasciare le coverlips incubazione durante la notte a 4 gradi centigradi se gli anticorpi sono coniugati a un fluoroforo.
- Il giorno 2, riportare i coperchi ai rispettivi pozzi e risciacquare 3x in 1x PBS per 5 min.
- Controstain con afluorescenza appropriata coniugato anticorpi secondari (diluizione 1:200) e con 12 g/mL Hoechst 33342 in 1x PBS per 2 h a RT e luce protetta nella camera di incubazione (20 l/coverslip).
- Lavare i coperchi 3x in 1x PBS per 5 min.
- Montare i copricapi su vetrini al microscopio utilizzando 5 litri di mezzo di montaggio a fluorescenza.
- Lasciare che i coperchi all'aria si asciughino a RT, protetto dalla luce, per 1 giorno.
- Microscopia
- Visualizzare e acquisire immagini utilizzando un microscopio a fluorescenza.
- Per ogni condizione, utilizzare tre repliche. Esegui il conteggio delle cellule in cinque campi microscopici indipendenti in ogni vetrino con un obiettivo 40x (100 celle per campo).
15. Preparazione delle soluzioni azionarie EGF e bFGF
- Soluzione stock EGF
- Per ricostituire l'EGF liofilizzato, diluire il prodotto in acqua ad alta purezza per raggiungere una concentrazione finale di 20 g/mL.
- Aliquota e conservare in microtubi a -5 a -20 gradi centigradi.
- bFGF soluzione stock
NOTA: bFGF deve essere ricostituito con una soluzione di 10 mM Tris, pH 7.6.- Centrifugare brevemente la fiala prima di aprirsi per portare il contenuto sul fondo.
- Preparare 50 mL di 10 mM Tris, pH 7.6. Per questo, pesare 60.57 mg di Tris ((HOCH2)3CNH2) e diluirlo in 40 mL di acqua ad alta purezza. Regolare il pH a 7,6 e fare fino a 50 mL con acqua ad alta purezza.
- Preparare 10 mL di 0,1% BSA in 10 mM Tris, pH 7.6. Per questo, pesare 10 mg di BSA e diluirlo in 10 mL di 10 mM Tris.
- Soluzioni di filtro preparate nei passaggi 15.2.2 e 15.2.3 con un filtro di 0,22 m sotto un cappuccio a flusso laminare.
- Ricostituire 10 g di bFGF in 1.000 .L di 0,1% DI BSA in 10 mM Tris con pH 7,6 per raggiungere una concentrazione finale di 10 g/mL. Aliquota in microtubi a -20 gradi centigradi per un massimo di 6 mesi.
Risultati
Le neurosfere SV z e DG, ottenute utilizzando la NSA, sono composte da cellule indifferenziate, positive per Sox2, un fattore di trascrizione coinvolto nella capacità di auto-rinnovamento e positivo per la nestina, una proteina di filamento intermedio espressa negli NSPC (Figura 1A). Inoltre, le neurosfere derivate da SV hanno dimensioni maggiori rispetto alle loro controparti della DG (Figura 1A). È importante sottolineare che, in condizioni differenzianti, gli NSPC derivati dalla SV e dalla DG migrano dalle neurosfere formando uno pseudomonostrato di cellule (Figura 1B).
Per accedere alla capacità di auto-rinnovamento, il saggio della coppia di cellule viene eseguito in base all'espressione di Sox2 e nestin che tende a scomparire nelle cellule di divisione che iniziano il processo di differenziazione con una combinazione di un marcatore del lignaggio neuronale vale a dire, DCX. In entrambe le regioni neurogeniche, è possibile osservare la presenza di Sox2 s//nestin/DCX-// divisioni simmetriche (auto-rinnovamento) (Figura 2A1,B1), Sox2-//nestin-/Divisioniasimmetriche DCX(Figura 2A1,B2) e Sox2-/-/nestin-/-/DCX /DCX//z divisioni simmetriche (differenziazione) ( Figura2A2,B1).+/+
Passare le neurosfere aumenta la resa degli NSPC; tuttavia, la morte cellulare a DIV2 cambia con il passaggio. Infatti, la percentuale di cellule PI-positive è aumentata con il passaggio cellulare in SV s (P0: 15,6% - 1,2% vs P1: 19,2% - 2,7% vs P2: 32,35% - 0,14% vs P3: 39,6% - 4,0%) e in DG (P0: 16,31% - 0,95% vs P1: 32,1% - 1,7% vs P2: 27,42% vs P3: 32,2% - 3,1%) (Figura 3).
La neuritogenesi può essere valutata nei neuroni ottenuti dalla differenziazione di SV e DG NSPC all'inizio della differenziazione: DIV1 (Figura 4A,D), DIV2 (Figura 4B,E) e DIV3 (Figura 4C,F). Infatti, come osservato nella Figura 4, la lunghezza e la ramificazione dei neuriti aumenta con la differenziazione.
La proliferazione cellulare può essere valutata nelle neurosfere derivate da SV e DG. Confrontando le neurosfere differenziate primarie a DIV1 da SV (Figura 5A1) e DG (Figura 5A2), la percentuale di celle BrdU-positive è superiore in SV , rispetto alla DG (SV: 6.15% : 0.64% vs DG: 3.27% : 0.13%; p < 0.05; Figura 5A3). Inoltre, la differenziazione cellulare è accessibile anche combinando la colorazione BrdU con un produttore maturo come i nuclei neuronali (NeuN) che identifica i neuroni maturi (Figura 5B1,B2). La figura 5B3 mostra che la percentuale di progenitori che proliferano che si differenziano in neuroni maturi è simile in SV e DG (SV: 12,04% - 1,58% vs DG: 13,56% - 0,48%; p > 0,05; n - 4).
È possibile accedere alla stesità e alla multipotenza degli NSPC derivati da SV e DG utilizzando l'NSA valutando l'espressione di diversi marcatori in diversi giorni di differenziazione (DIV2 e DIV7). Infatti, le NSC (geneina- e lealfia fibrillaria delle cellule [GFAP]-cellule doppio-positive) sono presenti in entrambe le regioni neurogeniche (Figura 6A,G). Queste cellule sono in grado di differenziarsi in neuroni immaturi (cellule dcX-positive) (Figura 6B,H), neuroni maturi (cellule neutre positive) (Figura 6F,L), cellule precursori oligodendrociti (antigene neurone-gliale 2 [NG2] e recettore del fattore di crescita derivato dalle piastrine (NG2] e recettore del fattore di crescita derivato dalle piastrine [cellule positive della PDGF) ((Figura 6C,I), oligodendrociti maturi (proteina di base della mielina [cellule mbP]-positive) (Figura 6E,K) e astrociti (cellule GFAP-positive) (Figura 6D,J).
Diversi substrati possono essere utilizzati per rivestirei per formare lo pseudomonostrato di cellule in condizioni differenzianti. Come mostrato nella Figura supplementare 1, le celle DG migrano di più quando i coperchi sono extra-rivestimenti con laminina combinato con PLO o PDL che con PDL da solo (Figura supplementare 1B -H). Infatti, quando PDL e laminina vengono utilizzati insieme come substrati (Figura supplementare 1C,G), le cellule DG formano uno pseudomonostrato più confluente rispetto alle cellule SV , per le quali il PDL viene utilizzato da solo (Figura supplementare 1A,E).
È importante sottolineare che questi risultati dimostrano il potenziale della NSA per valutare le proprietà di stelo e multipotenza delle NSC derivate dalle due principali nicchie neurogeniche.
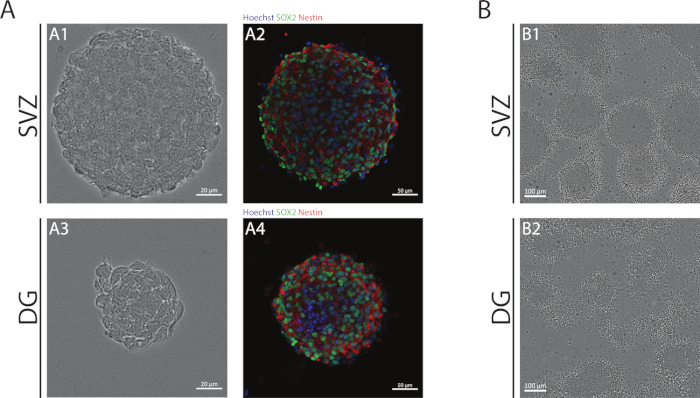
Figura 1: zona subventricolare e giro dentato derivato NSPC coltivato come neurosfere o come pseudomonostrati. (A) Immagini rappresentative del campo luminoso (A1,A3) e della fluorescenza(A2,A4)delle neurosfere derivate dalla SV e dalla DG, dove i nuclei sono stati macchiati con Hoechst 33342 (blu) e NSC per Sox2 (verde) e nestin (rosso). (B) Immagini rappresentative del campo luminoso di pseudomonostrati generati dalle neurosfere derivate da SV e DG in condizioni differenzianti. Fare clic qui per visualizzare una versione più grande di questa figura.
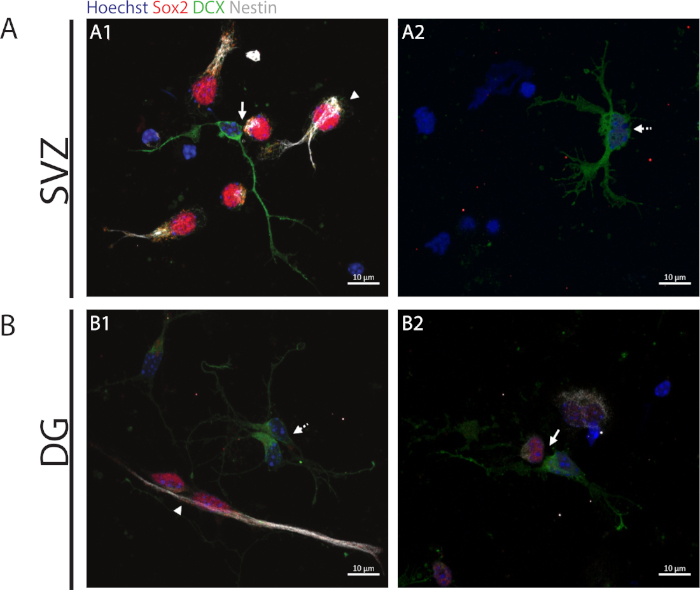
Figura 2: Il saggio della coppia di celle. Immagini di fluorescenza rappresentative di coppie di cellule derivate da una divisione cellulare progenitrice. I nuclei della SV e della DG sono stati macchiati con Hoechst 33342 (blu), cellule staminali per Sox2 (rosso) e ninestina (bianco) e neuroni immaturi con DCX (verde). Le punte delle frecce nei pannelli A1 e B1+/+indicano Le divisioni di auto-rinnovamentosimmetriche Sox2le frecce nei pannelli A1 e B2 indicano Sox2-/-/nestin//DCX-/z, le frecce tratteggiate nei pannelli A2 e+/+ B1 mostrano Le divisioni di differenziazione simmetrica Sox2-/-/nestin-/-/DCX/ Fare clic qui per visualizzare una versione più grande di questa figura.
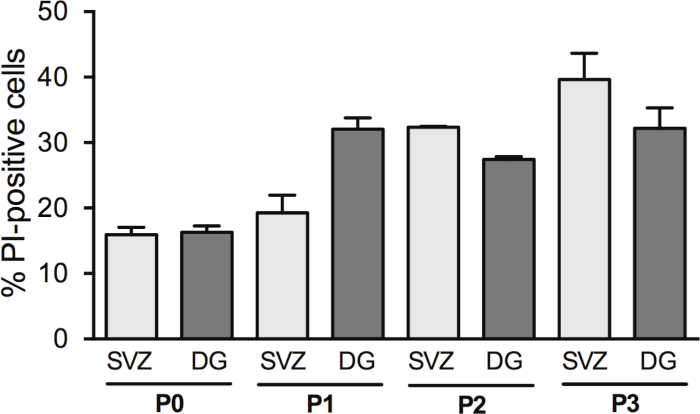
Figura 3: Analisi della sopravvivenza delle cellule con passaggio cellulare. Analisi quantitativa delle cellule PI-positive a DIV2 nella coltura della neurosfera differenziata SV e DG, dopo 0, 1, 2 e 3 passaggi (P0-P3). I dati sono espressi come media : SEM, n . PI - iodio propidio. Fare clic qui per visualizzare una versione più grande di questa figura.
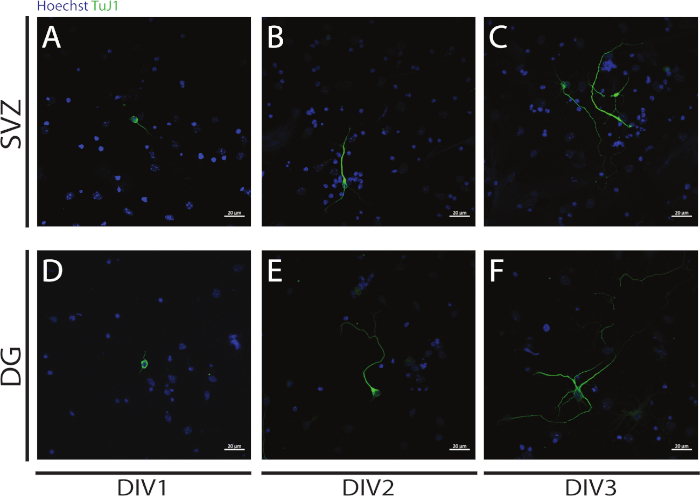
Figura 4: Analisi della neuritogenesi al DIV 1, 2 e 3. Rappresentativo delle immagini confocali a fluorescenza dei neuriti, identificate dal segnale di tubulina di ZIIII, nei neuroni SV e DG a (A,D) DIV1, (B,E) DIV2 e(C,F)DIV3. Fare clic qui per visualizzare una versione più grande di questa figura.
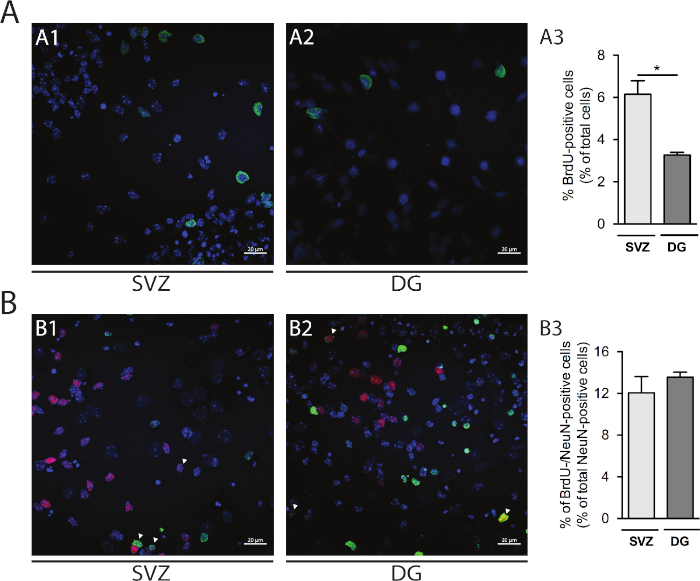
Figura 5: Saggio di proliferazione cellulare. Rappresentativo immagini confocali di cellule BrdU-positive a DIV1 in (A1) SV e (A2) DG. (A3) Analisi quantitativa delle cellule brdU-positive a DIV1 nella coltura della neurosfera differenziata derivata dalla DG e dalla SV. I dati sono espressi come media : SEM, n e 4. < 0,05 per t-test. Immagini rappresentative di fluorescenza di cellule BRDU e NeuN-positive a DIV7 in (B1) SV e (B2) DG. Le punte a freccia indicano le cellule BrdU-/NeuN-positive. (B3) Analisi quantitativa delle cellule BrdU-/NeuN-positive a DIV7 in entrambe le nicchie. I dati sono espressi come media : SEM, n e 4. BrdU: 5-bromo-2'-deoxyuridina, analogico sintetico di timinane. Fare clic qui per visualizzare una versione più grande di questa figura.
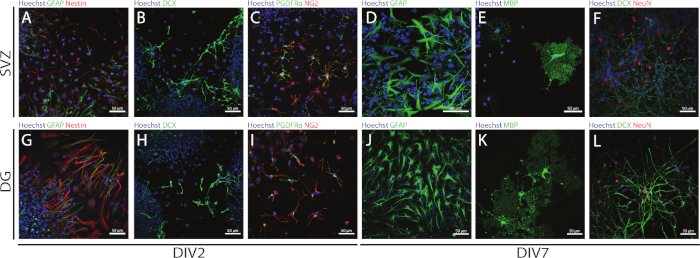
Figura 6: Tipi di cellule neurali presenti nella coltura della neurosfera differenziata sV e DG. Immagini di fluorescenza rappresentativa dei tipi di cellule derivate da SV e DG dopo 2 e 7 giorni di differenziazione della neurosfera (DIV2 e DIV7), dove i nuclei cellulari sono stati macchiati con Hoechst 33342 (blu) e: (A,G) NSC per GFAP (verde) e nestin (rosso), (Neurone B,H) immaturo per gli astrociti DCX (verde), (C,I) oligodendrociti per gli astrociti PDGFR ( verde) e NG2 (rosso), (D,J) per GFAP (verde), (E,K) oligodendrociti maturano per MBP (verde) e (F,L) i neuroni maturi per NeuN (rosso). Fare clic qui per visualizzare una versione più grande di questa figura.
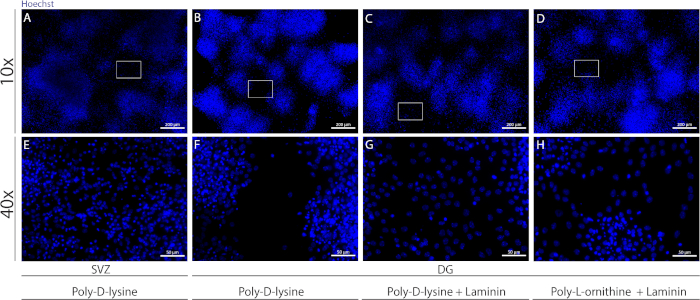
Figura supplementare Figura 1: Test di diversi substrati per l'aderenza alla neurosfera e la migrazione per formare uno pseudomonostrato. Immagini a fluorescenza rappresentativa di pseudomonolayer derivato da(A,E)con poli-D-lysina come substrato, (B,F) pseudomonolayer derivato dalla DG utilizzando la polid-lysina come substrato, (C,G) pseudomonostrato derivato dalla DG utilizzando la polid-lysina con lamina come substrato e ( Pseudomonostrato derivato daD,H)utilizzando la poli-D-lisina con poli-L-ornichea come substrato. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
I sistemi in vitro degli NSPC consentono una migliore comprensione dei meccanismi cellulari e molecolari, che possono essere ulteriormente convalidati in vivo. La NSA è un metodo molto potente per imitare le condizioni fisiologiche a causa della loro struttura tridimensionale. Inoltre, questo sistema di coltura è anche tecnicamente più facile da coltura10, rispetto ad altri sistemi in vitro come il sistema di coltura monostrato. Infatti, con la NSA, è facile controllare i segnali estrinseci esposti durante lo sviluppo cellulare, sia durante lo sviluppo della cellula, sia durante l'espansione che la fase di differenziazione, aggiungendo quantità precise e variabili di fattori di interesse ai media e coltivando le neurosfere con altri tipi di cellule6. Inoltre, rispetto alle colture monostratori, nella NSA, è possibile ottenere una maggiore densità cellulare da una piccola quantità di tessuto o con un piccolo numero di cellule, consentendo di eseguire studi paralleli, riducendo così il numero di animali1.
L'NSA è il metodo più comune per isolare ed espandere le NSC11,12,13, può essere utilizzato per stimare il numero di cellule precursori presenti in un dato campione di tessuto5 e la frequenza cellulare precursore tra diverse condizioni. Tuttavia, sia le neurosfere che le culture monostrato non tengono conto delle nNC di quiescenza14. Inoltre, la NSA ha alcune limitazioni11,12,13 e la frequenza della neurosfera risultante dipende da molti fattori tra cui i componenti medi, la procedura di dissezione, il processo di dissociazione11,12,13e l'aggregazione della neurosfera5. Infatti, in una coltura ad alta densità, le neurosfere tendono ad aggregarsi. Di conseguenza, è necessario prestare attenzione quando si stima il numero di cellule precursori in un campione. Per superare i limiti di cui sopra, i NSPC isolati possono anche essere espansi e passaggiin un monostrato5,,15. È importante sottolineare che l'utilizzo di NSA per confrontare la frequenza delle cellule precursori tra condizioni diverse è molto utile e accurato perché tutte queste limitazioni sono implicite e simili tra tutte le condizioni eseguite nello stesso esperimento.
Ci sono passi critici nella cultura della neurosfera che richiedono attenzione. Nella fase di raccolta del cervello, la rimozione completa delle meningi e un buon isolamento delle nicchie neurogeniche sono essenziali per massimizzare la purezza e la resa degli NSPC. Durante la dissociazione dei tessuti, a causa dell'attività proteolitica della trippsina, l'uso eccessivo di trippsina o tempi di incubazione più lunghi possono portare alla lisi cellulare. Inoltre, il giorno del passaggio è fondamentale per ottenere una popolazione sana di neurosfere. Superare le neurosfere con un diametro superiore a 200 m influisce notevolmente sulla vitalità, sulla capacità proliferazione e differenziante6degli NSPC. Inoltre, il rivestimento con PDL e PLD/laminin, rispettivamente, per le cellule SV e DG, è essenziale per garantire una buona migrazione cellulare dalle neurosfere senza compromettere il processo di differenziazione. In termini di analisi dell'immunocitochimica, tempi di incubazione più lunghi con PFA possono compromettere la colorazione mascherando gli antigeni e aumentando lo sfondo.
La NSA è un potente strumento per fornire una fonte coerente e illimitata di NSPC per studi in vitro di sviluppo neurale e differenziazione, nonché per scopi terapeutici16,17. Infatti, questo test può essere applicato a modelli genetici e comportamentali per comprendere ulteriormente i meccanismi molecolari e cellulari coinvolti nella proliferazione e differenziazione della NSPC18,19. Questo test è utile anche per testare diversi farmaci e composti20,21,22 così come per eseguire manipolazioni genetiche19,23 per modulare le proprietà NSC. Oltre all'immunocitochimica, la reazione a catena della polimerasi della trascrizione inversa e l'analisi delle macchie occidentali possono essere eseguite per accedere all'espressione dell'RNA e delle proteine, mentre gli studi elettrofisiologici e l'imaging del calcio possono essere utilizzati per valutare la funzione dei neuroni appena nati21.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da IF/01227/2015 e UID/BIM/50005/2019, projeto financiado pelao para a Ciància e a (FCT)/ Ministério da Ciància, e Ensino Superior (MCTES) atés de Fundos do orà di Estado. R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018) e R.S.R. (SFRH/BD/129710/2017) hanno ricevuto una borsa di studio FCT. Gli autori desiderano ringraziare i membri della struttura di bioimaging dell'Instituto de Medicina Molecular Joào Lobo Antunes per l'assistenza alla microscopia.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Riferimenti
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393(2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225(2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529(2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457(2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639(2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161(2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978(2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516(2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin? Frontiers in Cellular Neuroscience. 8, 59(2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962(2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon