Method Article
Изоляция и расширение нейросфер от постнатальных (P1'3) Мыши нейрогенных ниш
В этой статье
Резюме
В этой статье мы подробно описываем протокол для генерации нейросферных культур из послеродовых нейронных стволовых клеток мыши, полученных из основных нейрогенных ниш мыши. Нейросферы используются для выявления нервных стволовых клеток из ткани мозга, что позволяет оценить числа клеток-предшественников. Кроме того, эти 3D структуры могут быть покрыты в дифференцированных условиях, что приводит к нейронов, олигодендроцитов и астроцитов, что позволяет изучать судьбу клеток.
Аннотация
Анализ нейросферы является чрезвычайно полезным методом in vitro для изучения присущих нейронных стволовых/клеток-прародителей (NSPCs), включая пролиферацию, самообновление и многофункциональность. В послеродовом и взрослом мозге, NSPCs в основном присутствуют в двух нейрогенных нишах: субвентрикулярной зоне (СВЗ), выстилающих боковые желудочки и субгранулулярной зоне гиппокампальной зубной извилины (DG). Изоляция нейрогенных ниш от послеродового мозга позволяет получить большее количество NSPCs в культуре с последующим преимуществом более высоких урожаев. Тесный контакт между клетками в каждой нейросфере создает микросреду, которая может напоминать нейрогенные ниши. Здесь мы подробно описываем, как генерировать нейросферные культуры, полученные из св.З. и DG, у мышей от 1–3 дней (P1'3), а также прохожее для расширения нейросферы. Это выгодный подход, так как нейросферный ассеид позволяет быстрое поколение клонов NSPC (6–12 дней) и способствует значительному сокращению числа животных. Путем покрыть neurospheres в дифференцированных условиях, мы можем получить pseudomonolayer клеток составленных NSPCs и дифференцированных клеток по-разному нейронов, астроцитов и oligodendrocytes) позволяющ изучение действий внутренне или натронзительных факторов на пролиферации NSPC, дифференциации, выживании клетки и neuritogenesis.
Введение
Нейросферный асси (NSA) был впервые описан в 1992году 1,2 и до сих пор остается уникальным и мощным инструментом в нейронных стволовых клеток (NSC) исследования. Изоляция НСК от основных нейрогенных регионов имеет сложные проблемы, потому что требования для поддержания этих клеток в физиологических условиях остаются плохо изучены. В АНБ клетки культивируются в химически определяемой среде без сыворотки с наличием факторов роста, включая эпидермальный фактор роста (EGF) и основной фактор роста фибробластов (bFGF)1,2,3. Нейронные клетки-предшественники (стволовые и прародители) выбираются с помощью этих митогенов, так как эти клетки EGF и FGF-ответный ввода период активной пролиферации в то время как другие клетки, а именно дифференцированные клетки, умирают4. Нейронные клетки-предшественники растут как нейросферы, которые затем могут быть переданы для дальнейшего расширения пула этих клеток5. Важно, так как эти нервные стволовые клетки-прародители (NSPCs) являются мультипотентными они способны дифференцироваться в три основных типа клеток центральной нервной системы (ЦНС): нейроны, олигодендроциты и астроциты5.
АНБ является возобновляемым источником недифференцированных прекурсоров ЦНС, которые могут быть использованы для изучения нескольких процессов, включая распространение И самообновление НСК, а также нейрональную и глиальную дифференциацию, как в физиологическом, так и в контексте болезней. Кроме того, исследования in vitro могут быть использованы для оценки степени внутренней спецификации, присутствующей в нервных предшественниках во время развития, а также для изучения всего потенциала клеток, путем удаления выхнанных сигналов, связанных с их нормальной окружающей средой6. Нейросферная модель ценна для оценки предположенных регуляторов, так как путем поддержания клеток в среде, лишенной сыворотки, экологические сигналы предоставляются только окружающими клетками6. Кроме того, в АНБ, NSPCs легко расширяется в культуре, плотность клеток на площадь высока и неоднородный состав нейросфер имеет некоторое сходство с in vivo ниши6. Эти хорошо зарекомендовавшие себя преимущества являются причиной, почему эта методология широко используется многими исследователями.
В следующем протоколе подробно описаны все процессы от изоляции послеродовой популяции НСПК от двух основных нейрогенных регионов, субвентрикулярной зоны (СВЗ) и гиппокампа зубчатой извилины (ДГ), до расширения этих клеток как нейросфер, а также дифференциации на нейроны, астроциты и олигодендроциты. Наконец, различные анализы также описаны для доступа к стержне и свойствам мультипотency SV- и DG-производных NSPCs.
протокол
Все эксперименты проводились в соответствии с законодательством Европейского сообщества (86/609/EEC; 2010/63/EU; 2012/707/EU) и португальским (DL 113/2013) для защиты животных, используемых в научных целях. Протокол был одобрен "институциональным органом по защите животных МММ - ОРБЕА-ИММ и Национальным компетентным органом - DGAV (Direc'o Geral de Alimenta'o e Veterin'ria) ".
1. Базовая установка и подготовка среды культуры
- В день вскрытия, подготовить соответствующее количество роста среды, соответствующей сыворотки свободной среды (SFM) состоит из Dulbecco в модифицированных орлов среды (DMEM) / F12 с L-глютамина (Таблица материалов) дополнен100 U/mL пенициллин и 100 г /мL streptomycin (пен/стрептоцин, 17, B, 17 с также 10 нг /мл EGF и 5 нг/мл bFGF. Разогрейте культуру среды до 37 градусов по Цельсию в водяной бане.
ПРИМЕЧАНИЕ: Объем среды роста зависит от количества щенков, для 5 щенков готовят 100 мл (50 мл для СВз и 50 мл для DG); однако после подсчета количества ячеек (шаг 5.1) точный объем необходимо будет скорректировать. - Для микродиссекции SV и DG, подготовить кальция и магния свободного Хэнкса сбалансированного солевая раствор (HBSS) вскрытие среды дополнены 100 U/mL перо / стрептококк.
ПРИМЕЧАНИЕ: Подготовьте 50-100 мл среды вскрытия. - Настройте микроскоп по рассечению и подготовьте инструменты, необходимые для удаления мозга (ножницы и маленькие шпательные) и для микрорассежей СВз и ДГ (маленькие ножницы Dumont, #7 щипцы, #5 щипцы, #5S щипцы) замачивания в 70% этанола.
2. Сбор послеродового (P1-3) мозга мыши и sV /DG микродиссекций
- Приготовьте 60 мм посуду Петри (площадь роста 21 см2)с HBSS, дополненной ручкой/стрептом и 2 пробными трубками (один для СВз и один для ГД) с 500 л дополненного HBSS каждый.
- Эвтаназия мышей щенки (P1'3) в соответствии с протоколом, утвержденным институционального ухода за животными объекта / руководящих принципов. Выполните обезглавливание с одним разрезом с острыми ножницами у основания ствола мозга.
- Удерживая вентральную часть тела у основания головы и используя небольшие остроконечные ножницы, сделайте разрез средней линии кожи по всей длине головы, тем самым показывая поверхность черепа.
- Сделайте продольное разрез у основания черепа и продолжайте резать вдоль сагитального шва с помощью небольших ножниц с неглубоким углом, чтобы избежать повреждения структур мозга.
- Очистите череп в стороны с помощью изогнутых щипц и разоблачить мозг.
ВНИМАНИЕ: Убедитесь, что рассекающие инструменты свободны от этанола, прежде чем прикасаться к мозгу. - Изолировать мозг от черепа с помощью небольшого шпателя, скользя под основанием мозга, чтобы сократить черепные нервы и кровеносные сосуды, которые подключены к основанию мозга, и передать мозг в чашку Петри, содержащую холодный дополненный раствор HBSS.
- Поместите чашку Петри, содержащую мозг, под рассекающим микроскопом при низком увеличении и поместите мозг на его андреевую поверхность.
- Используя тонкие щипцы, удалить одра со брюшной стороны мозга и обонятельные луковицы, удерживая мозг в положении мозжечка. Поверните мозг на брюшной аспект и снимите остальные оранжереи.
ПРИМЕЧАНИЕ: Удаление дозалических олова является важным шагом для обеспечения правильной нарезки мозга. - Откажитесь от мозжечка сделать разрез с помощью щипцов. Поместите фильтровальную бумагу размером 11 мкм на тканевый измельчитель(Таблица материалов)и установите мозг на фильтровальную бумагу с помощью изогнутых щипц. Нарезать мозг на 450 мкм корональных секций и использовать влажный ламина для сбора разделенных мозга в новое блюдо Петри заполнены холодной дополненной HBSS.
- Чтобы вскрыть SV, используйте щипцы, чтобы отделить корональные ломтики в передней до задней моды до достижения ломтики с боковыми желудочками, под рассекающим микроскопом.
- Вырезать тонкий слой ткани, окружающей боковую стенку желудочков (что соответствует SV) с тонкими щипками, за исключением стриатал паренхимы и корпус мозоли. Изолировать SV, разместив кончик щипцы в боковых углах бокового желудочка: один непосредственно под корпусом мозоли, а другой в ткани непосредственно прилегающих к брюшной области бокового желудочка. Затем вырежьте небольшую линию ткани, окружающую боковой желудочек.
- Соберите расчлененные ткани в образец трубки с дополнением раствором HBSS, ранее идентифицированным как SV.
ПРИМЕЧАНИЕ: Исключить SV в ломтиках, где как боковые желудочки и формирования гиппокампа начинают появляться. - Пройдите через все ломтики после микродиссекции SV' в передней к задней моды и достичь формирования гиппокампа. Использование щиптем отказаться от первого ломтика с гиппокампа, где ГД до сих пор неузнаваемым.
- Чтобы удалить DG, сначала изолировать гиппокампа от ломтиков. Перефокусируйте микроскоп, чтобы визуализировать границы вокруг DG.
- Вскрыть часть DG, выполняя разрез между DG и CA1 региона следуют вертикальные разреза между DG и CA3 региона с помощью щипки. Удалите фимбрию и любые смежные ткани.
ПРИМЕЧАНИЕ: В P1-3 животных, DG почти неотличимы от рога Аммона, но отображает небольшой наконечник. - Соберите расчлененные ткани в образец трубки, содержащей дополнительные решения HBSS, ранее идентифицированные как DG.
ПРИМЕЧАНИЕ: Общая травма гиппокампа или прилегающей территории сделает его более трудным для изоляции ГД. Использование атласа послеродового мозга мыши имеет важное значение, когда пользователь не знаком с изоляцией ткани SV и DG от корональных секций.
3. Диссоциация тканей
- Чтобы разъединить ткани SV и DG, присутствующие в их соответствующих трубках, добавьте трипсин-EDTA 0,05%, чтобы иметь окончательную концентрацию 5-10% трипсина-ЭДТА 0,05% в HBSS. Инкубировать в течение примерно 15 мин при 37 градусах Цельсия, пока ткань не слипется вместе.
- Вымойте ткань из трипсина, удалив средства массовой информации и добавив 1 мл нового HBSS дополненного раствора в течение 4 раз подряд.
- Удалить HBSS и resuspend переваренной ткани в 1 мл SFM дополнены 10 нг / мл EGF и 5 нг /мл bFGF. Механически разъединяйте гранулы, аккуратно прокладывая вверх и вниз примерно в 7–10раз с помощью пипетки P1000, пока не получитодно однородное клеточное решение.
ВНИМАНИЕ: Чрезмерная механическая диссоциация может привести к увеличению клеточной смертности и негативно скажется на последующем росте клеток.
4. Cell-пара анализ для изучения судьбы клеток
- До начала эксперимента подготовьте покрытые 24-колодствуйные пластины для адептовых монослойных культур по разделам 8-10.
- Для подсчета количества sV или DG-клеток (полученных в разделе 3) для покрывало, используйте раствор, содержащий 0,2% Трипан синий и рассчитывать клетки с помощью гематоцитометра.
- Разбавить разобщенную клеточную суспензию в SFM, дополненную 5 нг/мл EGF и 2,5 нг/мл bFGF (низкий EGF/bFGF) при плотности 11300 клеток/см2 и пластины их на покрытых стеклянными крышками.
- После 24 ч, исправить клетки для иммуноцитохимии против NSC маркеров, таких как пол определения области Y-box 2 (Sox2) и nestin, а также с маркером нейрональной линии (а именно двойной кортохин »DCX), для незрелых нейронов) (см. раздел 14).
ПРИМЕЧАНИЕ: Sox2 является маркером NSCs, которые проходят митоз. Sox2q /) клеточные пары в результате одного деления клеток-прародителей отражает расширение стволовых клеток7.
5. Расширение послеродовых нервных стволовых клеток как нейросфер
- Чтобы определить плотность разъединенных СВЗ или DG-клеточной подвески (полученной в разделе 3), подсчитайте клетки с помощью гематоцитометра.
- Разбавленная суспензия СВз и ДГ с плотностью 2 х 104 ячеек/мл в SFM дополнена 10 нг/мл EGF и 5 нг/мл bFGF. Семенные клетки СВЗ и DG в непокрытом 60 мм чашках Петри с конечным объемом 5 мл/петри блюдо.
- Инкубировать SV и DG-клетки в течение 6-8 дней и 10-12 дней, соответственно, для формирования первичных нейросфер, при 37 градусах Цельсия с 5% CO2.
ПРИМЕЧАНИЕ: Инкубационные дни больше, чем упомянутые могут способствовать агрегации нейросфер и более высоких уровней клеточной смерти в центре нейросферы. - Когда большинство нейросфер имеют диаметр 150–200 мкм, выполняйте прохождение нейросферы.
ПРИМЕЧАНИЕ: Проходя нейросферы, когда они не имеют соответствующего диаметра компромиссов все следующие шаги.
6. Пропуск нейросфер
ПРИМЕЧАНИЕ: Следующий протокол может быть применен для расширения как СВз, так и DG нейросферы.
- Для прохождения нейросфер, собирать SFM с факторами роста, содержащими нейросферы из 60 мм Петри блюдо (es) и центрифуга в течение 5 мин при 300 х г.
- Откажитесь от супернатанта и повторно ежеровые нейросферные гранулы с помощью химического комплекта диссоциации (мышь) в соответствии с инструкциями производителя (Таблица материалов).
ПРИМЕЧАНИЕ: Наблюдайте за инкубационными временами точно, поскольку они имеют решающее значение для производительности. - Центрифуга в течение 5 мин при 300 х г,удалить супернатант и добавить 1 мл SFM дополнен10 нг /мЛ EGF и 5 нг /мЛ bFGF.
- Triturate вверх и вниз примерно в 10 раз с пипеткой P1000, чтобы разъединить нейросферы.
- Подсчитайте количество клеток, используя раствор, содержащий 0,2% Трипан синий и гематоцитометр.
- Пересеянные клетки при плотности 2 х 104 ячейки/мл в непокрытом 60 мм чашках Петри.
- Инкубировать SV и DG-клетки в течение 6-8 дней и 10-12 дней, соответственно, для получения вторичных нейросфер, при 37 градусах Цельсия с 5% CO2.
ПРИМЕЧАНИЕ: К возможностям самообновления NSPC, полученным из СВз- и DG, можно получить следующие разделы протокола 5 и 6. Для этого, семенные sV и DG-клетки при плотности 1,0 х 104 ячейки/мл (в непокрытых 24-колодцах пластин) в среде роста SFM, содержащей 5 нг/мл EGF и 2,5 нг/мл bFGF (низкий EGF/bFGF). Подсчитайте количество полученных первичных и вторичных нейросфер.
7. Хранение нейросфер
- Соберите среду, содержащую нейросферы (полученные из шагов 5,3 и 6,7) из 60 мм посуды Петри.
- Центрифуга в течение 5 мин при 300 х г и отбросить супернатант.
- Вымойте клетки 2x с 1 мл HBSS (5 мин при 300 х г).
- Центрифуга в течение 5 мин при 300 х г,отбросить супернатант и хранить гранулы нейросфер при -20 градусов по Цельсию для анализа молекулярной биологии.
8. Процедура покрытия PDL
- Для приготовления раствора 1 (0,1 м боратовый буфер) взвесьте 3,92 г борной кислоты и разбавьте в 400 мл высокой чистоты воды. Отрегулируйте рН до 8,2 и сделайте до 500 мл с высокой чистотой воды.
- Для приготовления раствора 2 (0,167 м боратбуфера) взвесьте 10,3 г борной кислоты и разбавьте в 900 мл высокой чистоты воды. Отрегулируйте рН до 8,2 и сделать до 1000 мл с высокой чистотой воды.
- Для восстановления поли-D-лизин (PDL) (1 мг/мл в буфере бората 0,1 м), разбавьте 100 мг PDL в 100 мл раствора 1.
- Сделать aliquots 10 мл, чтобы использовать немедленно или заморозить и хранить при -20 градусов по Цельсию.
- Под ламинарным потоком добавьте 1 крышку на скважину и стерилизуйте под ультрафиолетовым светом в течение 15 минут.
- Используйте восстановленный PDL или оттепель замороженных восстановленных PDL.
- Подготовьте окончательное решение 100 мкг/мл PDL в буфере бората 0,167 М, добавив 10 мл восстановленного PDL до 90 мл раствора 2.
- Добавьте окончательное решение к скважинам минимум на 2 ч до 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: Для 24-колодных пластин добавьте объем по 500 л в каждую скважину. - Снимите раствор и промойте 3x с высокой чистотой воды.
- Пусть крышки высохнут в ламинарном капоте потока.
- Оставьте многокомнатные культурные тарелки при 4 градусах Цельсия.
9. PDL/Laminin процедура покрытия пластины
- На 1-й день, пальто пластин ы с PDL, как описано в разделе 8.
- На второй день снимите раствор PDL и промойте 3x с высокой чистотой воды. Дайте высохнуть.
- Приготовьте 5 мкг/мл ламинина в холодном SFM, лишенном факторов роста.
- Добавить растворенный ламинин в крышки и инкубировать при 37 градусах Цельсия в одночасье.
ПРИМЕЧАНИЕ: Для 24-колодных пластин добавьте объем по 500 л в каждую скважину. - Удалите ламинин с помощью пипетки.
ПРИМЕЧАНИЕ: Не мыть крышки из ламинина. - Используйте немедленно или храните при -20 градусах Цельсия.
10. Поли-L-орнитин (PLO) /ламинина процедура покрытия
- Под ламинарным потоком добавьте один покрывало на скважину и стерилизуйте под ультрафиолетовым светом в течение 15 минут.
- Добавьте 0,01% оПО раствор к каждому колодцу в течение 20 минут при комнатной температуре (RT).
ПРИМЕЧАНИЕ: Для 24-колодных пластин добавьте объем по 500 л в каждую скважину. - Удалить раствор и вымыть 3x со стерилизованной 1x PBS. Дайте высохнуть.
- Подготовка 5 мкг/мл ламинина в стерильных 1x PBS.
- Инкубировать в течение 2 ч при 37 градусах Цельсия.
- Удалите ламинин.
ПРИМЕЧАНИЕ: Не мыть крышки из ламинина. - Используйте немедленно.
ПРИМЕЧАНИЕ: Убедитесь, что крышка полностью покрыта раствором ООП, осторожно нажав на крышку с помощью наконечника пипетки. При встряске многослойные пластины не должны издать звук.
11. Оценка неуритогенеза путем создания дифференцированного монослойа клеток
- Соберите носители, содержащие нейросферы из 60 мм посуды Петри (получены из раздела 5) и центрифуги в течение 5 мин при 300 х г на РТ.
- Отбросьте супернатант и разъедините гранулы нейросфер в 1 мл диссоциации PBS (т.е., PBS без Mg2 "/Ca2" и с EDTA 2,7 мм KCl, 1,5 мМ KH2PO4, 137 mM NaCl, 8,1 мМ Na 2 HPO4и 0,5 мМ EDTA 4Na, при рН 7,40) путем инкубации в течение 15 минут с последующей механической диссоциацией.4 Кроме того, диссоциировать нейросферы с помощью химического комплекта диссоциации (мышь) (Таблица материалов).
- Центрифуга в течение 5 мин при 300 х г на RT и отбросить супернатант.
- Приостанавливайте действие клеточных гранул в 1 мл SFM, лишенных факторов роста.
- Определить плотность клеток с помощью гематоцитометра.
- Разбавить разобщенную клеточную суспензию в SFM, лишенную факторов роста при плотности 3766 клеток/см2, и пластинки на покрытых стеклянных крышках в 24-колодцах пластин.
- После 1–3 дней исправьте клетки для иммуноцитохимии против белка цитоскелета (см. раздел 14).
12. Дифференциация нейросферных культур
ПРИМЕЧАНИЕ: Нейросферы, полученные от расширения клеток, либо из первичных или проходяных нейросфер (полученных в разделах 5 или 6) могут быть дифференцированы в клетки из различных нейронных линий.
- Когда нейросферы имеют диаметр 150-200 мкм, соберите 25 qL нейросферной подвески среднего и пластины на покрытых стеклянных крышках, в 24-колодцах пластин.
ПРИМЕЧАНИЕ: Чтобы собрать больше нейросфер, осторожно поверните чашку Петри, чтобы сконцентрировать нейросферы в центре. Затем, пипетка из центра. - Поместите пластины в инкубатор при 37 градусах по Цельсию в течение 15 мин, чтобы нейросферы придерживались субстрата. После этого добавьте 500 л SFM, лишенных факторов роста (дифференимационные условия).
- После 24 ч замените среду свежим SFM, лишенным факторов роста.
- Дифференцируйте для различных точек времени (например, 2 и 7 дней in vitro, DIV2 и DIV7, соответственно) с 5% CO2 и 95% атмосферным воздухом при температуре 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: Выживание клеток, пролиферация и дифференциация могут быть проанализированы с помощью различных анализов клеток.
13. Анализы клеточной биологии
- Выживаемость клеток
- Выставляют покрыные нейросферы до 3 мкг/мл пропидийййййййй (PI) в течение 30 минут до фиксации клеток в инкубаторе при 37 градусах Цельсия.
ПРИМЕЧАНИЕ: PI является автоматическим флуоресцентным агентом, который способен вводить только клетки с нарушенной целостностью мембраны8. Другие методы для анализа выживания клеток могут быть использованы, такие как caspase 3 окрашивания или терминал арении deoxynucleotidyl transferase dUTP ник-конец маркировки (TUNEL) анализ.
- Выставляют покрыные нейросферы до 3 мкг/мл пропидийййййййй (PI) в течение 30 минут до фиксации клеток в инкубаторе при 37 градусах Цельсия.
- Пролиферация клеток
- Выставляют покрывало нейросферы до 10 мкм 5-бромо-2'-deoxyuridine (BrdU) за 4 ч перед фиксацией в инкубаторе при 37 градусах Цельсия.
ПРИМЕЧАНИЕ: BrdU является синтетическим аналогом тимидина, который может быть включен во время синтеза ДНК в пролиферирующих клетках9.
- Выставляют покрывало нейросферы до 10 мкм 5-бромо-2'-deoxyuridine (BrdU) за 4 ч перед фиксацией в инкубаторе при 37 градусах Цельсия.
- Проверка дифференциации клеток
- Выставляют 7-дневные покрыванные нейросферы до 10 мкм BrdU в первые 24 ч, в инкубаторе при 37 градусах Цельсия.
- Обновите SFM, лишенный факторов роста (дифференимационных условий) и позвольте клеткам развиваться в отсутствие BrdU в течение следующих 6 дней до фиксации.
ПРИМЕЧАНИЕ: Эти эксперименты пульс-погони, путем совместной маркировки с маркерами зрелых нервных клеток, позволяют оценку клеток-прародителей, которые дифференцируются в зрелые клетки во время протокола.
14. Иммуностоинг нейросферных культур
- Фиксация ячеек
- Приготовьте 4% параформальдегида (PFA) в 1x PBS и храните при 4-C или -20 градусов по Цельсию.
- Удалите SFM, лишенный факторов роста, из скважин и добавьте, к каждой скважине, 500 qL 4% PFA при 4 кв. м в течение 20 мин на RT.
- Вымойте 3x с 1x PBS, в течение 5 минут каждый раз, крышки, содержащие дифференцированные нейросферы.
- Хранить крышки до использования в 500 зл и в 1x PBS при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Если эксперимент не имеет BrdU, перейдите к шагу 14.3.
- Метод денатурации (только для экспериментов BrdU)
- Подготовка 1 M HCl при 37 градусах Цельсия.
- Промыть охватывает 3x в 1x PBS.
- Пермяки ячеек в течение 30 мин в PBS, содержащий 1% неионический сурфактант (например, Тритон X-100).
- Денатурная dsDNA с 1 M HCl предварительно нагревается до 37 градусов по Цельсию в течение 30-40 мин при 37 кв/кв (300 л/ну).
- Вымойте скважины 4x с 1x PBS.
- Пермяки и блокирование
- Промыть покрывает в 1x PBS в течение 5 мин.
- Инкубировать 1,5 ч с 0,5% неионическим сурфактантом и 3% бычьего сывороточного альбумина (BSA) в 1x PBS (300 л/ну).
ПРИМЕЧАНИЕ: Для NeuN, используйте 6% BSA в 1x PBS.
- Инкубация и монтаж
- На 1 день, без мытья, инкубировать клетки с первичными антителами(Таблица материалов) в 0,1% неионический сурфактант и 0,3% BSA в 1x PBS в инкубационной камере (для 24-колодцев использовать 20 Л/ну). Оставьте крышки, инкубирующие на ночь при 4-C свет защищены, если антитела спрягаются в флюорофор.
- На второй день, возвращение охватывает крышки в их соответствующих скважин и промыть 3x в 1x PBS в течение 5 мин.
- Противокосятное пятно с соответствующей флуоресценцией конъюгированных вторичных антител (разбавление 1:200) и с 12 мкг/мл Hoechst 33342 в 1x PBS для 2 ч на РТ и свет защищен в инкубационной камере (20 л/крышка).
- Мытье охватывает 3x в 1x PBS в течение 5 мин.
- Гора охватывает скользит на микроскоп слайды с помощью 5 Л / coverslip флуоресценции монтажа среды.
- Пусть крышки покрывает воздух сухим на RT, защищены от света, в течение 1 дня.
- Микроскопии
- Просматривайте и приобретайте изображения с помощью флуоресцентного микроскопа.
- Для каждого состояния используйте три репликации. Выполнение клеток в пяти независимых микроскопических полей в каждом coverslip с 40x цель (100 ячеек на поле).
15. Подготовка фондовых решений EGF и bFGF
- Акционерное решение EGF
- Чтобы воссоздать лиофилизированный EGF, разбавить продукт в воде высокой чистоты, чтобы достичь конечной концентрации 20 мкг/мл.
- Aliquot и хранить в микротрубках при от -5 до -20 градусов по Цельсию.
- Акционерное решение bFGF
ПРИМЕЧАНИЕ: bFGF должен быть восстановлен с раствором 10 мМ Трис, рН 7.6.- Centrifuge флакон кратко перед открытием довести содержание на дно.
- Приготовьте 50 мл 10 мм Трис, рН 7,6. Для этого, весят 60,57 мг Tris ((HOCH2)3CNH2) и разбавить его в 40 мл воды высокой чистоты. Отрегулируйте рН до 7,6 и сделайте до 50 мл с высокой чистотой воды.
- Подготовка 10 мл 0,1% BSA в 10 мм Трис, рН 7,6. Для этого взвесьте 10 мг BSA и разбавьте его в 10 мл 10 мм Трис.
- Фильтровые решения, подготовленные шагами 15.2.2 и 15.2.3 с фильтром 0,22 мкм под ламинарным капотом потока.
- Восстановите 10 мкг bFGF в 1000 л 0,1% BSA в 10 мМ Трис с рН 7,6 для достижения конечной концентрации 10 мкг/мл. Aliquot в микротрубки при -20 градусах по Цельсию в течение максимум 6 месяцев.
Результаты
СВз и DG нейросферы, полученные с помощью АНБ, состоят из недифференцированных клеток, положительный для Sox2, транскрипционный фактор, участвующий в самообновления потенциала и положительный для nestin, промежуточный белок нити, выраженные в NSPCs (Рисунок 1A). Кроме того, нейросферы, полученные из СВЗ, имеют большие размеры, чем их коллеги из ГД(рисунок 1А). Важно отметить, что в дифференцированных условиях, СВз- и DG-производных NSPCs мигрируют из нейросфер формирования псевдомонослой клеток(Рисунок 1В).
Чтобы получить доступ к способности к самообновлению, анализ клеточной пары выполняется на основе выражения Sox2 и nestin, которые, как правило, исчезают в разделительных клетках, которые начинают процесс дифференциации с комбинацией маркера нейронной линии, а именно, DCX. В обоих нейрогенных регионах можно наблюдать наличие Sox2///nestin///DCX-/- симметричные деления (самообновление)(рисунок 2A1,B1),Sox2-//nestin-//////DCX/- асимметричные деления(рисунок 2A1,B2) и Sox2-/-/nestin-/-/DCX/ симметричные деления (дифференциация) (Рисунок 2A2,B1).
Пропуск нейросфер увеличивает выход NSPCs; однако, гибель клеток в DIV2 изменяется с прохождением. В самом деле, процент PI-положительных ячеек увеличивается с прохождением клеток в SV (P0: 15,6% и 1,2% против P1: 19,2% и 2,7% против P2: 32,35% и 0,14% против P3: 39,6% и 4,0%) и в DG (P0: 16,31% и 0,95% против P1: 32,1% и 1,7% против P2: 27,42% против P3: 32,2% и 3,1%) (Рисунок 3).
Неуритогенез может быть оценен в нейронах, полученных от дифференциации SV и DG NSPCs в начале дифференциации: DIV1 (Рисунок 4A,D), DIV2 (Рисунок 4B, E) и DIV3 (Рисунок 4C, F). В самом деле, как это наблюдается на рисунке 4, длина и последствия неврит увеличивается с дифференциацией.
Пролиферация клеток может быть оценена в св-и DG-производных нейросфер. Сравнение первичных дифференцированных нейросфер на DIV1 от СВз(рисунок 5A1) и DG(рисунок 5A2), процент BrdU-положительных клеток выше в СВз, чем в ДГ (СВз: 6,15% и 0,64% против ГД: 3,27% Рисунок 5A3). Кроме того, дифференциация клеток также может быть доступна путем объединения BrdU окрашивания со зрелым создателем, таких как нейронные ядра (NeuN), который определяет зрелые нейроны (Рисунок 5B1,B2). Рисунок 5B3 показывает, что процент размножающихся прародителей, которые дифференцируются в зрелые нейроны, схож в СВЗ и ДГ (СВЗ: 12,04% и 1,58% против DG: 13,56% и 0,48%; р.г.
Стволовые и многофункционтные NSPCs, полученные из СВЗ и ДГ, могут быть доступны с помощью АНБ, оценив аяру различных маркеров в дни дифференциации (DIV2 и DIV7). Действительно, НСК (нест- и глиальный фибриловый кислотный белок «GFAP»-двойной положительный элемент) присутствуют в обеих нейрогенных регионах(рисунок 6A,G). Эти клетки способны дифференцироваться в незрелые нейроны (DCX-позитивные клетки) (Рисунок 6B,H),зрелые нейроны (Нейн-позитивные клетки) (Рисунок 6F, L), клетки-предшественники олигодендроцитов (нейронно-глиальный антиген 2 »NG2» и тромбоциты-выводят рецептор фактора роста (PDGFR) - положительные клетки) (Рисунок 6C,I), зрелые олигодендроциты (миелин основной белок »MBP»-положительные клетки) (Рисунок 6E,K) и астроциты (GFAP-положительные клетки) (Рисунок 6D, J).
Различные субстраты могут быть использованы для покрытия крышки, чтобы сформировать псевдомонослой клеток в дифферезацивных условиях. Как показано на дополнительной рисунке 1, DG клетки мигрируют больше, когда крышки имеют дополнительное покрытие с ламинином в сочетании с ООП или PDL, чем с PDL в одиночку(Дополнительная цифра 1B 'H). В самом деле, когда PDL и ламинин используются вместе в качестве субстратов(Дополнительный рисунок 1C,G), DG клетки образуют более сопливый псевдомонослой, чем клетки СВЗ, для которых PDL используется в одиночку(Дополнительная цифра 1A, E).
Важно отметить, что эти результаты демонстрируют потенциал АНБ для оценки стерстворности и многофункциональных свойств НСК, полученных из двух основных нейрогенных ниш.
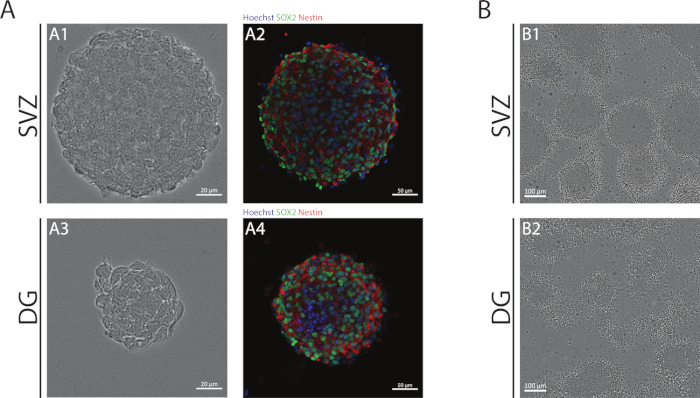
Рисунок 1: Субвентрикулярная зона и зубная извилина, выведенная NSPC, культивируемая как нейросферы или псевдомонослойы. (A) Представитель Brightfield (A1,A3) и флуоресценции (A2,A4) изображения SV- и DG-производных нейросфер, где ядра были окрашены Hoechst 33342 (синий) и NSCs для Sox2 (зеленый) и nestin (красный). (B) Представитель яркие изображения псевдомонослойов, полученных из СВз- и DG-производных нейросфер в дифференциативных условиях. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
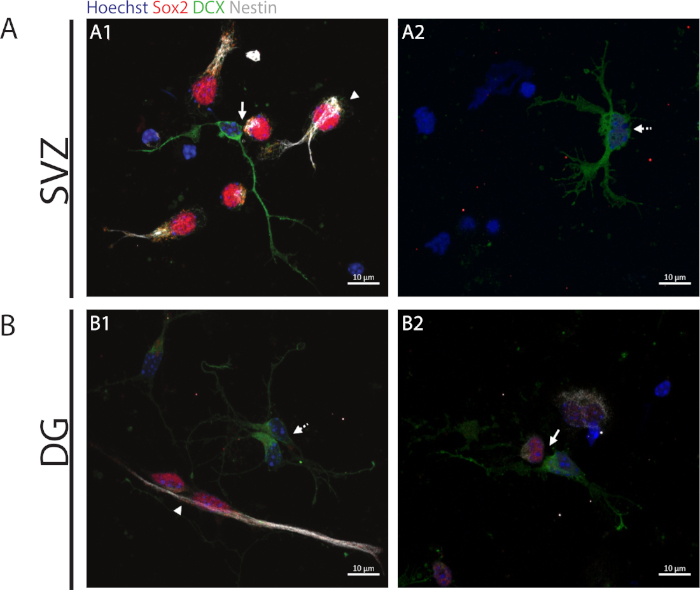
Рисунок 2: Асссеем пары клеток. Представитель флуоресценции изображения клеточных пар, полученных от деления клеток-прародителей. Ядра SV и DG были запятнаны Hoechst 33342 (синий), стволовыми клетками для Sox2 (красный) и nestin (белый), а также незрелыми нейронами с DCX (зеленый). Наконечники стрел в панелях A1 и B1 указывают на Sox2//nestin//DCX-/- симметричные самообновляющиеся деления, Стрелки в панелях A1 и B2 указывают на Sox2/-/nestin,/-/DCX-/) асимметричные деления, разбитые линии стрелок в панелях A2 и B1 показывают Sox2-/-/nestin-/-/DCX/ / симметричное дифференциациационное деления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
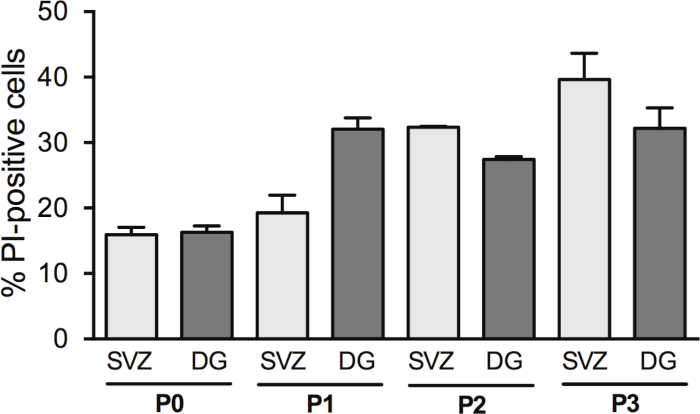
Рисунок 3: Анализ выживаемости клеток с прохожей клеток. Количественный анализ PI-положительных клеток на DIV2 в СВз- и DG-производная дифференцированной культуры нейросферы, после 0, 1, 2 и 3 проходов (P0-P3). Данные выражаются в виде средних значения хмея, n - 1-8. .. и пропидиум Иодид. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
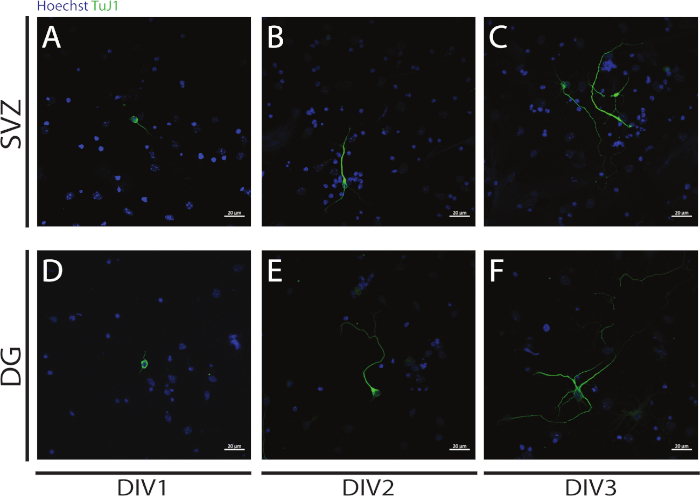
Рисунок 4: Анализ неуритогенеза в DIV 1, 2 и 3. Представитель конфокальной флуоресценции изображения невритов, определенные сигналом ЗIII-тубулин, в SV и DG нейронов на (A, D) DIV1, (B, E) DIV2, и (C, F) DIV3. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
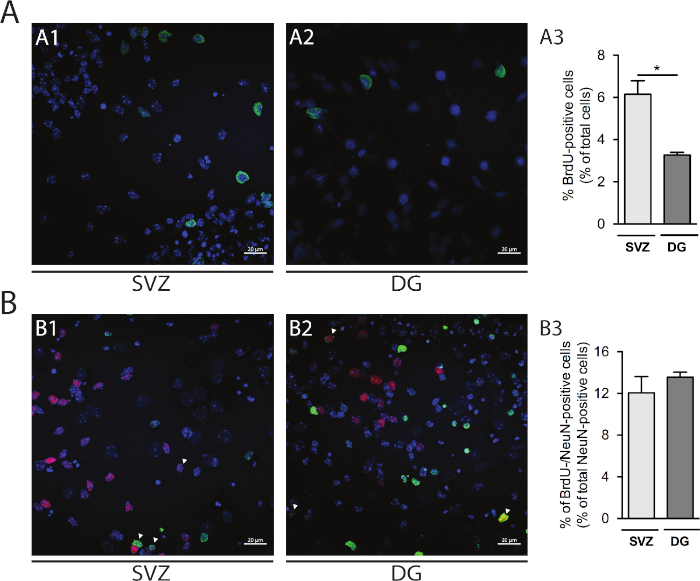
Рисунок 5: Пролиферация клеток. Представитель конфокальные изображения BrdU-положительных клеток на DIV1 в (A1) SV и (A2) DG. (A3) Количественный анализ BrdU-положительных клеток на DIV1 в DG- и SV,derived дифференцированной культуре нейросферы. Данные выражаются в виде средних - SEM, n No 4. Злт; 0,05 по t-тест. Представитель флуоресценции изображения BrdU- и NeuN-положительных клеток на DIV7 в (B1) SV и (B2) DG. Стрелы указывают на клетки BrdU-/NeuN-положительных. (B3) Количественный анализ BrdU-/NeuN-положительных клеток на DIV7 в обеих нишах. Данные выражаются в виде средних - SEM, n No 4. BrdU: 5-бромо-2'-деоксиюрин, синтетический аналог тимидина. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
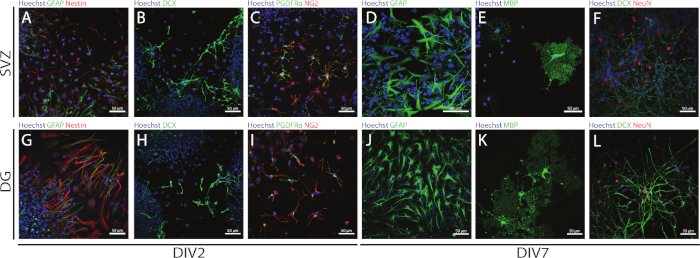
Рисунок 6: Типы нейронных клеток, присутствующие в СВЗ- и DG-производной дифференцированной культуре нейросферы. Представитель флуоресценции изображения SV- и DG-полученных типов клеток после 2 и 7 дней дифференциации нейросферы (DIV2 и DIV7), где ядра клеток были окрашены Hoechst 33342 (синий) и: (A, G) NSCs для GFAP (зеленый) и nestin (красный), (B, H) незрелые для DCX (зеленый), (C,I) олигодендроцитов клеток-предшественников для PDGFR (зеленый) и NG2 (красный), (D, J) астроциты для GFAP (зеленый), (E, K) зрелые олигодендроциты для MBP (зеленый), и (F, L) зрелые нейроны для NeuN (красный). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
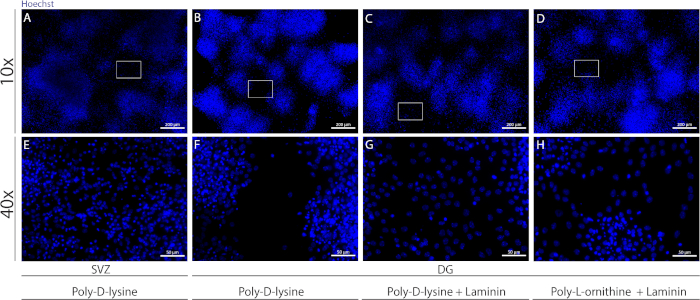
Дополнительная рисунок 1: Тестирование различных субстратов для присоединения нейросферы и миграции, чтобы сформировать псевдомонослой. Представитель флуоресценции изображения (A,E) SV ' полученных псевдомонослой с использованием поли-D-лизин в качестве субстрата, (B,F) DG-производные псевдомонослой с использованием поли-D-лизин в качестве субстрата, (C,G) DG-производные псевдомонослой с использованием поли-D-лизин с ламинином в качестве субстрата, и (D,H) DG-производные псевдомонослой с использованием поли-D-лизин с поли-L-орнитин как субт. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Системы in vitro NSPCs позволяют лучше понять клеточные и молекулярные механизмы, которые могут быть дополнительно проверены in vivo. АНБ является очень мощным методом для имитации физиологических условий из-за их трехмерной структуры. Кроме того, эта культурная система также технически легче культуры10, по сравнению с другими системами in vitro, такими как система культуры монослой. Действительно, с АНБ, легко контролировать подвергаются экстренные сигналы во время развития клеток, либо во время расширения или фазы дифференциации, путем добавления точного и переменного количества факторов, представляющих интерес для средств массовой информации, а также путем культивирования нейросфер с другими типами клеток6. Кроме того, по сравнению с монослойными культурами, в АНБ, можно получить более высокую плотность клеток из небольшого количества тканей или с небольшим количеством клеток, что позволяет проводить параллельные исследования, тем самым уменьшая количество животных1.
АНБ является наиболее распространенным методом изоляции и расширения NSCs11,12,13, может быть использован для оценки числа клеток-предшественников, присутствующих в данной образце ткани5 и частоты клеток-предшественников между различными условиями. Тем не менее, как нейросферы и монослойных культур не учитывают quiescence NSCs14. Кроме того, АНБ имеет некоторые ограничения11,,12,,13 и в результате нейросферной частоты зависит от многих факторов, включая средние компоненты, процедура вскрытия, процесс диссоциации11,12,13, и агрегации нейросферы5. Действительно, в культуре высокой плотности, нейросферы, как правило, агрегируются. Следовательно, при оценке количества клеток-предшественников в образце следует проявлять осторожность. Чтобы преодолеть вышеперечисленные ограничения, изолированные NSPCs также могут быть расширены и проходя в монослой5,15. Важно отметить, что использование АНБ для сравнения частоты клеток-предшественников между различными условиями очень полезно и точно, потому что все эти ограничения неявны и аналогичны среди всех условий, выполняемых в одном эксперименте.
Есть критические шаги в нейросферной культуре, которые требуют внимания. В шаге сбора мозга, полное удаление обезвоженых и хорошая изоляция нейрогенных ниш имеют важное значение для максимизации чистоты и урожайности NSPCs. Во время диссоциации тканей, из-за протеолитической активности трипсина, чрезмерное использование трипсина или более длительное время инкубации может привести к клеточному лисису. Кроме того, день прохождения имеет решающее значение для получения здоровой популяции нейросфер. Проходя нейросферы с диаметром выше 200 мкм значительно влияет на жизнеспособность, пролиферативную и дифференциативную способность NSPCs. Важно, что более длительные циклы проходов, более 10 может увеличить генетическую нестабильность6. Кроме того, покрытие PDL и PLD/laminin для клеток СВз и DG, соответственно, имеет важное значение для обеспечения хорошей миграции клеток из нейросфер без ущерба для процесса дифференциации. С точки зрения иммуноцитохимии анализа, больше времени инкубации с PFA может поставить под угрозу окрашивание, маскируя антигены и увеличение фона.
АНБ является мощным инструментом для обеспечения последовательного и неограниченного источника NSPCs для исследования в пробирке нервного развития и дифференциации, а также для терапевтических целей16,17. Действительно, этот анализ может быть применен к генетическим и поведенческим моделям для дальнейшего понимания молекулярных и клеточных механизмов, участвующих в распространении NSPC и дифференциации18,19. Этот анализ также полезен для тестирования различных препаратов и соединений20,,21,22, а также для выполнения генетических манипуляций19,,23 для модулировать свойства НСК., В дополнение к иммуноцитохимии, обратная транскрипция полимеразной цепной реакции и западного анализа побелки могут быть выполнены для доступа к РНК и экспрессии белка, в то время как электрофизиологические исследования и изображения кальция могут быть использованы для оценки функции новорожденных нейронов21.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана IF/01227/2015 и UID/BIM/50005/2019, projeto financiado pela Funda'o para a Ci'ncia e a Tecnologia (FCT)/ Minist'rio da Ci'ncia, Tecnologia e Ensino Superior (MCTES) atrav's de Fundos do Or'amento de Estado. Р.С. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018) и R.S.R. (SFRH/BD/129710/2017) получили стипендию. Авторы хотели бы поблагодарить членов биоизображения объекта в Институте медицины Молекулярная Jo'o Лобо Антунес для микроскопии помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Ссылки
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены