Method Article
Isolamento e Expansão das Neuroesferas a partir de Nichos Neurogênicos de Camundongos (P1-3)
Neste Artigo
Resumo
Neste artigo, descrevemos, em detalhes, um protocolo para a geração de culturas neurosferas a partir de células-tronco neurais de camundongos pós-natal derivadas dos principais nichos neurogênicos do rato. As neuroesferas são usadas para identificar células-tronco neurais do tecido cerebral permitindo a estimativa de números de células precursoras. Além disso, essas estruturas 3D podem ser banhadas em condições diferenciais, dando origem a neurônios, oligodendrócitos e astrócitos, permitindo o estudo do destino celular.
Resumo
O ensaio da neuroesfera é uma técnica in vitro extremamente útil para estudar as propriedades inerentes das células-tronco/progenitoras neurais (NSPCs), incluindo proliferação, auto-renovação e multipotência. No cérebro pós-natal e adulto, os NSPCs estão presentes principalmente em dois nichos neurogênicos: a zona subventricular (SVZ) que reveste os ventrículos laterais e a zona subgranular do giro dentato hipocampal (DG). O isolamento dos nichos neurogênicos do cérebro pós-natal permite obter uma maior quantidade de NSPCs na cultura com consequente vantagem de maiores rendimentos. O contato próximo entre as células dentro de cada neuroesfera cria um microambiente que pode se assemelhar a nichos neurogênicos. Aqui, descrevemos, em detalhes, como gerar culturas neurosferas derivadas de SVZ e DG de camundongos de 1-3 dias de idade (P1−3), bem como passaging, para expansão da neurosfera. Esta é uma abordagem vantajosa, uma vez que o ensaio da neurosfera permite uma geração rápida de clones NSPC (6-12 dias) e contribui para uma redução significativa no número de uso animal. Ao emplacar as neuroesferas em condições diferenciais, podemos obter uma pseudomonocamada de células compostas de NSPCs e células diferenciadas de diferentes linhagens neurais (neurônios, astrócitos e oligodendrócitos) permitindo o estudo das ações de fatores intrínsecos ou extrínsecos na proliferação do NSPC, diferenciação, sobrevivência celular e neuritogênese.
Introdução
O ensaio da neurosfera (NSA) foi descrito pela primeira vez em 19921,2 e ainda continua sendo uma ferramenta única e poderosa na pesquisa de células-tronco neurais (NSC). O isolamento das CNs das principais regiões neurogênicas tem problemas desafiadores porque os requisitos para manter essas células em condições fisiológicas permanecem pouco compreendidos. Na NSA, as células são cultivadas em um meio quimicamente definido sem soro com a presença de fatores de crescimento, incluindo o fator de crescimento epidérmico (EGF) e o fator básico de crescimento do fibroblasto (bFGF)1,2,3. Células precursoras neurais (tronco e progenitores) são selecionadas usando esses mitogens, uma vez que essas células são EGF e FGF-responsivas entrando em um período de proliferação ativa, enquanto outras células, ou seja, células diferenciadas, morrem4. As células precursoras neurais crescem como neuroesferas, que podem ser então transitadas para expandir ainda mais o pool dessas células5. É importante ressaltar que, uma vez que essas células progenitoras-tronco neurais (NSPCs) são multipotentes, elas são capazes de se diferenciar nos três principais tipos de células do sistema nervoso central (SNC): neurônios, oligodendrócitos e astrócitos5.
A NSA fornece uma fonte renovável de precursores indiferenciados do SNC, que podem ser usados para estudar vários processos, incluindo a proliferação e auto-renovação do NSC, e a diferenciação neuronal e glial, tanto no contexto fisiológico quanto no de doenças. Além disso, estudos in vitro podem ser utilizados para avaliar o grau de especificação intrínseca presente em precursores neurais durante o desenvolvimento, bem como para estudar todo o potencial das células, removendo pistas extrínsecas associadas ao seu ambiente normal6. O modelo da neurosfera é valioso para avaliar os reguladores putativos, uma vez que, mantendo as células em um meio desprovido de soro, as pistas ambientais são fornecidas apenas pelas células circundantes6. Além disso, na NSA, os NSPCs são facilmente expandidos na cultura, a densidade de células por área é alta e a composição heterogênea das neuroesferas tem alguma semelhança com nichos in vivo6. Essas vantagens bem estabelecidas são a razão pela qual essa metodologia tem sido amplamente utilizada por muitos pesquisadores.
O protocolo a seguir descreve em detalhes todos os processos desde o isolamento da população de Nspc pós-natal das duas principais regiões neurogênicas, a zona subventricular (SVZ) e o giro dentato hipocampal (DG), até a expansão dessas células como neuroesferas, bem como a diferenciação em neurônios, astrócitos e oligodendrocytes. Por último, diferentes ensaios também são descritos para acessar propriedades de haste e multipotência de NSPCs derivados de SVZ e DG.
Protocolo
Todos os experimentos foram realizados de acordo com a legislação da Comunidade Europeia (86/609/CEE; 2010/63/UE; 2012/707/UE) e português (DL 113/2013) para a proteção de animais utilizados para fins científicos. O protocolo foi aprovado pelo "Órgão institucional de Bem-Estar Animal do IMM - ORBEA-iMM e pela Autoridade Nacional competente - DGAV (Direcção Geral de Alimentação e Veterinária)".
1. Configuração básica e preparação do meio cultural
- No dia da dissecção, prepare a quantidade adequada de meio de crescimento correspondente ao meio sem soro (SFM) composto pelo meio de águia modificado de Dulbecco [(DMEM)/F12 com L-glutamina](Tabela de Materiais)complementado com 100 penicilina u/mL e 100 μg/mL estreptomicina (caneta/estreptomia), 1% B27, com também 10 ng/mL EGF e 5 ng/mL bFGF. Aqueça o meio de cultura a 37 °C em banho-maria.
NOTA: O volume de meio de crescimento depende do número de filhotes, para 5 filhotes preparar ~100 mL (50 mL para SVZ e 50 mL para DG); no entanto, após a contagem do número de células (etapa 5.1) o volume exato terá que ser ajustado. - Para microdissecção de SVZ e DG, prepare o meio de dissecção balanceado da solução de soro de cálcio e magnésio hanks (HBSS) suplementado com caneta/estreptococos de 100 U/mL.
NOTA: Prepare 50-100 mL de meio de dissecção. - Configure um microscópio de dissecção e prepare as ferramentas necessárias para remover o cérebro (tesoura e espátula pequena) e para microdissecções SVZ e DG (tesouras pequenas dumont, #7 fórceps, #5 fórceps, #5S fórceps) por imersão em 70% de etanol.
2. Colheita de cérebros de camundongos pós-natal (P1−3) e microdissecções SVZ/DG
- Preparar pratos de Petri de 60 mm (área de crescimento 21 cm2) com HBSS complementado com caneta/estreptococos e 2 tubos de amostra (um para SVZ e outro para DG) com 500 μL de HBSS suplementado cada.
- Eutanie filhotes de camundongos (P1-3) de acordo com o protocolo aprovado pela unidade de Cuidados/Diretrizes Institucionais de Animais. Realize a decapitação com uma única incisão com uma tesoura afiada na base do tronco cerebral.
- Segurando a parte ventral do corpo na base da cabeça e usando uma pequena tesoura pontiaguda, faça uma incisão midline na pele sobre todo o comprimento da cabeça, revelando assim a superfície do crânio.
- Faça uma incisão longitudinal na base do crânio e continue cortando ao longo da sutura sagital usando uma pequena tesoura com um ângulo raso possível, a fim de evitar danificar as estruturas cerebrais.
- Descasque o crânio para os lados usando fórceps curvos e exponha o cérebro.
ATENÇÃO: Certifique-se de que os instrumentos de dissecação estão livres de etanol antes de tocar o cérebro. - Isolar o cérebro do crânio usando uma pequena espátula, deslizando sob a base do cérebro para cortar os nervos cranianos e vasos sanguíneos que estão conectados à base do cérebro, e transferir o cérebro para uma placa de Petri contendo solução HBSS suplementada a frio.
- Coloque a placa de Petri contendo o cérebro sob um microscópio dissecando em baixa ampliação e posicione o cérebro em sua superfície dorsal.
- Usando pinças finas, remova as meninges do lado ventral do cérebro e das lâmpadas olfativas, mantendo o cérebro em posição pelo cerebelo. Gire o cérebro para o aspecto ventral e retire o resto das meninges.
NOTA: A remoção das meninges dorsais é um passo crucial para garantir o corte cerebral correto. - Descarte o cerebelo fazendo um corte usando fórceps. Coloque um papel filtro com um tamanho de poro de 11 μm em um helicóptero de tecido(Tabela de Materiais)e coloque o cérebro no papel do filtro usando fórceps pontiagudos curvos. Corte o cérebro em seções coronais de 450 μm e use uma lâmina molhada para coletar o cérebro seccionado em uma nova placa de Petri cheia de HBSS suplementada a frio.
- Para dissecar o SVZ, use fórceps para separar fatias coronais de forma anterior-posterior até alcançar fatias com os ventrículos laterais, sob um microscópio dissecando.
- Corte a fina camada de tecido ao redor da parede lateral dos ventrículos (que corresponde ao SVZ) com fórceps finos, excluindo o parenchyma estriatal e o corpo caloso. Isole o SVZ colocando a ponta dos fórceps nos cantos laterais do ventrículo lateral: um imediatamente sob o corpo caloso e o outro no tecido imediatamente adjacente à área ventral do ventrículo lateral. Em seguida, corte uma pequena linha de tecido em torno do ventrículo lateral.
- Coletar o tecido dissecado em um tubo de amostra com solução HBSS suplementada previamente identificada como SVZ.
NOTA: Exclua o SVZ em fatias onde tanto os ventrículos laterais quanto a formação hipocampal começam a aparecer. - Passe por todas as fatias após a microdissecção SVZ de forma anterior-posterior e alcance a formação hipocampal. Usando fórceps descarte a primeira fatia com hipocampo onde o DG ainda está irreconhecível.
- Para remover o DG, primeiro isole o hipocampo das fatias. Reconcentre o microscópio para visualizar as bordas ao redor do DG.
- Dissecar a porção DG através da realização de um corte entre a região dg e CA1 seguido de um corte vertical entre a região DG e CA3 utilizando fórceps. Remova a fimbria e qualquer tecido adjacente.
NOTA: Em animais P1-3, o DG é quase indistinguível do chifre de Ammon, mas exibe uma pequena ponta. - Coletar o tecido dissecado em um tubo de amostra contendo soluções hbss suplementadas previamente identificadas como DG.
NOTA: A lesão geral no hipocampo ou na área circundante tornará mais difícil isolar o DG. O uso de um atlas do cérebro do rato pós-natal é essencial quando o usuário não está familiarizado com o isolamento do tecido SVZ e DG das seções coronais.
3. Dissociação tecidual
- Para dissociar o tecido SVZ e DG presente em seus respectivos tubos, adicione trypsin-EDTA 0,05% para ter uma concentração final de 5-10% de Trypsin-EDTA 0,05% no HBSS. Incubar por aproximadamente 15 min a 37 °C, até que o tecido esteja agrupado.
- Lave o tecido da tripsina removendo a mídia e adicionando 1 mL de nova solução suplementada de HBSS por 4 vezes consecutivas.
- Remova o HBSS e resuspenda o tecido digerido em 1 mL de SFM suplementado com 10 ng/mL EGF e 5 ng/mL bFGF. Dissociar mecanicamente a pelota, encanando suavemente para cima e para baixo aproximadamente 7-10x usando uma pipeta P1000, até obter uma solução celular homogênea.
ATENÇÃO: A dissociação mecânica excessiva pode levar ao aumento da morte celular e impactar negativamente o crescimento celular subseqüente.
4. Ensaio de par de células para estudar o destino celular
- Antes do experimento, prepare placas revestidas de 24 poços para culturas de monocamada aderentes de acordo com as seções 8-10.
- Para contar o número de células SVZ ou DG (obtidas na seção 3) a serem banhadas, utilize uma solução contendo 0,2% de trypan azul e conte as células usando um hematocitometro.
- Diluir a suspensão celular dissociada em SFM suplementada com 5 ng/mL EGF e 2,5 ng/mL bFGF (baixo EGF/bFGF) a uma densidade de 11.300 células/cm2 e emplaca-las em tampas de vidro revestidas.
- Após 24 h, fixe as células para imunocitoquímica contra marcadores NSC, como a região de determinação sexual Y-box 2 (Sox2) e nestin, bem como com um marcador da linhagem neuronal (ou seja, doublecortin [DCX], para neurônios imaturos) (ver seção 14).
NOTA: Sox2 é um marcador de NSCs que sofrem mitose. Os pares de células Sox2+/+ resultantes de uma única divisão de células progenitoras refletem a expansão das células-tronco7.
5. Expansão das células-tronco neurais pós-natal como neuroesferas
- Para determinar a densidade da suspensão de células SVZ ou DG dissociada (obtida na seção 3), conte as células usando um hematocitometro.
- Diluir a suspensão celular única SVZ e DG a uma densidade de 2 x 104 células/mL em SFM complementada com 10 ng/mL EGF e 5 ng/mL bFGF. Sementes SVZ e Células DG em placas de Petri de 60 mm não revestidas com um volume final de 5 mL/placa de Petri.
- Incubar células SVZ e DG durante 6-8 dias e 10-12 dias, respectivamente para formar neuroesferas primárias, a 37 °C com 5% de CO2.
NOTA: Dias de incubação mais do que os mencionados podem promover a agregação de neuroesferas e níveis mais elevados de morte celular no centro da neurosfera. - Quando a maioria das neuroesferas tem um diâmetro de 150-200 μm, realiza a passagem da neurosfera.
NOTA: Passar neuroesferas quando não têm um diâmetro adequado compromete todos os próximos passos.
6. Passaging de neuroesferas
NOTA: O protocolo a seguir pode ser aplicado para expandir as neuroesferas SVZ e DG.
- Para passar as neuroesferas, colete o SFM com fatores de crescimento contendo neuroesferas da placa de Petri(es) de 60 mm e centrífugas por 5 min a 300 x g.
- Descarte o sobrenadante e resuspenda a pelota da neurosfera usando um kit de dissociação química (mouse) de acordo com as instruções do fabricante(Tabela de Materiais).
NOTA: Observe os tempos de incubação precisamente, pois eles são cruciais para o desempenho. - Centrifugagem para 5 min a 300 x g, remova o sobrenadante e adicione 1 mL de SFM complementado com 10 ng/mL EGF e 5 ng/mL bFGF.
- Triturar para cima e para baixo aproximadamente 10x com uma pipeta P1000 para dissociar as neuroesferas.
- Conte o número de células usando uma solução contendo 0,2% trypan azul e hematocitometro.
- Células de reseed a uma densidade de 2 x 104 células/mL em placas de Petri de 60 mm não revestidas.
- Incubar células SVZ e DG durante 6-8 dias e 10-12 dias, respectivamente para obter neuroesferas secundárias, a 37 °C com 5% de CO2.
NOTA: A capacidade de auto-renovação dos NSPCs derivados de SVZ e DG pode ser acessada seguindo as seções de protocolo 5 e 6. Para isso, as células SVZ e DG de sementes a uma densidade de 1,0 x 104 células/mL (em placas de 24 poços não revestidas) em meio SFM de crescimento contendo 5 ng/mL EGF e 2,5 ng/mL bFGF (baixo EGF/bFGF). Conte o número de neuroesferas primárias e secundárias resultantes.
7. Armazenamento de neuroesferas
- Recolher o meio contendo neuroesferas (obtidas das etapas 5.3 e 6.7) das placas de Petri de 60 mm.
- Centrifugação por 5 min a 300 x g e descarte o sobrenadante.
- Lave as células 2x com 1 mL de HBSS (5 min a 300 x g).
- Centrífuga por 5 min a 300 x g,descarte o sobrenadante e armazene a pelota das neuroesferas a -20 °C para análise de biologia molecular.
8. Procedimento da placa de revestimento PDL
- Para preparar a solução 1 (tampão borato de 0,1 M), pesar 3,92 g de ácido bórico e diluir em 400 mL de água de alta pureza. Ajuste o pH para 8,2 e faça até 500 mL com água de alta pureza.
- Para preparar a solução 2 (tampão borato de 0,167 M), pesar 10,3 g de ácido bórico e diluir em 900 mL de água de alta pureza. Ajuste o pH para 8,2 e faça até 1.000 mL com água de alta pureza.
- Para reconstituir a poli-D-lisina (PDL) (1 mg/mL em tampão de borato de 0,1 M), diluir 100 mg de PDL em 100 mL da solução 1.
- Faça alíquotas de 10 mL para usar imediatamente ou congele e armazene a -20 °C.
- Sob o fluxo laminar, adicione 1 deslizamento de cobertura por poço e esterilize sob luz UV por 15 min.
- Use o PDL reconstituído ou descongele o PDL congelado reconstituído.
- Prepare a solução final de 100 μg/mL PDL em buffer de borato de 0,167 M adicionando 10 mL de PDL reconstituído a 90 mL da solução 2.
- Adicione a solução final aos poços para uma mínima de 2h a 37 °C.
NOTA: Para placas de 24 poços, adicione um volume de 500 μL em cada poço. - Remova a solução e lave 3x com água de alta pureza.
- Deixe as tampas secarem na capa de fluxo laminar.
- Deixe as placas de cultura de vários poços a 4 °C.
9. Procedimento da placa de revestimento PDL/Laminin
- No dia 1º, revestir as placas com PDL conforme descrito na seção 8.
- No dia 2, retire a solução PDL e lave 3x com água de alta pureza. Deixe secar.
- Prepare 5 μg/mL de lamina em SFM frio desprovido de fatores de crescimento.
- Adicione lamina dissolveda às tampas e incubar a 37 °C durante a noite.
NOTA: Para placas de 24 poços, adicione um volume de 500 μL em cada poço. - Remova a lamina usando uma pipeta.
NOTA: Não lave as tampas da lamina. - Use imediatamente ou armazene a -20 °C.
10. Procedimento de revestimento poli-L-ornithine (OLP) /lamin
- Sob o fluxo laminar, adicione um deslizamento de cobertura por poço e esterilize sob luz UV por 15 min.
- Adicione 0,01% de solução de PLO a cada poço por 20 min à temperatura ambiente (RT).
NOTA: Para placas de 24 poços, adicione um volume de 500 μL em cada poço. - Remova a solução e lave 3x com 1x PBS esterilizado. Deixe secar.
- Prepare 5 μg/mL de lamina em 1x PBS estéril.
- Incubar por 2h a 37 °C.
- Remova a lamina.
NOTA: Não lave as tampas da lamina. - Use imediatamente.
NOTA: Certifique-se de que o deslizamento de cobertura está totalmente coberto pela solução PLO tocando suavemente no deslizamento de cobertura com uma ponta de pipeta. Quando abalados, as placas de vários poços não devem fazer nenhum som.
11. Avaliação da neuritogênese gerando uma monocamada diferenciada de células
- Coletar mídias contendo neuroesferas de placas de Petri de 60 mm (obtidas da seção 5) e centrífugas por 5 min a 300 x g no RT.
- Descarte o sobrenadante e dissocie a pelota das neuroesferas em 1 mL de PBS dissociação (ou seja, PBS sem Mg2+/Ca2+ e com EDTA [2,7 mM KCl, 1,5 mM KH2PO4, 137 mM NaCl, 8,1 mM Na2HPO4 e 0,5 mM EDTA 4Na, no pH = 7,40]) incubando por 15 min seguido de dissociação mecânica. Alternativamente, dissociar as neuroesferas usando um kit de dissociação química (mouse) (Tabela de Materiais).
- Centrifugação por 5 min a 300 x g no RT e descarte o sobrenadante.
- Resuspender a pelota celular em 1 mL de SFM desprovido de fatores de crescimento.
- Determine a densidade celular usando um hematocitometro.
- Diluir a suspensão celular dissociada em SFM desprovida de fatores de crescimento a uma densidade de 3.766 células/cm2 e células de placa em tampas de vidro revestidas em placas de 24 poços.
- Após 1-3 dias, fixar células para imunocitoquímica contra uma proteína do citoesqueleto (ver seção 14).
12. Diferenciação das culturas da neurosfera
NOTA: As neuroesferas obtidas a partir da expansão celular, seja das neuroesferas primárias ou passageiras (obtidas nas seções 5 ou 6) podem ser diferenciadas em células de diferentes linhagens neurais.
- Quando as neuroesferas têm um diâmetro de 150-200 μm, coletar 25 μL de meio de suspensão neurosfera e placa em tampas de vidro revestidas, em placas de 24 poços.
NOTA: Para coletar mais neuroesferas, gire suavemente a placa de Petri para concentrar as neuroesferas no centro. Então, pipeta do centro. - Coloque as placas em uma incubadora a 37 °C por 15 minutos para que as neuroesferas aderam ao substrato. Posteriormente, adicione 500 μL de SFM desprovidos de fatores de crescimento (condições diferenciais).
- Após 24 h, substitua o meio por SFM fresco desprovido de fatores de crescimento.
- Diferencie-se para diferentes pontos de tempo (por exemplo, 2 e 7 dias in vitro, DIV2 e DIV7, respectivamente) com 5% de CO2 e 95% de ar atmosférico a 37 °C.
NOTA: A sobrevivência celular, a proliferação e a diferenciação podem ser analisadas por meio de diferentes ensaios celulares.
13. Ensaios de biologia celular
- Ensaio de sobrevivência celular
- Exponha as neuroesferas banhadas a 3 μg/mL de iodeto de propidium (PI) por 30 min antes da fixação celular na incubadora a 37 °C.
NOTA: Pi é um agente autofluorescente que só é capaz de entrar em células com integridade da membrana comprometida8. Outros métodos para analisar a sobrevivência celular podem ser usados, como a coloração de caspase 3 ou o ensaio de rotulagem de desoxiextracleotidyl dUTP (TUNEL).
- Exponha as neuroesferas banhadas a 3 μg/mL de iodeto de propidium (PI) por 30 min antes da fixação celular na incubadora a 37 °C.
- Ensaio de proliferação celular
- Exponha as neuroesferas banhadas a 10 μM 5-bromo-2'-deoxyuridina (BrdU) por 4 h antes da fixação na incubadora a 37 °C.
NOTA: BrdU é um análogo de timmidina sintético que pode ser incorporado durante a síntese de DNA em célulasproliferadoras 9.
- Exponha as neuroesferas banhadas a 10 μM 5-bromo-2'-deoxyuridina (BrdU) por 4 h antes da fixação na incubadora a 37 °C.
- Ensaio de diferenciação celular
- Expor as neuroesferas banhadas de 7 dias a 10 μM de BrdU nas primeiras 24 horas, na incubadora a 37 °C.
- Renovar o SFM desprovido de fatores de crescimento (condições diferenciais) e permitir que as células se desenvolvam na ausência de BrdU pelos 6 dias seguintes até a fixação.
NOTA: Esses experimentos de perseguição de pulso, por co-rotulagem com marcadores de células neurais maduras, permitem a avaliação de células progenitoras que se diferenciam em células maduras durante o protocolo.
14. Imunocoloração das culturas da neurosfera
- Fixação celular
- Prepare 4% de paraformaldeído (PFA) em 1x PBS e armazene a 4 °C ou -20 °C.
- Remova o SFM desprovido de fatores de crescimento de poços e adicione, a cada poço, 500 μL de 4% de PFA a 4 °C por 20 min em RT.
- Lave 3x com 1x PBS, por 5 min cada vez, as tampas contendo neuroesferas diferenciadas.
- Guarde as tampas até usar em 500 μL de 1x PBS a 4 °C.
NOTA: Se o experimento não tiver BrdU, pule para o passo 14.3.
- Método de desnaturação (apenas para experimentos de BrdU)
- Prepare 1 M HCl a 37 °C.
- Enxágüe tampas 3x em 1x PBS.
- Células permeabilizadas por 30 min em PBS contendo surfactante nonionico de 1% (por exemplo, Triton X-100).
- Denatureza dsDNA com 1 M HCl pré-aquecido a 37 °C para 30-40 min a 37 °C (~300 μL/poço).
- Lave poços 4x com 1x PBS.
- Permeabilização e bloqueio
- Enxágüe as tampas em 1x PBS por 5 min.
- Incubar por 1,5 h com surfactante de 0,5% e 3% de albumina de soro bovino (BSA) em 1x PBS (~300 μL/bem).
NOTA: Para NeuN, use 6% de BSA em 1x PBS.
- Incubação e montagem
- No primeiro dia, sem lavagem, incubam células com anticorpos primários(Tabela de Materiais)em surfactante de 0,1% e 0,3% bsa em 1x PBS na câmara de incubação (para placas de 24 poços usam 20 μL/poço). Deixe as tampas incubando durante a noite a 4 °C de luz protegida se os anticorpos forem conjugados a um fluoróforo.
- No dia 2, retorne as coberturas para seus respectivos poços e enxágue 3x em 1x PBS por 5 min.
- Contra-mancha com fluorescência adequada de anticorpos secundários conjugados (diluição 1:200) e com 12 μg/mL Hoechst 33342 em 1x PBS para 2 h em RT e luz protegida na câmara de incubação (20 μL/enversão).
- Lavar tampas 3x em 1x PBS por 5 min.
- Montagem de tampas em lâminas de microscópio usando 5 μL /deslizamento de cobertura do meio de montagem de fluorescência.
- Deixe as tampas secarem ao ar em RT, protegidos da luz, por 1 dia.
- Microscopia
- Visualize e adquira imagens usando um microscópio de fluorescência.
- Para cada condição, use três réplicas. Realizar contagem de células em cinco campos microscópicos independentes em cada deslizamento de cobertura com um objetivo de 40x (~100 células por campo).
15. Preparação das soluções de estoque EGF e bFGF
- Solução de ações da EGF
- Para reconstituir o EGF liofilizado, diluir o produto em água de alta pureza para atingir uma concentração final de 20 μg/mL.
- Alíquota e armazene em microtubos a -5 a -20 °C.
- solução de ações bFGF
NOTA: bFGF deve ser reconstituído com uma solução de 10 mM Tris, pH 7.6.- Centrifugue o frasco brevemente antes de abrir para levar o conteúdo para o fundo.
- Prepare 50 mL de 10 mM Tris, pH 7.6. Para isso, pesar 60,57 mg de Tris ((HOCH2)3CNH2) e diluí-lo em 40 mL de água de alta pureza. Ajuste o pH para 7,6 e faça até 50 mL com água de alta pureza.
- Preparar 10 mL de 0,1% BSA em 10 mM Tris, pH 7.6. Para isso, pesar 10 mg de BSA e diluí-lo em 10 mL de 10 mM Tris.
- Soluções de filtro preparadas nas etapas 15.2.2 e 15.2.3 com um filtro de 0,22 μm sob uma capa de fluxo laminar.
- Reconstituir 10 μg de bFGF em 1.000 μL de 0,1% BSA em 10 mM Tris com pH 7.6 para atingir uma concentração final de 10 μg/mL. Alíquota em microtubos a -20 °C para um máximo de 6 meses.
Resultados
As neuroesferas SVZ e DG, obtidas por meio da NSA, são compostas por células indiferenciadas, positivas para Sox2, fator de transcrição envolvido na capacidade de auto-renovação e positiva para a nestin, uma proteína de filamento intermediário expressa em NSPCs(Figura 1A). Além disso, as neuroesferas derivadas do SVZ têm dimensões maiores do que suas contrapartes DG(Figura 1A). É importante ressaltar que, em condições diferenciais, os NSPCs derivados de SVZ e DG migram para fora das neuroesferas formando uma pseudomonocamada de células(Figura 1B).
Para acessar a capacidade de auto-renovação, o ensaio do par celular é realizado com base na expressão de Sox2 e nestin que tende a desaparecer em células divisórias que iniciam o processo de diferenciação com uma combinação de um marcador da linhagem neuronal, ou seja, DCX. Em ambas as regiões neurogênicas, é possível observar a presença de Sox2+/+/nestin+/+/DCX-/- divisões simétricas (auto-renovação) (Figura 2A1,B1), Sox2-/+/nestin-/+/DCXX +/- divisões assimétricas(Figura 2A1,B2) e Sox2-/-/nestin-/-/DCX+/+ divisões simétricas (diferenciação) (Figura 2A2,B1).
A passagem das neuroesferas aumenta o rendimento dos NSPCs; no entanto, a morte celular em DIV2 muda com a passagem. De fato, o percentual de células PI positivas é aumentado com a passagem celular em SVZ (P0: 15,6% ± 1,2% vs P1: 19,2% ± 2,7% vs P2: 32,35% ± 0,14% vs P3: 39,6% ± 4,0%) e em DG (P0: 16,31% ± 0,95% vs P1: 32,1% ± 1,7% vs P2: 27,42% vs P3: 32,2% ± 3,1%) (Figura 3).
A neuritogênese pode ser avaliada em neurônios obtidos a partir da diferenciação de NSPCs SVZ e DG no início da diferenciação: DIV1 (Figura 4A,D), DIV2(Figura 4B,E) e DIV3 ( Figura4C,F). De fato, como observado na Figura 4,o comprimento e a ramificação dos neurites aumentam com a diferenciação.
A proliferação celular pode ser avaliada em neuroesferas derivadas de SVZ e DG. Comparando-se as neuroesferas primárias diferenciadas na DIV1 da SVZ (Figura 5A1) e DG (Figura 5A2),o percentual de células BrdU-positivas é maior em SVZ do que em DG (SVZ: 6,15% ± 0,64% vs DG: 3,27% ± 0,13%; p < 0,05; n = 4; Figura 5A3). Além disso, a diferenciação celular também pode ser acessada combinando a coloração de BrdU com um fabricante maduro, como núcleos neuronais (NeuN) que identifica neurônios maduros(Figura 5B1,B2). A Figura 5B3 mostra que o percentual de progenitores que se diferenciam em neurônios maduros é semelhante em SVZ e DG (SVZ: 12,04% ± 1,58% vs DG: 13,56% ± 0,48%; p > 0,05; n = 4).
A haste e a multipotência dos NSPCs derivados de SVZ e DG podem ser acessados usando a NSA avaliando a expressão de diferentes marcadores em diferentes dias de diferenciação (DIV2 e DIV7). De fato, os NSCs (proteína fibriária fibriária de nestin e glial [GFAP]-células duplas positivas) estão presentes em ambas as regiões neurogênicas(Figura 6A,G). Essas células são capazes de se diferenciar em neurônios imaturos (células DCX-positivas) (Figura 6B,H),neurônios maduros (células neun-positivas) ( Figura6F,L), células precursoras oligodendrócitos (antígeno neuron-glial 2 [NG2] e plaquetas derivadas receptor fator de crescimento α [PDGFRα]- células positivas) (Figura 6C,I), oligodendrócitos maduros (proteína básica de mielina [células mbp]-positivas) (Figura 6E,K) e astrócitos (células GFAP-positivas) (Figura 6D,J).
Diferentes substratos podem ser usados para cobrir tampas para formar a pseudomonocamada de células em condições diferenciais. Como mostrado na Figura Suplementar 1,as células DG migram mais quando as tampas têm revestimento extra com lamin combinado com PLO ou PDL do que apenas com PDL(Figura Suplementar 1B-H). De fato, quando pDL e laminin são usados juntos como substratos(Figura Suplementar 1C,G), as células DG formam uma pseudomonocamada mais confluente do que as células SVZ para as quais o PDL é usado sozinho(Figura Suplementar 1A,E).
É importante ressaltar que esses resultados demonstram o potencial da ANS para avaliar as propriedades de haste e multipotência dos CNs derivados dos dois principais nichos neurogênicos.
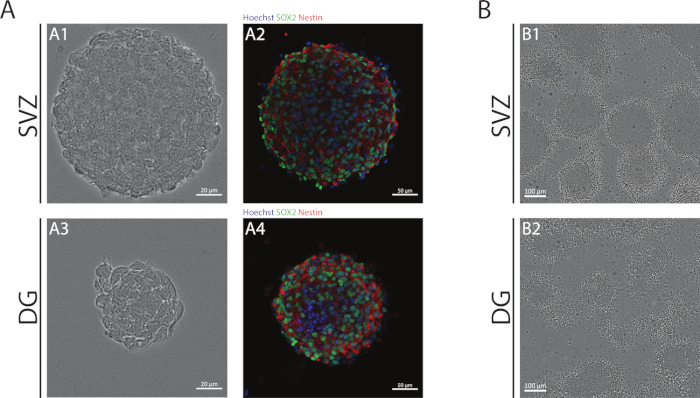
Figura 1: Zona subventricular e giro dentado derivado nspc cultivado como neuroesferas ou como pseudomonocamadas. (A) Imagens representativas de brightfield(A1,A3) e fluorescência(A2,A4)de neuroesferas derivadas de SVZ e DG, onde os núcleos foram manchados com Hoechst 33342 (azul) e NSCs para Sox2 (verde) e nestin (vermelho). (B) Imagens representativas de pseudomonocamadas geradas a partir de neuroesferas derivadas de SVZ e DG em condições diferenciais. Clique aqui para ver uma versão maior desta figura.
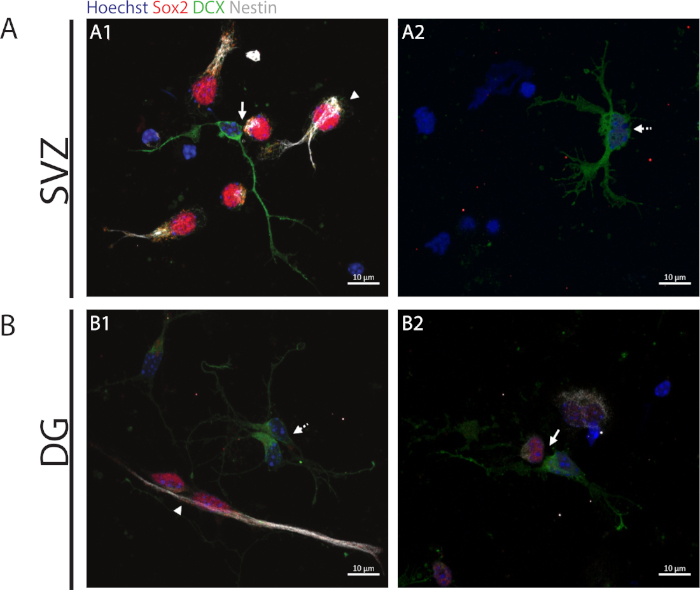
Figura 2: O ensaio do par de células. Imagens representativas de fluorescência de pares celulares derivados de uma divisão celular progenitora. Os núcleos SVZ e DG foram manchados com Hoechst 33342 (azul), células-tronco para Sox2 (vermelho) e nestin (branco), bem como neurônios imaturos com DCX (verde). Pontas de flecha nos painéis A1 e B1 indicam Sox2+/+/nestin+/+/DCX-/- divisões simétricas de auto-renovação, setas nos painéis A1 e B2 indicam que as divisões assimétricas Sox2+/-/nestin+/-/DCX-/+, setas de linha tracejadas nos painéis A2 e B1 mostram sox2-/-/nestin-/-/DCX+/+ divisões de diferenciação simétricas. Clique aqui para ver uma versão maior desta figura.
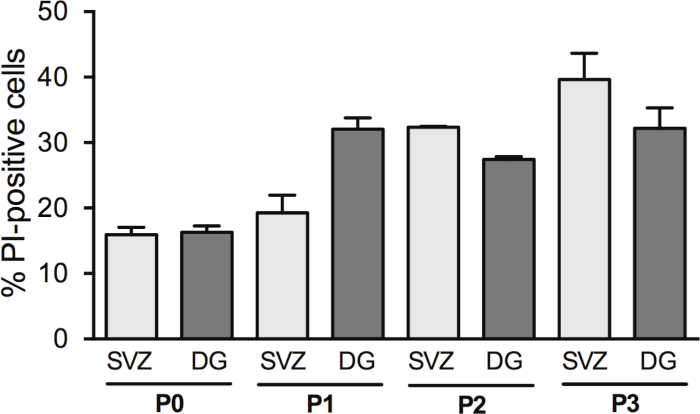
Figura 3: Análise de sobrevivência celular com passaging celular. Análise quantitativa de células PI positivas em DIV2 na cultura da neurosfera diferenciada derivada de SVZ e DG, após 0, 1, 2 e 3 passagens (P0−P3). Os dados são expressos como média ± SEM, n = 1-8. PI = iodeto de propidium. Clique aqui para ver uma versão maior desta figura.
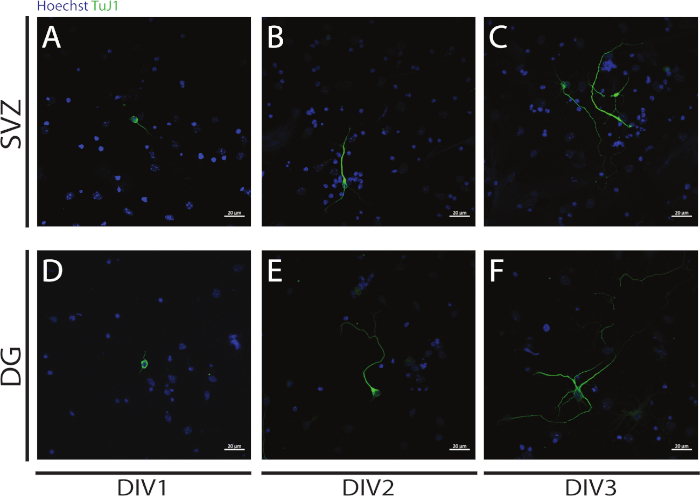
Figura 4: Análise de neuritogênese na DIV 1, 2 e 3. Imagens representativas de fluorescência confocal de neurites, identificadas pelo sinal βIII-tubulina, nos neurônios SVZ e DG em (A,D) DIV1, (B,E) DIV2 e(C,F) DIV3. Clique aqui para ver uma versão maior desta figura.
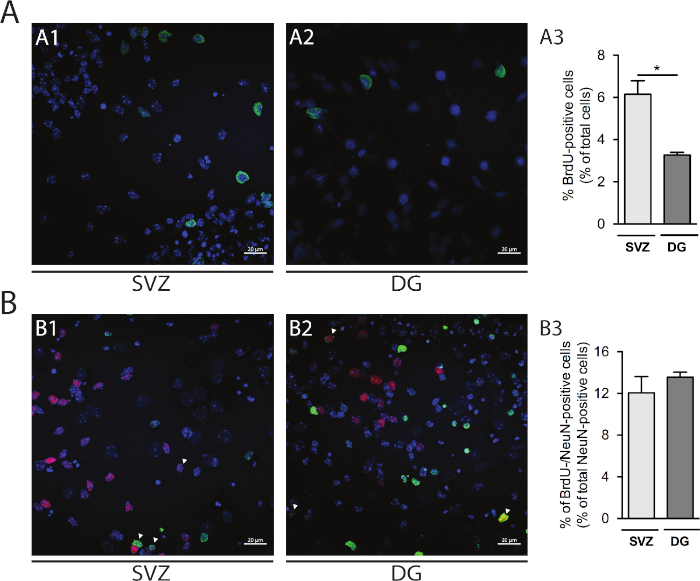
Figura 5: Ensaio de proliferação celular. Imagens confocais representativas de células BrdU-positivas em DIV1 em (A1) SVZ e (A2) DG. (A3) Análise quantitativa de células brdu-positivas em DIV1 na cultura de neurosfera diferenciada derivada de DG e SVZ. Os dados são expressos como média ± SEM, n = 4. *p < 0,05 por t-test. Imagens representativas de fluorescência de células BrdU e NeuN-positivas em DIV7 em (B1) SVZ e (B2) DG. As pontas das flechas indicam células brdU-/NeuN-positivas. (B3) Análise quantitativa de células BrdU-/NeuN-positivas em DIV7 em ambos os nichos. Os dados são expressos como média ± SEM, n = 4. BrdU: 5-bromo-2'-deoxyuridina, análogo de timmidina sintética. Clique aqui para ver uma versão maior desta figura.
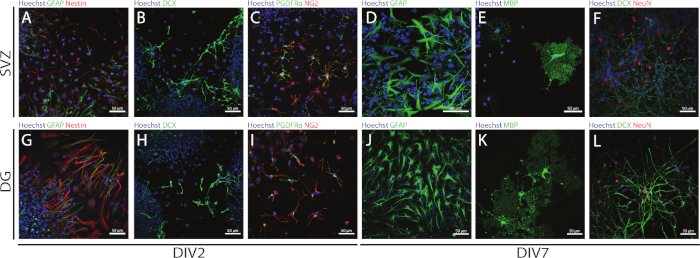
Figura 6: Tipos de células neurais presentes na cultura da neurosfera diferenciada derivada de SVZ e DG. Imagens representativas de fluorescência de tipos de células derivadas de SVZ e DG após 2 e 7 dias de diferenciação da neurosfera (DIV2 e DIV7), onde os núcleos celulares foram manchados com Hoechst 33342 (azul) e: (A,G) NSCs para GFAP (verde) e nestin (vermelho),(B,H) imaturos neurônios para DCX (verde), (C,I) células precursoras oligodendrocyte para PDGFRα (verde) e NG2 (vermelho),(D,J) osasócitos para GFAP (verde),(E,K) oligodendrócitos maduros para MBP (verde) e (F,L) neurônios maduros para NeuN (vermelho). Clique aqui para ver uma versão maior desta figura.
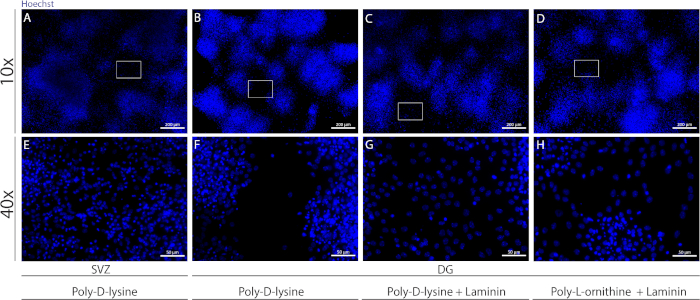
Figura suplementar 1: Testando diferentes substratos para adesão à neuroesfera e migração para formar uma pseudomonocamada. Imagens representativas de fluorescência de (A,E) pseudomonocamada derivada de SVZ usando poli-d-lisina como um substrato, (B,F) Pseudomonocamada derivada do DG usando poli-D-lisina como substrato, (C,G) pseudomonocamada derivada do DG usando poli-D-lisina com lamina como um substrato, e (D,H) pseudomonocamada derivada do DG usando poli-D-lysine com poli-L-ornitina como um substrato. Clique aqui para ver uma versão maior desta figura.
Discussão
Sistemas in vitro de NSPCs permitem uma melhor compreensão dos mecanismos celulares e moleculares, que podem ser validados ainda mais in vivo. A NSA é um método muito poderoso para imitar condições fisiológicas devido à sua estrutura tridimensional. Além disso, este sistema de cultura também é tecnicamente mais fácil de cultivar10, em comparação com outros sistemas in vitro, como o sistema de cultura de monocamadas. De fato, com a NSA, é fácil controlar as pistas extrínsecas expostas durante o desenvolvimento celular, seja durante a expansão ou a fase de diferenciação, adicionando quantidades precisas e variáveis de fatores de interesse para a mídia, bem como por cultivar neuroesferas com outros tipos celulares6. Além disso, em comparação com as culturas de monocamada, na ANS, é possível obter uma maior densidade celular a partir de uma pequena quantidade de tecido ou com um pequeno número de células, permitindo a realização de estudos paralelos, reduzindo assim o número de animais1.
A NSA é o método mais comum para isolar e expandir OSCs11,,12,,13, pode ser usado para estimar o número de células precursoras presentes em uma determinada amostra de tecido5 e a freqüência celular precursora entre diferentes condições. No entanto, tanto as neuroesferas quanto as culturas de monocamada não são responsáveis por quiescência NSCs14. Além disso, a ANS possui algumas limitações11,,12,,13 e a freqüência da neurosfera resultante depende de muitos fatores, incluindo os componentes médios, o procedimento de dissecção, o processo de dissociação11,12,13, e a agregação da neuroesfera5. De fato, em uma cultura de alta densidade, as neuroesferas tendem a se agregar. Consequentemente, deve-se ter cuidado ao estimar o número de células precursoras em uma amostra. Para superar as limitações acima, os NSPCs isolados também podem ser expandidos e passados em uma monocamada5,15. É importante ressaltar que o uso da NSA para comparar a freqüência celular precursora entre diferentes condições é muito útil e preciso porque todas essas limitações são implícitas e semelhantes entre todas as condições realizadas no mesmo experimento.
Há passos críticos na cultura da neurosfera que precisam de atenção. Na etapa de colheita cerebral, a remoção completa das meninges e o bom isolamento dos nichos neurogênicos são essenciais para maximizar a pureza e o rendimento dos NSPCs. Durante a dissociação tecidual, devido à atividade proteolítica da tripsina, o uso excessivo de tripsina ou tempos de incubação mais longos podem levar à lse celular. Além disso, o dia da passagem é fundamental para a obtenção de uma população saudável de neuroesferas. A passagem de neuroesferas com diâmetro superior a 200 μm afeta muito a viabilidade, a capacidade proliferativa e diferenciativa dos NSPCs. Importante, mais de 10 ciclos mais longos de passagens, mais de 10 podem aumentar a instabilidade genética6. Além disso, o revestimento com PDL e PLD/laminin para células SVZ e DG, respectivamente, é essencial para garantir uma boa migração celular para fora das neuroesferas sem comprometer o processo de diferenciação. Em termos de análise imunocitoquímica, tempos de incubação mais longos com PFA podem comprometer a coloração mascarando os antígenos e aumentando o fundo.
A NSA é uma poderosa ferramenta para fornecer uma fonte consistente e ilimitada de NSPCs para estudos in vitro de desenvolvimento neural e diferenciação, bem como para fins terapêuticos16,17. De fato, este ensaio pode ser aplicado a modelos genéticos e comportamentais para compreender melhor os mecanismos moleculares e celulares envolvidos na proliferação e diferenciação do INSS18,19. Este ensaio também é útil para testar diferentes drogas e compostos20,,21,22, bem como para realizar manipulações genéticas19,23 para modular as propriedades do NSC. Além da imunocitoquímica, a reação em cadeia de polimerase reversa e a análise de manchas ocidentais podem ser realizadas para acessar o RNA e a expressão proteica, enquanto estudos eletrofisiológicos e imagens de cálcio podem ser utilizados para avaliar a função dos neurônios recém-nascidos21.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho contou com o apoio do IF/01227/2015 e UID/BIM/50005/2019, projeto financiado pela Fundação para a Ciência e a Tecnologia (FCT)/ Ministério da Ciência, Tecnologia e Ensino Superior (MCTES) através dos Fundos do Orçamento de Estado. R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018) e R.S.R. (SFRH/BD/129710/2017) receberam bolsa da FCT. Os autores agradecem aos membros da unidade de bioimagem do Instituto de Medicina Molecular João Lobo Antunes pela assistência à microscopia.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Referências
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393(2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225(2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529(2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457(2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639(2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161(2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978(2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516(2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin? Frontiers in Cellular Neuroscience. 8, 59(2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados