Method Article
Isolement et expansion des neurosphères des niches neurogéniques de souris postnatales (P1-3)
Dans cet article
Résumé
Dans cet article, nous décrivons, en détail, un protocole pour la génération des cultures de neurosphère à partir de cellules souches neurales de souris postnatales dérivées des principales niches neogènes de souris. Les neurosphères sont utilisées pour identifier les cellules souches neuronales à partir de tissus cérébraux permettant l’estimation du nombre de cellules précurseurs. En outre, ces structures 3D peuvent être plaquées dans des conditions différenciatives, donnant lieu à des neurones, des oligodendrocytes et des astrocytes, permettant l’étude du destin cellulaire.
Résumé
L’analyse de la neurosphère est une technique in vitro extrêmement utile pour étudier les propriétés inhérentes des cellules souches/progénitrices neurales (NSPC), y compris la prolifération, l’auto-renouvellement et la multipotence. Dans le cerveau postnatal et adulte, les NSPC sont principalement présents dans deux niches neigogènes : la zone subventriculaire (SVZ) qui borde les ventricules latéraux et la zone sous-grulaire du gyrus denté hippocampal (DG). L’isolement des niches neigogènes du cerveau postnatal permet d’obtenir une plus grande quantité de NSPC dans la culture avec un avantage conséquent de rendements plus élevés. Le contact étroit entre les cellules de chaque neurosphère crée un microenvironnement qui peut ressembler à des niches neurogènes. Ici, nous décrivons, en détail, comment générer des cultures de neurosphère dérivées de SVZ et DG à partir de souris de 1 à 3 jours (P1-3), ainsi que de la passaging, pour l’expansion de la néurosphère. Il s’agit d’une approche avantageuse puisque l’analyse de la neurosphère permet une génération rapide de clones NSPC (6-12 jours) et contribue à une réduction significative du nombre d’utilisation animale. En placant les neurosphères dans des conditions différenciatives, nous pouvons obtenir un pseudomonolayer de cellules composées de NSPC et de cellules différenciées de différentes lignées neurales (neurones, astrocytes et oligodendrocytes) permettant l’étude des actions des facteurs intrinsèques ou extrinsèques sur la prolifération du NSPC, la différenciation, la survie cellulaire et la néuritogenèse.
Introduction
L’analyse de la neurosphère (NSA) a d’abord été décrite en 19921,2 et reste un outil unique et puissant dans la recherche sur les cellules souches neurales (NSC). L’isolement des CNS des principales régions neigogènes a des problèmes difficiles parce que les exigences pour maintenir ces cellules dans des conditions physiologiques restent mal comprises. Dans la NSA, les cellules sont cultivées dans un milieu chimiquement défini sans sérum avec la présence de facteurs de croissance, y compris le facteur de croissance épidermique (EGF) et le facteur de croissance fibroblastique de base (bFGF)1,2,3. Les cellules précurseurs neuronales (cellules souches et progénitrices) sont sélectionnées en utilisant ces mitogènes puisque ces cellules sont EGF et FGF-sensible entrant dans une période de prolifération active tandis que d’autres cellules, à savoir les cellules différenciées, meurent4. Les cellules précurseurs neuronales se développent sous forme de neurosphères, qui peuvent ensuite être adoptées pour élargir davantage le bassin de ces cellules5. Fait important, puisque ces cellules progénitrices de tiges neurales (NSPC) sont multipotentes, elles sont capables de se différencier en trois principaux types cellulaires du système nerveux central (CNS) : neurones, oligodendrocytes et astrocytes5.
La NSA fournit une source renouvelable de précurseurs indifférents du SNC, qui peuvent être utilisés pour étudier plusieurs processus, y compris la prolifération et l’auto-renouvellement de la CSN, et la différenciation neuronale et gliale, dans le contexte physiologique et de la maladie. En outre, les études in vitro peuvent être utilisées pour évaluer le degré de spécification intrinsèque présente chez les précurseurs neuronaux pendant le développement, ainsi que pour étudier le plein potentiel des cellules, en enlevant les indices extrinsèques associés à leur environnement normal6. Le modèle de neurosphère est précieux pour évaluer les régulateurs putatifs car en maintenant les cellules dans un milieu dépourvu de sérum, les indices environnementaux ne sont fournis que par les cellules environnantes6. En outre, dans la NSA, les NSPC sont facilement élargis dans la culture, la densité des cellules par zone est élevée et la composition hétérogène des neurosphères a une certaine similitude avec les niches in vivo6. Ces avantages bien établis sont la raison pour laquelle cette méthodologie a été largement utilisée par de nombreux chercheurs.
Le protocole suivant décrit en détail tous les processus de l’isolement de la population postnatale NSPC des deux principales régions neogènes, la zone subventriculaire (SVZ) et le gyrus dentifrice hippocampique (DG), à l’expansion de ces cellules comme néurosphères, ainsi qu’à la différenciation dans les neurones, les astrocytes et les oligodendrocytes. Enfin, différents essais sont également décrits pour accéder aux propriétés de tige et de multipotence des NSPC dérivés de la SVZ et de la DG.
Protocole
Toutes les expériences ont été réalisées conformément à la Communauté européenne (86/609/CEE; 2010/63/UE; 2012/707/UE) et à la législation portugaise (DL 113/2013) pour la protection des animaux utilisés à des fins scientifiques. Le protocole a été approuvé par le "Corps institutionnel de bien-être animal de l’IMM - ORBEA-iMM et l’autorité compétente nationale - DGAV (Direcço Geral de Alimentaçào e Veterinària)."
1. Configuration de base et préparation du milieu de la culture
- Le jour de la dissection, préparez la quantité appropriée de milieu de croissance correspondant au milieu sans sérum (SFM) composé du milieu aigle modifié de Dulbecco [(DMEM)/F12 avec L-glutamine](Tableau des matériaux) complété par 100 P/ML pénicilline et 100 G/mL streptomycine (pen/sreprep), 1% B27, avec également 10 ng/mL EGF et 5 ng/mL bFGF. Réchauffer la culture à 37 oC dans un bain d’eau.
REMARQUE : Le volume de croissance moyenne dépend du nombre de chiots, car 5 chiots préparent 100 ml (50 ml pour SVZ et 50 ml pour la DG); cependant, après avoir compté le nombre de cellules (étape 5.1), le volume exact devra être ajusté. - Pour la microdissection de SVZ et DG, préparez le milieu de dissection équilibré de la solution saline équilibrée (HBSS) sans calcium et sans magnésium (HBSS) complété par un stylo/streptocoque de 100 U/mL.
REMARQUE : Préparer 50 à 100 ml de milieu de dissection. - Installez un microscope à dissection et préparez les outils nécessaires pour enlever le cerveau (ciseaux et petites spatules) et pour les microdissections SVZ et DG (petits ciseaux Dumont, forceps #7, forceps #5, #5S forceps) en trempant dans 70% d’éthanol.
2. Récolte des cerveaux de souris postnatals (P1-3) et des microdissections SVZ/DG
- Préparer des plats Petri de 60 mm (zone de croissance 21 cm2) avec HBSS complétés par un stylo/streptococcie et 2 tubes d’échantillon (un pour SVZ et un pour la DG) avec 500 L de HBSS complété chacun.
- Euthanasier les chiots souris (P1-3) selon le protocole approuvé par l’établissement de soins aux animaux /lignes directrices. Effectuez la décapitation avec une seule incision avec des ciseaux pointus à la base du tronc cérébral.
- Tenant la partie ventrale du corps à la base de la tête et à l’aide de petits ciseaux pointus, faire une incision de ligne médiane dans la peau sur toute la longueur de la tête, révélant ainsi la surface du crâne.
- Faire une incision longitudinale à la base du crâne et continuer à couper le long de la suture sagittale à l’aide de petits ciseaux avec un angle peu profond que possible afin d’éviter d’endommager les structures du cerveau.
- Peler le crâne sur les côtés à l’aide de forceps incurvés et exposer le cerveau.
AVERTISSEMENT : Assurez-vous que les instruments de dissection sont exempts d’éthanol avant de toucher le cerveau. - Isolez le cerveau du crâne à l’aide d’une petite spatule, en glissant sous la base du cerveau pour couper les nerfs crâniens et les vaisseaux sanguins qui sont connectés à la base du cerveau, et transférer le cerveau dans un plat Petri contenant la solution HBSS froidement complétée.
- Placez le plat Petri contenant le cerveau sous un microscope disséquant à faible grossissement et placez le cerveau sur sa surface dorsale.
- À l’aide de forceps fins, retirez les méninges du côté ventral du cerveau et des ampoules olfactives, tout en maintenant le cerveau en position par le cervelet. Faites pivoter le cerveau sur l’aspect ventral et décollez le reste des méninges.
REMARQUE : L’élimination des méninges dorsales est une étape cruciale pour assurer un coup de découpage correct du cerveau. - Jeter le cervelet en faisant une coupe à l’aide de forceps. Placez un papier filtre d’une taille de pore de 11 m sur un hélico de tissu(tableau des matériaux) et placez le cerveau sur le papier filtre à l’aide de forceps incurvés. Hacher le cerveau en sections coronales de 450 m et utiliser une lamina humide pour recueillir le cerveau sectionné dans un nouveau plat Petri rempli de HBSS complété par le froid.
- Pour disséquer le SVZ, utilisez des forceps pour séparer les tranches coronales d’une manière antérieure à postérieure jusqu’à ce qu’elles atteignent les tranches avec les ventricules latéraux, sous un microscope disséquant.
- Couper la fine couche de tissu entourant la paroi latérale des ventricules (qui correspond à la SVZ) avec de fines forceps, à l’exclusion du parenchyme striatal et du corpus callosum. Isoler le SVZ en plaçant la pointe des forceps dans les coins latéraux du ventricule latéral : l’un immédiatement sous le callosum de corpus et l’autre dans le tissu immédiatement adjacent à la zone ventrale du ventricule latéral. Ensuite, couper une petite ligne de tissu entourant le ventricule latéral.
- Recueillir le tissu disséqué dans un tube d’échantillon avec la solution HBSS complétée précédemment identifiée comme SVZ.
REMARQUE : Exclure la ZSV en tranches où les ventricules latéraux et la formation hippocampe commencent à apparaître. - Passez par toutes les tranches après la microdissection SVZ d’une manière antérieure à postérieure et atteindre la formation hippocampique. À l’aide de forceps, jetez la première tranche avec de l’hippocampe où la DG est encore méconnaissable.
- Pour enlever le DG, d’abord isoler l’hippocampe des tranches. Recentrer le microscope pour visualiser les frontières autour de la DG.
- Disséquer la partie DG en effectuant une coupure entre la région de la DG et du CA1 suivie d’une coupe verticale entre la DG et la région CA3 à l’aide de forceps. Enlever la fimbria et tout tissu adjacent.
REMARQUE : Chez les animaux P1-3, le DG est presque indiscernable de la corne d’Ammon, mais affiche une petite pointe. - Recueillir le tissu disséqué dans un tube d’échantillon contenant des solutions HBSS complétées précédemment identifiées comme DG.
REMARQUE : Les blessures globales à l’hippocampe ou à la région environnante rendront plus difficile l’isolement de la DG. L’utilisation d’un atlas du cerveau de souris postnatale est essentielle lorsque l’utilisateur n’est pas familiarisé avec l’isolement du SVZ et du tissu DG des sections coronales.
3. Dissociation tissulaire
- Pour dissocier les tissus SVZ et DG présents dans leurs tubes respectifs, ajoutez 0,05 % trypsin-EDTA pour avoir une concentration finale de 5 à 10 % de Trypsin-EDTA 0,05 % dans le SBSS. Incuber pendant environ 15 minutes à 37 oC, jusqu’à ce que le tissu soit aggloméré.
- Laver le tissu de la trypsine en enlevant les médias et en ajoutant 1 ml de nouvelle solution HBSS complétée pour 4 fois consécutives.
- Retirez le HBSS et réutilisez le tissu digéré dans 1 ml de SFM complété par 10 ng/mL EGF et 5 ng/mL bFGF. Dissocier mécaniquement le granule en faisant monter et descendre doucement à l’aide d’une pipette P1000, jusqu’à ce qu’elle soit homogène.
CAUTION : La dissociation mécanique excessive peut mener à la mort accrue de cellules et affectera négativement la croissance suivante de cellules.
4. Analyse de paire de cellules pour étudier le destin cellulaire
- Avant l’expérience, préparer des plaques enduites de 24 puits pour les cultures monolyer adhérentes selon les sections 8-10.
- Pour compter le nombre de cellules SVZ ou DG (obtenues à la section 3) à plaquer, utilisez une solution contenant 0,2% de bleu Trypan et comptez les cellules à l’aide d’un hématocytomètre.
- Diluer la suspension cellulaire dissociée dans SFM complétée par 5 ng/mL EGF et 2,5 ng/mL bFGF (faible EGF/bFGF) à une densité de 11 300 cellules/cm2 et les plaquer sur des housses en verre enduit.
- Après 24 h, fixez les cellules pour l’immunocytochemistry contre des marqueurs de NSC tels que la région de détermination de sexe 2 (Sox2) et la nestin aussi bien qu’avec un marqueur de la lignée neuronale (à savoir la doublecortine [DCX], pour les neurones immatures) (voir la section 14).
REMARQUE : Sox2 est un marqueur des CNS qui subissent une mitose. Sox2paires de cellules résultant d’une seule division de cellules progénitrices reflète l’expansion des cellules souches7.
5. Expansion des cellules souches neurales postnatales en tant que néurosphères
- Pour déterminer la densité de la suspension dissociée de la SVZ ou de la cellule DG (obtenue à la section 3), comptez les cellules à l’aide d’un hématocytomètre.
- Diluer la suspension à cellule unique SVZ et DG à une densité de 2 x 104 cellules/mL en SFM complétée par 10 ng/mL EGF et 5 ng/mL bFGF. Cellules SVZ et DG de graines dans des plats Petri non revêtus de 60 mm avec un volume final de 5 ml/Petri plat.
- Incuber les cellules SVZ et DG pendant 6 à 8 jours et 10 à 12 jours, respectivement pour former des neurosphères primaires, à 37 oC avec 5% de CO2.
REMARQUE : Les jours d’incubation plus que ceux mentionnés peuvent favoriser l’agrégation des néurosphères et des niveaux plus élevés de mort cellulaire dans le centre de la neurosphère. - Lorsque la majorité des neurosphères ont un diamètre de 150 à 200 m, effectuez le passage de la neurosphère.
REMARQUE : Les néurosphères de passage lorsqu’elles n’ont pas de diamètre approprié comprometnt toutes les étapes suivantes.
6. Passaging des neurosphères
REMARQUE : Le protocole suivant peut être appliqué pour étendre les neurosphères SVZ et DG.
- Pour passer les neurosphères, recueillir le SFM avec des facteurs de croissance contenant des neurosphères à partir du plat De 60 mm Petri(es) et la centrifugeuse pendant 5 min à 300 x g.
- Jetez le supernatant et réutilisez la granule de neurosphère à l’aide d’un kit de dissociation chimique (souris) selon les instructions du fabricant(Tableau des matériaux).
REMARQUE : Observez les temps d’incubation précisément car ils sont cruciaux pour la performance. - Centrifugeuse pour 5 min à 300 x g,retirer le supernatant et ajouter 1 mL de SFM complété par 10 ng/mL EGF et 5 ng/mL bFGF.
- Triturate de haut en bas d’environ 10x avec une pipette P1000 pour dissocier les néurosphères.
- Comptez le nombre de cellules à l’aide d’une solution contenant 0,2 % de bleu Trypan et un hématocytomètre.
- Cellules reseed à une densité de 2 x 104 cellules/mL dans les plats Non couchés de 60 mm Petri.
- Incuber les cellules SVZ et DG pendant 6 à 8 jours et 10 à 12 jours, respectivement pour obtenir des neurosphères secondaires, à 37 oC avec 5% de CO2.
REMARQUE : La capacité d’auto-renouvellement des NSPC dérivés de SVZ et de DG peut être consultée en suivant les sections 5 et 6 du protocole. Pour cela, les cellules SVZ et DG de semences à une densité de 1,0 x 104 cellules/mL (en plaques non couchées de 24 puits) dans le milieu de croissance SFM contenant 5 ng/mL EGF et 2,5 ng/mL bFGF (faible EGF/bFGF). Comptez le nombre de neurosphères primaires et secondaires qui en résultent.
7. Stockage des neurosphères
- Recueillir le milieu contenant des neurosphères (obtenues à partir des étapes 5.3 et 6.7) des plats Petri de 60 mm.
- Centrifugeuse pendant 5 min à 300 x g et jeter le supernatant.
- Laver les cellules 2x avec 1 mL de HBSS (5 min à 300 x g).
- Centrifugeuse pendant 5 min à 300 x g,jeter le supernatant et stocker le granulé de neurosphères à -20 oC pour l’analyse de biologie moléculaire.
8. Procédure de plaque de revêtement PDL
- Pour préparer la solution 1 (0,1 M tampon de borate), peser 3,92 g d’acide borique et diluer dans 400 ml d’eau de haute pureté. Ajuster le pH à 8,2 et faire jusqu’à 500 ml d’eau de haute pureté.
- Pour préparer la solution 2 (0,167 M tampon de borate), peser 10,3 g d’acide borique et diluer dans 900 ml d’eau de haute pureté. Ajuster le pH à 8,2 et faire jusqu’à 1000 ml d’eau de haute pureté.
- Pour reconstituer poli-D-lysine (PDL) (1 mg/mL dans 0,1 M tampon de borate), diluer 100 mg de PDL dans 100 ml de solution 1.
- Faire des aliquots de 10 ml à utiliser immédiatement ou congeler et stocker à -20 oC.
- Sous le flux lamineur, ajouter 1 coverlip par puits et stériliser sous la lumière UV pendant 15 min.
- Utilisez le PDL reconstitué ou le dégel congelé de PDL reconstitué.
- Préparer la solution finale de 100 G/mL PDL en tampon de 0,167 M borate en ajoutant 10 ml de PDL reconstitué à 90 ml de solution 2.
- Ajoutez la solution finale aux puits pour un minimum de 2 h à la nuit à 37 oC.
REMARQUE : Pour les plaques de 24 puits, ajoutez un volume de 500 L dans chaque puits. - Retirez la solution et lavez 3x avec de l’eau de haute pureté.
- Laisser sécher les coverlips dans le capot de flux lamineur.
- Laissez les plaques de culture multi-puits à 4 oC.
9. Procédure de plaque de revêtement PDL/Laminin
- Le jour 1, enrober les plaques de PDL comme décrit à la section 8.
- Le jour 2, retirez la solution PDL et lavez 3x avec de l’eau de haute pureté. Laisser sécher.
- Préparer le laminin de 5 g/mL dans le SFM froid dépourvu de facteurs de croissance.
- Ajouter la laminine dissoute aux reprises et incuber à 37 oC pendant la nuit.
REMARQUE : Pour les plaques de 24 puits, ajoutez un volume de 500 L dans chaque puits. - Retirer le laminin à l’aide d’une pipette.
REMARQUE : Ne lavez pas les couvertures de laminine. - Utiliser immédiatement ou entreposer à -20 oC.
10. Poly-L-ornithine (PLO) /procédure de revêtement laminin
- Sous le flux lamineur, ajouter un coverlip par puits et stériliser sous la lumière UV pendant 15 min.
- Ajouter 0,01% de solution PLO à chaque puits pendant 20 minutes à température ambiante (RT).
REMARQUE : Pour les plaques de 24 puits, ajoutez un volume de 500 L dans chaque puits. - Retirez la solution et lavez 3x à l’adresse stérilisée 1x PBS. Laisser sécher.
- Préparer le laminin de 5 g/mL dans le sterile 1x PBS.
- Incuber pendant 2 h à 37 oC.
- Retirer le laminin.
REMARQUE : Ne lavez pas les couvertures de laminine. - Utilisez immédiatement.
REMARQUE : Assurez-vous que le coverlip est entièrement recouvert par la solution PLO en tapant doucement sur le coverlip avec une pointe de pipette. Lorsqu’elles sont secouées, les plaques multi-puits ne doivent pas faire de bruit.
11. Évaluation de la neuritogenesis en générant un monolayer différencié de la cellule
- Recueillir des supports contenant des neurosphères à partir de plats Petri de 60 mm (obtenus à partir de la section 5) et une centrifugeuse pendant 5 min à 300 x g à RT.
- Jetez le supernatant et dissociez le granulé de néurosphères dans 1 ml de DISsociation PBS (c.-à-d., PBS sans Mg2 '/Ca2 ' et avec EDTA [2,7 mM KCl, 1,5 m KH2PO4, 137 mM NaCl, 8,1 mM Na2HPO4 et 0,5 mM EDTA 4Na, à pH à 7,40)) en incuber pendant 15 min suivi de dissociation mécanique. Alternativement, dissocier les néurosphères à l’aide d’un kit de dissociation chimique (souris)(Tableau des matériaux).
- Centrifugeuse pendant 5 min à 300 x g à RT et jeter le supernatant.
- Résuspendez la pastille de cellules dans 1 ml de SFM dépourvue de facteurs de croissance.
- Déterminer la densité cellulaire à l’aide d’un hématocytomètre.
- Diluer la suspension cellulaire dissociée dans SFM dépourvue de facteurs de croissance à une densité de 3 766 cellules/cm2 et de cellules de plaque sur des couvertures en verre enduites dans des plaques de 24 puits.
- Après 1 à 3 jours, fixez les cellules pour l’immunocytochemistry contre une protéine du cytosquelette (voir la section 14).
12. Différenciation des cultures de néurosphère
REMARQUE : Les neurosphères obtenues à partir de l’expansion cellulaire, soit à partir de neurosphères primaires ou de passage (obtenues dans les sections 5 ou 6) peuvent être différenciées en cellules de différentes lignées neuronales.
- Lorsque les neurosphères ont un diamètre de 150 à 200 m, collectez 25 L de suspension de neurosphère moyenne et plaque sur des couvertures en verre enduit, dans des plaques de 24 puits.
REMARQUE : Pour recueillir plus de neurosphères, faites pivoter doucement le plat Petri pour concentrer les neurosphères au centre. Puis, pipette du centre. - Mettre les plaques dans un incubateur à 37 oC pendant 15 minutes afin que les neurosphères adhèrent au substrat. Ensuite, ajoutez 500 L de SFM dépourvus de facteurs de croissance (conditions différenciantes).
- Après 24 h, remplacez le milieu par un SFM frais dépourvu de facteurs de croissance.
- Différencier pour différents points de temps (p. ex., 2 et 7 jours in vitro, DIV2 et DIV7, respectivement) avec 5% de CO2 et 95% d’air atmosphérique à 37 oC.
REMARQUE : La survie, la prolifération et la différenciation cellulaires peuvent être analysées à l’aide de différents essais cellulaires.
13. Essais de biologie cellulaire
- Analyse de survie cellulaire
- Exposer les neurosphères plaquées à 3 g/mL propidium iodide (PI) pendant 30 min avant fixation cellulaire dans l’incubateur à 37 oC.
REMARQUE : L’IP est un agent autofluorescent qui n’est capable d’entrer que dans les cellules avec l’intégrité de membrane compromise8. D’autres méthodes d’analyse de la survie cellulaire peuvent être utilisées telles que la tache de caspase 3 ou l’essai de transfert de dUTP de de deoxynucleotidyl terminale.
- Exposer les neurosphères plaquées à 3 g/mL propidium iodide (PI) pendant 30 min avant fixation cellulaire dans l’incubateur à 37 oC.
- Analyse de prolifération cellulaire
- Exposer les neurosphères plaquées à 10 M 5-bromo-2'-deoxyuridine (BrdU) pendant 4 h avant fixation dans l’incubateur à 37 oC.
REMARQUE : BrdU est un analogue synthétique de thymidine qui peut être incorporé pendant la synthèse d’ADN dans les cellules proliférantes9.
- Exposer les neurosphères plaquées à 10 M 5-bromo-2'-deoxyuridine (BrdU) pendant 4 h avant fixation dans l’incubateur à 37 oC.
- Analyse de différenciation cellulaire
- Exposez les neurosphères plaquées de 7 jours à 10 M BrdU dans les 24 premiers h, dans l’incubateur à 37 oC.
- Renouveler la SFM dépourvue de facteurs de croissance (conditions différenciantes) et permettre aux cellules de se développer en l’absence de BrdU pendant les 6 jours suivants jusqu’à la fixation.
REMARQUE : Ces expériences de chasse au pouls, en co-étiquetant avec des marqueurs de cellules neurales matures, permettent l’évaluation des cellules progénitrices qui se différencient en cellules matures pendant le protocole.
14. Immunostaining des cultures de neurosphère
- Fixation cellulaire
- Préparer 4 % de paraformaldéhyde (PFA) en 1x PBS et entreposez à 4 oC ou -20 oC.
- Retirez le SFM dépourvu de facteurs de croissance des puits et ajoutez, à chaque puits, 500 L de 4% de PFA à 4 oC pendant 20 min à RT.
- Laver 3x avec 1x PBS, pendant 5 minutes à chaque fois, les coverlips contenant des neurosphères différenciées.
- Entreposez les reprises jusqu’à l’utilisation dans 500 L de 1x PBS à 4 oC.
REMARQUE : Si l’expérience n’a pas De BrdU, sautez à l’étape 14.3.
- Méthode de dénaturation (pour les expériences BrdU seulement)
- Préparer 1 M HCl à 37 oC.
- Rincer coverslips 3x en 1x PBS.
- Perméabiliser les cellules pendant 30 min dans PBS contenant 1% de surfactant non ionique (par exemple, Triton X-100).
- Denature dsDNA avec 1 M HCl préchauffé à 37 oC pendant 30-40 min à 37 oC (300 l/l/puits).
- Laver les puits 4x avec 1x PBS.
- Perméabilisation et blocage
- Rincer les coverlips en 1x PBS pendant 5 min.
- Incubate pour 1,5 h avec 0,5% de surfactant non ionique et 3% de sérum bovin albumin (BSA) en 1x PBS (300 'L/puits).
REMARQUE: Pour NeuN, utilisez 6% de BSA dans 1x PBS.
- Incubation et montage
- Le jour 1, sans lavage, incuber les cellules avec anticorps primaires (Tableau des matériaux) dans 0,1% surfactant non ionique et 0,3% BSA en 1x PBS dans la chambre d’incubation (pour 24-puits plaques utilisent 20 'L/puits). Laissez les couvertures incuber pendant la nuit à 4 oC de lumière protégée si les anticorps sont conjugués à un fluorophore.
- Le jour 2, retourner les couvertures à leurs puits respectifs et rincer 3x en 1x PBS pendant 5 min.
- Contre-détention avec des anticorps secondaires conjugués de fluorescence appropriés (dilution 1:200) et avec 12 'g/mL Hoechst 33342 en 1x PBS pour 2 h à RT et lumière protégée dans la chambre d’incubation (20 L/coverslip).
- Laver les coverlips 3x en 1x PBS pendant 5 min.
- Monter des couvertures sur des lames de microscope à l’aide de 5 L/coverslip de fluorescence de montage moyen.
- Laissez les couvertures sécher à l’air à RT, à l’abri de la lumière, pendant 1 jour.
- Microscopie
- Afficher et acquérir des images à l’aide d’un microscope à fluorescence.
- Pour chaque condition, utilisez trois répliques. Effectuez des nombres de cellules dans cinq champs microscopiques indépendants dans chaque coverlip avec un objectif 40x (100 cellules par champ).
15. Préparation des solutions d’actions EGF et bFGF
- Solution d’actions EGF
- Pour reconstituer lyophilized EGF, diluer le produit dans de l’eau de haute pureté pour atteindre une concentration finale de 20 g/mL.
- Aliquot et stocker dans des microtubes à -5 à -20 oC.
- solution d’actions bFGF
REMARQUE : bFGF doit être reconstitué avec une solution de 10 mM Tris, pH 7.6.- Centrifugez brièvement la fiole avant l’ouverture pour amener le contenu au fond.
- Préparer 50 mL de 10 mM Tris, pH 7,6. Pour cela, peser 60,57 mg de Tris ((HOCH2)3CNH2) et le diluer dans 40 ml d’eau de haute pureté. Ajuster le pH à 7,6 et faire jusqu’à 50 ml d’eau de haute pureté.
- Préparer 10 mL de 0,1% BSA en 10 mM Tris, pH 7,6. Pour cela, peser 10 mg de BSA et le diluer en 10 ml de Tris de 10 mM.
- Solutions de filtre préparées dans les étapes 15.2.2 et 15.2.3 avec un filtre de 0,22 m sous un capot de flux lamineur.
- Reconstituer 10 g de bFGF dans 1 000 L de 0,1 % de BSA en 10 mM Tris avec pH 7,6 pour atteindre une concentration finale de 10 g/mL. Aliquot en microtubes à -20 oC pendant un maximum de 6 mois.
Résultats
Les neurosphères SVZ et DG, obtenues à l’aide de la NSA, sont composées de cellules indifférentes, positives pour Sox2, un facteur de transcription impliqué dans la capacité d’auto-renouvellement et positive pour la nidtine, une protéine intermédiaire de filament exprimée dans les PNS (figure 1A). En outre, les neurosphères dérivées de SVZ ont des dimensions plus grandes que leurs homologues DG(figure 1A). Fait important, dans des conditions différenciantes, les NSPC dérivés de SVZ et de DG migrent hors des neurosphères formant un pseudomonolayer des cellules(figure 1B).
Pour accéder à la capacité d’auto-renouvellement, l’analyse de paire de cellules est effectuée basée sur l’expression de Sox2 et nestin qui tend à disparaître dans les cellules de division qui commencent le processus de différenciation avec une combinaison d’un marqueur de la lignée neuronale à savoir, DCX. Dans les deux régions neurogènes, il est possible d’observer la présence de Sox2/nestin/DCX-/- divisions symétriques (auto-renouvellement)(figure 2A1,B1), Sox2-/nestin-/MD/DCXLes divisions asymétriques(figure 2A1,B2) et Sox2-/-/nestin-/-/DCX-/md divisions symétriques (différenciation)(figure 2A2,B1).
Le fait de passer les néurosphères augmente le rendement des CSN; cependant, la mort cellulaire à DIV2 change avec le passage. En fait, le pourcentage de cellules PI-positives est augmenté avec le passage cellulaire dans SVZ (P0: 15,6% - 1,2% vs P1: 19,2% - 2,7% vs P2: 32,35% - 0,14% vs P3: 39,6% - 4,0%) et en DG (P0: 16,31% - 0,95% vs P1: 32,1% - 1,7% vs P2: 27,42% vs P3: 32,2% - 3,1%) (Figure 3).
La neuritogénèse peut être évaluée dans les neurones obtenus à partir de la différenciation des NSPC SVZ et DG au début de la différenciation : DIV1(figure 4A,D), DIV2(figure 4B,E) et DIV3(figure 4C,F). En fait, comme l’observe la figure 4, la longueur et la ramification des neurites augmentent avec différenciation.
La prolifération cellulaire peut être évaluée dans les néurosphères dérivées de SVZ et de DG. En comparant les neurosphères différenciées primaires à la DIV1 de SVZ(figure 5A1) et DG(figure 5A2), le pourcentage de cellules brdU-positives est plus élevé en SVZ que dans la DG (SVZ: 6,15% - 0,64% vs DG: 3,27% - 0,13%; p 'lt; 0.05; n '4; Figure 5A3). En outre, la différenciation cellulaire peut également être consultée en combinant la coloration BrdU avec un fabricant mature tel que les noyaux neuronaux (NeuN) qui identifie les neurones matures(figure 5B1,B2). La figure 5B3 montre que le pourcentage d’ancêtres proliférants qui se différencient en neurones matures est similaire dans SVZ et DG (SVZ : 12,04 % - 1,58 % vs DG : 13,56 % et 0,48 % ; p 'gt; 0,05; n ' 4).
La tige et la multipotence des NSPC dérivés de SVZ et de DG peuvent être consultées à l’aide de la NSA en évaluant l’expression de différents marqueurs à différents jours de différenciation (DIV2 et DIV7). En effet, les CNS (protéine acide fibrillaire et gliales de nidification [GFAP]-double-positives) sont présentes dans les deux régions neigogènes(figure 6A,G). Ces cellules sont capables de se différencier en neurones immatures (cellules séroposées DCX) (figure 6B,H), neurones matures (cellules NeuN-positives) (Figure 6F,L), cellules précurseurs oligodendrocyte (antigène neuronal-glial 2 [NG2] et récepteur de facteur de croissance dérivé de plaquettes Cellules positives(figure 6C,I),oligodendrocytes matures (myelin basic protein [MBP]-positive cells)(figure 6E,K)et astrocytes (cellules GFAP-positives)(figure 6D,J).
Différents substrats peuvent être utilisés pour enrober les coverlips pour former le pseudomonolayer des cellules dans des conditions différenciatives. Comme le montre la figure supplémentaire 1, les cellules DG migrent plus lorsque les reprises ont un revêtement extra-enduit avec du stratifié combiné avec de l’OLP ou du PDL qu’avec PDL seul(figure supplémentaire 1B-H). En fait, lorsque le PDL et la laminine sont utilisés ensemble comme substrats(figure supplémentaire 1C,G), les cellules DG forment un pseudomonolayer plus confluent que les cellules SVZ pour lesquelles PDL est utilisé seul(figure supplémentaire 1A,E).
Fait important, ces résultats démontrent le potentiel de la NSA d’évaluer les propriétés de tige et de multipotence des NC dérivées des deux principales niches neigogènes.
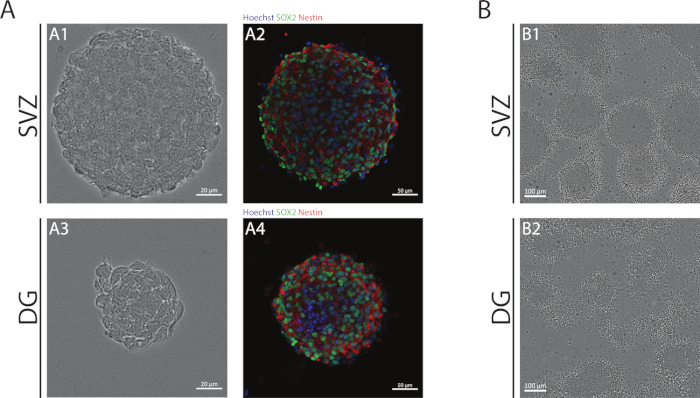
Figure 1 : Zone subventriculaire et gyrus denté dérivé NSPC cultivé comme neurosphères ou comme pseudomonolayers. (A) Représentatif champ lumineux (A1,A3) et fluorescence (A2,A4) images de neurosphères dérivées de SVZ et DG, où les noyaux ont été tachés de Hoechst 33342 (bleu) et de NSCs pour Sox2 (vert) et nestin (rouge). (B) Représentatif des images de champs lumineux de pseudomonolayers générés à partir de neurosphères dérivées de SVZ et DG dans des conditions différenciatives. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
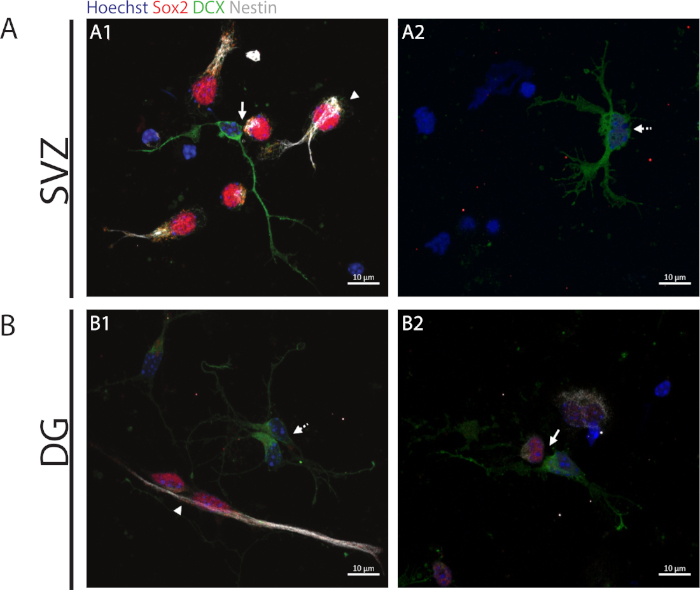
Figure 2 : Le test de paire de cellules. Images représentatives de fluorescence des paires de cellules dérivées d’une division de cellules progénitrices. Les noyaux de SVZ et de DG ont été tachés de Hoechst 33342 (bleu), de cellules souches pour Sox2 (rouge) et de nestin (blanc) ainsi que de neurones immatures avec DCX (vert). Les pointes d’flèche dans les panneaux+/+A1 et B1 indiquent que les divisions d’auto-renouvellement symétriques de Sox2/nestin//DCX,/ les flèches dans les panneaux A1 et B2 indiquent Sox2-/-/nestin-/-/DCX-/MD divisions asymétriques, flèches de ligne pointillées dans les panneaux A2 et B1 montrent Sox2-/-/nestin-/-/DCX- / divisions de différenciation symétrique.+/+-/- S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
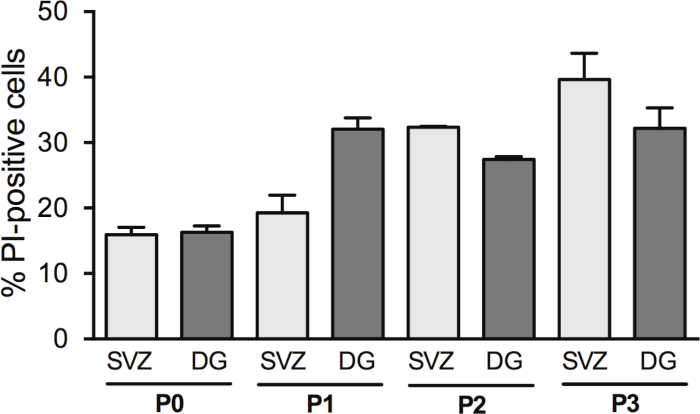
Figure 3 : Analyse de survie cellulaire avec passage cellulaire. Analyse quantitative des cellules IP-positives à DIV2 dans la culture différenciée de neurosphère dérivée de SVZ et de DG, après 0, 1, 2 et 3 passages (P0-P3). Les données sont exprimées comme moyennes ' SEM, n ' 1'8. PI et propidium Iodide. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
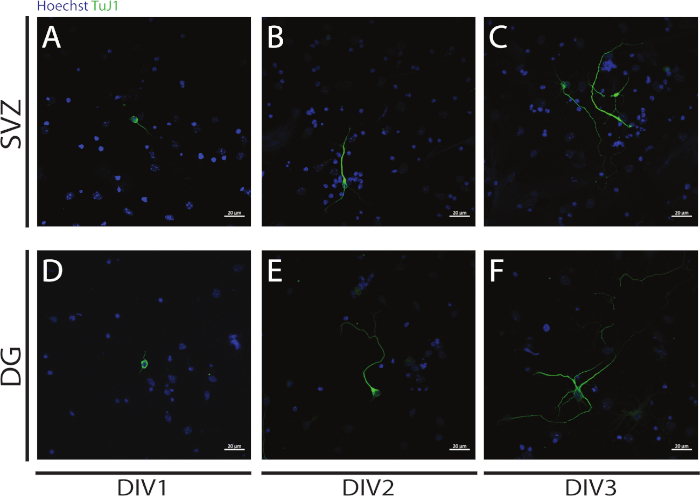
Figure 4 : Analyse de neuritogenesis chez DIV 1, 2 et 3. Images représentatives de fluorescence confocale de neurites, identifiées par le signal de l’III-tubulin, dans les neurones SVZ et DG à (A,D) DIV1, (B,E) DIV2, et (C,F) DIV3. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
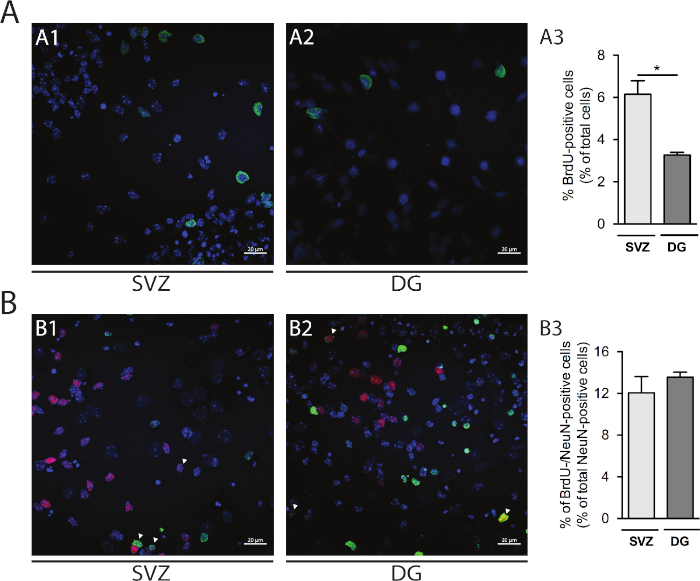
Figure 5 : Analyse de prolifération cellulaire. Images confocales représentatives des cellules brdU-positives à DIV1 in (A1) SVZ et (A2) DG. (A3) Analyse quantitative des cellules brdU-positives à DIV1 dans la culture différenciée de neurosphère différenciée dérivée de DG et de SVZ. Les données sont exprimées comme moyennes ' SEM, n ' 4. p 'lt; 0.05 par t-test. Images représentatives de fluorescence des cellules brdU- et NeuN-positives à DIV7 dans (B1) SVZ et (B2) DG. Les pointes de flèche indiquent les cellules brdU-/NeuN-positives. (B3) Analyse quantitative des cellules BrdU-/NeuN-positives chez DIV7 dans les deux niches. Les données sont exprimées comme moyennes ' SEM, n ' 4. BrdU: 5-bromo-2'-deoxyuridine, analogue synthétique de thymidine. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
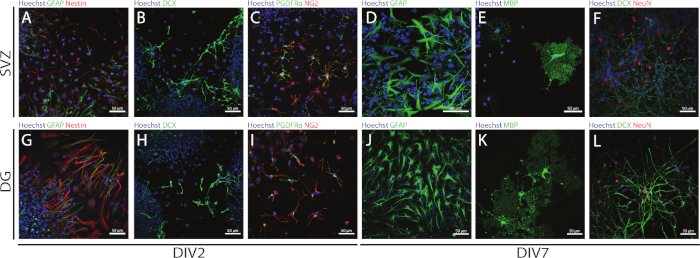
Figure 6 : Types de cellules neurales présents dans la culture différenciée de neurosphère dérivée de SVZ et de DG. Images représentatives de fluorescence des types de cellules dérivées de SVZ et de DG après 2 et 7 jours de différenciation de la néurosphère (DIV2 et DIV7), où les noyaux cellulaires étaient tachés de Hoechst 33342 (bleu) et : (A,G) NSCs pour GFAP (vert) et nestin (rouge), (B,H) neurones immatures pour DCX (vert), (C,I) cellules précurseurs oligodendrocyte pour LES PDGFR (vert) et NG2 (rouge), (D,J) astrocytes pour GFAP (vert), (E,K) oligodendrocytes matures pour MBP (vert), et (F,L) neurones matures pour NeuN (rouge). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
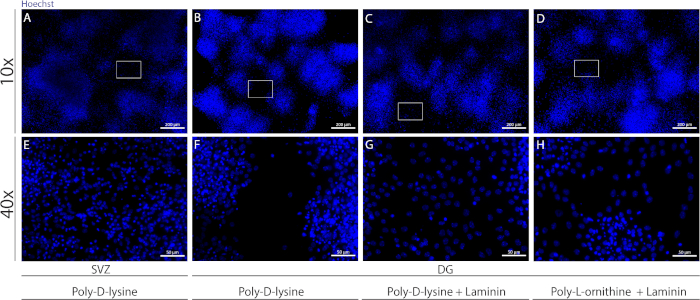
Figure supplémentaire 1 : Tester différents substrats pour l’adhérence et la migration de la neurosphère pour former un pseudomonolayer. Images représentatives de fluorescence de (A,E) pseudomonolayer dérivé de SVZ utilisant la poly-D-lysine comme substrat, (B,F) DG-derived pseudomonolayer using poly-D-lysine as a substrat, (C,G) DG-derived pseudomonolayer using poly-D-lysine with laminin as a substrate, and (D,H) DG-derived pseudomonolayer using poly-D-lysine with poly-L-ornithine as a substrat. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Les systèmes in vitro des NSPC permettent une meilleure compréhension des mécanismes cellulaires et moléculaires, qui peuvent être validés in vivo. La NSA est une méthode très puissante pour imiter les conditions physiologiques en raison de leur structure tridimensionnelle. En outre, ce système culturel est également techniquement plus facile à culture10, par rapport à d’autres systèmes in vitro tels que le système de culture monolayer. En effet, avec la NSA, il est facile de contrôler les indices extrinsèques exposés pendant le développement cellulaire, soit pendant l’expansion ou la phase de différenciation, en ajoutant des quantités précises et variables de facteurs d’intérêt pour les médias ainsi que par la culture des neurosphères avec d’autres types de cellules6. En outre, par rapport aux cultures monocouches, dans la NSA, il est possible d’obtenir une densité cellulaire plus élevée à partir d’une petite quantité de tissu ou avec un petit nombre de cellules, permettant des études parallèles à effectuer, réduisant ainsi le nombre d’animaux1.
La NSA est la méthode la plus courante pour isoler et étendre les CNS11,12,13, peut être utilisée pour estimer le nombre de cellules précurseurs présentes dans un échantillon de tissu donné5 et la fréquence des cellules précurseurs entre les différentes conditions. Cependant, les neurosphères et les cultures monocouches ne tiennent pas compte de la quiescence des NSC14. En outre, la NSA a certaines limitations11,12,13 et la fréquence de néurosphère résultante dépend de nombreux facteurs, y compris les composants moyens, la procédure de dissection, le processus de dissociation11,12,13, et l’agrégation de la néurosphère5. En effet, dans une culture à haute densité, les neurosphères ont tendance à s’agréger. Par conséquent, il faut faire preuve de prudence lorsqu’on estime le nombre de cellules précurseurs dans un échantillon. Pour surmonter les limites ci-dessus, les NSPC isolés peuvent également être élargis et passages dans un monolayer5,15. Fait important, l’utilisation de la NSA pour comparer la fréquence des cellules précurseurs entre les différentes conditions est très utile et précise parce que toutes ces limitations sont implicites et similaires entre toutes les conditions effectuées dans la même expérience.
Il y a des étapes critiques dans la culture de la neurosphère qui ont besoin d’attention. Dans l’étape de récolte du cerveau, l’élimination complète des méninges et le bon isolement des niches neurogènes sont essentiels pour maximiser la pureté et le rendement des NSPC. Pendant la dissociation de tissu, due à l’activité protéolytique de la trypsine, l’utilisation excessive de la trypsine ou des temps d’incubation plus longs peuvent mener à la lyse cellulaire. En outre, le jour du passage est essentiel pour obtenir une population saine de neurosphères. Les néurosphères de passage d’un diamètre supérieur à 200 m affectent grandement la viabilité, la prolifération et la capacité différenciante des NSPC. Il est important de noter que les cycles de passages plus longs, plus de 10 peuvent accroître l’instabilité génétique6. En outre, le revêtement avec PDL et PLD/laminin pour les cellules SVZ et DG, respectivement, est essentiel pour assurer une bonne migration cellulaire hors des neurosphères sans compromettre le processus de différenciation. En termes d’analyse de l’immunocytochimie, des temps d’incubation plus longs avec PFA peuvent compromettre la coloration en masquant les antigènes et en augmentant l’arrière-plan.
La NSA est un outil puissant pour fournir une source cohérente et illimitée de NSPC pour les études in vitro de développement neuronal et de différenciation ainsi que pour des fins thérapeutiques16,17. En effet, cet essai peut être appliqué aux modèles génétiques et comportementaux pour mieux comprendre les mécanismes moléculaires et cellulaires impliqués dans la prolifération et la différenciation18,19. Cet essai est également utile pour tester différents médicaments et composés20,21,22 ainsi que pour effectuer des manipulations génétiques19,23 pour moduler les propriétés NSC. En plus de l’immunocytochimie, la réaction en chaîne de polymérase inverse de transcription et l’analyse occidentale de tache peuvent être exécutées pour accéder à l’expression d’ARN et de protéine, tandis que les études électrophysiologiques et l’imagerie de calcium peuvent être employées pour évaluer la fonction des neurones nouveau-nés21.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par IF/01227/2015 et UID/BIM/50005/2019, projeto financiado pela fundaçào para a Ciência e a Tecnologia (FCT)/ Ministério da Ciência, Tecnologia e Ensino Superior (MCTES) atravs de Fundos do Orçamento de Estado. R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018) et R.S.R. (SFRH/BD/129710/2017) ont reçu une bourse de LA FCT. Les auteurs souhaitent remercier les membres de l’installation de bioimagerie de l’Instituto de Medicina Molecular Joo Lobo Antunes pour leur aide à la microscopie.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
Références
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393(2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225(2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529(2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457(2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639(2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161(2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978(2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516(2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin? Frontiers in Cellular Neuroscience. 8, 59(2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon