Method Article
산후 (P1−3) 마우스 신경성 틈새에서 신경구의 격리 그리고 확장
요약
이 기사에서는, 구체적으로, 메인 마우스 신경생성 틈새에서 유래된 산후 마우스 신경 줄기 세포로부터의 신경구 배양물의 생성을 위한 프로토콜을 설명한다. 신경구는 전구체 세포 수의 추정을 허용하는 두뇌 조직에서 신경 줄기 세포를 확인하기 위하여 이용됩니다. 더욱이, 이 3D 구조물은 세포 운명의 연구 결과허용하는 신경, oligodendrocytes 및 성상 세포를 초래하는 분화한 조건에서 도금될 수 있습니다.
초록
신경구 분석법은 증식, 자기 갱신 및 다능성을 포함하는 신경 줄기/전구 세포 (NSPC)의 고유 특성을 연구하기 위한 매우 유용한 시험관 내 기술입니다. 산후 및 성인 두뇌에서, NSPC는 2개의 신경성 틈새에 주로 존재합니다: 심실 영역 (SVZ) 외측 심실 및 해마 치과 자이러스의 자궁 내부 영역 (DG). 출생 후 뇌에서 신경 성 틈새 의 격리 는 더 높은 수율의 결과적인 이점과 문화에서 NSPC의 높은 금액을 얻을 수 있습니다. 각 신경구 내의 세포 사이 가까운 접촉은 신경성 틈새 시장을 닮을 수 있는 미세 환경을 만듭니다. 여기서, 우리는 1-3 일 (P1−3) 마우스에서 SVZ- 및 DG 유래 신경구 배양권뿐만 아니라, 신경구 확장을 위한 통과를 생성하는 방법을 자세히 설명합니다. 이것은 신경구 분석실험이 NSPC 클론(6-12일)의 빠른 생성을 허용하고 동물 사용의 수를 현저하게 감소시키기 때문에 유리한 접근법이다. 분화 한 조건에서 신경 구를 도금함으로써, 우리는 NSPC 증식, 분화, 세포 생존 및 신생에 대한 본질적 또는 외인적 인자의 행동을 연구 할 수 있도록 NSPC와 다른 신경 계보 (뉴런, 성상 세포 및 올리고드로시스트)의 분화 된 세포로 구성된 세포의 의사 단독 층을 얻을 수 있습니다.
서문
신경구 분석 (NSA)는 1992년1,,2에서 처음 기술되었으며 여전히 신경 줄기 세포 (NSC) 연구에서 독특하고 강력한 도구로 남아 있습니다. 주요 신경 발생 지역에서 신경 세포의 격리는 생리적 조건에서 이러한 세포를 유지하기 위한 요구 사항이 제대로 이해되지 않아 어려운 문제가 있습니다. NSA에서, 세포는 표피 성장 인자(EGF) 및 기본 섬유아세포 성장 인자(bFGF)를 포함하는 성장 인자의 존재와 함께 화학적으로 정의된 무혈청 배지에서 배양된다1,,2,,3. 신경 전구체 세포(stem 및 전구체)는 이들 세포가 EGF 및 FGF-반응성 다른 세포, 즉 분화세포, 즉 분화세포, 다이4동안활성 증식의 기간에 진입하기 때문에 이들 미토겐을 이용하여 선택된다. 신경 전구체 세포는 신경구로서 성장하며, 이는 이들 세포의 풀을 더 확장하기 위해 통과될 수 있다5. 중요한 것은, 이들 신경줄기 전구세포(NSPC)가 다능하기 때문에 중추신경계(CNS)의 3대 세포 유형으로 분화할 수 있다:뉴런, 올리고헨드로시트 및 성상세포5.
NSA는 생리학적 및 질병 맥락에서 NSC 증식 및 자기 갱신, 신경 및 신경교 분화를 포함한 여러 프로세스를 연구하는 데 사용할 수 있는 미분화 CNS 전구체의 재생 가능한 공급원을 제공합니다. 더욱이, 시험관내 연구는 발달 동안 신경 전구체에 존재하는 본질적인 명세의 정도를 평가하고, 세포의 완전한 잠재력을 연구하는 데 사용될 수 있으며, 그들의 정상 환경과 관련된 외적 단서를 제거함으로써6. 신경구 모델은 혈청이 없는 배지에서 세포를 유지함으로써, 환경 큐는 주변세포6에의해서만 제공되기 때문에 가제 조절제를 평가하는 데 유용하다. 더욱이, NSA에서 NSPC는 배양에서 용이하게 확장되고, 영역당 세포의 밀도가 높고, 신경구의 이질적인 조성은 생체 내 틈새와 약간의 유사성을 갖는다6. 이러한 잘 확립 된 장점은이 방법론이 많은 연구자들에 의해 널리 사용되는 이유입니다.
다음 프로토콜은 두 가지 주요 신경 발생 영역, 심실 영역 (SVZ) 및 해마 치과 자이러스 (DG)에서 산후 NSPC 집단의 격리에서부터 신경 구체로서의 세포의 확장뿐만 아니라 뉴런, 성상 세포 및 올리고덴드로질로의 분화에 이르기까지 모든 과정을 자세히 설명합니다. 마지막으로, 상이한 세포는 또한 SVZ- 및 DG 유래 NSPC의 줄기 및 다기능 특성에 접근하기 위해 기술된다.
프로토콜
모든 실험은 과학적 목적으로 사용되는 동물의 보호를 위해 유럽 공동체(86/609/EEC; 2010/63/EU; 2012/707/EU) 및 포르투갈어(DL 113/2013) 법률에 따라 수행되었습니다. 이 프로토콜은 "iMM의 제도적 동물 복지 기구 - ORBEA-iMM 및 국가 권한 기관 - DGAV (디렉카오 제랄 드 알리멘타카오 e 베테리나리아)에 의해 승인되었습니다."
1. 문화 매체의 기본 설정 및 준비
- 해부 당일, 덜베코의 변형 된 독수리 배지 [(DMEM)/F12와 L-글루타민으로 구성된 혈청없는 배지 (SFM)에 해당하는 적당량의 성장 배지를 준비하십시오 .(재료 표)100 U/mL 페니실린과 100 μg/mL 스트렙토마이신(100 μg/mL)으로 보충됨 또한 10 ng/mL EGF 및 5 ng/mL bFGF. 배양 배지를 수조에서 37°C로 따뜻하게 합니다.
참고 : 성장 매체의 볼륨은 새끼의 수에 따라 달라집니다, 5 새끼준비 ~ 100 mL (SVZ50 mL 및 DG에 대한 50 mL); 그러나 셀 수를 계산한 후(5.1단계) 정확한 부피를 조정해야 합니다. - SVZ와 DG의 미세 해부를 위해, 100 U/mL 펜/스트렙으로 보충된 칼슘과 마그네슘이 없는 행크스의 균형 잡힌 식염수(HBSS) 해부 매체를 준비하십시오.
참고 : 해부 매체의 50-100 mL을 준비합니다. - 해부 현미경을 설치하고 뇌 (가위와 작은 주걱)를 제거하고 SVZ 및 DG 미세 침부 (Dumont 작은 가위, #7 집게, #5 집게, #5S 집게)를 70 % 에탄올에 담가 제거하는 데 필요한 도구를 준비하십시오.
2. 산후 (P1−3) 마우스 뇌와 SVZ / DG 미세 내해의 수확
- 펜/스트렙이 보충된 HBSS와 2개의 샘플 튜브(SVZ용 1개, DG용 1개)와 500 μL의 보충 된 HBSS를 각각 사용하여 60mm 페트리 접시 (성장 영역 21cm2)를준비하십시오.
- 기관 동물 관리 시설/지침에 의해 승인된 프로토콜에 따라 마우스 새끼를 안락사(P1−3). 뇌간 기저부에서 날카로운 가위로 한 번의 절개로 참수 작업을 수행합니다.
- 머리의 기지에 신체의 복부 부분을 잡고 작은 뾰족한 가위를 사용하여, 따라서 두개골의 표면을 공개, 머리의 전체 길이에 걸쳐 피부에 중간 절개를합니다.
- 두개골 의 기지에서 세로 절개를하고 뇌 구조를 손상시키지 않도록 가능한 한 얕은 각도로 작은 가위를 사용하여 시상 봉합사를 따라 절단을 계속하십시오.
- 구부러진 집게를 사용하여 두개골을 옆으로 벗기고 뇌를 노출시다.
주의: 뇌를 만지기 전에 해부 기구에 에탄올이 없는지 확인하십시오. - 작은 주걱을 사용하여 두개골에서 뇌를 분리, 뇌의 기지에 연결된 두개골 신경과 혈관을 절단하기 위해 뇌의 기지 아래 슬라이딩하여, 차가운 보충 HBSS 솔루션을 포함하는 페트리 접시로 뇌를 전송.
- 뇌가 들어있는 페트리 접시를 해부 현미경 아래에 낮은 배율로 놓고 뇌를 등지 표면에 놓습니다.
- 미세 집게를 사용하여 뇌의 복부 측과 후각 전구에서 수막을 제거하고 뇌를 소뇌의 위치에 유지하십시오. 복부 측면에 뇌를 회전하고 수막의 나머지 부분을 벗겨.
참고: 등쪽 수막 제거는 올바른 뇌 슬라이스를 보장하는 중요한 단계입니다. - 집게를 사용하여 절단을 만드는 소뇌를 폐기. 기공 크기가 11 μm인 필터 페이퍼를 티슈헬기(재료 표)에놓고 구부러진 포셉을 사용하여 뇌를 필터 용지위에 놓습니다. 450 μm 관상 동맥 섹션으로 뇌를 잘라 차가운 보충 HBSS로 채워진 새로운 페트리 접시에 절편 된 두뇌를 수집 하는 젖은 라미를 사용 하 여.
- SVZ를 해부하려면 집게를 사용하여 해부 현미경으로 측면 심실로 슬라이스에 도달 할 때까지 앞쪽에서 후방 방식으로 관상 조각을 분리하십시오.
- 심실의 측면 벽을 둘러싼 조직의 얇은 층을 잘라 (이는 SVZ에 해당) 미세 집게로, 줄무늬 자영과 코퍼스 callosum을 제외. 측면 심실의 측면 모서리에 집게의 끝을 배치하여 SVZ를 분리 : 하나는 즉시 코퍼스 callosum 아래에 다른 하나는 즉시 측면 심실의 심실 의 복부 영역에 인접한 조직으로. 그런 다음 측면 심실을 둘러싼 작은 조직 선을 잘라냅니다.
- 이전에 SVZ로 확인된 보충된 HBSS 용액으로 해부된 조직을 샘플 튜브로 수집합니다.
참고: 측면 심실과 해마 형성이 모두 나타나기 시작하는 조각에서 SVZ를 제외합니다. - 전방 - 투 - 후방 방식으로 SVZ 미세 해부 후 모든 조각을 통해 이동하고 해마 형성에 도달. 집게를 사용하면 DG가 여전히 인식할 수 없는 해마가 있는 첫 번째 조각을 버립니다.
- DG를 제거하려면 먼저 해마를 슬라이스로부터 분리합니다. 현미경을 다시 초점을 맞추어 DG 주변의 테두리를 시각화합니다.
- DG와 CA1 영역 사이의 컷을 수행한 다음 집게를 사용하여 DG와 CA3 영역 사이의 수직 컷을 수행하여 DG 부분을 해부합니다. 프림리아와 인접한 조직을 제거하십시오.
참고: P1−3 동물에서 DG는 암몬의 뿔과 거의 구별할 수 없지만 작은 팁을 표시합니다. - 이전에 DG로 확인된 보충된 HBSS 용액을 포함하는 견본 관으로 해부된 조직을 수집합니다.
참고 : 해마 또는 주변 지역에 대한 전반적인 부상은 DG를 격리하는 것을 더 어렵게 만듭니다. 사용자가 관상 섹션에서 SVZ 및 DG 조직의 격리에 익숙하지 않은 경우 산후 마우스 뇌의 아틀라스를 사용하는 것은 필수적이다.
3. 조직 해리
- 각각의 튜브에 존재하는 SVZ 및 DG 조직을 해리하기 위해, 트립신-EDTA 0.05%를 첨가하여 HBSS에서 트립신-EDTA 0.05%의 최종 농도를 갖는다. 37 °C에서 약 15 분 동안 배양하고 조직이 함께 뭉쳐질 때까지 배양하십시오.
- 미디어를 제거하고 새로운 HBSS 보충 용액 1 mL을 4 회 연속하여 트립신으로부터 조직을 세척하십시오.
- HBSS를 제거하고 10 ng/mL EGF 및 5 ng/mL bFGF로 보충된 SFM 1 mL에서 소화된 조직을 다시 중단시소. P1000 파이펫을 사용하여 약 7-10x를 부드럽게 파이펫팅하여 펠릿을 기계적으로 해리시켜 균일한 세포 용액을 얻을 때까지.
주의: 과도한 기계적 해리는 세포 사멸을 증가시킬 수 있으며 후속 세포 성장에 부정적인 영향을 미칠 수 있습니다.
4. 세포 운명을 연구하는 세포 쌍 분석
- 실험에 앞서, 섹션 8-10에 따라 부착 단층 배양용 코팅 된 24 웰 플레이트를 준비하십시오.
- 도금될 SVZ 또는 DG 셀(섹션 3에서 수득)의 수를 계산하려면 0.2% Trypan blue를 함유하는 용액을 사용하고 혈세포계를 사용하여 세포를 계산합니다.
- 11,300 세포 /cm2의 밀도에서 5 ng / mL EGF 및 2.5 ng / mL bFGF (낮은 EGF / bFGF)로 보충 SFM에서 해리 세포 현탁액을 희석하고 코팅 유리 커버 립에 접시.
- 24시간 후, 성결정 영역 Y-box 2(Sox2) 및 네스테인과 같은 NSC 마커에 대한 면역세포화학에 대한 세포를 고치고 뉴런 계보의 마커(즉, 미성숙 뉴런의 경우[DCX])를 마커로 한다(섹션 14 참조).
참고 : Sox2는 유사분열을 겪는 NSC의 마커입니다. 단일 전구 세포 분열로 인한 Sox2+/+ 세포 쌍은 줄기 세포 확장을반영합니다 7.
5. 신경구로 산후 신경 줄기 세포의 확장
- 해리된 SVZ 또는 DG 세포 현탁액의 밀도를 결정하기 위해(섹션 3에서 수득됨), 혈세포계를 사용하여 세포를 계산한다.
- SFM에서 2 x 104 세포/mL의 밀도로 SVZ 및 DG 단세포 현탁액을 10 ng/mL EGF 및 5 ng/mL bFGF로 보충하였다. 5 mL / 페트리 접시의 최종 볼륨과 코팅되지 않은 60mm 페트리 접시에 종자 SVZ 및 DG 세포.
- 6-8일 및 10-12일 동안 각각 SVZ 및 DG 세포를 배양하고, 5%CO2를가진 37°C에서 1차 신경구를 형성한다.
참고: 언급된 것보다 더 많은 인큐베이션 일은 신경구의 응집을 촉진하고 신경구의 중심에 있는 세포 사멸의 상부를 승진시킬 수 있습니다. - 대부분의 신경구의 직경이 150-200 μm인 경우, 신경구 통로를 수행합니다.
참고: 적절한 직경이 없을 때 신경구를 통과하는 것은 다음 단계를 모두 손상시게 됩니다.
6. 신경구의 통과
참고: 다음 프로토콜은 SVZ 및 DG 신경구를 모두 확장하기 위해 적용될 수 있습니다.
- 신경구를 통과하려면, 60 mm 페트리 접시(es)와 원심분리기로부터 신경구를 함유하는 성장 인자를 300 x g에서5분 동안 수집한다.
- 상류층을 버리고 제조사의 지침에 따라 화학적 해리 키트(mouse)를 이용하여 신경구 펠릿을 다시정지시켰다(재료표).
참고: 인큐베이션 시간은 성능에 매우 중요하기 때문에 정확하게 관찰합니다. - 300 x g에서5 분 동안 원심 분리기를 제거하고 상류를 제거하고 10 ng / mL EGF 및 5 ng / mL bFGF로 보충 된 SFM 1 mL을 추가하십시오.
- P1000 파이펫으로 약 10배 위아래로 신경구를 해리합니다.
- 0.2% 트립판 블루 및 혈세포계를 포함하는 용액을 사용하여 세포의 수를 계산한다.
- 코팅되지 않은 60 mm 페트리 접시에서 2 x 104 세포 / mL의 밀도로 세포를 다시 시드하십시오.
- 6-8일 및 10-12일 동안 각각 SVZ 및 DG 세포를 배양하고, 5%CO2를가진 37°C에서 이차 신경구를 얻었다.
참고: SVZ 및 DG 파생 NSPC의 자체 갱신 용량은 다음 프로토콜 섹션 5 및 6을 통해 액세스할 수 있습니다. 이를 위해, 종자 SVZ 및 DG 세포는 5 ng/mL EGF 및 2.5 ng/mL bFGF(낮은 EGF/bFGF)를 함유하는 성장 SFM 배지에서 1.0 x 10 4 세포/mL(코팅되지 않은 24웰 플레이트)의 밀도로.4 결과 기본 및 보조 신경구의 수를 계산합니다.
7. 신경구의 저장
- 60 mm 페트리 접시로부터 신경구(단계 5.3 및 6.7단계에서 얻어진)를 함유하는 배지를 수집한다.
- 300 x g에서 5 분 동안 원심 분리기를 제거하고 상류를 버립니다.
- HBSS 1 mL로 세포를 2x 세척하십시오 (300 x g에서5 분).
- 300 x g에서5 분 동안 원심 분리기를 폐기하고 분자 생물학 분석을 위해 -20 °C에서 신경구의 펠릿을 저장합니다.
8. PDL 코팅 플레이트 절차
- 용액 1 (0.1 M 붕산 완충액)을 준비하려면 3.92 g의 붕산을 측정하고 400 mL의 고순도 물로 희석하십시오. pH를 8.2로 조정하고 고순도물로 최대 500 mL를 만듭니다.
- 용액 2 (0.167 M 붕산 완충액)를 준비하려면 붕산 10.3 g의 무게를 측정하고 900 mL의 고순도 물로 희석하십시오. pH를 8.2로 조정하고 고순도물로 최대 1,000 mL를 만듭니다.
- 폴리-D-리신(PDL)(0.1 M 붕산 완충액에서 1 mg/mL)을 재구성하려면 용액 100 mL에서 100 mg의 PDL을 희석합니다.
- 10 mL의 aliquots를 즉시 사용하거나 -20 °C에서 동결 및 보관하십시오.
- 층류 하에서, 잘 당 커버 슬립 1개추가하고 15분 동안 자외선 아래에서 살균합니다.
- 재구성된 PDL을 사용하거나 동결된 재구성된 PDL을 해동한다.
- 용액 2의 90 mL에 재구성된 PDL 10 mL을 추가하여 0.167 M 붕산 완충액에서 100 μg/mL PDL의 최종 용액을 준비합니다.
- 37°C에서 최소 2시간 에서 하룻밤 동안 웰에 최종 용액을 추가합니다.
참고: 24웰 플레이트의 경우 각 웰에 500 μL의 부피를 추가합니다. - 용액을 제거하고 고순도물로 3x 씻어내.
- 커버립을 층류 후드에서 건조시키십시오.
- 멀티 웰 배양 플레이트를 4°C에 둡니다.
9. PDL / 라미닌 코팅 플레이트 절차
- 1일째에 섹션 8에 설명된 대로 판에 PDL을 코팅합니다.
- 2일째에는 PDL 용액을 제거하고 고순도물로 3x를 씻으소서. 말리십시오.
- 성장 인자가없는 차가운 SFM에서 5 μg / mL 라미닌을 준비하십시오.
- 커버립에 용존 라미닌을 넣고 밤새 37°C에서 배양합니다.
참고: 24웰 플레이트의 경우 각 웰에 500 μL의 부피를 추가합니다. - 파이펫을 사용하여 라미닌을 제거합니다.
참고 : 라미닌에서 덮개입술을 세척하지 마십시오. - 즉시 사용하거나 -20°C에서 보관하십시오.
10. 폴리-L-오르니틴 (PLO) /라미닌 코팅 절차
- 층류 하에서, 잘 당 하나의 커버 슬립을 추가하고 15 분 동안 UV 빛에서 살균.
- 실온(RT)에서 20분 동안 각 웰에 0.01% PLO 용액을 추가합니다.
참고: 24웰 플레이트의 경우 각 웰에 500 μL의 부피를 추가합니다. - 용액을 제거하고 멸균 된 1x PBS로 3 x를 씻으하십시오. 말리십시오.
- 멸균 1x PBS로 5 μg/mL 라미닌을 준비합니다.
- 37 °C에서 2 시간 동안 배양하십시오.
- 라미닌을 제거합니다.
참고 : 라미닌에서 덮개입술을 세척하지 마십시오. - 즉시 사용하십시오.
참고: 피펫 팁으로 커버슬립을 부드럽게 눌러 커버슬립이 PLO 용액으로 완전히 덮여 있는지 확인합니다. 흔들릴 때, 멀티 웰 플레이트는 소리를하지 않습니다.
11. 세포의 분화 단층생성에 의한 신생의 평가
- RT에서 300 x g에서 5 분 동안 60mm 페트리 접시 (섹션 5에서 얻은)와 원심 분리기에서 신경 구를 함유 한 매체를 수집합니다.
- 상류층을 버리고 해리 PBS의 1 mL에서 신경 구의 펠릿을 해리 (즉, MG2+ /Ca2+가없는 PBS 및 EDTA [2.7 mM KCl, 1.5 mM KH2PO4,137 mM NaCl, 8.1 mM Na2HPO4 및 0.5 mM EDTA 4Na, pH = 7.40]) 및 기계적 해리후 15 분 동안 배양하였다. 대안적으로, 화학적 해리 키트(mouse)를 이용하여 신경구를해리한다(물질표).
- RT에서 300 x g에서 5 분 동안 원심 분리기를 폐기하고 상급기를 버립니다.
- 성장 인자없는 SFM의 1 mL에서 세포 펠릿을 다시 중단하십시오.
- 혈세포계를 사용하여 세포 밀도를 결정합니다.
- 3,766 세포 /cm2의 밀도에서 성장 인자없는 SFM에서 해리 된 세포 현탁액을 희석하고 코팅 된 유리 커버립에 플레이트 셀을 24 웰 플레이트에 희석하십시오.
- 1-3 일 후 세포 골격의 단백질에 대한 면역 세포 화학 세포를 수정하십시오 (섹션 14 참조).
12. 신경구 문화의 분화
참고: 세포 확장에서 얻은 신경구는 1 차 또는 통과된 신경구(섹션 5 또는 6에서 수득)에서 다른 신경 계보로부터 세포로 분화될 수 있습니다.
- 신경구의 직경이 150-200 μm인 경우, 24웰 플레이트에서 코팅된 유리 커버슬립에 25 μL의 신경구 현탁액 배지와 플레이트를 수집합니다.
참고: 신경구를 더 많이 수집하려면 페트리 접시를 부드럽게 회전하여 중앙에 신경구를 집중시다. 그런 다음, 중심에서 피펫. - 신경구가 기판에 부착되도록 15 분 동안 37 °C에서 인큐베이터에 플레이트를 넣습니다. 그 후, 성장 인자 (차별화 조건)가없는 SFM 500 μL을 추가하십시오.
- 24 시간 후, 성장 인자없는 신선한 SFM으로 매체를 교체하십시오.
- 37°C에서 5%CO2 및 95% 대기 공기로 서로 다른 시간 포인트(예: 시험관 내, DIV2 및 DIV7)를 각각 구별합니다.
참고: 세포 생존, 증식 및 분화는 상이한 세포 분석문을 사용하여 분석될 수 있다.
13. 세포 생물학 시험
- 세포 생존 분석
- 37°C에서 세포 고정전에 30분 동안 3 μg/mL 프로피듐 요오드화물(PI)에 도금된 신경구를 노출시켰다.
참고 : PI는 손상된 멤브레인 무결성8로세포를 입력 할 수있는 자동 형광 에이전트입니다. 세포 생존을 분석하는 다른 방법은 카스파제 3 염색 또는 말단 디옥시누클레오디딜 트랜스퍼라제 dUTP 닉엔드 라벨링(TUNEL) 분석과 같은 사용될 수 있다.
- 37°C에서 세포 고정전에 30분 동안 3 μg/mL 프로피듐 요오드화물(PI)에 도금된 신경구를 노출시켰다.
- 세포 증식 분석
- 도금된 신경구를 37°C에서 인큐베이터에 고정하기 전에 4시간 동안 10 μM 5-브로모-2'-데옥시우리딘(BrdU)에 노출시켰다.
참고: BrdU는 증식 세포9에서DNA 합성 중에 통합될 수 있는 합성 티미딘 유사체이다.
- 도금된 신경구를 37°C에서 인큐베이터에 고정하기 전에 4시간 동안 10 μM 5-브로모-2'-데옥시우리딘(BrdU)에 노출시켰다.
- 세포 분화 분석
- 7일 된 도금 신경구를 처음 24시간 에서 10 μM BrdU에 노출하고, 37°C에서 인큐베이터에 노출시켰다.
- 성장 인자 (분화 조건)가없는 SFM을 갱신하고 다음 6 일 동안 BrdU가없는 상태에서 세포가 발달 할 수 있게합니다.
참고 : 이러한 펄스 추적 실험은 성숙한 신경 세포의 마커와 공동 라벨링하여 프로토콜 동안 성숙한 세포로 분화하는 전구 세포의 평가를 허용합니다.
14. 신경구 배양의 면역 염색
- 셀 고정
- 1x PBS에 4% 파라포름 알데히드(PFA)를 준비하고 4°C 또는 -20°C에서 보관합니다.
- 웰에서 성장 인자없는 SFM을 제거하고 RT에서 20 분 동안 4 °C에서 4 % PFA의 500 μL을 각 우물에 추가하십시오.
- 1x PBS로 3x를 씻고, 매번 5분 동안, 분화한 신경구를 함유한 커버슬립을 세척합니다.
- 4°C에서 1x PBS의 500 μL에서 사용할 때까지 커버립을 보관하십시오.
참고: 실험에 BrdU가 없는 경우 14.3단계로 건너뜁니다.
- 탈수 방법(BrdU 실험에만)
- 37°C에서 1M HCl을 준비합니다.
- 린스 커버는 1x PBS에서 3배입니다.
- 1% 난오계면활성제(예를 들어, 트리톤 X-100)를 함유하는 PBS에서 30분 동안 세포를 투과화한다.
- 1 M HCl을 37°C로 37°C로 예열하여 37°C(~300 μL/well)에서 30-40분 동안 변성 내성 dsDNA를.
- 1x PBS로 우물 4배 씻으소서.
- 투압 화 및 차단
- 린스는 5 분 동안 1 x PBS에서 입술을 커버합니다.
- 1.5%의 요오닉 계면활성제와 3% 소 혈청 알부민(BSA)을 1x PBS(~300 μL/well)로 배양하였다.
참고: NeuN의 경우 1x PBS에서 6% BSA를 사용하십시오.
- 인큐베이션 및 마운팅
- 1 일째에는 세척하지 않고 1 차 항체(재료 표)를인큐베이션 챔버에서 1 x PBS에서 0.1 % 요온 계면 활성제 및 0.3 % BSA로 배양합니다 (24 웰 플레이트의 경우 20 μL / well을 사용합니다). 항체가 형광에 공액되는 경우 4 °C 빛보호에서 하룻밤 동안 배양하는 커버립을 남긴다.
- 2일째에는 리턴 커버를 각 웰에 가며 5분 동안 1x PBS로 3배 헹구어보라고 합니다.
- 적절한 형광 결합 이차 항체 (희석 1 : 200)와 RT에서 2 시간 동안 1x PBS에서 12 μg / mL Hoechst 33342로 카운터 스테인및 인큐베이션 챔버에서 보호 된 빛 (20 μL / 커버 슬립).
- 워시 커버는 5 분 동안 1 x PBS에 3 x 입술.
- 형광 장착 매체의 5 μL /커버 슬립을 사용하여 현미경 슬라이드에 입술을 덮습니다.
- 1 일 동안 빛으로부터 보호된 RT에서 공기 건조를 커버합니다.
- 현미경 검사 법
- 형광 현미경을 사용하여 이미지를 보고 수집합니다.
- 각 조건에 대해 세 개의 복제를 사용합니다. 40배 목표(필드당 ~100셀)로 각 커버슬립의 5개의 독립적인 현미경 필드에서 셀 카운트를 수행합니다.
15. EGF 및 bFGF 재고 솔루션 준비
- EGF 스톡 솔루션
- 용서우성 EGF를 재구성하려면 제품을 고순도 물로 희석하여 최종 농도20 μg/mL에 도달합니다.
- 알리쿼트 및 -5 ~ -20 °C에서 마이크로 튜브에 저장합니다.
- bFGF 스톡 솔루션
참고 : bFGF는 10 mM 트리스, pH 7.6의 용액으로 재구성해야합니다.- 열기 전에 바이알을 잠시 원심분리하여 내용물 하단에 가져온다.
- 10 mM 트리스, pH 7.6의 50 mL을 준비합니다. 이를 위해, 트리스 ((HOCH2)3CNH2)의60.57 mg의 무게를 달고 40 mL의 고순도 물로 희석하십시오. pH를 7.6으로 조정하고 고순도물로 최대 50 mL를 만듭니다.
- 10 mM Tris, pH 7.6에서 0.1 % BSA의 10 mL을 준비하십시오. 이를 위해, 무게 10 BSA의 mg과 희석 10 mL의 10 mMM 트리스.
- 단계 15.2.2 및 15.2.3으로 제조된 필터 솔루션은 층류 후드 하에서 0.22 μm 필터로 제조하였다.
- 10 mM Tris에서 0.1% BSA의 1,000 μL에서 bFGF 의 10 μg를 pH 7.6으로 재구성하여 최종 농도인 10 μg/mL에 도달합니다. 최대 6개월 동안 -20°C에서 마이크로튜브에 Aliquot.
결과
NSA를 사용하여 얻어진 SVZ 및 DG 신경구는 미분화 세포로 구성되며, Sox2에 대한 양성, 자가 재생 능력에 관여하는 전사 인자 및 네스팅에 대한 양성, NSPC에서 발현되는 중간 필라멘트단백질(그림 1A). 또한, SVZ 유래 신경구는 그들의 DG 대응물보다 더 큰 치수를갖는다(그림 1A). 중요한 것은, 분화성 조건에서, SVZ- 및 DG 유래 NSPC는 세포의 의사 단층층을 형성하는 신경구에서 이동한다(그림 1B).
자가 재생 용량에 액세스하기 위해, 세포 쌍 분석기는 Sox2 및 네스텐의 발현에 기초하여 수행되며 이는 즉, DCX의 마커와 함께 분화 과정을 시작하는 세포를 분할하여 사라지는 경향이 있다. 두 신경 성 영역에서, Sox2+/+/nestin+/+/DCX-/- 대칭 부문 (자체 갱신)(그림 2A1,B1),Sox2-/+/네스트틴의 존재를 관찰할 수 있습니다./+/DCX+/- 비대칭 부문(그림 2A1, B2)및 Sox2-/-/네스팅-/-/DCX+/+ 대칭 부문(그림2A2,B1).
신경구를 통과하면 NSPC의 수율이 증가합니다. 그러나 DIV2에서의 세포 사멸은 통과와 함께 변경됩니다. 실제로, PI 양성 세포의 백분율은 SVZ에서 세포 통과와 함께 증가된다 (P0: 15.6% ± 1.2% vs P1: 19.2% ± 2.7% 대 P2: 32.35% ± 0.14% vs P3: 39.6% ± 4.0%) 및 DG에서 (P0: 16.31% ± 0.95% vs P1: 32.1% ± 1.7% vs P2: 27.42% 대 P3: 32.2% ± 3.1%) (그림3).
신경발생은 분화의 시작 시에 SVZ 및 DG NSPC의 분화로부터 수득된 뉴런에서 평가될 수 있다: DIV1(도 4A, D),DIV2(도 4B, E)및 DIV3(도 4C, F). 사실, 도 4에서관찰된 바와 같이, 신경염의 길이 및 파급효과는 분화에 따라 증가한다.
세포 증식은 SVZ-및 DG 유래 신경구에서 평가될 수 있다. Div1에서 1차 분화 신경구를 SVZ(그림5A1)및 DG(그림5A2)에서비교하는 경우, BrdU 양성 세포의 비율은 DG(SVZ: 6.15% ± 0.64% 대 DG: 3.27% ±0.13%, p & 0.05; n=4; 그림 5A3). 더욱이, 세포 분화는 또한 BrdU 염색을 성숙한 뉴런을 식별하는 뉴런 핵(NeuN)과 같은 성숙한 제조사와 결합함으로써 접근할 수있다(도 5B1,B2). 도 5B3는 성숙한 뉴런으로 분화하는 증식 선조의 비율이 SVZ 및 DG에서 유사하다는 것을 보여준다(SVZ: 12.04% ± 1.58% 대 DG: 13.56% ± 0.48% ; p > 0.05; n= 4).
SVZ-및 DG 유래 NSPC의 줄기 및 다중 포력은 상이한 분화 일(DIV2 및 DIV7)에서 상이한 마커의 발현을 평가함으로써 NSA를 사용하여 접근할 수 있다. 실제로, NSC(네스테인-및 신경교 섬유성 단백질[GFAP]-이중 양성 세포)는 두 신경발생 영역 모두에존재한다(도 6A,G). 이들 세포는 미성숙 뉴런(DCX 양성 세포)(그림6B,H),성숙한 뉴런(NeuN 양성 세포)(그림 6F,L),올리고덴드로시테 전구체 세포(뉴런-신경교항원 2[NG2] 및 혈소판 유래)로 분화할 수 있다. 성장 인자 수용체 α [PDGFRα]-양성 세포)(도 6C,I),성숙한 올리고엔드로시트 (미엘린 기본 단백질 [MBP]-양성 세포)(그림 6E,K)및 성상 세포 (GFAP 양성 세포)(그림 6D,J).
상이한 기질은 커버립을 코팅하여 분화 조건 하에서 세포의 의사 단일층을 형성하는 데 사용될 수 있다. 보충 도 1에도시된 바와 같이, DG 세포는 PDL 단독보다 PLO 또는 PDL과 결합된 라미닌으로 엑스트라 코팅을 할 때 더 많이 이동한다(보충도 1B−H). 실제로, PDL과 라미닌이 기판으로 함께 사용될 때(보충 도 1C, G),DG 세포는 PDL이 단독으로 사용되는 SVZ 세포보다 더 많은 수민단층을 형성한다(보충도1A,E).
중요한 것은, 이러한 결과는 두 가지 주요 신경발생 틈새에서 유래된 NSC의 줄기 및 다기능 특성을 평가하는 NSA의 잠재력을 입증한다.
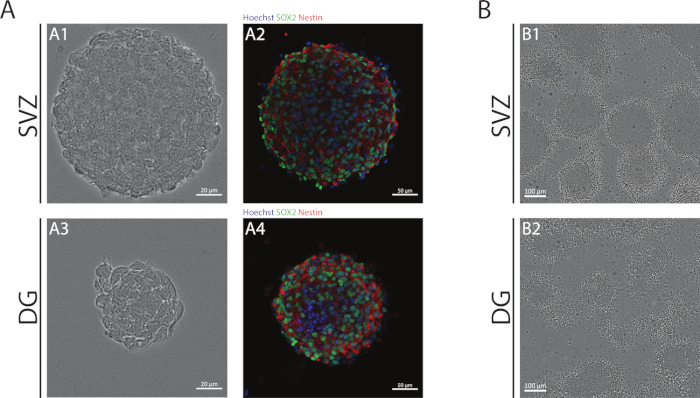
그림 1: 심실 영역 및 치과 자이러스 유래 NSPC는 신경구 또는 가명 단층으로 배양되었다. (A)대표적인브라이트필드(A1,A3)및형광(A2,A4)SVZ-및 DG 유래 신경구의 이미지, 여기서 핵은 Hoechst 33342(파란색)와 Sox2(녹색)와 네스틴(빨간색)에 대한 NSC로 염색되었다. (B)분화 조건 하에서 SVZ- 및 DG 유래 신경구에서 생성된 의사 단층의 대표적인 브라이트필드 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
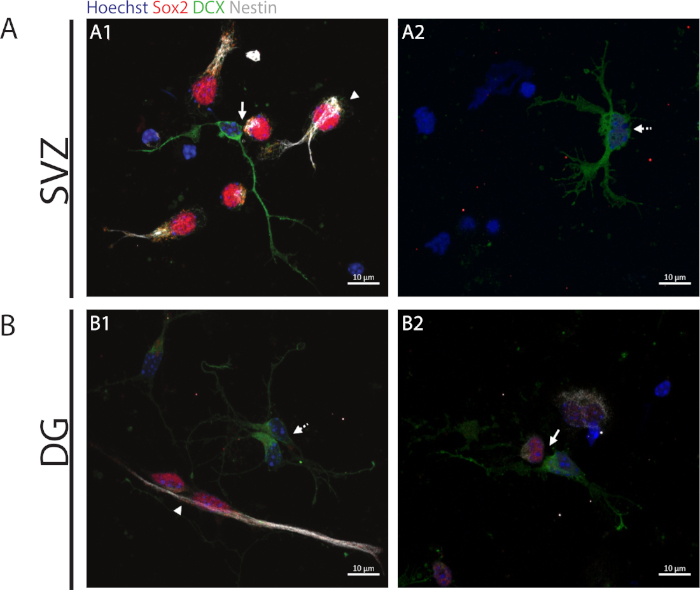
도 2: 세포 쌍 분석. 전구 세포 분열로부터 유래된 세포 쌍의 대표적인 형광 이미지. SVZ 및 DG 핵은 Hoechst 33342 (파란색), Sox2 (빨간색) 및 네스틴 (흰색)뿐만 아니라 DCX (녹색)를 가진 미성숙 뉴런에 대한 줄기 유사 세포로 염색되었습니다. 패널 A1 및 B1의 화살촉은 Sox2+/+/네스트틴+/+/DCX-/- 대칭 자체 갱신 부문을 나타냅니다. 패널 A1 및 B2의 화살표는 Sox2+/-/nestin+/-/DCX-/+ 비대칭 분할, 패널 A2 및 B1의 파선 화살표를 나타내며 Sox2-/-네스팅-/-DCX+/+ 대칭 차별화 구분을 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
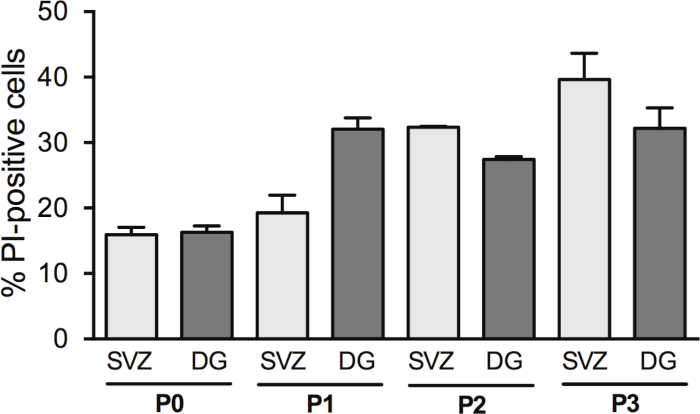
그림 3: 세포 통과를 가진 세포 생존 분석. SVZ-및 DG 유래 분화 신경구 배양에서 DIV2에서의 PI 양성 세포의 정량적 분석은 0, 1, 2 및 3 대후(P0−P3) 후에. 데이터는 평균 ± SEM, n = 1−8로 표현된다. PI = 프로피듐 요오드화물. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
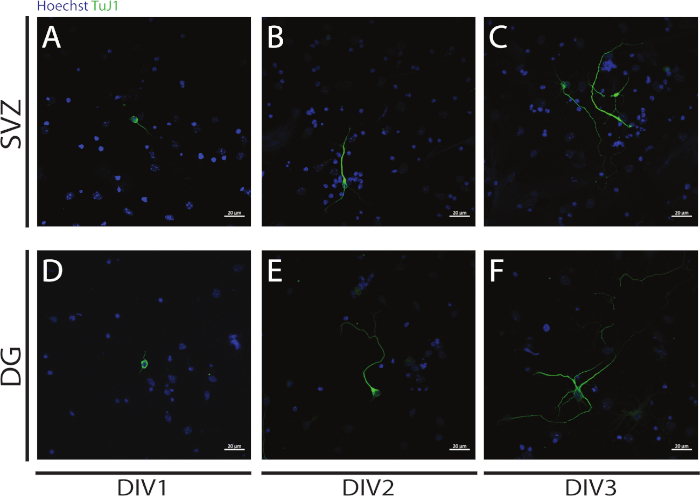
그림 4: DIV 1, 2 및 3에서의 신발생 분석. βIII-tubulin 신호에 의해 확인된 신경염의 대표적인 공초점 형광 이미지는, SVZ 및 DG 뉴런에서(A,D)DIV1,(B,E)DIV2 및(C,F)DIV3에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
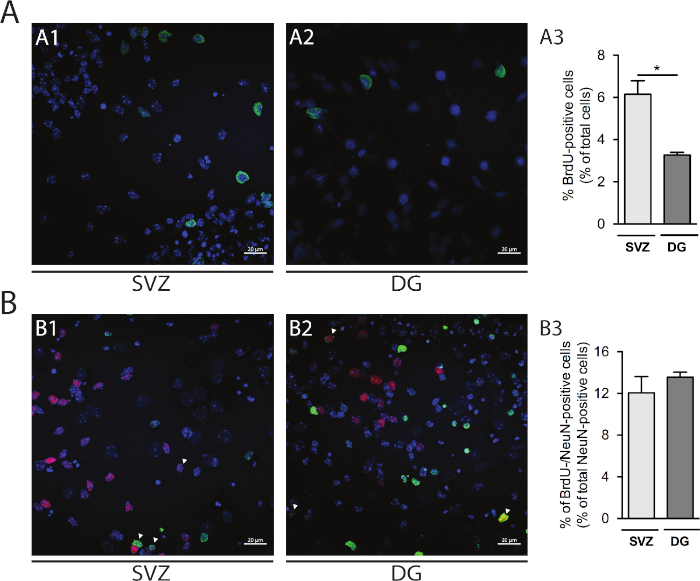
도 5: 세포 증식 분석. DIV1에서 BrdU 양성 세포의 대표적인 공초점 이미지(A1)SVZ 및(A2)DG. (A3) DG-및 SVZ 유래 분화 신경구 배양에서 DIV1에서 BrdU 양성 세포의 정량적 분석. 데이터는 평균 ±SEM, n=4로 표현된다. * p < 0.05 t-테스트에 의해. 대표적인 뇌-및 뉴엔 양성 세포의 대표적인 형광 이미지는 DIV7에서(B1)SVZ 및(B2)DG에서. 화살촉은 BrdU-/NeuN 양성 세포를 나타냅니다. (B3) 두 틈새 시장에서 DIV7에서 BrdU-/NeuN 양성 세포의 정량분석. 데이터는 평균 ±SEM, n=4로 표현된다. BrdU: 5-브로모-2'-데옥시우리딘, 합성 티미딘 유사체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
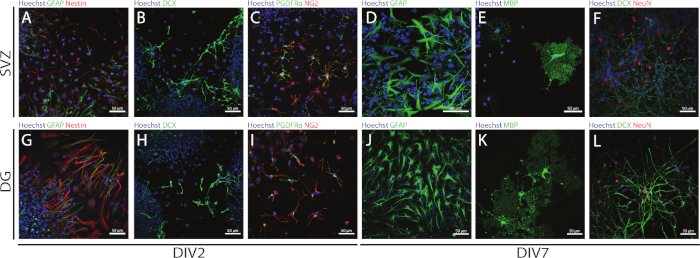
도 6: SVZ-및 DG 유래 분화 신경구 배양에 존재하는 신경 세포 유형. SVZ- 및 DG 유래 세포 유형의 대표적인 형광 이미지는 2 및 7일 후 신경구 분화(DIV2 및 DIV7)를 거쳐, 세포 핵이 Hoechst 33342(파란색)로 염색된 후:(A,G)GFAP(녹색) 및 네스틴(적색)및네스틴(적색) NSC DX(녹색),(C,I)올리고벤드로시테 전구체 세포는 PDGFRα(녹색) 및 NG2(빨강) 및(D,J)GFAP용 성상세포(녹색),(E,K)MBP(녹색)에 대한 성숙한 올리고젠드로시테(green), 및(F,L)NeuN(적색)에 대한 성숙한 뉴런이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
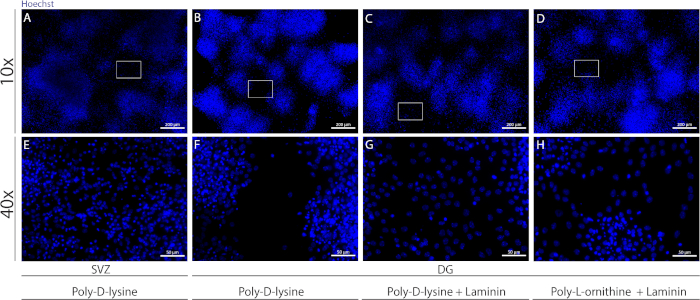
보충 그림 1: 신경구 준수 및 이동에 대한 다른 기질을 테스트하여 의사 모노레이어를 형성합니다. 대표적인 형광 이미지(A,E)SVZ 유래 의사 단층기로서 폴리-D-리신을 사용하여,(B,F)DG 유래 의사단층은 폴리-D-리신을 기판으로,(C,G)다중-D-리신을 기판으로 사용하는 DG 유래 의사단층, 및(D,H)다중-L-L-L을 이용한 폴리-D-리신을 이용한 DG 유래 의사단층이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
NSPC의 체외 시스템은 세포 및 분자 메커니즘을 더 잘 이해할 수 있으며, 이는 생체 내에서 더 검증될 수 있습니다. NSA는 그들의 3 차원 구조 때문에 생리적인 조건을 모방하는 아주 강력한 방법입니다. 더욱이, 이러한 배양 시스템은 또한 단층 배양 시스템과 같은 다른 시험관 내 시스템과 비교하여 기술적으로배양(10)이더 쉽다. 실제로, NSA를 사용하면, 세포 발달 동안 노출된 외인성 단서를 조절하기 쉬우며, 확장 또는 분화 단계 동안, 다른 세포 유형으로 신경구를 배양함으로써 뿐만 아니라 미디어에 관심 요인의 정확하고 가변적인 양을 추가함으로써6. 더욱이, 단층 배양에 비해, NSA에서, 소량의 조직 또는 소수의 세포로부터 더 높은 세포 밀도를 얻을 수 있으며, 병렬 연구가 수행될 수 있게 하여, 따라서 동물의 수를 감소시킨다1.
NSA는 NSCs11,,12,,13을분리하고 확장하는 가장 일반적인 방법이며, 주어진 조직 샘플5및 상이한 조건 사이의 전구체 세포 빈도에 존재하는 전구체 세포의 수를 추정하는데 사용될 수 있다. 그러나, 신경구와 단층 문화 둘 다 정지 NSCs14를고려하지 않습니다. 더욱이, NSA는11,,12,,13 및 생성된 신경구 주파수는 배지 성분, 해부 절차, 해리 과정11,12,,13,및 신경구 응집5를포함하는 많은 인자에 의존한다., 실제로, 고밀도 문화에서, 신경구는 집합하는 경향이 있습니다. 따라서 샘플에서 전구체 셀수를 추정할 때는 주의해야 합니다. 위의 한계를 극복하기 위해, 분리된 NSPC는 또한 단층5,,15로확장 및 통과될 수 있다. 중요한 것은, NSA를 사용하여 서로 다른 조건 들 사이에서 전구체 세포 주파수를 비교하는 것은 이 모든 한계가 암시적이고 동일한 실험에서 수행된 모든 조건 사이에서 유사하기 때문에 매우 유용하고 정확합니다.
주의가 필요한 신경구 문화에는 중요한 단계가 있습니다. 뇌 수확 단계에서, 수막의 완전한 제거와 신경 성 틈새의 좋은 격리는 NSPC의 순도와 수율을 극대화하는 데 필수적입니다. 조직 해리 동안, 트립신의 프로테올분해 활성으로 인해, 트립신의 과도한 사용 또는 더 긴 배양 시간은 세포 용해로 이어질 수 있습니다. 또한, 통로의 날은 신경 구의 건강한 인구를 얻기 위해 중요합니다. 직경이 200 μm 보다 높은 신경구를 통과하는 것은 NSPC의 생존성, 증식 및 분화 능력에 크게 영향을미칩니다. 또한 SVZ 및 DG 세포에 대한 PDL 및 PLD/라미닌코팅은 분화 과정을 손상시키지 않으면서 신경구에서 좋은 세포 이동을 보장하는 데 필수적입니다. 면역 세포 화학 분석의 관점에서, PFA를 가진 더 긴 배양 시간은 항원을 마스킹하고 배경을 증가시킴으로써 염색을 손상시킬 수 있습니다.
NSA는 신경 발달 및 분화뿐만 아니라 치료목적16,,17의시험관 내 연구를 위한 일관되고 무제한의 NSPC 소스를 제공하는 강력한 도구이다. 실제로, 이러한 분석은 NSPC 증식 및 분화에 관여하는 분자 및 세포 기전을 더욱 이해하기 위해 유전적 및 행동 모델에 적용될 수있다 18,,19. 이러한 분석실험은 NSC 특성을 조절하기 위해 다른 약물 및 화합물,23 20,,21,,22뿐만 아니라 유전자 조작을 수행하는데에도유용하다. 면역세포화학 이외에, 역전사 중합효소 연쇄 반응 및 웨스턴 블롯 분석은 RNA 및 단백질 발현에 접근하기 위해 수행될 수 있으며, 전기생리학 연구 및 칼슘 이미징은 신생뉴런21의기능을 평가하는데 사용될 수 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 IF/01227/2015 및 UID/BIM/50005/2019, projeto financiado pela Fundação para a Ciência e a Tecnologia (FCT)/ Ministério da Ciência, Tecnologia e Ensino Superior (MCTES) através de Fundos do Orçamento de Estado. R.S. (SFRH/BD/128280/2017, F.F.R. (IMM/CT/35-2018), D.M.L. (PD/BD/141784/2018), 그리고 R.S.R.(SFRH/BD/129710/2017)에서 FC십을 받았습니다. 저자는 현미경 검사법 지원을 위한 Instituto de Medicina 분자 João Lobo Antunes에 있는 생물 화상 진찰 시설의 일원에게 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
참고문헌
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393(2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225(2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529(2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457(2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639(2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161(2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978(2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516(2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin? Frontiers in Cellular Neuroscience. 8, 59(2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962(2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유