Method Article
Kardiyak Hedefleme Peptidin Transdüksiyon Verimlerinin Vivo Görüntülemesinde
Bu Makalede
Özet
Eksvivo görüntüleme sistemlerini kullanan hücre penetran peptidler ile transdüksiyon derecesini değerlendirmek için protokolleri, parafin katıştırma, kesitleme ve konfokal floresan mikroskopisi kalp hedefleme peptidini örnek olarak kullanarak açıklıyoruz. Protokolümüzde, tek bir hayvan aynı organların her iki tür de görüntüleme değerlendirmesini elde etmek için kullanılabilir ve bu da çalışmalar için gerekli hayvan sayısını yarı yarıya azaltabilir.
Özet
Protein transdüksiyon etki alanlarının ilk açıklamasından bu yana, hücre delici peptidler olarak da bilinen, 25 yıl önce, tanı ve tedavi edici malzemelerin teslimi için yeni vektörler olarak bu peptidlerin, özellikle de hücreye özgü olanların geliştirilmesine yoğun ilgi olmuştur. Faj taraması içeren geçmiş çalışmamızda, intravenöz enjeksiyondan sonra 15 dakika gibi kısa bir sürede görülen pik alımı ile normal kalp dokusunu invivo olarak aktarabilme yeteneği nedeniyle kardiyak hedefleme peptid (CTP) adını verdiğimiz 12 amino asit uzunluğunda bir peptid tanımlanmıştır. Florofor siyanür5.5 etiketli CTP enjekte ederek, çeşitli süreler boyunca dolaşmasına izin vererek ve floresan mikroskopi görüntülemenin ardından birden fazla organın ötenazi, sabitlenmesi ve kesitlenmesi ile detaylı biyodağıtım çalışmaları yaptık. Bu yayında, in vivo görüntüleme sistemi kullanılarak hasat edilen organların ex vivo görüntülemesinin yanı sıra bu süreçleri de ayrıntılı olarak açıklıyoruz. Örnek olarak CTP kullanarak transdüksiyon ve biyodağıtım çalışmaları nın üstlenilen ayrıntılı metodolojiler ve uygulamalar sayılmaktadır.
Giriş
Hücre plazma membranı hücre bütünlüğü ve hayatta kalma için gerekli olan yarı geçirbilebilir bir bariyerdir ve hücre içine maddelerin hareketini kontrol ederek hücrenin iç düzenlemek için hizmet vermektedir. Hayatta kalmak için hayati olmasına rağmen, aynı zamanda hücreye kargo teslimi için bir engel sunuyor. 1988 yılında, transkripsiyon trans-aktivatör (Tat) protein insan immün yetmezlik virüsü kültürlü hücrelere girmek ve viral gen ekspresyonu teşvik gösterilmiştir1,2, etki alanları bu transdüksiyon için üçüncü helix sınırlı ve lizin zengin 13-amino asit bölgesi ile sınırlı olan bu böylece hücre peptidler (CPPs) olarak adlandırılmıştır.3 Bunu, Tat peptidin fonksiyonel β-galaktosidazı birden fazla hücretipinetaşıma yeteneğini gösteren araştırmalar izledi 4 . İlk tanımdan bu yana, hücre delici peptidlerin sayısı önemli ölçüde artmıştır. Bu transdüksiyon etki alanları doğal olarak meydana gelen veya sentetik kısa peptidler, genellikle 6−20 amino asitler uzunluğunda, hücre zarları arasında fonksiyonel yükleri taşımak edebiliyoruz. Bu yükler diğer küçük peptidler, tam uzunlukta proteinler, nükleik asitler, nano tanecikleri, viral parçacıklar, floresan moleküller ve radyoizotoplar5arasında değişebilir. Açıklanan ilk KPS hücre spesifik değildi, Tat birden fazla hücre tipleri tarafından alınan ve hatta kan-beyin bariyerini geçerek4, dolayısıyla tedavi potansiyelini sınırlayan. Hücreye özgü CpPs belirlemek için, araştırmacılar büyük kullanarak faj ekran üstlenilen var, ticari olarak kullanılabilir faj kütüphaneleri6. Bir kombinatoryal in vitro ve in vivo faj görüntüleme metodolojisi kullanarak kendi çalışmamız kardiyak hedefleme peptid (CTP)7adlı bir CPP belirlenmesine yol açtı , 12-amino asit, doğal olmayan oluşan peptid (NH2-APWHLSSQYSRT-COOH) bir periferik intravenöz enjeksiyon 8 sonra pik alımı ile kalbi hedefleyen8. Aktin ile immünfloresan kolokalizasyon kullanarak, hücre içi belirteç, ve lamina hariç, bir hücre zarı belirteci, biz CTP bir intravenöz enjeksiyon sonra fare kardiyomiyosit içine internalize olduğunu gösterdi7. Ayrıca, insan indüklenen pluripotent kök hücre kaynaklı dayak kardiyomiyositler çift etiketli CTP ile, onun C-terminus ve rhodamine onun N-terminus sadece hücre içi ester ester esterases tarafından yarıdan olabilir bir ester bağlantı ile etiketli. Konfokal mikroskopide 15 dk içinde kardiyomiyositlere rhodamine hızlı birikimi gözlendi8.
Bu makalede, biyodağılımı izlemek ve CTP kullanarak KPP'lerin dokuya özgü içselleşmesini onaylamak için kullanılabilecek iki ücretsiz metodoloji sayılmaktadır. Bu metodolojiler için CTP sentezlendi, floresan olarak N-terminus'ta siyanür5.5 (CY5.5) ile etiketlendi ve daha fazla peptit stabilitesi için C-terminusta amid-kapaklı. Kullanılan iki metodoloji in vivo floresan optik görüntüleme sistemleri ve doku kesitlerinin floresan mikroskobu. Her iki yöntem de biyodağıtım, alım ve floresan etiketli CpPs ortadan kaldırılması çalışmalarında çok yararlıdır. Tek foton emisyon tomografisi (SPECT) veya pozitron emisyon tomografisi (PET) gibi bu yöntemlerle biyodağılımı değerlendirmenin avantajı, tüm peptit sentez tesislerinde nispeten kolay ve rutin kullanımda olan floresan etiketleme ile karşılaştırıldığında CpP'lerin zaman yoğun radyolabeling'ine gerek olmamasıdır. In vivo görüntülemekullanımı hızlı bir şekilde yaşayan bir sistem bağlamında biyodağıtım verileri üretirken, kesit, morfolojik detayların korunması yoluyla hücrelerdeki peptit alımı ve lokalizasyonu hakkında daha ayrıntılı bilgi sağlar. Bu protokol kalp, akciğer, karaciğer, böbrek, beyin, dalak, mide, kalın bağırsak, ince bağırsak, iskelet kası, kemik, testisler/yumurtalıklar ve gözler gibi çok çeşitli organ ve dokulara uygulanabilir.
Protokol
Pittsburgh Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi bu hayvan deneylerinden herhangi birini üstlenmeden önce bu yayında belirtilen tüm hayvan protokollerini onayladı.
NOT: Bu protokol, ex vivo optik floresan görüntüleme yi kullanan ex vivo optik floresan görüntüleme ve in vivo biyodistribution çalışmalarını kullanarak organları parafin, kesitleme ve floresan mikroskopi ile nasıl yapılanayrıntıları. CTP örnek olarak kullanılsa da, bu yöntem floresan olarak etiketlenmiş herhangi bir CPP'ye uygulanabilir.
1. In vivo görüntüleme
- Katı faz sentez teknikleri kullanarak CTP sentezinisynthesize 9,10 Cy5.5 ve C-terminus amid ile etiketlenmiş bir N-terminus ile L-amino asitler kullanarak bir peptid sentez tesisinden artan istikrar için.
NOT: Sentezlenen tüm CpP'ler,11kullanmadan önce yüksek performanslı sıvı kromatografisi (HPLC) ve/veya matris destekli lazer desorpsiyon/iyonizasyon (MALDI) kullanılarak karakterize edilmelidir. - Dimetil sülfoksit (DMSO) içinde 1 mM veya 10 mM stok çözeltisi yapın ve -80 °C'de ışık la korunun.
NOT: Peptidler lyophilized toz olarak teslim edilir. Liyofilize toz uzun süreli (6 ay-2 yıl) -20 °C'de, ışıkla korunan ve higroskopik koşullarda saklanabilir. DMSO'da yorumlanıp depolandığında, donma-çözülme döngülerinden kaçınılmalıdır. - Bir ketamin/ksilazin çözeltisinin (100 mg/kg ketamin ve 20 mg/kg ksilazin) intramüsküler (arka bacak) veya intraperitoneal (sol alt kadranda) doku ağırlığının 2 μL/g'sini kullanarak 6 haftalık CD1 dişi fareleri tartMak ve anestezik.
NOT: Ketamin/ksilazin çözeltileri kullanım gününde taze yapılmalıdır. Kullanılmayan ketamin/ksilazin uygun şekilde bertaraf edilmeli ve ketamin kontrollü bir madde olduğu için bir kütükte kaydedilmiş hacimlere karşı kullanılan hacimler atılmalıdır. Bir parmak sıkışmasına yanıt verilmemesi ile değerlendirildiği gibi, yeterli anestezi düzeyi 5−7 dk içinde elde edilecektir. - 10 mg/kg Cy5.5-CTP dozu hesaplayın, fosfat tamponlu salin (PBS) ile en fazla 200 μL'ye seyreltin ve insülin şırınga kullanarak retro-orbital veya kuyruk damar enjeksiyonu yoluyla enjekte edin(Şekil 1A).
- Peptid15 dakika-6 saat arasında değişen, önceden belirtilen süre boyunca sirküle izin verin.
- Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından belirtildiği gibi yüksek CO2 inhalasyon yöntemini kullanarak fareyi ötenazi ve makas kullanarak göğüs boşluğunu açın(Şekil 1B).
- Sağ atriyumun lateral, serbest duvarküçük bir nick yerleştirmek için makas kullanın ve perfüzyon farenin organları sabitleme ve kırmızı kan hücrelerini dışarı yıkama çift amacı için 26 G iğne kullanarak% 10 tamponlu formalin fosfat 3 mL enjekte (Şekil 1C).
- Kalp, akciğer, karaciğer, böbrekler, dalak, kalın bağırsaklar, ince bağırsaklar, mesane, yumurtalıklar/testisler ve beyin ve ex vivo optik görüntüleme için 12 kuyu plakasının tek tek kuyularına yerleştirin (Şekil 1D).
- Görüntü edinme yazılımını başlatın ve sistemi görüntüleme örnekleri için hazırlamak için Initialize düğmesini tıklayın. Görüntüleme sihirbazını açın, floresan seçin, sonra filtre çifti, sonra 580 nm uyarma ve 620 nm emisyon filtreleri uygulamak için boyalar listesinden Cy5.5 boya seçin. Pozlama parametreleri için manuel ayarları seçin ve sahne konumunu B'ye ayarlayın, pozlama süresini 1 saniyeye ayarlayın, F/stop'u 8'e ayarlayın ve binning'i küçük olarak ayarlayın.
NOT: Uyarma emisyon filtreleri kullanılan etikete bağlı olarak değişir. Kullanılan etiketin uyarılması ve salınımı, yazılımın uyarma ve emisyon filtrelerini ataması için el ile girilebilir. Doygunluğu önlemek için sayımların 600-60.000 arasında olduğundan emin olun. Kullanılan sisteme bağlı olarak, otomatik edinme optimizasyonu kullanılabilir. Sistem, elde edilen görüntüleri farklı ayarlarla karşılaştırmak için bir tazminata sahipse, otomatik ayarlar kullanılabilir. Herhangi bir tazminat yoksa, ayarların örnekler arasında sürekli olarak belirlenmesi, kaydedilmesi ve kullanılması gerekir. - Sistem tamamen başfasyona geçtiğinde, ilgi çeken organları 12 kuyu plakası içine yerleştirin ve optik görüntüleme odasının içine yerleştirin, böylece örneklerin görüntüler için istenilen şekilde düzenlenmesini sağlar. Edinme'yi seçin ve ardından görüntüler için bir kaydet konumu seçin. Fare hakkındaki bilgiler, görüntü etiketleri açılır penceresine yazılabilir.
- Görüntülemeden sonra, örnekleri odadan çıkarın ve oda sıcaklığında ışık koruması (RT) ile sintilasyon şişelerinde doku hacminin en az 20 katı kadar tamponlu formalin fosfatı %10 oranında depolayın.
- Birimleri Radyant Verimlilik'e ayarlayarak görüntüleri ölçün, ardından 4x3 ROI'yı seçin ve her birini yg'nin bir karesine eşit olarak sığdıracak şekilde ayarlayın ve ardından ölçüye tıklayın. Grid YG ölçümleri sekmesini açın, dışa aktarma'yı seçin ve ölçümleri .cvs dosyası olarak kaydedin.
2. Histoloji
NOT: Farklı organlar elde etmek için 1.1−1.8 adımlarını izleyin. Alternatif olarak, resimde aynı organlar formalin hemen yerleştirilebilir ve aşağıda ayrıntılı olarak kesit için kullanılır.
- Histoloji için işleme den önce her organı %10'luk tamponlu formalin fosfatta en az 48 saat saklayın.
- Organlar 48 saat sonra yeterince sabitlendiğinde, organları doku işleme ve katıştırma kasetlerine aktarın ve bir doku işleme makinesine yerleştirin(Şekil 1E).
- 30 dakika boyunca % 70 etanol doku dehydrate için işleme makinesi ayarlayın, 30 dakika için% 80 etanol takip, 30 dakika için% 95 etanol, 30 dakika için% 95 etanol, 15 dakika için% 100 etanol, 20 dakika için% 100 etanol ve son olarak% 100 etanol 20 dakika için.
- Her ksilen tedavisi için 30 dk ile, ksilen 2x doku temizleyin.
- Her tedavi ile 30 dk için 60 °C'de parafin balmumu 4x ile temizlenmiş doku infiltrasyon.
- Metal kalıplar kullanarak parafin embed. Kalıbı erimiş parafinle doldurun (65 °C'de tutulur) ve soğuk bir tabağa aktarın. Kalıbın altındaki parafin katılaşmaya başladığında, organı parafinin içine yerleştirin (Şekil 1F).
- Kalıp üstüne bir destek olarak etiketli bir kaset yerleştirin ve erimiş parafin ile dolgu. Katı kadar soğumasını bekleyin. Daha sonra bloğu bir gecede -20 °C'lik bir dondurucuda saklayarak balmumu kalıplardan kolayca uzaklaştırılabilmek için daha da küçültün.
NOT: Bloklar artık RT'de ışık koruması ile saklanabilir. - Distile su ile 38 °C su banyosu hazırlayın. Mikrotomu 6° bıçak açısı ve 10 μm'lik bir kesit kalınlığı ile ayarlayın.
- Doku bloklarını mikrotome monte edin ve doku içeren kesitler elde edilene kadar kesmeye başlayın. Daha sonra blokları 5 dakika boyunca suya yüzüstü yerleştirin veya doku biraz nemi emilinceye kadar (örneğin, bloğun ince beyaz bir anahattı belirdiğinde[Şekil 1G]).
NOT: Kesitlerin kalitesini sağlamak için bıçak sık sık değiştirilmelidir. - 10 dakika boyunca düz bir buz bloğu üzerine doku yerleştirin, sonra adım 2.9 aynı yönde mikrotome geri dönün. Bölümleri almaya başlayın ve kesilen bölümlerin her biri 6−10 bölümden oluşan uzun şeritler oluşturmasına izin verin. Bir slaytı kapsayacak kadar yüksek kaliteli bir şerit üretilene kadar suboptimal parafin şeritleratın. Doku kesitlerinin kesilmesini veya kırışmasını önlemek için kesme hızlarını, doku nemlendirmesini ve su banyosu sıcaklığını ayarlayarak kesitleri optimize edin.
NOT: Dokuların düştüğü delikler, dokuda yırtıklar veya dokudaki sıkı kırışıklık ve kıvrımlar olan kesitler atılmalıdır. - Künt kenar forsepsile tercih edilen kalite kurdelesini dikkatlice seçin ve 38 °C su banyosunun yüzeyinde yüzebilirsiniz. Kesitler düzleşene kadar yüzeyde oturun, parafinin parçalanmasını ve parçalanmasını önlemek için onları çok uzun süre bırakmamaya özen.
- Düzleştirilmiş bölümleri temiz cam slaytların yüzeyine yüzdürün. Balmumu eritmek için 30 dakika için 65 ° C fırın içine slaytlar yerleştirin.
NOT: Bu slaytlar RT ışık koruması ile saklanabilir. - Ksilen 3x, 10 dk her tedavi için slaytlar deparaffinize.
- 5 dakika için% 100 etanol doku rehydrate, 5 dakika için% 95 etanol takip, 5 dakika için% 70 etanol, 5 dakika için% 50 etanol, ve son olarak 1x tris-tamponlu salin (TBS) 5 dakika(Şekil 1H). Slaytların bir gecede kurumasını bekleyin.
NOT: Bu slaytlar, ışıkla korundukları sürece RT'de uzun süre saklanabilir. - 4′,6-diamidino-2-fenilindole (DAPI), bir nükleer floresan prob içeren montaj ortamı 125 μL kullanarak kapakları ile slaytlar montaj(Şekil 1I). Rt'de bir gecede kuru slaytlar, ışık korumalı.
NOT: Kurutulmuş kaydıralar 4 °C'de uzun süreli, ışıkla korunabilir. - Floresan mikroskopi kullanarak görüntü slaytlar.
NOT: Kantitatif olarak yararlı olmadıklarından, doymuş görüntülerden kaçınılmalıdır. Doygunluğu önlemek için pozlama ve kazanç ayarlarını ayarlamak azaltılabilir. Karşılaştırılan örnekler arasında aynı ayarları kullanmaya özen. Maruz kalma sürelerini sınırlayarak dokunun beyazlatma kaçının.
Sonuçlar
Bu protokolü kullanarak, retro-orbital enjeksiyon yoluyla 10 mg/kg cy5.5-CTP dozu ile üç fareyi tedavi ettik(Şekil 1A). Peptitin 15 dakika boyunca dolaşmasına izin verdikten sonra, fareler CO2 haznesi kullanılarak ötenazi yedirildi, göğüs ortan sternotomi kesisinden açıldı, sağ atriyum çalındı ve fare perfüzyonu %10 fosfat tamponlu formalinin 3 mL'si kullanılarak düzeltildi (Şekil 1B,C). Fiksasyon dan sonra, kalp, akciğerler, karaciğer, böbrek, dalak ve beyin diseksiyon edildi ve ex vivo optik floresan görüntüleme için 12 iyi plaka halinde düzenlenmiştir(Şekil 1D ve Şekil 2A). İğnesi olmayan üç kontrol faresi de perfüzyon, parçalara ayrılmıştı röcam ve görüntülenmiştir (Şekil 1B−D ve Şekil 2B). Her bir organ kümesi için elde edilen floresan verileri, görüntüleme yazılımının göreceli floresan birimi olan radyant verime dönüştürülen sayımlar nedeniyle karşılaştırılabilir. Bu veriler, biyodağıtım çalışmaları için farklı zaman noktaları arasında söz konusu her organ için hem nitel görüntü hem de nicel veri(Şekil 2C)elde etmek için ölçülebilir. Farklı uyarma dalga boylarına yanıt olarak farklı organların otofloresansı Şekil 3A−E'degösterilmiştir. Gelişmiş yeşil floresan protein (EGFP) gibi daha kısa uyarma dalga boyları, özellikle karaciğer ve beyinde, uzak kırmızı (Cy5.5) veya yakın kızılötesi (Cy7) uyarma dalga boylarından daha yüksek otofloresans ile ilişkilidir(Şekil 3). Görüntülenmiş organlar RT'de en az 48 saat süreyle %10 fosfat tamponlu formalin ile sabitlenmiş, ardından doku işleme ve katıştırma kasetlerine transfer edilmiştir(Şekil 1E). Organlar bir doku işleme makinesinde işlendi ve parafinleştirildi, parafin le doldurulmuş kalıplara yerleştirilmiş, -20 °C'de dondurulmuş ve gece boyunca -20 °C'de saklanmış(Şekil 1F). Örnekler kesitli(Şekil 1G)ve dokuremi rehidratasyoniçin çözelti değişimleri ile tedavi edildi (Şekil 1H). Hazırlanan slaytlar daha sonra DAPI floresan montaj ortamı(Şekil 1I)ile monte edilmiştir. Bir kez kuru, genellikle bir gecede, slaytlar floresan mikroskopi kullanılarak görüntülendi. Her bir organın fareden temsili görüntüleri Şekil 4A'dagösterilmiştir. Farklı organlardan elde edilen görüntüler, fareler arasında karşılaştırmaya olanak sağlamak ve nicelliğe izin vermek için aynı ayarlar kullanılarak elde edilmiştir (Şekil 4B).
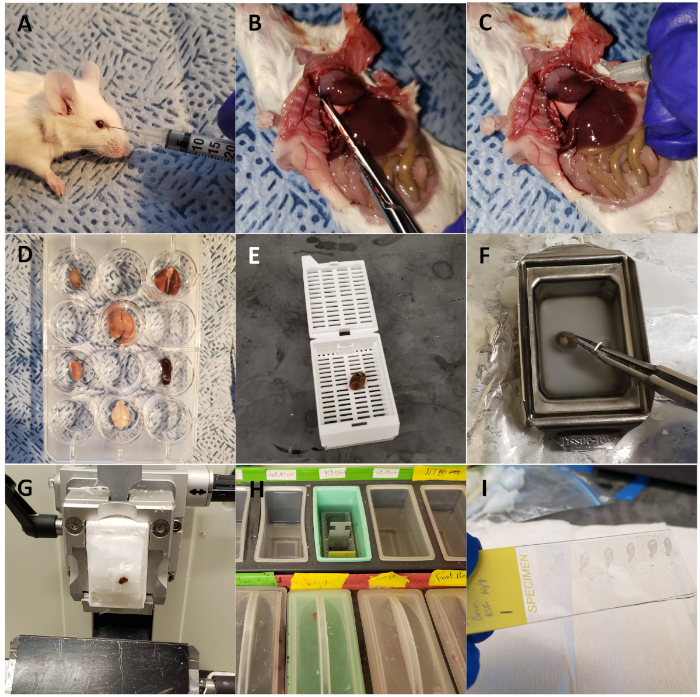
Şekil 1: Ex vivo optik floresan görüntüleme ve kesit için fare organlarının toplanması. (A) Yabani tip fare CTP-Cy5.5 ile retro-orbital olarak enjekte. (B) Fare perfüzyon fiksasyon için göğüs açık, sağ atriyum kesilir ile diseksiyon. (C) Kalp 3 mL ile enjekte 10% tamponlu formalin fosfat hayvanPerfüzyon fiksasyon için. (D) Floresan optik görüntüleme için 12 kuyu plakası içinde hasat edilen ve düzenlenmiş organlar. (E) Kalp bir kasete yüklenir ve bir doku işlemcisi kullanılarak işlenir. (F) Kalp parafin gömülü. (G) Kalp bir mikrotom üzerine kesitli. (H) Slaytlar bir dizi çözüm değişimi yoluyla deparafinize. (I) DAPI kullanılarak kapaklı bölümler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
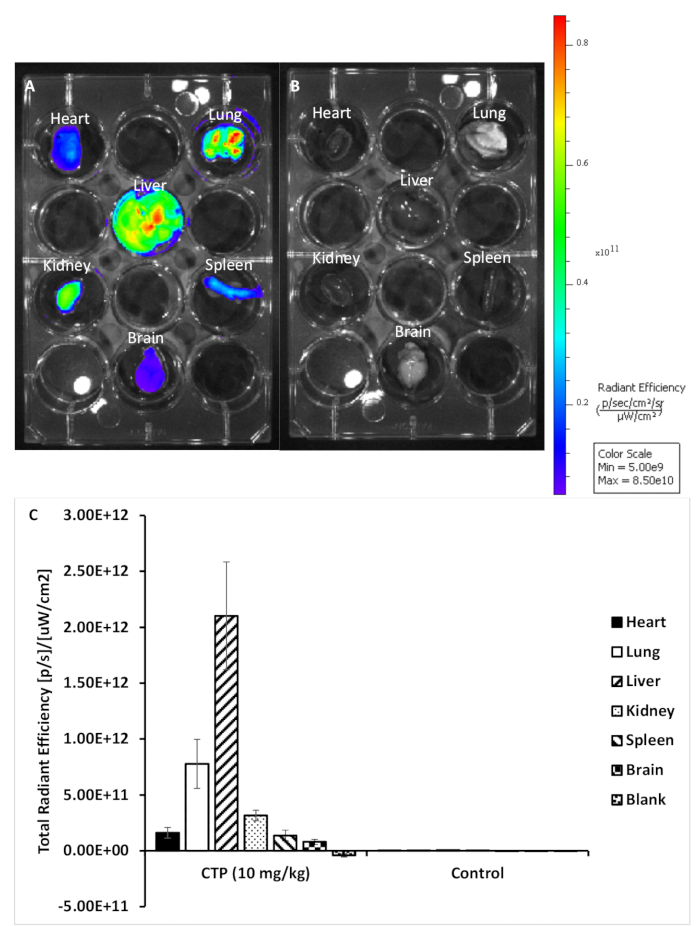
Şekil 2: Tedavi ve kontrol organlarından temsili görüntüler. (A) 10 mg/kg CTP-Cy5.5 ile tedavi edilen bir fareden organlar. (B) Tedavi edilmeyen bir kontrol faresinden gelen organlar. (C) Her organ kümesi için floresan ölçütü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
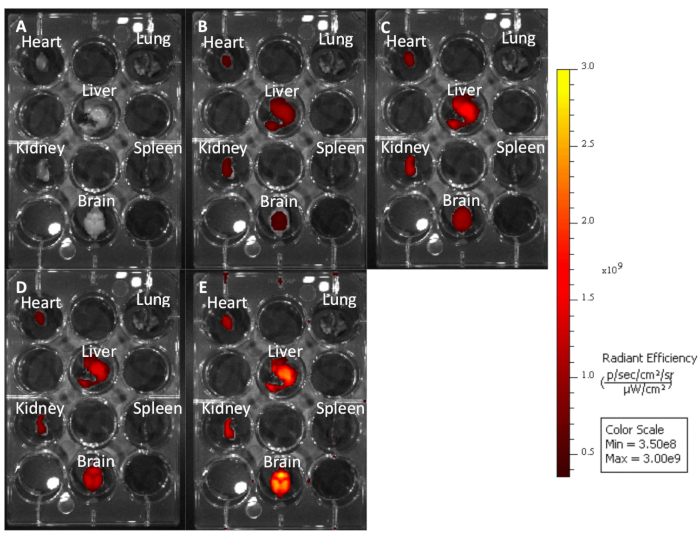
Şekil 3: Dalga boylarının ne kadar uzun otofloresan ürediğini göstermek için farklı uyarma emisyon dalga boylarında görüntülenmiş tedavi edilmemiş fare organları. (A) Cy7: 740−790. (B) Cy5.5: 660−710. (C) Cy5: 620−670. (D) Cy3: 520−570. (E) EGFP: 480−520. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
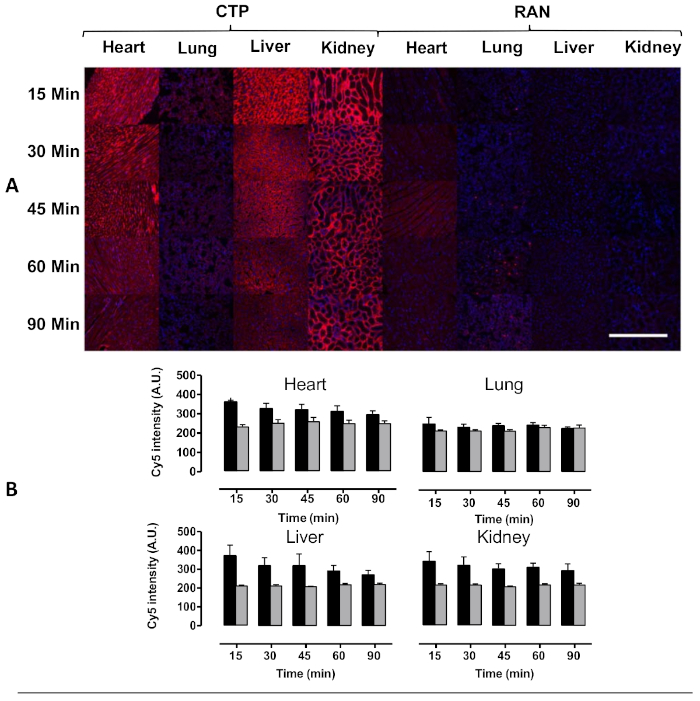
Şekil 4: Farelerde intravenöz enjeksiyon sonrası kalp, akciğer, karaciğer ve böbrek transdüksiyonu. Yabani tip farelere 10 mg/kg Cy5.5-CTP veya rastgele bir peptit (RAN-Cy5.5) enjekte edildi ve belirtilen zaman noktalarında ötenazi yapıldı. (A) Kalp dokusunun pik transdüksiyonu 15 dakika da görüldü ve zaman içinde floresan da sürekli azalma görüldü. Bazı kapiller alımı karaciğerde sağlam transdüksiyon ile akciğerlerde yanı sıra böbrek glomerüler kılcal damarlar, ikincisi atılım bir böbrek mekanizması ima dikkat çekti. (B) Floresan yoğunluğunun nicelliği, RAN-Cy5.5 üzerinde CTP-Cy5.5'in kalp alımını önemli ölçüde artırdığını göstermektedir. Ölçek çubuğu = 500 μm. Bu rakam Zahid ve ark.8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Hayvan modelleri, yeni KP'lerin tanımlanmasından, biyodağıtım çalışmalarından, transdüksiyon mekanizmasından, bu yeni CpP'leri vektör olarak kullanarak teslim edilen kargonun etkinliğini test etmeye kadar sürecin her aşamasında klinik öncesi ilaç gelişimi için gereklidir. Histoloji, nükleer tıp görüntüleme (SPECT ve PET) ve in vivo optik görüntüleme12gibi biyodağıtımı değerlendirmek için yaygın olarak kullanılan birçok yöntem vardır. Nükleer görüntüleme yöntemleri küçük hayvan SPECT ve PET sistemlerinin sınırlı kullanılabilirliği nedeniyle hantal olabilir, yanı sıra radyokimyacı uzmanlık gerektiren radiolabel-ilaç konjugeler üretmek için yeteneği. Buna karşılık, floresan etiketler çok daha basittir ve çalışmak için maliyet etkin olabilir. Bu yazıda açıklanan protokol, birden fazla yöntem kullanılarak biyodağılımın hızlı analizini sağlar. Ex vivo tüm organ floresan optik görüntüleme farklı doku lar ve tedavi grupları arasında floresan hemen karşılaştırma sağlar ve yarı kantitatif bir şekilde ilgi organında alımı pik organ alımını ve zaman belirleyebilirsiniz. Kantitatif doku histolojisi dokuların tedavisi, kesiti, görüntülenmesi ve analiz iúlenmesi için daha kapsamlı bir işleme gerektirir, ancak mikroskobik düzeyde daha fazla veri sağlar ve güncel bir standart tekniktir. Farklı organlar ve uyarma dalga boyları için her teknikte görülen otofloresans önemli ölçüde değiştiğinden, iki teknik arasında doğrudan, nicel karşılaştırmanın mümkün olmadığını belirtmekte değerlidir.
Bu protokolün önemli bir bölümü, denemeiçin aday CpPs etiketlemek için doğru florofor seçmektir. Bir potansiyel sorun birden fazla florofor gerektiğinde sorunlu olabilir spektrum örtüşmesi vardır. DAPI floresan montaj ortamı ve Cy5.5 örtüşen spektrumları yok. Ancak, birden fazla floroforgereklinin gerekli olduğu bazı uygulamalarda spektral çakışma riskinin dikkatle değerlendirilmesi gerekmektedir. Kullanılan sisteme bağlı olarak florofor seçimi sınırlı olabilir. Bu nedenle, sistemin yetenekleri hakkında bilgi önemlidir. Floresan optik sistemler en iyi kısa dalga boylarının yüksek doku emilimi nedeniyle uzak kırmızı veya yakın kızılötesi floropores ile kullanılmaktadır13. Gelişmiş yeşil floresan protein aralığında floresan önemli bir sınırlama var, onun uyarma dalga boyunda görülen önemli organ otofloresans çünkü, özellikle beyin ve karaciğer dokusunda. Bir deneyin koşullarına bağlı olarak, bazı floroforlar en iyi kaçınılmalıdır. Bazı suda çözünen organik floroforlar lipid iki katları ile güçlü bir etkileşime sahiptir, hangi yanlış pozitif neden olabilir. Bu nedenle, bir florofor ilgi dokusuna güçlü bir yakınlık olup olmadığını belirlemek için adımlar atılması tavsiye edilir14. Göz önünde bulundurulması gereken bir diğer faktör de sonuçları etkileyen önemli bir parametre olabilecek uygun florofor çekimi yöntemini seçmektir. CpPs n floresan olarak etiketlenebilir- veya C-terminus peptid N-terminus ve Cy5.5-NHS gibi boya karboksil grubu arasında kovalent bir bağ yoluyla. Çoğu KPS'nin transdüksiyon mekanizması ayrıntılı olarak anlaşılamadığından ve bir uçtaki çekim alım mekanizmasını diğer uca göre daha çok etkileyebileceğinden, özen izlenmelidir. CpPs etiketleme için başka bir olasılık floresan streptavidin etiketli konjugasyon için N-terminus biotinylating yoluyla. Bu stratejiyi kullanarak farklı floresan streptavidin conjugates kullanılmasına izin kolaylığı vardır. Ancak, bu stratejinin olası bir sınırlama bir biotin-streptavidin kompleksi potansiyel transdüksiyon engel olabilir büyük bir yapı olmasıdır.
Floresan optik görüntüleme sistemleri, farklı organlar ve tedaviler arasında floresan karşılaştırması verimli bir şekilde oluşturmak için etkili bir stratejidir, ancak dokudaki mutlak konsantrasyonların nicel bir ölçüsünü üretememektedir. Bu doku içinde ışık saçılma etkileri nedeniyle, hangi daha fazla doku boyutları ve yoğunlukları doğal olarak oluşan çeşitli ile bileşik, ve vaskülarite farklılıkları, değişken floresan saçılma ile. Doku otofloresans da bir faktör olabilir, kollajen gibi doğal olarak oluşan biyokimyasal kaynaklar nedeniyle, ya da gıda klorofil gibi diyet kaynakları13.
Histoloji biyodağılımı ölçmenin en yaygın kullanılan yöntemidir ve zaman içinde farklı dokular arasında alımını doğru bir şekilde ölçmek ve karşılaştırmak için kullanılabilir. Tüm dokular aynı kalınlığa15kesitli olduğundan ışık saçılma sorunları bu yöntem kullanılarak önlenir. Bu yöntemin en önemli avantajı immünohistokimya için ek floresan etiketler postsectioning dahil yeteneğidir. Başka bir florofor eklenmesi görüntülemeyi daha zor hale getirse de, floresan etiketlerin kullanımı, lysosomes veya mitokondri gibi belirli hücre içi bölmelere CPP lokalizasyonu için yararlı olabilir. Bir antikor bir konfokal mikroskopi deneyinde transeksif bir aday CPP'nin bir araştırma yapısıyla bir araya olup olmadığını belirlemek için kullanılabilir, bu da bir Dağıtım maddesi olarak Bir CPP'nin potansiyelini gösterebilir. Bu yöntemin bir sınırlama organ örneklerinden slaytlar hazırlanması zaman alıcı olabilir, emek yoğun, ve insan hatasına eğilimli12,15. Görüntü slaytları, photobleaching önlemek için çok uzun süre aynı konumu görüntü değil dikkatli olmalıdır. Florofor hassasiyetine bağlı olarak bazı fotobeyazrlama kaçınılmaz olacaktır. Örneklerin ortam ışığından korunması ve düzgün bir şekilde sakkorunmasına özen16. Slaytların ileride görüntüleme için ışık korumalı olarak 4 °C'de saklanmalarını öneririz.
Daha karmaşık CPP etiketleme gerektirebilir rağmen, özel ekipman gerektiren ve karşılaştırılabilir sonuçlar üretebilir bir aday CPP biyodağıtım ölçmek için çeşitli yöntemler vardır. Bu yazıda açıklanan protokol, aynı örnekten hücrelerdeki peptit içselleştirmesi hakkında daha derinlemesine bilgi edinimi sağlarken, yaşam sistemi bağlamında biyodağıtım verilerini verimli bir şekilde üretmek için iki uyumlu yöntem kullanır ve böylece bir çalışma için gerekli olan hayvan sayısını yarı yarıya azaltmaktadır. Bu yöntemler, her iki yöntemin de aynı hayvanda sırayla kullanılabileceğini ve her biri tarafından oluşturulan verilerin kalitesini gösteren yukarıdaki verileri oluşturmak için kullanılmıştır. Sonuçlarımız ayrıca, iki teknik arasındaki sonuçları nicel bir şekilde doğrudan ilişkilendirememenin de altını çizmektedir.
Açıklamalar
M.Z. ve Paul D. Robbins (Minnesota Üniversitesi, Minnesota, MN, ABD) kardiyak vektör olarak kardiyak hedefleme peptid kullanımı üzerinde bir patent tutun (Kardiyak spesifik protein hedefleme etki alanı, ABD Patent Seri No. 9,249,184). M.Z. aynı zamanda Baş Bilimsel Yetkili olarak görev yapmakta ve vivasc Therapeutics Inc.'in yönetim kurulunda yer alıyor ve bu şirkette önemli bir özsermayesi var.
Teşekkürler
M.Z. ve K.S.F. Amerikan Kalp Derneği Bilim Adamı Geliştirme Ödülü 17SDG334111180 tarafından desteklenir ve Pittsburgh Üniversitesi Klinik ve Çeviri Bilim Enstitüsü aracılığıyla Pitt Innovation Challenge (PInCh®) altında verilen bir hibe ile desteklenir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% Buffered Formalin Phosphate | ThermoFisher | SF100-4 | |
| 10x Tris Buffered Saline (TBS) | ThermoFisher | BP2471-1 | |
| 12-well Cell Culture Plate | ThermoFisher | 353043 | |
| 1x TBS Solution | 10x TBS is diluted 1:10 with deionized water. This solution can be stored at room temperature. | ||
| 20 mL Scintillation Vials | Wheaton | 334173 | |
| 26G Needles | Becton Dickinson | 305110 | |
| 28G 0.5ml Insulin syringes | Becton Dickinson | 329461 | |
| 3mL Syringe | Becton Dickinson | 309657 | |
| CD1 Mice | Charles River | 022 | 6 to 12 week old albino, female mice |
| Cover Glass | ThermoFisher | 12-544-14 | |
| Cy5.5-CTP-amide | Prepared by peptide synthesis, conjugated with Cy5.5 fluorophore, and purified using HPLC. Lyophilized powder is reconstituted in DMSO at 10mM concentration. After reconstituting, store at -80 °C. | ||
| Dapi Fluoromount G | SouthernBiotech | 0100-20 | |
| Dumont #5 Forceps | Fine Science Tools | 99150-20 | |
| Ethanol | |||
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Ketamine HCl 100mg/mL | KetaVed | NDC 50989-161-06 | |
| Ketamine/Xylazine Solution | Ketamine HCl is mixed with Xylazine 1:1 to produce a stock solution containing 50mg/mL ketamine and 10mg/mL Xylazine. This solution is made fresh before each use. | ||
| Leica RM2235 Rotary Microtome | Leica | RM2235 | |
| Microscope Slides | ThermoFisher | B9992000TN | |
| Paraplast X-TRA | Sigma | P3808-1KG | |
| Perkin Elmer Lumina S5 IVIS | Perkin Elmer | CLS148588 | |
| Sparkle Optical Lens Cleaner | ThermoFisher | NC0090079 | |
| Tissue-Tek Processing/Embedding Cassettes | ThermoFisher | NC9499605 | |
| Tissue-Tek VIP Processing machine | Tissue-Tek | VIP 5A-F1 | |
| Xylazine 20 mg/mL | AnaSed | NDC 59399-110-20 | |
| Xylenes | ThermoFisher | X5-4 |
Referanslar
- Green, M., Loewenstein, P. M. Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein. Cell. 55 (6), 1179-1188 (1988).
- Frankel, A. D., Pabo, C. O. Cellular uptake of the tat protein from human immunodeficiency virus. Cell. 55 (6), 1189-1193 (1988).
- Derossi, D., Joliot, A. H., Chassaing, G., Prochiantz, A. The third helix of the Antennapedia homeodomain translocates through biological membranes. Journal of Biological Chemistry. 269 (14), 10444-10450 (1994).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Zahid, M., Robbins, P. D. Cell-type specific penetrating peptides: therapeutic promises and challenges. Molecules. 20 (7), 13055-13070 (2015).
- Zahid, M., Robbins, P. D. Identification and characterization of tissue-specific protein transduction domains using peptide phage display. Methods in Molecular Biology. 683, 277-289 (2011).
- Zahid, M., et al. Identification of a cardiac specific protein transduction domain by in vivo biopanning using a M13 phage peptide display library in mice. PLoS One. 5 (8), e12252 (2010).
- Zahid, M., et al. Cardiac Targeting Peptide, a Novel Cardiac Vector: Studies in Bio-Distribution, Imaging Application, and Mechanism of Transduction. Biomolecules. 8 (4), E147 (2018).
- Amblard, M., Fehrentz, J. A., Martinez, J., Subra, G. Methods and protocols of modern solid phase Peptide synthesis. Molecular Biotechnology. 33 (3), 239-254 (2006).
- Katritzky, A. R., Yoshioka, M., Narindoshvili, T., Chung, A., Johnson, J. V. Fluorescent labeling of peptides on solid phase. Organic and Biomolecular Chemistry. 6 (24), 4582-4586 (2008).
- Prabhala, B. K., Mirza, O., Hojrup, P., Hansen, P. R. Characterization of Synthetic Peptides by Mass Spectrometry. Methods in Molecular Biology. 1348, 77-82 (2015).
- Arms, L., et al. Advantages and Limitations of Current Techniques for Analyzing the Biodistribution of Nanoparticles. Frontiers in Pharmacology. 9, 802 (2018).
- Leblond, F., Davis, S. C., Valdes, P. A., Pogue, B. W. Pre-clinical whole-body fluorescence imaging: Review of instruments, methods and applications. Journal of Photochemistry and Photobiology. 98 (1), 77-94 (2010).
- Hughes, L. D., Rawle, R. J., Boxer, S. G. Choose your label wisely: water-soluble fluorophores often interact with lipid bilayers. PLoS One. 9 (2), e87649 (2014).
- McGowan, J. W., Bidwell, G. L. The Use of Ex Vivo Whole-organ Imaging and Quantitative Tissue Histology to Determine the Bio-distribution of Fluorescently Labeled Molecules. Journal of Visualized Experiments. (118), e54987 (2016).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. Journal of Cell Biology. 185 (7), 1135-1148 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır