Method Article
심장 표적 펩타이드의 트랜스포션 효율성의 생체 내 이미징
요약
당사는 예를 들어 심장 표적 펩타이드를 사용하여 파라핀 임베딩, 단면 및 공초점 형광 현미경 검사법을 선행한 전 생체 이미징 시스템을 활용한 세포 관통 펩티드에 의한 침투 정도를 평가하기 위한 프로토콜을 설명합니다. 우리의 프로토콜에서, 단 하나 동물은 동일 기관의 화상 진찰 평가의 두 모형을 취득하기 위하여 이용될 수 있고, 따라서 연구 결과에 필요한 동물의 수를 반으로 삭감합니다.
초록
25년 전 세포 관통 펩티드로도 알려진 단백질 트랜스듀션 도메인에 대한 초기 설명 이후, 진단 및 치료 물질을 전달하기 위한 새로운 벡터로서 이러한 펩티드, 특히 세포 별 것들을 개발하는 데 큰 관심이 있었습니다. 파지 디스플레이와 관련된 우리의 과거 작업은 우리가 정맥 주사 후 15 분 정도에서 볼 피크 섭취량으로 생체 내에서 정상적인 심장 조직을 변환하는 능력으로 인해 심장 표적 펩티드 (CTP)라는 이름의 새로운, 비자연적으로 발생하는 12 아미노산 긴 펩티드를 확인했습니다. 우리는 형광 성소 cyanine5.5로 표시된 CTP를 주입하여 다양한 기간 동안 순환할 수 있도록 하고, 형광 현미경 이미징에 이어 여러 장기를 안락사, 고정 및 단면화하여 상세한 생체 분포 연구를 수행했습니다. 이 간행물에서는, 우리는 이 프로세스를 기술하고 생체 내 화상 진찰 시스템을 사용하여 수확한 기관의 전 생체 화상 진찰을 상세히 기술합니다. CTP를 이용한 생체분배 연구뿐만 아니라 트랜스포션을 위한 상세한 방법론과 관행을 예로 들 수 있습니다.
서문
세포 혈장 막은 세포 무결성 및 생존에 필수적인 반과구형 장벽이며 세포내물질의 움직임을 조절하여 세포의 내부를 조절하는 역할을 한다. 생존에 중요하지만, 또한 셀에화물의 배달장벽을 제시한다. 1988년, 인간 면역결핍 바이러스의 전사(Tat) 단백질의 트랜스 활성제는 배양된 세포를 입력하고 바이러스 유전자 발현1,2,2제3나선의 아르기닌 및 리신리치 13 아미노산 영역으로 제한된 이 전염에 대한 책임이 있는 도메인을 통해 이와 같이 세포 관통 펩티드(cptides)라는 이름으로 명명되었다. 이는 기능성 β-갈라콘토시다아제를 다세포 유형4로운반하는 Tat 펩티드의 능력을 보여주는 연구에 선행되었다. 초기 설명 이후, 세포 관통 펩티드의 수가 급격히 증가했습니다. 이러한 트랜스듀션 도메인은 자연적으로 발생하거나 합성적인 짧은 펩타이드, 일반적으로 6-20 아미노산을 길게 운반할 수 있으며, 세포막을 통해 기능성 화물을 운반할 수 있습니다. 이 화물은 다른 작은 펩티드, 전체 길이 단백질, 핵산, 나노 입자, 바이러스 입자, 형광 분자 및 방사성 동위 원소5에서다양할 수 있다. 설명된 초기 CPP는 세포 특정아니었다, Tat는 여러 세포 유형에 의해 채택되고 심지어 혈액 뇌 장벽을 건너4,따라서 그것의 치료 잠재력을 제한. 세포별 CPP를 식별하기 위해, 조사관은 크고 시판적으로 이용 가능한 파지 라이브러리6을활용하여 파지 디스플레이를 착수했다. 시험관 내 및 생체 내 파지 디스플레이 방법론을 이용한 우리 자신의 작업은 심부전 주사후15분 후 15분 만에 최고 섭취량으로 심장을 표적으로 하는 심장 표적 펩티드(CTP)7,12아미노산, 비자연발생 펩티드(NH2-APWHLSSQYSRT-COOH)의 식별으로 이어졌다.2 세포막 마커인 라미닌의 면역형광 관절화, 세포내 마커 및 라미닌의 배제를 사용하여 CTP가 정맥 주사 후 마우스 심근세포로 내면화되는 것으로나타났다 7. 또한, 우리는 인간 유도만능 줄기 세포 유래 박동 심근 세포를 이중 라벨 CTP로 배양, 그것의 C-terminus와 로다민에 6 carboxy fluorescein로 표시 된 그것의 N-종부 에서 단지 세포 내 에스테라에 의해 갈라질 수 있는 에스테르 연결. 로다민의 급속한 축적을 구타하는 심근세포로 15분 이내에 공초점 현미경검사8에서관찰되었다.
이 문서에서는 CTP를 사용하여 바이오 유통을 추적하고 CPP의 조직별 내재화를 확인하는 데 사용할 수 있는 두 가지 무료 방법론을 제시합니다. 이러한 방법론의 경우 CTP는 C-terminus에서 cyanine5.5(CY5.5)를 합성하고 형광으로 표시하고, 더 큰 펩타이드 안정성을 위해 C-terminus에서 아미드 캡을 부착하였다. 사용된 2개의 방법론은 생체 내 형광 광학 화상 진찰 시스템 및 조직 단면도의 형광 현미경 검사법입니다. 두 방법 모두 형광으로 표시된 CPP의 생체 분포, 섭취 및 제거를 연구하는 데 매우 유용합니다. 단일 광자 방출 단층 촬영(SPECT) 또는 양전자 방출 단층 촬영(PET)과 같은 이러한 방법을 사용하여 생체 분포를 평가하는 장점은 모든 펩타이드 합성 시설에서 비교적 쉽고 일상적인 사용으로 인해 형광 라벨링에 비해 CPP의 시간 집약적인 무선 라벨링이 필요하지 않다는 것입니다. 생체 내 이미징의 사용은 살아있는 시스템의 맥락에서 생체 분포 데이터를 신속하게 생성하며, 단면화는 형태학적 세부 사항의 보존을 통해 세포 내 펩타이드 섭취 및 국소화에 대한 더 큰 심층 정보를 제공합니다. 이 프로토콜은 심장, 폐, 간, 신장, 뇌, 비장, 위, 대장, 소장, 골격 근육, 뼈, 고환/난소 및 눈과 같은 다양한 장기 및 조직에 적용될 수 있습니다.
프로토콜
피츠버그 대학의 기관 동물 관리 및 사용 위원회는 이러한 동물 실험을 착수하기 전에이 간행물에 지정된 모든 동물 프로토콜을 승인했습니다.
참고: 본 프로토콜은 전 생체 내 광학 형광 이미징을 활용한 전 생체 분포 연구를 수행하는 방법을 자세히 설명하며, 파라핀에 장기를 포함시켜 생체 내 생체 분포 연구를 수행하고, 단면화 및 형광 현미경 검사를 수행합니다. CTP를 예로 사용하지만 이 방법은 형광으로 표시된 CPP에 적용할 수 있습니다.
1. 생체 내 이미징
- CtP는 고체 상 합성 기법9,,10을 사용하여 L 아미노산을 사용하는 펩타이드 합성 시설에서 Cy5.5 및 C-terminus amide-캡으로 표지되어 안정성이 향상됩니다.
참고: 모든 합성 된 CPP는11을사용하기 전에 고성능 액체 크로마토그래피 (HPLC) 및 / 또는 매트릭스 보조 레이저 탈착 / 이온화 (MALDI)를 사용하여 특징지어져야한다. - 디메틸 설플옥화물(DMSO)에서 CTP의 1mM 또는 10mM 스톡 용액을 만들고, 알리쿼트,-80°C, 빛 보호에 저장한다.
참고 : 펩타이드는 lyophilized 분말로 전달됩니다. lyophilized 분말은 -20 °C, 빛 보호 및 히스테리 조건 하에서 장기 (6 개월 -2 년)에 저장 될 수있다. DMSO에서 알리인용을 인용하고 저장하면 동결 해동 주기를 피해야 합니다. - 계량 및 마취 케타민/자일라진 용액의 조직 중량 2 μL/g(100 mg/kg 케타민 및 20 mg/kg 자일라진)을 사용하여 6주 된 CD1 암컷 마우스를 근육질(뒷다리) 또는 인트라페리톤(왼쪽 왼쪽 사분면 하부)으로 투여합니다.
참고: 케타민/자일라진 솔루션은 사용 당일 신선하게 만들어야 합니다. 미사용 케타민/자일라진은 케타민이 통제물질이기 때문에 로그에 기록된 부피대 사용볼륨을 적절히 폐기해야 한다. 발상소에 대한 반응의 부족에 의해 평가된 바와 같이, 마취의 적당한 수준은 5-7 분에 달성될 것입니다. - Cy5.5-CTP의 10 mg/kg 용량을 계산하고, 인산완충식식염(PBS)으로 희석하여 200 μL 이하로 희석하고, 인슐린 주사기를 사용하여 레트로 궤도 또는 꼬리 정맥 주사를 통해 주입한다(그림1A).
- 펩타이드는 15 분-6 h에 이르는 미리 지정된 시간 동안 순환하도록 허용합니다.
- 기관 동물 관리 및 사용위원회에 의해 지정된 바와 같이 높은CO2 흡입 방법을 사용하여 마우스를 안락사시키고 가위를 사용하여 가슴 구멍을 엽니다(도1B).
- 가위를 사용하여 오른쪽 아트리움의 측면, 자유 벽에 작은 닉을 배치하고 마우스의 장기를 고정하고 적혈구(도 1C)를세척하는 이중 목적을 위해 26 G 바늘을 사용하여 10 % 완충 된 포르말린 인산염 3 mL을 주입합니다.
- 심장, 폐, 간, 신장, 비장, 대장, 소장, 방광, 난소/고환 및 뇌를 해부하고 전 생체 광학 이미징을 위한 12웰 플레이트의 개별 우물로 배치합니다(그림1D).
- 이미지 수집 소프트웨어를 시작하고 초기화 버튼을 클릭하여 이미징 샘플에 대한 시스템을 준비합니다. 이미징 마법사를 열고 형광을 선택한 다음 필터 쌍을 선택한 다음 염료 목록에서 Cy5.5 염료를 선택하여 580 nm 흥분 및 620 nm 방출 필터를 적용합니다. 노출 매개 변수에 대한 수동 설정을 선택한 다음 스테이지 위치를 B로 설정하고 노출 시간을 1초로 설정하고 F/stop을 8초로 설정하고 비닝을 작게 설정합니다.
참고: 여기 방출 필터는 사용되는 라벨에 따라 다릅니다. 사용되는 라벨의 여기 및 방출은 소프트웨어에 대해 수동으로 입력하여 여기 및 방출 필터를 할당할 수 있습니다. 채도를 피하기 위해 카운트가 600-60,000 사이인지 확인합니다. 사용 중인 시스템에 따라 자동 획득 최적화를 사용할 수 있습니다. 시스템에 다른 설정으로 획득한 이미지를 비교하는 보정이 있는 경우 자동 설정을 사용할 수 있습니다. 보상을 사용할 수 없는 경우 샘플 간에 설정을 결정, 저장 및 일관되게 사용해야 합니다. - 시스템이 완전히 초기화되면 관심 있는 장기를 12개의 웰 플레이트에 배치하고 광학 이미징 챔버 내부에 배치하여 샘플이 이미지에 원하는 대로 배치되도록 합니다. 획득을 선택한 다음 이미지에 대한 저장 위치를 선택합니다. 마우스에 대한 정보는 편집 이미지 레이블 팝업 창에 기록할 수 있습니다.
- 이미징 후, 챔버에서 샘플을 제거하고 실온(RT)에서 광 보호를 통해 신경화 바이알에서 조직의 부피의 20배 이상 부피로 10% 완충된 포르말린 인산염을 저장한다.
- 단위를 방광 효율로 설정한 다음 4x3 ROI를 선택하고 각 액수의 ROI 에 균일하게 맞게 조정한 다음 측정값을 클릭하여 이미지를 정량화합니다. 그리드 ROI 측정 탭을 열고 내보내기를 선택하고 측정값을 .cvs 파일로 저장합니다.
2. 히스토로지
참고: 다른 장기를 얻기 위해 1.1-1.8 단계를 따르십시오. 또는, 이미지화 된 동일한 장기는 즉시 포르말린에 배치하고 아래에 자세히 설명된 대로 단면화에 사용할 수 있습니다.
- 각 장기를 조직학을 위해 처리하기 전에 최소 48시간 동안 버퍼링된 포르말린 인산염을 10% 개별적으로 보관하십시오.
- 장기가 48h 후에 충분히 고정되면 장기를 조직 처리 및 삽입 카세트로 옮기고 조직 처리 기계(도 1E)에배치하십시오.
- 30분 동안 70% 에탄올로 조직을 탈수하도록 가공기계를 설정하고, 30분 동안 80%, 에탄올 95% 30분, 에탄올 95% 30분, 100% 에탄올 100% 에탄올 100% 에탄올 20분, 그리고 마지막으로 100% 에탄올20분으로 설정한다.
- 자일렌 2x로 조직을 지우고, 각 자일렌 치료에 대해 30분씩 처치하십시오.
- 각 치료와 함께 30 분 동안 60 °C에서 파라핀 왁스 4x로 클리어 된 조직에 침투하십시오.
- 금속 금형을 사용하여 파라핀에 포함. 몰드를 녹인 파라핀(65°C로 보관)으로 채우고 콜드 플레이트로 옮춥니다. 곰팡이 의 바닥에 파라핀이 고화되기 시작하면, 파라핀(도 1F)에장기를 배치합니다.
- 라벨이 부착된 카세트를 금형 위에 백업으로 놓고 용융 파라핀으로 덮어놓습니다. 단단할 때까지 식힙니다. 그런 다음 블록을 -20°C 냉동고에 하룻밤 동안 저장하여 왁스가 금형에서 쉽게 제거할 수 있도록 더 축소할 수 있도록 합니다.
참고: 이제 블록은 광 보호 기능을 갖춘 RT에 저장할 수 있습니다. - 증류수로 38°C 의 수조를 준비합니다. 6°의 블레이드 각도와 10 μm의 단면 두께로 마이크로토메를 설정합니다.
- 마이크로토메의 조직 블록을 마운트하고 조직을 포함하는 단면도가 얻어질 때까지 절단을 시작합니다. 그런 다음 블록을 5 분 동안 물 속으로 향하게 하거나 조직이 약간의 수분을 흡수 할 때까지 놓습니다 (예를 들어, 조직의 얇은 흰색 윤곽선이 블록에 나타날 때[도 1G]).
참고: 면도날을 자주 교체하여 단면의 품질을 확인해야 합니다. - 조직을 평평한 얼음 블록에 10 분 동안 놓고 2.9 단계와 동일한 방향으로 마이크로 토메로 되돌려 놓습니다. 섹션을 시작하고 잘린 섹션이 각각 6-10 섹션의 긴 리본을 형성 할 수 있도록합니다. 슬라이드를 덮을 수 있는 충분한 길이의 고품질 리본이 생성될 때까지 최적이 아닌 파라핀 리본을 폐기하십시오. 조직 섹션의 전단이나 주름을 피하기 위해 절삭 속도, 조직 보습 및 수조 온도를 조정하여 단면을 최적화합니다.
참고: 조직이 빠진 구멍이 있거나, 조직에 찢어지거나, 조직에 있는 단단한 주름 및 주름이 있는 단면도는 버려야 합니다. - 무딘 가장자리 집게로 원하는 품질의 리본을 조심스럽게 선택하고 38 °C 수조의 표면에 떠 있습니다. 파라핀이 분해되고 섹션을 찢어버리는 것을 막기 위해 너무 오래 방치하지 않도록 주의를 기울여 부서가 부드러워질 때까지 표면에 놓아 둡니다.
- 평평한 부분을 깨끗한 유리 슬라이드 표면에 띄워 놓습니다. 왁스를 녹여 30 분 동안 65 ° C 오븐에 슬라이드를 놓습니다.
참고: 이러한 슬라이드는 가벼운 보호 기능을 갖춘 RT에 저장할 수 있습니다. - 각 치료에 대해 3배, 10분 동안 슬라이드를 분리합니다.
- 5분 동안 100% 에탄올로 조직을 재수화하고, 5분 동안 95%, 에탄올이 5분 70%, 5분 동안 50% 에탄올, 5분 동안 50% 에탄올, 5분 동안 1x 트리스 버퍼링식식염수(TBS)가 5분(그림1H)으로소화된다.Figure 1 슬라이드가 하룻밤 동안 건조되도록 합니다.
참고: 이러한 슬라이드는 빛으로 보호되는 한 RT에서 장기적으로 저장할 수 있습니다. - 4′,6-diamidino-2-phenylindole (DAPI), 핵 형광 프로브(그림 1I)를포함하는 장착 매체의 125 μL을 사용하여 커버립 슬라이드를 마운트합니다. 빛으로 보호된 RT에서 밤새 드라이 슬라이드.
참고: 말린 슬라이드는 4°C에서 장기적으로 저장하여 빛으로 보호할 수 있습니다. - 형광 현미경 검사를 사용하여 이미지 슬라이드.
참고: 포화 된 이미지는 정량적으로 유용하지 않기 때문에 피해야 합니다. 채도를 피하기 위해 노출 및 게인 설정을 조정할 수 있습니다. 비교되는 샘플에서 동일한 설정을 사용하십시오. 노출 시간을 제한하여 조직의 표백을 피하십시오.
결과
이 프로토콜을 사용하여, 우리는 복고풍 궤도 주입을 통해 Cy5.5-CTP의 10 mg/kg 복용량으로 3 개의 마우스를 치료(그림 1A). 펩티드가 15분 동안 순환하도록 허용한 후, 마우스는CO2 챔버를 사용하여 안락사되었고, 가슴은 중앙분리증 절개를 통해 열렸고, 오른쪽 아트리움은 닉화되었고, 마우스 관류는 10% 인산염 완충 포르민(도1B,C)의3mL을 사용하여 고정하였다. 고정 후, 심장, 폐, 간, 신장, 비장 및 뇌를 해부하고 전 생체 광학 형광 이미징(도 1D 및 도 2A)에대한 12 웰 플레이트에 배치되었다. 주사가 없는 3개의 대조군 마우스도 퍼피지고, 해부되고, 이미지화되었다(도1B-D 및 도 2B). 각 장기 집합에 대해 수집된 형광 데이터는 이미징 소프트웨어의 상대형형광 부인 복사 효율, 상대형형으로 변환되는 개수로 인해 비교될 수 있다. 이 데이터는 생체 분포 연구를 위한 다른 시간 점에 걸쳐 문제의 각 기관에 대한 정성적 이미지와 정량적 데이터를 모두 산출하도록 정량화될 수있다(그림 2C). 다른 흥분 파장에 대한 응답으로 다른 기관의 자동 불발성은 도 3A−E에서입증된다. 향상된 녹색 형광 단백질 (EGFP)과 같은 짧은 흥분 파장, 특히 간 및 뇌에서, 원홍색 (Cy5.5) 또는 근적외선 (Cy7) 근접 적외선 (Cy7) 흥분 파장(그림 3)보다더 높은 자동 형광과 관련이 있습니다. 영상기관은 RT에서 최소 48시간 동안 10% 인산염 완충 포름틴으로 고정되었고, 그 다음으로 조직 처리 및 카세트(도1E)로의이송이 뒤따랐다. 장기는 조직 처리 기계에서 처리 및 파라핀으로 채워진 몰드에 위치하고- 20°C 단계에서 동결하고, 하룻밤 -20°C(도1F)에저장하였다. 샘플은 단면(도1G)을단면화하고 조직을 재수화하기 위한 용액 교환으로 처리하였다(도1H). 준비된 슬라이드는 DAPI 형광 장착 매체(도1I)로장착하였다. 일단 건조, 일반적으로 하룻밤, 슬라이드는 형광 현미경 검사를 사용하여 심화되었다. 마우스에서 각 기관의 대표적인 이미지는 도 4A에표시됩니다. 상이한 기관의 이미지는 마우스 를 통해 비교를 허용하고, 정량화를 허용하기 위해 동일한 설정을 사용하여 획득하였다(도4B).
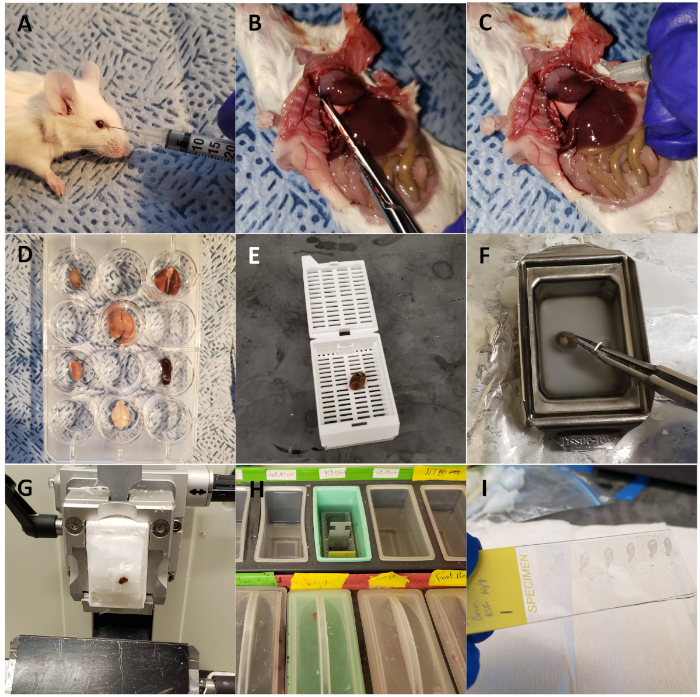
그림 1: 전 생체 내 광학 형광 이미징 및 단면에 대한 마우스 장기를 수확합니다. (A)야생형 마우스는 CTP-Cy5.5로 복고풍 궤도를 주입하였다. (B)가슴으로 해부된 마우스, 오른쪽 아트리움을 스니핑하여 관류 고정을 위해 해부합니다. (C)동물의 관류 고정을 위해 10% 완충된 포르말린 인산염의 3mL로 주입된 심장. (D)경화 광학 이미징을 위해 12웰 플레이트에 수확및 배열된 관심 기관의 장기. (E)심장은 카세트에 적재하고 티슈 프로세서를 사용하여 처리하였다. (F)파라핀에 내장된 심장. (G)마이크로톤에 절개된 심장. (H)일련의 솔루션 교환을 통해 분리된 슬라이드. (I)DAPI를 사용하여 커버립으로 장착된 섹션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
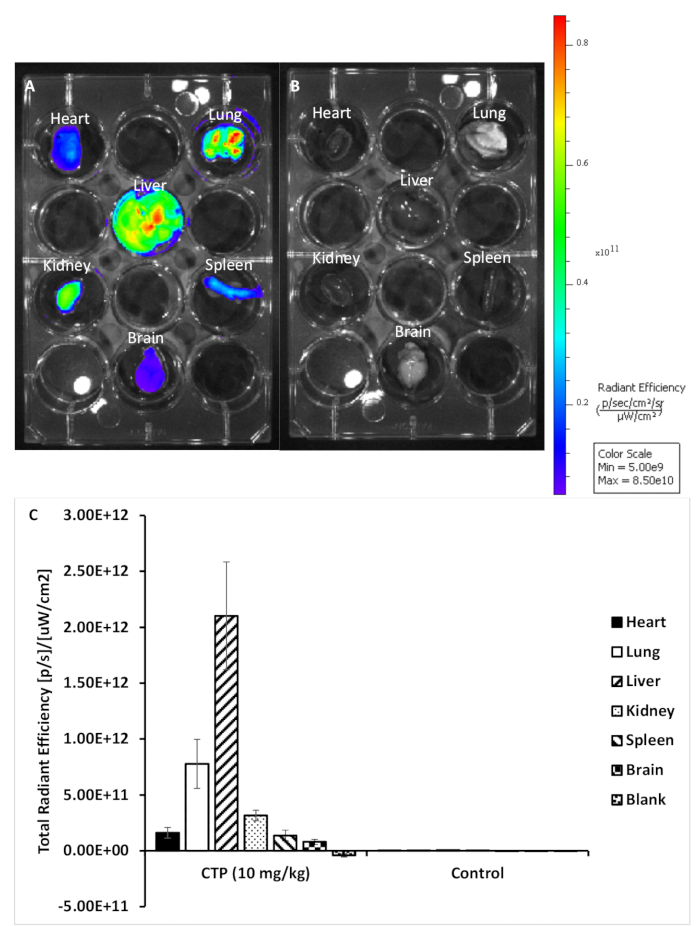
그림 2: 치료 및 제어 기관의 대표적인 이미지입니다. (A)10 mg/kg CTP-Cy5.5로 처리된 마우스로부터의 장기. (B)치료되지 않은 제어 마우스에서 장기. (C)각 장기 세트에 대한 형광의 정량화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
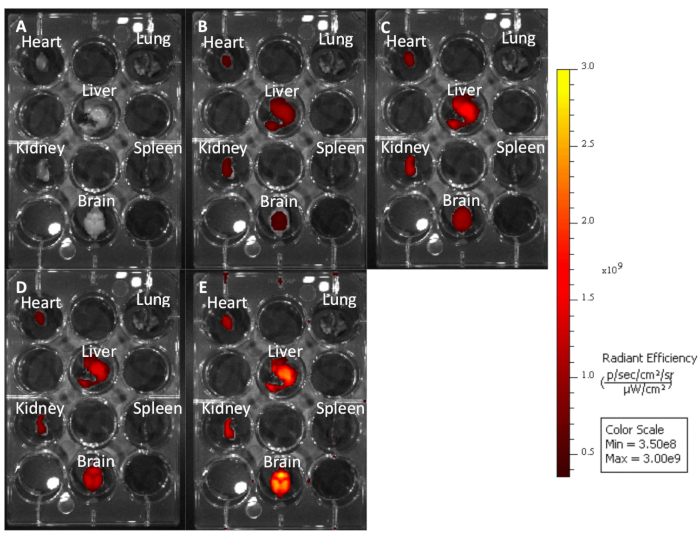
그림 3: 다른 여기 발광 파장에서 이미지된 처리되지 않은 마우스 장기는 파장이 얼마나 오래 발생하는지 보여 줍니다. (A) Cy7: 740-790. (B) Cy5.5: 660-710. (C) Cy5: 620-670. (D) Cy3: 520-570. (E) EGFP: 480-520. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
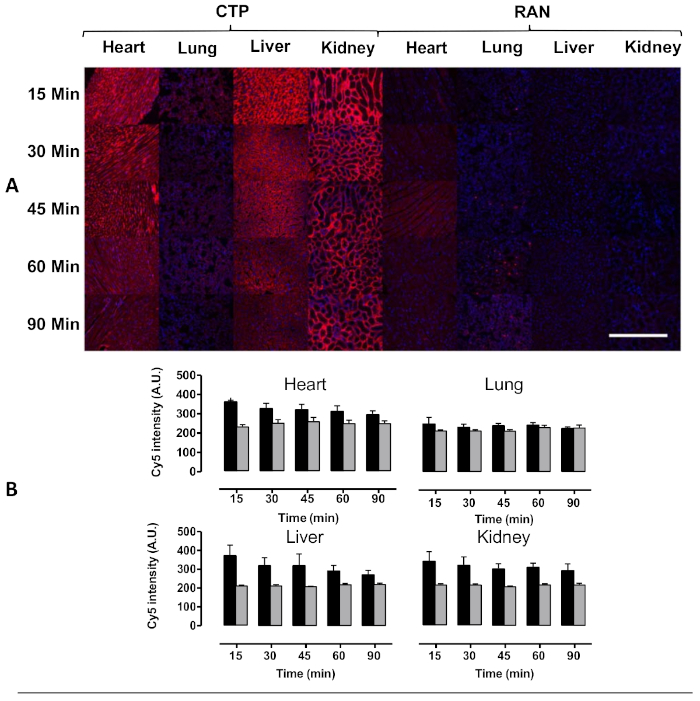
그림 4: 마우스에서 정맥 주사 후 심장, 폐, 간 및 신장의 전도. 야생형 마우스는 Cy5.5-CTP의 10 mg/kg 또는 임의 펩타이드(RAN-Cy5.5)를 주입하고, 표시된 시점에서 안락사하였다. (A)심장 조직의 피크 트랜스듀싱은 시간이 지남에 따라 형광이 꾸준히 감소하면서 15분에서 보였다. 몇몇 모세혈관 흡수는 신장 구체 모세혈관에서 뿐만 아니라 간에서 강력한 트랜스퍼빙을 가진 폐에서, 배설의 신장 기계장치를 암시하는 후자에서 지적되었습니다. (B)형광 강도의 정량화는 RAN-Cy5.5를 통해 CTP-Cy5.5의 심장 섭취량이 현저히 증가함을 나타낸다. 스케일 바 = 500 μm. 이 그림은 자히드 등에서수정되었습니다. 8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
동물 모델은 새로운 CpP의 식별에서 프로세스의 모든 단계에서 전임상 약물 개발에 필수적이다, 생물 분배 연구, 변환 메커니즘, 궁극적으로 벡터로 이러한 새로운 CPP를 사용하여 전달화물의 효능에 대한 테스트. 히스토로지, 핵의학 영상(SPECT 및 PET) 및 생체 내 광학이미징(12)과같은 생체 분포를 평가하기 위해 일반적으로 사용되는 많은 방법이 있다. 핵 화상 진찰 방법은 작은 동물 SPECT 및 PET 시스템의 제한된 가용성, 뿐만 아니라 방사선 화학자의 전문 지식을 필요로 하는 방사선 표지 약 접합을 생성하는 기능 때문에 번거로울 수 있습니다. 반면 형광 라벨은 훨씬 간단하며 작업비용 효과적일 수 있습니다. 이 논문에 설명된 프로토콜은 여러 방법을 사용하여 생체 분포를 신속하게 분석할 수 있게 합니다. Ex vivo 전체 기관 형광 광학 이미징은 다른 조직 및 치료 그룹에 걸쳐 형광의 즉각적인 비교를 허용하고 반정성 방식으로 관심기관의 섭취를 피크하는 장기 섭취량과 시간을 식별 할 수 있습니다. 정량적 조직 조직학은 조직을 치료, 단면, 이미지 및 분석하기 위해 보다 광범위한 처리를 필요로 하지만 현미경 수준에 대한 더 많은 데이터를 제공하고 현재 표준 기술입니다. 서로 다른 장기 및 흥분 파장에 대한 각 기술로 볼 수 있는 자가 형광이 크게 다르기 때문에 두 기술에 걸쳐 직접적이고 정량적 비교가 불가능하다는 점에 유의할 가치가 있습니다.
이 프로토콜의 중요한 부분은 실험에 대한 후보 CpP에 레이블을 지정하는 올바른 플루오로포어를 선택하는 것입니다. 한 가지 잠재적인 문제는 스펙트럼 중복이며, 여러 형광이 필요할 때 문제가 될 수 있습니다. DAPI 형광 장착 매체와 Cy5.5에는 스펙트럼이 겹치지 않습니다. 그러나 여러 형광이 필요한 특정 응용 프로그램의 경우 스펙트럼 중복 의 위험을 신중하게 고려해야합니다. 사용되는 시스템에 따라 불소포의 선택이 제한될 수 있습니다. 따라서 시스템의 기능에 대한 지식이 핵심입니다. 형광 광학 시스템은파장(13)의높은 조직 흡수로 인해 원적외선 또는 근적외선 형광류로 가장 잘 활용된다. 향상 된 녹색 형광 단백질의 범위에 있는 형광은 중요한 한계가 있습니다, 그것의 흥분 파장에서 보인 중요한 기관 자동 형광이 있기 때문에, 특히 두뇌와 간 조직에서. 실험의 조건에 따라 일부 형광은 피하는 것이 가장 좋습니다. 일부 수용성 유기 형광은 거짓 긍정을 일으킬 수있는 지질 이중 층과 강한 상호 작용을합니다. 따라서, 불소가 관심있는 조직에 강한 친화력을 가지고 있는지 확인하기 위해 조치를 취하는 것이 좋습니다14. 고려해야 할 또 다른 요소는 결과에 영향을 미치는 중요한 매개 변수가 될 수있는 불소 류 연상의 적절한 방법을 선택하는 것입니다. CPP는 Cy5.5-NHS와 같은 염료의 펩타이드 및 카바실 그룹의 N-종자 사이의 공유 결합을 통해 N-또는 C-종자에서 형광체로 표시될 수 있다. 대부분의 CpP의 변환 메커니즘이 자세히 이해되지 않고 한쪽 끝에서 의 양해작용이 다른 쪽 끝보다 더 많은 섭취 메커니즘에 영향을 줄 수 있기 때문에 주의를 기울여야 합니다. CPP 라벨링의 또 다른 가능성은 형광으로 표기된 스트렙타비딘에 대한 연상을 위한 N-종착제를 바이오티니팅하는 것입니다. 이 전략을 사용하면 다른 형광 연쇄상 구문회가 활용될 수 있도록 하는 편리함이 있습니다. 그러나, 이 전략의 가능한 한계는 biotin-streptavidin 복합체는 잠재적으로 변환을 방해할 수 있는 큰 구조물이다.
형광 이미징 시스템은 다른 장기와 치료에 걸쳐 형광의 비교를 효율적으로 생성하기위한 효과적인 전략이지만 조직에서 절대 농도의 정량적 측정을 생성 할 수 없습니다. 이것은 조직 내의 빛 산란 효과 때문이며, 이는 조직 크기와 밀도에서 자연적으로 발생하는 다양성에 의해 더욱 복합되고, 가변형 산란과 함께 혈관의 차이에 의해 더욱 복합된다. 조직 자가형작용은 콜라겐과 같은 자연적으로 발생하는 생화학적 공급원, 또는식품(13)의엽록소와 같은 식이 소스로 인해 인자가 될 수 있다.
조직학은 생체 분포를 측정하는 가장 일반적으로 사용되는 방법이며 시간이 지남에 따라 다른 조직에 걸쳐 섭취량을 정확하게 측정하고 비교하는 데 잠재적으로 사용될 수 있습니다. 모든 조직이 동일한두께(15)로구분되기 때문에 광 산란 문제는 이 방법을 사용하여 피합니다. 이 방법의 주요 장점은 면역 조직 화학을 위한 추가 형광 라벨을 포함하는 기능입니다. 다른 형광소를 첨가하면 이미징이 더 어려워질 수 있지만, 형광 라벨의 사용은 리소좀이나 미토콘드리아와 같은 특정 세포 내 구획에 CPP의 국소화에 유용할 수 있습니다. 항체는 유도된 후보 CPP가 CPP가 관심 구조와 공존하는지 결정하기 위해 공초점 현미경 실험에서 사용될 수 있으며, 이는 CPP의 잠재력을 전달 에이전트로서 보여줄 수 있다. 이 방법의 한 가지 제한은 장기 샘플에서 슬라이드를 준비하는 것은 시간이 많이 걸리고, 노동 집약적이며, 인간의실수(12,,15)에취약할 수 있다는 것이다. 이미징 슬라이드를 사용할 때는 광표백을 피하기 위해 너무 오랫동안 같은 위치를 이미지하지 않도록 주의를 기울여야 합니다. 일부 광표백은 불소의 감도에 따라 피할 수 없습니다. 주변 광등으로부터 샘플을 보호하고 제대로 저장하기 위해이 프로토콜의 모든 단계에서주의를 기울여야한다16. 향후 이미징을 위해 조명으로 보호되는 4°C에 슬라이드를 저장하는 것이 좋습니다.
특수 장비를 필요로 하고 비교 결과를 생성할 수 있는 후보 CPP의 바이오 분배를 측정하기 위해 사용할 수 있는 다양한 방법이 있습니다, 그러나 그(것)들은 더 복잡한 CPP 라벨링을 요구할 수 있더라도. 본 논문에 기재된 프로토콜은 동일한 샘플에서 세포 내 펩티드 내재화에 대한 심층적 정보를 수집하여 연구에 필요한 동물의 수를 절반으로 줄이는 동시에 살아있는 시스템의 맥락에서 생체 분포 데이터를 효율적으로 생성하기 위해 두 가지 호환 방법을 사용합니다. 이러한 방법은 위의 데이터를 생성하는 데 사용되었으며, 이는 두 가지 방법이 동일한 동물에서 순차적으로 활용될 수 있으며 각각에 의해 생성된 데이터의 품질을 보여 줍니다. 또한 결과 두 기술 간의 결과를 정량적으로 직접 상호 연관시킬 수 없다는 점도 강조합니다.
공개
M.Z. 및 Paul D. Robbins (미네소타 대학, 미네소타, 미네소타, 미네소타, 미네소타, 미국)는 심장 벡터로 심장 표적 펩티드의 사용에 대한 특허를 보유하고 있습니다 (심장 특정 단백질 타겟팅 도메인, 미국 특허 직렬 번호 9,249,184). M.Z.는 또한 최고 과학 책임자역할을 하며 스타트업 Vivasc Therapeutics Inc.의 이사회에 있으며 상당한 미래 지분을 보유하고 있습니다.
감사의 말
M.Z.와 K.S.F.는 미국 심장 협회 과학자 개발 상 17SDG33411180에 의해 지원되며, 피츠버그 대학의 임상 및 번역 과학 연구소를 통해 피트 혁신 챌린지 (PInCh®)에 따라 수여되는 보조금으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Buffered Formalin Phosphate | ThermoFisher | SF100-4 | |
| 10x Tris Buffered Saline (TBS) | ThermoFisher | BP2471-1 | |
| 12-well Cell Culture Plate | ThermoFisher | 353043 | |
| 1x TBS Solution | 10x TBS is diluted 1:10 with deionized water. This solution can be stored at room temperature. | ||
| 20 mL Scintillation Vials | Wheaton | 334173 | |
| 26G Needles | Becton Dickinson | 305110 | |
| 28G 0.5ml Insulin syringes | Becton Dickinson | 329461 | |
| 3mL Syringe | Becton Dickinson | 309657 | |
| CD1 Mice | Charles River | 022 | 6 to 12 week old albino, female mice |
| Cover Glass | ThermoFisher | 12-544-14 | |
| Cy5.5-CTP-amide | Prepared by peptide synthesis, conjugated with Cy5.5 fluorophore, and purified using HPLC. Lyophilized powder is reconstituted in DMSO at 10mM concentration. After reconstituting, store at -80 °C. | ||
| Dapi Fluoromount G | SouthernBiotech | 0100-20 | |
| Dumont #5 Forceps | Fine Science Tools | 99150-20 | |
| Ethanol | |||
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Ketamine HCl 100mg/mL | KetaVed | NDC 50989-161-06 | |
| Ketamine/Xylazine Solution | Ketamine HCl is mixed with Xylazine 1:1 to produce a stock solution containing 50mg/mL ketamine and 10mg/mL Xylazine. This solution is made fresh before each use. | ||
| Leica RM2235 Rotary Microtome | Leica | RM2235 | |
| Microscope Slides | ThermoFisher | B9992000TN | |
| Paraplast X-TRA | Sigma | P3808-1KG | |
| Perkin Elmer Lumina S5 IVIS | Perkin Elmer | CLS148588 | |
| Sparkle Optical Lens Cleaner | ThermoFisher | NC0090079 | |
| Tissue-Tek Processing/Embedding Cassettes | ThermoFisher | NC9499605 | |
| Tissue-Tek VIP Processing machine | Tissue-Tek | VIP 5A-F1 | |
| Xylazine 20 mg/mL | AnaSed | NDC 59399-110-20 | |
| Xylenes | ThermoFisher | X5-4 |
참고문헌
- Green, M., Loewenstein, P. M. Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein. Cell. 55 (6), 1179-1188 (1988).
- Frankel, A. D., Pabo, C. O. Cellular uptake of the tat protein from human immunodeficiency virus. Cell. 55 (6), 1189-1193 (1988).
- Derossi, D., Joliot, A. H., Chassaing, G., Prochiantz, A. The third helix of the Antennapedia homeodomain translocates through biological membranes. Journal of Biological Chemistry. 269 (14), 10444-10450 (1994).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Zahid, M., Robbins, P. D. Cell-type specific penetrating peptides: therapeutic promises and challenges. Molecules. 20 (7), 13055-13070 (2015).
- Zahid, M., Robbins, P. D. Identification and characterization of tissue-specific protein transduction domains using peptide phage display. Methods in Molecular Biology. 683, 277-289 (2011).
- Zahid, M., et al. Identification of a cardiac specific protein transduction domain by in vivo biopanning using a M13 phage peptide display library in mice. PLoS One. 5 (8), e12252 (2010).
- Zahid, M., et al. Cardiac Targeting Peptide, a Novel Cardiac Vector: Studies in Bio-Distribution, Imaging Application, and Mechanism of Transduction. Biomolecules. 8 (4), E147 (2018).
- Amblard, M., Fehrentz, J. A., Martinez, J., Subra, G. Methods and protocols of modern solid phase Peptide synthesis. Molecular Biotechnology. 33 (3), 239-254 (2006).
- Katritzky, A. R., Yoshioka, M., Narindoshvili, T., Chung, A., Johnson, J. V. Fluorescent labeling of peptides on solid phase. Organic and Biomolecular Chemistry. 6 (24), 4582-4586 (2008).
- Prabhala, B. K., Mirza, O., Hojrup, P., Hansen, P. R. Characterization of Synthetic Peptides by Mass Spectrometry. Methods in Molecular Biology. 1348, 77-82 (2015).
- Arms, L., et al. Advantages and Limitations of Current Techniques for Analyzing the Biodistribution of Nanoparticles. Frontiers in Pharmacology. 9, 802 (2018).
- Leblond, F., Davis, S. C., Valdes, P. A., Pogue, B. W. Pre-clinical whole-body fluorescence imaging: Review of instruments, methods and applications. Journal of Photochemistry and Photobiology. 98 (1), 77-94 (2010).
- Hughes, L. D., Rawle, R. J., Boxer, S. G. Choose your label wisely: water-soluble fluorophores often interact with lipid bilayers. PLoS One. 9 (2), e87649 (2014).
- McGowan, J. W., Bidwell, G. L. The Use of Ex Vivo Whole-organ Imaging and Quantitative Tissue Histology to Determine the Bio-distribution of Fluorescently Labeled Molecules. Journal of Visualized Experiments. (118), e54987 (2016).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. Journal of Cell Biology. 185 (7), 1135-1148 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유