Method Article
Hayvansal Gıdalarda Salmonella Taramak ve Salmonella'yı Kültür İzolasyonundan Doğrulamak için Döngü Aracılı İzotermal Amplifikasyon
Bu Makalede
Özet
Döngü aracılı izotermal amplifikasyon (LAMP), patojen tespit alanında geniş ilgi gören bir izotermal nükleik asit amplifikasyon testidir (iNAAT). Burada, Salmonella'yı hayvansal gıdalarda taramak ve tahmin edilen Salmonella'yı kültür izolasyonundan doğrulamak için hızlı, güvenilir ve sağlam bir yöntem olarak çok laboratuvar onaylı bir Salmonella LAMP protokolü sunuyoruz.
Özet
Döngü aracılı izotermal amplifikasyon (LAMP), çok sayıda bakteriyel, mantar, parazitik ve viral ajanın hızlı tespiti için güçlü bir nükleik asit amplifikasyon testi olarak ortaya çıkmıştır. Salmonella, hayvanlar için yiyecekler de dahil olmak üzere dünya çapında gıda güvenliği endişesi olan bakteriyel bir patojendir. Burada sunulan, Salmonella kontaminasyonunun varlığı için hayvansal yiyecekleri hızlı bir şekilde taramak için kullanılabilecek ve ayrıca tüm gıda kategorilerinden kurtarılan varsayılan Salmonella izolelerini doğrulamak için de kullanılabilen çok laboratuvar onaylı bir Salmonella LAMP protokolüdür. LAMP tahlili özellikle Salmonella istila genini(invA)hedefler ve hızlı, hassas ve son derece spesifiktir. Şablon DNA'lar, hayvansal gıdaların zenginleştirme et sularından veya varsayılan Salmonella izolelerinin saf kültürlerinden hazırlanır. LAMP reaktif karışımı bir izotermal ana karışım, astarlar, DNA şablonu ve su birleştirilerek hazırlanır. LAMP tahlili 30 dakika boyunca 65 °C sabit bir sıcaklıkta çalışır. Pozitif sonuçlar gerçek zamanlı floresan ile izlenir ve 5 dk gibi erken bir sürede tespit edilebilir. LAMP tahlili, hayvansal gıda veya kültür ortamındaki inhibitörlere karşı yüksek tolerans göstererek Salmonella'yıtaramak ve onaylamak için hızlı, güvenilir, sağlam, uygun maliyetli ve kullanıcı dostu bir yöntem olarak hizmet eder. LAMP yöntemi yakın zamanda ABD Gıda ve İlaç İdaresi'nin Bakteriyolojik Analitik El Kitabı (BAM) Bölüm 5'e dahil edilmiştir.
Giriş
Döngü aracılı izotermal amplifikasyon (LAMP), bir grup Japon bilim adamı tarafından 2000 yılında icat edilen yeni bir izotermal nükleik asit amplifikasyon testidir1. İlk adımlar sırasında hedefe özgü bir kök döngü DNA yapısının oluşturulması yoluyla LAMP, bu başlangıç malzemesini yarı katlanarak verimli bir şekilde yükseltmek için iplikçik yerinden eden bir DNA polimeraz kullanır ve 1saat1'den daha az bir sürede 109 hedef kopyasına neden olur. Yaygın olarak kullanılan bir NAAT olan polimeraz zincir reaksiyonu (PCR) ile karşılaştırıldığında, LAMP çeşitli avantajlara sahiptir. İlk olarak, LAMP reaksiyonları izotermal koşullar altında gerçekleştirilir. Bu, sofistike bir termal bisiklet aletine olan ihtiyacı ortadan ortadan ayırmaktadır. İkinci olarak, LAMP hem klinik hem de gıda uygulamaları için gösterilen sağlamlığa sahip kültür medyasına ve biyolojik maddeler2'ye karşı oldukça hoşgörülüdür3,4. Bu, numune hazırlamayı basitleştirir ve yanlış negatif sonuçları en aza indirir5. Üçüncüsü, LAMP bulanıklık, renklendirme, biyolüminesans, floresan ve mikroakışkanlar6gibi birden fazla algılama platformuna açıktır. Dördüncü olarak, LAMP, altı ila sekiz belirli bölgeyi hedeflemek için dört ila altı özel olarak tasarlanmış astar kullandığı için son derece spesifiktir1,7. Beşinci olarak, LAMP ultra duyarlıdır ve çok sayıda çalışma PCR veya gerçek zamanlı PCR8'eüstün hassasiyetini bildirmektedir. Son olarak, LAMP artık PCR tipi tahliller genellikle 1−2 h8alırken, birçok tahlil ile 30 dakikalık standart çalışma süresini benimseyerek daha hızlıdır.
Bu çekici özellikler, in vitro tanı9,hayvan hastalığı tanılama10ve gıda ve çevre testi11dahil olmak üzere geniş patojen tespit alanlarında LAMP uygulamasını körükledi. Özellikle, periferik ortamlarda pulmoner tüberküloz tanıları için balgam-smear mikroskopisi için geçerli bir değiştirme testi olarak DSÖ tarafından bir TB-LAMP (Mycobacteriumtuberculosis için LAMP) önerilmiştir12. LAMP uygulaması ayrıca alerjenlerin, hayvan türlerinin, ilaç direncinin, genetiği değiştirilmiş organizmaların ve pestisitlerin tespitini içerecek şekilde mikrobiyal tanımlamanın ötesine genişler13.
Nontyphoidal Salmonella, dünya çapında önemli gıda güvenliği ve halk sağlığı endişesinin zoonotik bir patojenidir14. Ayrıca hayvanlar için gıdalarda (yani hayvansal gıdalarda) önemli bir mikrobiyal tehlike olarak tanımlanmıştır15,16. Salmonella hastalıklarının/salgınlarının kontamine insan gıdası ve hayvansal gıdalardan uzak olmasını önlemek için, Salmonella'yı çeşitli matrislerde test etmek için hızlı, güvenilir ve sağlam yöntemlere sahip olmak zorunludur. Son on yılda, salmonella LAMP tahlillerinin geliştirilmesi ve uygulanması konusunda uluslararası alanda önemli çabalar sarf edilmiştir, son zamanlarda kapsamlı bir incelemede özetlendiğiniz gibi8. Burada sunulan da dahil olmak üzere birkaç Salmonella LAMP tahlilleri, köklü uluslararası yönergeler 17 , 18 ,19,20'yitakiben çok laboratuvarlı doğrulamayı başarıyla tamamlamıştır.
Salmonella LAMP testimiz özellikle Salmonella istila gen invA (GenBank katılım numarası M90846)21'i hedef alıyor ve birden fazla gıda matrisindehızlı,güvenilir ve sağlam 4 , 22,23,24,25,26. Yöntem, önkolaboratif bir çalışmada altı hayvansal gıda matrisinde26 ve kuru köpek mamasında çok laboratuvarlı bir işbirliği çalışmasında doğrulanmıştır19. Sonuç olarak, burada sunulan Salmonella LAMP yöntemi yakın zamanda ABD Gıda ve İlaç İdaresi'nin (FDA) Bakteriyolojik Analitik El Kitabı (BAM) Bölüm 5 Salmonella27'ye, biri hayvansal gıdalarda Salmonella varlığı için hızlı bir tarama yöntemi ve iki tüm gıdalardan izole edilmiş varsayımsal Salmonella için güvenilir bir onay yöntemi olarak iki amaca hizmet etmek üzere dahil edilmiştir.
Protokol
NOT: Lamba reaksiyon karışımı DNA polimeraz, tampon, MgSO4,dNTP'ler, astarlar, DNA şablonu ve su içerir. İlk dört reaktif bir izotermal ana karışımda(Malzeme Tablosu)bulunur. Astarlar, astar karışımı (10x) olmak için şirket içinde önceden karıştırılır. DNA şablonları, tarama amacıyla hayvansal gıda örneklerinin zenginleştirme et sularından veya onay amacıyla varsayılan Salmonella izole kültürlerinden hazırlanabilir. Buna ek olarak, pozitif bir kontrol (salmonella referans suşlarından çıkarılan DNA, örneğin Salmonella enterica serovar Typhimurium ATCC 19585 [LT2]) ve şablonsuz kontrol (NTC; steril moleküler sınıf su) her LAMP çalışmasına dahildir.
1. DNA şablonlarının hazırlanması
- Hayvansal gıda zenginleştirmelerinden DNA şablonları hazırlamak için şu adımları izleyin.
- Aseptik olarak 25 g hayvan maması örneğini (örneğin, kuru kedi maması, kuru köpek maması, sığır yemi, at yemi, kümes hayvanı yemi ve domuz yemi) steril bir filtre torbasına(Malzeme Masası)veya eşdeğeri bir şekilde tartar. Kuluçka sırasında destek için torbayı büyük bir kaba veya rafa yerleştirin.
- 225 mL steril tamponlu pepton suyu (BPW) ekleyin. Dönen ve kısa el masajı ile iyice karıştırın. Oda sıcaklığında 60 ± 5 dakika bekletin.
- Döndürerek iyice karıştırın ve bir test kağıdı ile pH'ı belirleyin. Gerekirse pH'ı steril 1 N NaOH veya 1 N HCl. Incubate ile 24 ± 2 saat boyunca 35 ± 2 °C'de 6,8 ± 0,2'ye ayarlayın.
- Hayvansal gıda zenginleştirme et suları içeren torbayı döndürerek iyice karıştırın. Torbanın filtrelenmiş tarafından mikrosantrifüj tüpüne 1 mL aktarın. Kısaca Girdap.
- Aşağıdaki gibi bir numune hazırlama reaktifi (Malzeme Tablosu) kullanarak DNA ayıklayın.
- Büyük parçacıkları çıkarmak ve süpernatantı yeni bir mikrosantrifüj tüpüne aktarmak için 1 dakika boyunca 900 x g'da santrifüj.
- 2 dakika boyunca 16.000 x g'da santrifüj ve supernatant atın.
- Peleni numune hazırlama reaktifinin 100 μL'sinde askıya alın ve kuru bir ısı bloğunda 10 dakika boyunca 100 ± 1 °C'de ısıtın.
- Oda sıcaklığına soğutin ve örnek DNA özlerini -20 °C'de saklayın.
- Varsayılan Salmonella kültürlerinden DNA şablonları hazırlamak için şu adımları izleyin.
- FDA'nın BAM Bölüm 5 Salmonella bölümü D: Salmonellaİzolasyonu27'ninardından tüm gıdalarda kültür izolasyonundan varsayılan Salmonella izoleleri elde edin.
- Inoculate presumptive Salmonella, seçimsiz bir agar plakasında (örneğin, kan agarı, besin agarı ve triptodikaz soya agarı) izole eder ve 24 ± 2 saat boyunca 35 ± 2 °C'de kuluçkaya yaslar.
- Birkaç tek koloniyi 5 mL triptose soya suyuna (TSB) veya beyin kalbi infüzyonu (BHI) suyuna aktarın ve 16 ± 2 saat boyunca 35 ± 2 ° C'de kuluçkaya yatırın.
NOT: Bu adım, varsayılan Salmonella kültürü safsa isteğe bağlı olabilir. Bu durumda, DNA şablonları 5 mL TSB'de birkaç tek koloniyi askıya alarak ve süspansiyonun 500 μL'± 1 °C'de kuru bir ısı bloğunda 10 dakika ısıtılarak hazırlanabilir. Aşağıdaki 5. - Gece kültürünün 500 μL'lik kısmını bir mikrosantrifüj tüpüne aktarın ve kuru bir ısı bloğunda 10 dakika boyunca 100 ± 1 °C'de ısıtın.
- Oda sıcaklığına soğutin ve izole DNA özlerini -20 °C'de saklayın.
- Pozitif kontrol DNA'sı hazırlamak için, bir ekstra seyreltme adımı ile varsayımsal Salmonella kültürlerinden DNA şablonları hazırlamak için yukarıdaki gibi benzer adımları izleyin.
- Inoculate S. Typhimurium ATCC 19585 (LT2) veya herhangi bir Salmonella referansı, seçimsiz bir agar plakasında (örneğin, kan agarı, besin agarı ve triptodikaz soya agarı) suşlar ve 24 ± 2 saat boyunca 35 ± 2 °C'de kuluçkaya yaslanır.
- Birkaç tek koloniyi 5 mL TSB veya BHI suyuna aktarın ve ~10 9 CFU / mL'ye ulaşmak için 16 ± 2 saat boyunca 35 ±2 ° C'de kuluçkaya yatırın.
- ~107 CFU/mL elde etmek için gece kültürünü %0,1 pepton suyunda seri olarak seyreltin.
- Bu seyreltmenin 500 μL'lik kısmını bir mikrosantrifüj tüpüne aktarın ve kuru bir ısı bloğunda 10 dakika boyunca 100 ± 1 °C'de ısıtın.
- Oda sıcaklığına soğutin ve pozitif kontrol DNA'sını -20 °C'de saklayın.
2. Astar karışımının hazırlanması (10x)
- Standart tuzdan arındırma(Tablo 1)ile ticari olarak sentezlenmiş LAMP astarları (Sal4-F3, Sal4-B3, Sal4-FIP, Sal4-BIP, Sal4-LF ve Sal4-LB) elde edin.
| Astar adı | Açıklama | Sıra (5'-3') | Uzunluk (bp) |
| Sal4-F3 | İleri dış astar | GAACGTGTCGCGGAAGTC | 18 |
| Sal4-B3 | Geri dış astar | CGGCAATAGCGTCACCTT | 18 |
| Sal4-FIP | İleri iç astar | GCGCGGCATCCGCATCAATA-TCTGGATGGTATGCCCGG | 38 |
| Sal4-BIP | Geri iç astar | GCGAACGGCGAAGCGTACTG-TCGCACCGTCAAAGGAAC | 38 |
| Sal4-LF | İleri astarı döngüye | TCAAATCGGCATCAATACTCA-TCTG | 25 |
| Sal4-LB | Döngü geri astarı | AAAGGGAAAGCCAGCTTTACG | 21 |
Tablo 1: Hayvansal gıdalarda Salmonella'yı taramak ve Salmonella'yı kültür izolasyonundan onaylamak için LAMP astarları. Astarlar Salmonella invA dizisine (GenBank katılım numarası M90846) göre tasarlanmıştır.
- Astarı uygun miktarda steril moleküler dereceli su ile yeniden sulayarak her astarın (100 μM) stok çözeltilerini hazırlayın. 10 sn boyunca girdapla iyice karıştırın ve -20 °C'de (uzun süreli depolama için -80 °C) saklayın.
- Astar karışımını (10x) bir çalışma sayfasına göre hazırlayın (Tablo 2). Bir mikrosantrifüj tüpüne uygun miktarlarda astar stok çözeltileri ve steril moleküler sınıf su ekleyin. 10 sn boyunca girdap yaparak tüm reaktifleri iyice karıştırın.
| Bileşen | Stok conc. (μM) | Astar karışımı conc. (μM) | Hacim (μL) |
| Sal4-F3 astar | 100 | 1 | 10 |
| Sal4-B3 astar | 100 | 1 | 10 |
| Sal4-FIP astar | 100 | 18 | 180 |
| Sal4-BIP astar | 100 | 18 | 180 |
| Sal4-LF astar | 100 | 10 | 100 |
| Sal4-LB astar | 100 | 10 | 100 |
| Moleküler sınıf su | Yok | Yok | 420 |
| Toplam | Yok | Yok | 1000 |
Tablo 2: LAMP astar karışımını (10x) hazırlamak için çalışma sayfası. Astarlar Tablo 1'de listelenmiştir.
- 10x astar karışımını mikrosantrifüj tüpü başına 500 μL'ye çıkarın ve -20 °C'de saklayın.
3. Lamp reaksiyonunun montajı
NOT: Çapraz kontaminasyonu önlemek için LAMP master karışımını hazırlamak ve DNA şablonları eklemek için kullanılan alanları fiziksel olarak ayırmanız şiddetle tavsiye edilir. Şekil 1 bir LAMP diyagramıdır.
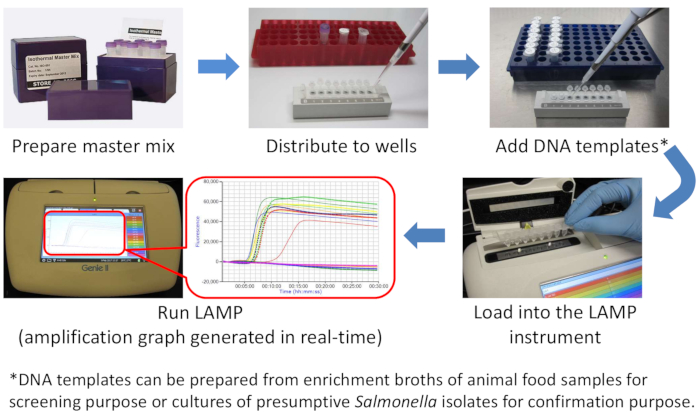
Şekil 1: Salmonella LAMP iş akışının şematik diyagramı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Hazırlık ve çalıştırma kurulumu
- İzopropanol ve DNA ve DNaz kırıcı çözelti ile temiz tezgah (Malzeme Masası). Pipetleri ve tüp şerit tutucuları (Malzeme Masası) DNA ve DNaz düşürücü çözelti ile temizleyin.
- İzotermal ana karışımı, astar karışımını (10x), moleküler dereceli suyu, pozitif kontrol DNA'sını ve DNA şablonlarını oda sıcaklığında çözün.
- LAMP enstrümanını (Malzeme Masası)açın ve ana ekrana erişmek için açılış ekranına dokunun. Çalıştırma oluşturmak için şu adımları izleyin.
NOT: LAMP enstrümanının bir modeli her blokta 8 örnek içeren 2 bloğa (A ve B) sahiptir ve başka bir modelde 8 numuneye(Malzeme Tablosu)uyum sağlayan tek bir blok vardır.- LAMP+Tavla'ya dokunun ve örnek bilgileri girmek için Düzenle'yi seçin.
NOT: Varsayılan LAMP çalıştırma profili, 30 dakika boyunca 65 °C'de amplifikasyondan ve saniyede 0,05 °C'lik bir azalarak 98 °C'den 80 °C'ye kadar bir tavlama fazından oluşur. - İmleci etkinleştirmek için her örnek satıra dokunun ve iki LAMP enstrüman bloğu arasında geçiş yapmak için AB bloğu simgesini kullanarak ilgili örnek bilgileri girin.
- Tüm örnek bilgiler girildiğinde Denetle simgesine dokunun.
NOT: İsteğe bağlı olarak, çalıştırma kurulumu (varsayılan LAMP çalıştırma profiliyle birlikte örnek bilgileri içeren "Profil" olarak ad altındadır) daha sonra kullanılmak üzere kaydedilebilir. Kaydet simgesine dokunun ve profile benzersiz bir ad verin. Aynı örnek kümesini bir dahaki sefere test ederken, kaydedilen profil kullanılarak yeni bir çalıştırma başlatılabilir. Ana ekranın sol alt kısmındaki Klasör simgesine dokunun ve kaydedilen profilleri yüklemek için Profil'i seçin.
- LAMP+Tavla'ya dokunun ve örnek bilgileri girmek için Düzenle'yi seçin.
- LAMP reaksiyon tertibatı
NOT: Her iki LAMP gösterge bloğu (A ve B, toplam 16 örnek) kullanırken, LAMP master karışımını 18 numune için hazırlayın. Yalnızca bir LAMP enstrüman bloğu kullanıyorsanız (toplam 8 örnek), LAMP master karışımını 10 numune için hazırlayın. Diğer örnek numaralar için, pipetleme kaybına uyum sağlamak için hacmi uygun şekilde ayarlayın. Her LAMP çalıştırmasına her zaman pozitif bir kontrol ve bir NTC ekleyin. Bağımsız LAMP çalıştırmalarında her numunenin çoğaltılmış testi önerilir.- LAMP ana karışımını bir çalışma sayfasına göre hazırlayın (Tablo 3). Bir mikrosantrifüj tüpüne uygun hacimlerde izotermal ana karışım, astar karışımı ve moleküler dereceli su ekleyin ve 3 s. Santrifüj için hafifçe girdap ekleyin.
- Tüp şeridini şerit tutucuya yerleştirin ve LAMP master karışımının 23 μL'lik kısmını her kuyuya dağıtın.
- Vortex tüm DNA şablonları ve santrifüj kısaca. Uygun kuyuya 2 μL DNA şablonu ekleyin ve sıkıca kaplayın.
- Tüm reaktiflerin tüpün dibinde birikmiş olduğundan emin olmak için tüp şeridini tutucudan çıkarın ve bileği hafifçe vurun.
- Kapağı kapatmadan önce kapakların güvenli olduğundan emin olarak tüp şeridini LAMP cihaz bloklarına yükleyin.
| Bileşen | Çalışma conc. | Son tepki sonucu. | Numune başına hacim (μL) | 18 numune için hacim (μL) | 10 numune için hacim (μL) |
| ISO-001 izotermal ana karışım | 1,67x | 1x | 15 | 270 | 150 |
| Astar karışımı | 10x | 1x | 2.5 | 45 | 25 |
| Moleküler sınıf su | Yok | Yok | 5.5 | 99 | 55 |
| Ana karışım alt toplamı | Yok | Yok | 23 | 414 | 230 |
| DNA şablonu | Yok | Yok | 2 | Yok | Yok |
Tablo 3: LAMP reaksiyon karışımını hazırlamak için çalışma sayfası. Astar karışımı (10x), Tablo 1'delistelenen astarların stok çözeltileri kullanılarak Tablo 2'ye göre hazırlanır.
4. LAMBA Çalıştırma
NOT: Lamp çalışması sırasında, fam kanalı kullanılarak floresan okumaları elde edilir. Floresan oranının amplifikasyon oranı eğrisinin maksimum değerine ulaştığı zaman noktası için en yüksek zaman değerleri(Tmaks .min) cihaz tarafından otomatik olarak belirlenir. Tm (°C), son yükseltilmiş ürünün erime/tavlama sıcaklığıdır.
- Ekranın sağ üst basmağındaki Çalıştır simgesine tıklayın ve LAMP çalıştırmasını başlatmak için tüp şeritleri içeren blokları seçin.
- İsteğe bağlı olarak, reaksiyon devam ederken, LAMP çalışması sırasında çeşitli parametrelerin dinamik değişikliklerini görmek için Sıcaklık, Amplifikasyonve Tavlama sekmelerine dokunun.
- Çalıştırma tamamlandıktan sonra, amplifikasyon ve tavlama eğrilerinin tamamını görmek için Amplifikasyon ve Tavlama sekmelerine dokunun ve sonuçları görüntülemek için Sonuçlar sekmesine dokunun.
- İsteğe bağlı olarak, kayıt tutmak için, "enstrüman seri number_run numarası" biçimini kullanarak ekranın sol üst kısmında bulunan çalışma numarasını kaydedin, örneğin,"GEN2-2209_0030."
5. LAMP Sonuçlarının Yorumlanması
NOT: LAMP sonuçları doğrudan LAMP gösterge panelinde ve/veya bir LAMP yazılımı(Malzeme Masası)kullanılarak görüntülenebilir.
- Lamba sonuçlarını gösterge panelinde yorumlamak için şu adımları izleyin.
- Ana ekranın sol alt kısmındaki Klasör simgesine dokunun ve LAMP'nin ilgi çekici çalışmasını yüklemek üzere dosya konumuna gitmek için Günlüğe Kaydet'i seçin.
NOT: LAMP çalıştırmaları yıldan başlayarak tarihe göre düzenlenir. - Her çalıştırmayla ilişkili beş sekmeyi gözlemleyin: Profil, Sıcaklık, Amplifikasyon, Tavlamave Sonuçlar.
NOT: Profil ve Sıcaklık sekmeleri, LAMP reaksiyonu devam ederken numune kuyularında sırasıyla programlanmış ve gerçek sıcaklıkları gösterir. Amplifikasyon ve Tavlama sekmeleri sırasıyla amplifikasyon ve tavlama aşamalarında floresan okumalarını ve floresan değişikliklerini gösterir. Sonuçlar sekmesi LAMP sonuçlarının tablolu bir görünümünü gösterir. - Her kuyunun LAMP sonuçlarını gözlemlemek için Sonuçlar sekmesine dokunun.
NOT: Üç sütun vardır (Peki, Amplification ve Tavlama). "Amplifikasyon" sütunu her örnek için en yüksek zaman değerlerini(Tmax; min:sn) gösterir ("Peki") ve "Tavlama" sütunu o kuyudaki herhangi bir güçlendirilmiş ürün için erime/tavlama sıcaklıklarını(Tm; °C) gösterir. - LAMP sonuçlarını yorumlayın ve nihai LAMP sonuçlarını aşağıdaki gibi bildirin.
- Önce kontrol kuyularını inceleyin. NTC kuyusu boş Tmax'e sahipken, Tm boş (her iki LAMP enstrüman modeli) veya < 83 °C (yalnızca iki bloklu LAMP enstrüman modeli için) olabilir. Pozitif kontrol kuyusu 5 ila 10 dakika arasında Tmax ve 90 ° C civarında Tm olmalıdır.
- Örnek kuyuları inceleyin. Doğru Tm (yaklaşık 90 °C) ve T maks.(5−30 dk arasında) olan tüm numuneler Salmonellaiçin pozitif olarak kabul edilir.
- Yinelenen çalıştırmalardan elde edilen sonuçlara göre nihai LAMP sonuçlarını bildirin. Yinelenen çalıştırmalar tutarlı sonuçlara sahipse, nihai LAMP sonuçları bildirilebilir. Yinelenen çalıştırmalar tutarsızsa, her iki çalıştırmayı da bağımsız olarak yineleyin. Sonuçlar hala tutarsızsa, örnek Salmonella için varsayımsal pozitif olarak kabul edilmelidir ve kültür onayından geçmesi gerekecektir.
- Ana ekranın sol alt kısmındaki Klasör simgesine dokunun ve LAMP'nin ilgi çekici çalışmasını yüklemek üzere dosya konumuna gitmek için Günlüğe Kaydet'i seçin.
- Lamp sonuçlarını yazılımı kullanarak yorumlamak için şu adımları izleyin.
- Sol paneldeki Bilgisayar simgesine tıklayın ve LAMP'nin ilgisini çekmek için dosya konumuna gidin.
NOT: Yazılımın yüklü olduğu bilgisayarın LAMP sonuçlarını analiz etmek için LAMP cihazına bağlanması gerekmez, yani uzaktan erişim mevcuttur. LAMP çalıştırmaları tarihe göre düzenlenmiştir. - Her çalıştırmayla ilişkili yedi sekmeyi gözlemleyin: Profil, Sıcaklık, Amplifikasyon, Amplifikasyon Oranı, Tavla, Tavla Türevive Sonuç.
NOT: Gösterge paneli görünümüne benzer şekilde, Profil ve Sıcaklık sekmeleri, LAMP reaksiyonu devam ederken numune kuyularında sırasıyla programlanmış ve gerçek sıcaklıkları gösterir. Amplifikasyon/Amplifikasyon Oranı ve Tavlama/Tav türevi sekmeleri sırasıyla amplifikasyon ve tavlama aşamalarında floresan okumalarını veya floresan değişikliklerini gösterir. Sonuçlar sekmesi, lamba sonuçlarının gösterge paneli görünümünden biraz farklı olan tablolu bir görünümünü gösterir. - Floresan oranlarının zamana göre grafik görüntüsünü görüntülemek için Amplifikasyon Hızı sekmesine dokunun. Ekranın sağ üst kısmındaki Ayar simgesine tıklayın ve "Tepe Algılama Eşik Oranı"nı 0,020'den 0,010'a ayarlayın.
NOT: Ayarlama, tüm geçerli tepelerin tanımlandığından ve yazılım kullanılarak elde edilen sonuçların gösterge panelinde görüntülenenlerle eşleştiğından emin olmak için gereklidir. - Her kuyu için LAMP sonuçlarını gözlemlemek için Sonuç sekmesine dokunun.
NOT: Dört sütun vardır (Grafik Adı, Kuyu Numarası, Kuyu Adı ve Tepe Değeri). "Tepe Değeri" sütununun üst kısmında her örnek için "Amp Time" (Tmaks .min:sn) ("Kuyu Adı") gösterilirken, alt kısımda bu kuyudaki herhangi bir güçlendirilmiş ürün için "Tav türevi" ( Tm; °C) gösterilir. - LAMP sonuçlarını yorumlayın ve cihaz panelini kullanırken olduğu gibi, LAMP yazılım ayarları bu Tm < 83 °C sonuçlarını ortadan kaldırdığı için NTC kuyusunun ve diğer negatif örneklerin boş Tm'ye sahip olması gerektiği gibi benzer adımları izleyerek nihai LAMP sonuçlarını bildirin. Benzer şekilde, doğru T m (yaklaşık 90 °C) ve T maks(5−30 dk arasında) olan tüm numuneler Salmonellaiçin pozitif olarak kabul edilir.
- Sol paneldeki Bilgisayar simgesine tıklayın ve LAMP'nin ilgisini çekmek için dosya konumuna gidin.
Sonuçlar
Şekil 2 ve Şekil 3 her iki platformda görüntülenen temsili LAMP grafiklerini/tablolarını göstermektedir. Bu LAMP çalışmasında, S1 ila S6 örnekleri, reaksiyon başına 1.1 x 106 CFU ila 11 CFU arasında değişen S. enterica serovar Infantis ATCC 51741'in 10 kat seri seyreltmeleridir. Pozitif kontrol S. enterica serovar Typhimurium ATCC 19585 (LT2) reaksiyon başına 1.7 x 104 CFU ve NTC moleküler dereceli sudur.
Şekil 2E ve Şekil 3G'degösterildiği gibi, hem NTC hem de PC kuyuları geçerli kontrollerdir. NTC kuyusu boş Tmax'e sahipken Tm, LAMP gösterge panelinde < 83 °C ve LAMP yazılımında boştur, bu da olumsuz bir sonuç olduğunu gösterir. PC kuyusu her iki platformda da Tmax 7 dk 45 sn ve Tm ~ 90 °C'ye sahiptir, bu da olumlu bir sonuç olduğunu gösterir. S1 ila S6 örnekleri, hepsi Salmonella-pozitif olmak üzere 6 dk 30 sn ile 12 dk 15 sn arasında Tmax'e sahiptir.
Aynı örnek kümesinin yinelenen çalıştırmalarını takiben, bu örnekler için son LAMP sonuçları bildirilmektedir. Bu temsili LAMP çalışması, LAMP'in salmonella'nın numunelerde çok çeşitli konsantrasyonlarla başarıyla tespit ettiğini göstermektedir.

Şekil 2: LAMP gösterge panelinde görüntülenen temsili LAMP sonuçları. (A) Profil sekmesinde programlanmış sıcaklık profili gösterilir. (B) Sıcaklık sekmesi, LAMP reaksiyon devam ederken numune kuyularındaki gerçek sıcaklıkları gösterir. (C) Amplifikasyon sekmesi LAMP amplifikasyonu sırasında floresan okumalarını gösterir. (D) Tavlama sekmesi, tavlama aşamasında floresan (türev) değişiklikleri gösterir. (E) Sonuçlar sekmesi LAMP sonuçlarının tablolu bir görünümünü gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
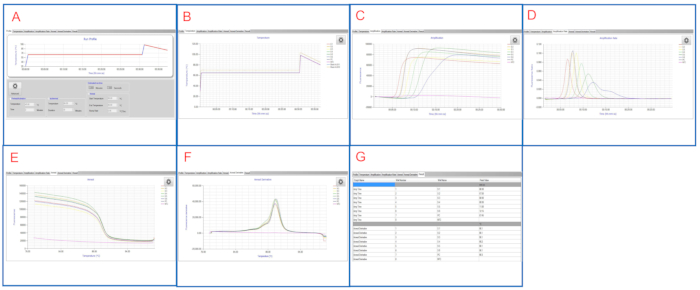
Şekil 3: Lamp yazılımında görüntülenen temsili LAMP sonuçları. (A) Profil sekmesinde programlanmış sıcaklık profili gösterilir. (B) Sıcaklık sekmesi, LAMP reaksiyon devam ederken numune kuyularındaki gerçek sıcaklıkları gösterir. (C) Amplifikasyon sekmesi LAMP amplifikasyonu sırasında floresan okumalarını gösterir. (D) Amplifikasyon Oranı sekmesi, LAMP amplifikasyonu sırasında floresan (floresan oranı) değişiklikleri gösterir. (E) Tavlama sekmesi, tavlama aşamasında floresan okumalarını gösterir. (F) Tav türevi sekmesi, tavlama aşamasında floresan (türev) değişiklikleri gösterir. (G) Sonuç sekmesi LAMP sonuçlarının tablolu bir görünümünü gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada sırasıyla hayvansal gıda ve saf kültürde Salmonella'yı taramak ve onaylamak için basit, hızlı, spesifik ve hassas bir LAMP yöntemi sunduk. Dört anahtar reaktif içeren bir izotermal ana karışımın rahatlığı ve kullanıma hazır, şirket içinde hazırlanmış bir astar karışımı ile, bir LAMP reaksiyonunun montajı sadece birkaç pipetleme adımı gerektirir (Şekil 1). Amplifikasyon ve tavlama aşamaları dahil olmak üzere toplam çalışma süresi 38 dakikadan azdır(Şekil 2A,B ve Şekil 3A,B). Olumlu sonuçlar gerçek zamanlı floresan ( Şekil2C ve Şekil 3C,D) aracılığıyla izlenir ve 5 dk26kadar erken bir tarihte tespit edilebilir. Tavlama fazı LAMP özgüllüğünün ekstra bir teyidi olarak işlev görür, çünkü sadece doğru Tm (yaklaşık 90 °C) olan numuneler pozitif olarak bildirilir (Şekil 2D,E ve Şekil 3E−G). Saf kültürde 1 Salmonella hücresinin ve hayvansal gıdalarda < 1 CFU/25 g hassasiyetlerinin daha önce26olduğu bildirilmiştir.
LAMP oldukça etkili olduğundan ve çok miktarda DNA1ürettiğinden, LAMP ana karışımını hazırlamak ve DNA şablonları eklemek için alanları fiziksel olarak ayırmayı, aerosol üretmekten kaçınmayı, filtre pipet uçlarını kullanmaktan, eldivenleri sık sık değiştirmeyi ve amplifikasyon sonrası LAMP reaksiyon tüplerini açmaktan kaçınmayı içerebilecek çapraz kontaminasyonu önlemek için en iyi laboratuvar uygulamalarının kullanılması kritik öneme sahiptir.
Bu Salmonella LAMP yönteminin özgüllüğü daha önce 300 bakteri suşu (185 serovar ve 53 Salmonella olmayan 247Salmonella)kullanılarak test edildi ve% 100 spesifik26olduğu gösterildi. Özellikle, iki Salmonella türü, S. enterica ve Salmonella bongoriarasında ve S. enterica alt türleri arasında, özellikle subsp. arizonae (IIIa)26arasında Tmax'te önemli farklılıklar gözlenmiştir. Bununla birlikte, bunlar LAMP sonuçlarını yorumlama kurallarına göre hala geçerli olumlu sonuçlardı. 14 analist 19 'u içeren kuru köpekmamasındakiçok laboratuvarlı işbirliği çalışmamızda, yinelenen LAMP çalışmalarında tutarsız sonuçlara sahip örnekler zaman zaman gözlendi. Bunlar genellikle gecikmiş pozitif sonuçlara sahip örnekleri içeriyordu(Tmax > 15 dk). Her iki çalıştırmayı da bağımsız olarak yinelemek genellikle sorunu çözmüştür. Daha nadiren, doğru Tm ancak düzensiz Tmax değerlerine (< 5 dk) sahip örnekler gözlemledik. Buna genellikle reaksiyon tüpündeki hava kabarcıkları neden oldu.
LAMP yöntemi geliştirme, değerlendirme, önkolaboratif çalışma ve çok laboratuvarlı doğrulama yaşam döngüsü boyunca, LAMP'nin çeşitli hayvansal gıda veya gıda matrislerindeki inhibitörlere ve kültür ortamlarına karşı yüksek tolerans gösterdiğini gözlemledik4,19,22,23,24, yöntemin sağlamlığını vurgulayan ve küresel ölçekte çok sayıda diğer çalışmalarla işbirliği yapmak8. Bu, PCR veya gerçek zamanlı PCR'ye kıyasla daha üstündür, bu da genellikle olumsuz sonuçların matris inhibisyonuna bağlı olmadığından emin olmak için dahili bir amplifikasyon kontrolü gerektirir28. Ayrıca LAMP, çalışmaların büyük çoğunluğunda PCR veya gerçek zamanlı PCR ile karşılaştırıldığında benzer (veya üstün) özgüllük ve hassasiyet göstermiştir8. LAMP reaktiflerinin maliyeti reaksiyon başına yaklaşık 1 $ 'dır. Bu protokolde kullanılan LAMP cihazları küçük, az bakım gerektiren ve taşınabilirdir. Lamp dahil floresan ölçümü ile hedef tespiti kullanan herhangi bir izotermal amplifikasyon yöntemini işleyebilirler. LAMP yazılımı kullanılarak, kapsamlı raporlar birden fazla biçimde (pdf, metin ve görüntü) oluşturulabilir.
Yöntem doğrulaması, rutin kullanım için yeni bir yöntemin benimsenebilmesi için kritik bir adımdır. Burada bildirilen LAMP protokolünün çoklu laboratuvar doğrulamasını başarıyla tamamlamış olması dikkat çekicidir19. Bu LAMP protokolünün abd FDA'nın BAM Bölüm 5 Salmonella27'ye yakın zamanda dahil olmasıyla, yöntemin hem hayvansal gıdalarda hızlı bir tarama yöntemi hem de tüm gıda kategorilerinden izole edilen muhtemel Salmonella için güvenilir bir onay yöntemi olarak çok daha geniş bir kullanım kazanması beklanmaktadır.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler. Bu yazıda ifade edilen görüşler yazarlara aittir ve Sağlık ve İnsan Hizmetleri Bakanlığı, ABD Gıda ve İlaç İdaresi veya ABD Hükümeti'nin resmi politikasını yansıtmak zorunda değildir. Herhangi bir ticari malzemeye, ekipmana veya işleme atıfta bulunulması hiçbir şekilde Gıda ve İlaç İdaresi tarafından onay, onay veya tavsiye teşkil etmez.
Teşekkürler
Yazarlar, Salmonella LAMP yöntem doğrulama çalışmalarını eleştirel bir şekilde incelediklerinden dolayı FDA'nın Mikrobiyoloji Yöntemleri Doğrulama Alt Komitesi (MMVS) ve Bakteriyolojik Analitik El Kitabı (BAM) Konseyi üyelerine teşekkür etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Brain heart infusion (BHI) broth | BD Diagnostic Systems, Sparks, MD | 299070 | Liquid growth medium used in the cultivation of Salmonella. |
| Buffered peptone water (BPW) | BD Diagnostic Systems, Sparks, MD | 218105 | Preenrichment medium for the recovery of Salmonella from animal food samples. |
| DNA AWAY | Thermo Fisher Scientific, Waltham, MA | 7010 | Eliminates unwanted DNA and DNase from laboratory bench, glassware, and plasticware without affecting subsequent DNA samples. |
| Genie Explorer software | OptiGene Ltd., West Sussex, United Kingdom | Version 2.0.6.3 | Supports remote operation of Genie instruments including LAMP runs and data analysis. |
| Genie II or Genie III (LAMP instrument) | OptiGene Ltd., West Sussex, United Kingdom | GEN2-02 or GEN3-02 | A small instrument capable of temperature control up to 100 °C with ± 0.1 °C accuracy and simultaneous fluorescence detection via the FAM channel. Genie II has 2 blocks (A and B) with 8 samples in each block. Genie III has a single block that accommodates 8 samples. |
| Genie strip | OptiGene Ltd., West Sussex, United Kingdom | OP-0008 | 8-well microtube strips with integral locking caps and a working volume of 10 to 150 µl. |
| Genie strip holder | OptiGene Ltd., West Sussex, United Kingdom | GBLOCK | Used to hold Genie strips when setting up a LAMP reaction, the aluminum holder can also be used as a cool block. |
| Hydrochloric acid (HCl) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SA48-500 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Heat block | Thermo Fisher Scientific, Waltham, MA | 88-860-022 | Heats samples at 100 ± 1 oC for DNA extraction. |
| Incubator | Thermo Fisher Scientific, Waltham, MA | 3960 | Standard laboratory incubator. |
| ISO-001 isothermal master mix | OptiGene Ltd., West Sussex, United Kingdom | ISO-001 | An optimized master mix to simplify the assembly of a LAMP reaction, containing a strand-displacing GspSSD DNA polymerase large fragment from Geobacillus spp., thermostable inorganic pyrophosphatase, reaction buffer, MgSO4, dNTPs, and a double-stranded DNA binding dye (FAM detection channel). |
| Isopropanol | Thermo Fisher Scientific, Waltham, MA | A416 | Disinfects work surfaces. |
| LAMP primers | Integrated DNA Technologies Inc., Coralville, IA | Custom | LAMP primers with detailed information in Table 1. |
| Microcentrifuge | Eppendorf North America, Hauppauge, NY | 22620207 | MiniSpin plus personal microcentrifuge. |
| Microcentrifuge tubes | Thermo Fisher Scientific, Waltham, MA | 05-408-129 | Standard microcentrifuge tubes. |
| Molecular grade water | Thermo Fisher Scientific, Waltham, MA | AM9938 | Used in making primer stocks, primer mix, and LAMP reaction mix. |
| Sodium hydroxide (NaOH) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SS266-1 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Nonselective agar (e.g., blood agar, nutrient agar, and trypticase soy agar) | Thermo Fisher Scientific, Waltham, MA | R01202 | Solid growth medium used in the cultivation of Salmonella. |
| Peptone water | BD Diagnostic Systems, Sparks, MD | 218071 | Dilutes overnight Salmonella cultures to make positive control DNA. |
| Pipettes and tips | Mettler-Toledo Rainin LLC, Oakland CA | Pipet Lite LTS series | Standard laboratory pipettes and tips. |
| PrepMan Ultra sample preparation reagent | Thermo Fisher Scientific, Waltham, MA | 4318930 | A simple kit used for the rapid preparation of DNA templates for use in a LAMP reaction. |
| Salmonella reference strain LT2 | ATCC, Manassas, VA | 700720 | Salmonella reference strain used as positive control. |
| Trypticase soy broth (TSB) | BD Diagnostic Systems, Sparks, MD | 211768 | Liquid growth medium used in the cultivation of Salmonella. |
| Vortex mixer | Scientific Industries, Inc., Bohemia, NY | SI-0236 | Standard laboratory vortex mixer. |
| Whirl-pak filter bag | Nasco Sampling Brand, Fort Atkinson, WI | B01318 | Filter bags to hold animal food samples for preenrichment. |
Referanslar
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), 63(2000).
- Kaneko, H., Kawana, T., Fukushima, E., Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. Journal of Biochemical and Biophysical Methods. 70 (3), 499-501 (2007).
- Francois, P., et al. Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications. FEMS Immunology and Medical Microbiology. 62 (1), 41-48 (2011).
- Yang, Q., Wang, F., Prinyawiwatkul, W., Ge, B. Robustness of Salmonella loop-mediated isothermal amplification assays for food applications. Journal of Applied Microbiology. 116 (1), 81-88 (2014).
- Nagamine, K., Watanabe, K., Ohtsuka, K., Hase, T., Notomi, T. Loop-mediated isothermal amplification reaction using a nondenatured template. Clinical Chemistry. 47 (9), 1742-1743 (2001).
- Zhang, X., Lowe, S. B., Gooding, J. J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP). Biosensors & Bioelectronics. 61, 491-499 (2014).
- Nagamine, K., Hase, T., Notomi, T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and Cellular Probes. 16 (3), 223-229 (2002).
- Yang, Q., Domesle, K. J., Ge, B. Loop-mediated isothermal amplification for Salmonella detection in food and feed: Current applications and future directions. Foodborne Pathogens and Disease. 15 (6), 309-331 (2018).
- Mori, Y., Notomi, T. Loop-mediated isothermal amplification (LAMP): Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy. 26 (1), 13-17 (2020).
- Mansour, S. M., Ali, H., Chase, C. C., Cepica, A. Loop-mediated isothermal amplification for diagnosis of 18 World Organization for Animal Health (OIE) notifiable viral diseases of ruminants, swine and poultry. Animal Health Research Reviews. 16 (2), 89-106 (2015).
- Kumar, Y., Bansal, S., Jaiswal, P. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Comprehensive Reviews in Food Science and Food Safety. 16 (6), 1359-1378 (2017).
- WHO. The use of loop-mediated isothermal amplification (TB-LAMP) for the diagnosis of pulmonary tuberculosis: policy guidance. , Available from: http://www.who.int/tb/publications/lamp-diagnosis-molecular/en (2016).
- Kundapur, R. R., Nema, V. Loop-mediated isothermal amplification: Beyond microbial identification. Cogent Biology. 2, 1137110(2016).
- WHO. Salmonella (non-typhoidal) fact sheet. , Available from: http://www.who.int/mediacentre/factsheets/fs139/en (2018).
- FAO/WHO. Executive summary report of the joint FAO/WHO expert meeting on hazards associated with animal feed. , Available from: http://www.fao.org/3/a-az851e.pdf (2015).
- FDA. Compliance Policy Guide Sec. 690.800 Salmonella in Food for Animals. , Available from: https://www.fda.gov/downloads/iceci/compliancemanuals/compliancepolicyguidancemanual/ucm361105.pdf (2013).
- Bird, P., et al. Evaluation of the 3M molecular detection assay (MDA) 2 - Salmonella for the detection of Salmonella spp. in select foods and environmental surfaces: collaborative study, first action 2016.01. Journal of AOAC International. 99 (4), 980-997 (2016).
- D'Agostino, M., et al. Validation of a loop-mediated amplification/ISO 6579-based method for analysing soya meal for the presence of Salmonella enterica. Food Analytical Methods. 9 (11), 2979-2985 (2016).
- Ge, B., et al. Multi-laboratory validation of a loop-mediated isothermal amplification method for screening Salmonella in animal food. Frontiers in Microbiology. 10, 562(2019).
- D'Agostino, M., Diez-Valcarce, M., Robles, S., Losilla-Garcia, B., Cook, N. A loop-mediated isothermal amplification-based method for analysing animal feed for the presence of Salmonella. Food Analytical Methods. 8 (10), 2409-2416 (2015).
- Galan, J. E., Ginocchio, C., Costeas, P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of InvA to members of a new protein family. Journal of Bacteriology. 174 (13), 4338-4349 (1992).
- Chen, S., Wang, F., Beaulieu, J. C., Stein, R. E., Ge, B. Rapid detection of viable salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification. Applied and Environmental Microbiology. 77 (12), 4008-4016 (2011).
- Yang, Q., Chen, S., Ge, B. Detecting Salmonella serovars in shell eggs by loop-mediated isothermal amplification. Journal of Food Protection. 76 (10), 1790-1796 (2013).
- Yang, Q., et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection of Salmonella in produce. Food Microbiology. 46, 485-493 (2015).
- Yang, Q., Domesle, K. J., Wang, F., Ge, B. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time. BMC Microbiology. 16 (1), 112(2016).
- Domesle, K. J., Yang, Q., Hammack, T. S., Ge, B. Validation of a Salmonella loop-mediated isothermal amplification assay in animal food. International Journal of Food Microbiology. 264, 63-76 (2018).
- Andrews, W. H., Jacobson, A., Hammack, T. S. Bacteriological Analytical Manual. Chapter 5: Salmonella. , Available from: http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm070149.htm (2020).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır