Method Article
Amplificação isotérmica mediada por loop para triagem de salmonela em alimentos animais e confirmando salmonela do isolamento cultural
Neste Artigo
Resumo
Amplificação isotérmica mediada por loop (LAMP) é um teste isotémico de amplificação de ácido nucleico (iNAAT) que tem atraído amplo interesse no campo de detecção de patógenos. Aqui, apresentamos um protocolo salmonella LAMP validado em vários laboratórios como um método rápido, confiável e robusto para a triagem de Salmonella em alimentos animais e confirmando salmonela presuntiva do isolamento cultural.
Resumo
A amplificação isotérmica mediada por loop (LAMP) emergiu como um poderoso teste de amplificação de ácido nucleico para a rápida detecção de numerosos agentes bacterianos, fúngicos, parasitários e virais. Salmonela é um patógeno bacteriano da preocupação mundial com a segurança alimentar, incluindo alimentos para animais. Apresentado aqui é um protocolo salmonella LAMP validado em vários laboratórios que pode ser usado para rastrear rapidamente alimentos de origem animal para a presença de contaminação salmonela e também pode ser usado para confirmar os presuntivos isolados salmonella recuperados de todas as categorias alimentares. O ensaio LAMP tem como alvo especificamente o gene de invasão salmonela (invA)e é rápido, sensível e altamente específico. Modelo DNAs são preparados a partir de caldos de enriquecimento de alimentos de origem animal ou culturas puras de isolados de Salmonella presunçosos. A mistura de reagente LAMP é preparada combinando uma mistura isotemal mestre, primers, modelo de DNA e água. O ensaio LAMP funciona a uma temperatura constante de 65 °C por 30 min. Os resultados positivos são monitorados via fluorescência em tempo real e podem ser detectados em até 5 minutos. O ensaio LAMP exibe alta tolerância aos inibidores em alimentos ou meios de cultura animal, servindo como um método rápido, confiável, robusto, econômico e fácil de usar para triagem e confirmação de Salmonella. O método LAMP foi recentemente incorporado ao Manual Analítico Bacteriológico (BAM) da Administração de Alimentos e Medicamentos dos EUA, capítulo 5.
Introdução
Amplificação isotérmica mediada por loop (LAMP) é um novo teste isotémico de amplificação de ácido nucleico (iNAAT) inventado em 2000 por um grupo de cientistas japoneses1. Através da formação de uma estrutura de DNA específica para o alvo durante as etapas iniciais, a LAMP usa uma polimerase de DNA deslocada para amplificar eficientemente este material inicial quase exponencialmente, resultando em 109 cópias do alvo em menos de 1 h1. Comparado com a reação em cadeia de polimerase (PCR), um NAAT amplamente utilizado, o LAMP possui várias vantagens. Em primeiro lugar, as reações lampiães são realizadas em condições istermais. Isso evita a necessidade de um sofisticado instrumento de ciclismo térmico. Em segundo lugar, o LAMP é altamente tolerante à mídia cultural e às substâncias biológicas2 com robustez demonstrada tanto para aplicações clínicas quanto alimentares3,4. Isso simplifica a preparação da amostra e minimiza os resultados negativos falsos5. Em terceiro lugar, o LAMP é amenável a múltiplas plataformas de detecção, como turbidez, colorimetria, bioluminescência, fluorescência e microfluidos6. Em quarto lugar, o LAMP é altamente específico, pois usa de quatro a seis primers especialmente projetados para atingir de seis a oito regiões específicas1,7. Em quinto lugar, lamp é ultrasensível e inúmeros estudos relataram sua sensibilidade superior ao PCR ou PCR8em tempo real . Finalmente, o LAMP é mais rápido com muitos ensaios agora adotando um tempo de execução padrão de 30 minutos, enquanto os ensaios do tipo PCR geralmente levam 1−2 h8.
Essas características atraentes alimentaram a aplicação de LÂMPADA em amplas áreas de detecção de patógenos, incluindo diagnóstico in vitro 9, diagnóstico de doenças animais10e testes alimentares e ambientais11. Notavelmente, uma LÂMPADA de TB (LAMP for Mycobacterium tuberculosis)tem sido recomendada pela OMS como um teste de substituição válido para microscopia de esfutum-difamação para diagnósticos de tuberculose pulmonar em ambientes periféricos12. A aplicação de LÂMPADAs também se expande além da identificação microbiana para incluir a detecção de alérgenos, espécies animais, resistência a medicamentos, organismos geneticamente modificados e pesticidas13.
A Salmonella Não ticidal é um patógeno zoonótico de preocupação substancial com segurança alimentar e saúde pública em todo o mundo14. Também foi identificado como um importante risco microbiano em alimentos para animais (ou seja, alimentos de animais)15,16. Para prevenir doenças/surtos de Salmonella de alimentos humanos e animais contaminados, é imperativo ter métodos rápidos, confiáveis e robustos para testar Salmonella em uma variedade de matrizes. Na última década, esforços consideráveis foram feitos internacionalmente no desenvolvimento e aplicação de ensaios salmonella LAMP em uma ampla gama de matrizes alimentares, como recentemente resumido em uma extensa revisão8. Vários ensaios da Salmonella LAMP, incluindo o apresentado aqui, concluíram com sucesso a validação multi-laboratorial seguindo diretrizes internacionais bem estabelecidas17,18,19,20.
Nosso ensaio Salmonella LAMP tem como alvo especificamente o gene de invasão salmonela invA (número de adesão do GenBank M90846)21 e é rápido, confiável e robusto em múltiplas matrizes alimentares4,22,23,24,25,26. O método foi validado em seis matrizes de alimentos de origem animal em um estudo pré-colaborativo26 e em alimentos para cães secos em um estudo colaborativo multi-laboratorial19. Como resultado, o método Salmonella LAMP apresentado aqui foi recentemente incorporado à Food and Drug Administration (FDA) do Manual Analítico Bacteriológico (BAM) Capítulo 5 Salmonella27 para servir a dois propósitos, um como método de triagem rápida para a presença de Salmonella em alimentos animais e dois como um método de confirmação confiável para a salmonela isolada de todos os alimentos.
Protocolo
NOTA: Uma mistura de reação lâmpada contém polimerase de DNA, tampão, MgSO4, dNTPs, primers, modelo de DNA e água. Os quatro primeiros reagentes estão contidos em uma mistura isotemal master(Tabela de Materiais). Os primers são pré-misturados internamente para se tornar uma mistura de primer (10x). Modelos de DNA podem ser preparados a partir de caldos de enriquecimento de amostras de alimentos de origem animal para fins de triagem ou de culturas de isolados de Salmonella presunçosos para fins de confirmação. Além disso, um controle positivo (DNA extraído de qualquer cepa de referência Salmonella, por exemplo, Salmonella enterica serovar Typhimurium ATCC 19585 [LT2]) e um controle sem modelo (NTC; água de grau molecular estéril) estão incluídos em cada corrida de LÂMPADA.
1. Preparação de modelos de DNA
- Para preparar modelos de DNA a partir de enriquecimentos de alimentos de origem animal, siga estes passos.
- Asepticamente pesam 25 g de amostra de alimentos de origem animal (por exemplo, alimentos para gatos secos, ração seca para cães, ração para gado, ração para cavalos, ração de aves e ração suína) em um saco de filtro estéril(Tabela de Materiais),ou equivalente. Coloque o saco em um recipiente grande ou rack para suporte durante a incubação.
- Adicione 225 mL de água peptone tamponada estéril (BPW). Misture bem girando e breve massagem manual. Deixe ficar em temperatura ambiente por 60 ± 5 min.
- Misture bem girando e determine o pH com um papel de teste. Ajuste o pH, se necessário, para 6,8 ± 0,2 com estéril 1 N NaOH ou 1 N HCl. Incubar a 35 ± 2 °C por 24 ± 2 h.
- Misture bem girando o saco contendo caldos de enriquecimento de alimentos de animais. Transfira 1 mL do lado filtrado do saco para um tubo de microcentrífuga. Vórtice brevemente.
- Extrair DNA utilizando um reagente de preparação de amostras(Tabela de Materiais)da seguinte forma.
- Centrífuga a 900 x g por 1 min para remover partículas grandes e transferir supernascer para um novo tubo de microcentrifuge.
- Centrifugar a 16.000 x g por 2 min e descartar supernaspeuta.
- Suspenda a pelota em 100 μL do reagente de preparação da amostra e aqueça a 100 ± 1 °C por 10 minutos em um bloco de calor seco.
- Esfrie até a temperatura ambiente e armazene extratos de DNA de amostras a -20 °C.
- Para preparar modelos de DNA de culturas salmonela presuntivas, siga esses passos.
- Obter isolações presuntivas de Salmonella do isolamento cultural em todos os alimentos após a seção de Salmonella da FDA 5 Capítulo 5: Isolamento da Salmonella27.
- Salmonella presuntiva inoculada isola em uma placa de ágar não-eletrídrica (por exemplo, ágar de sangue, ágar nutriente e ágar de soja tripática) e incubar a 35 ± 2 °C por 24 ± 2 h.
- Transfira várias colônias individuais para 5 mL de caldo de soja trippticase (TSB) ou caldo de infusão cerebral (BHI) e incubar a 35 ± 2 °C por 16 ± 2 h.
NOTA: Esta etapa pode ser opcional se a cultura salmonella presunçosa for pura. Nesse caso, os modelos de DNA podem ser preparados suspendendo várias colônias únicas em 5 mL de TSB e aquecendo 500 μL da suspensão a 100 ± 1 °C por 10 minutos em um bloco de calor seco. Continue com o passo 5 abaixo. - Transfira 500 μL da cultura durante a noite para um tubo de microcentrífuga e aqueça a 100 ± 1 °C por 10 minutos em um bloco de calor seco.
- Esfrie até a temperatura ambiente e armazene extratos de DNA isolados a -20 °C.
- Para preparar o DNA de controle positivo, siga passos semelhantes como acima para preparar modelos de DNA de culturas de Salmonella presunçosas com um passo extra de diluição.
- Inoculado S. Typhimurium ATCC 19585 (LT2) ou qualquer referência salmonela em uma placa de ágar não-eletrídrica (por exemplo, ágar de sangue, ágar nutriente e ágar de soja tripleco) e incubar a 35 ± 2 °C por 24 ± 2 h.
- Transfira várias colônias individuais para 5 mL de caldo TSB ou BHI e incubar a 35 ± 2 °C por 16 ± 2h para atingir ~109 UFC/mL.
- Diluir em série a cultura da noite para o dia em 0,1% de água peptone para obter ~107 UFC/mL.
- Transfira 500 μL desta diluição para um tubo de microcentrífuga e aqueça a 100 ± 1 °C por 10 min em um bloco de calor seco.
- Esfrie até a temperatura ambiente e armazene DNA de controle positivo a -20 °C.
2. Preparação da mistura de primer (10x)
- Obtenha primers LAMP sintetizados comercialmente (Sal4-F3, Sal4-B3, Sal4-FIP, Sal4-BIP, Sal4-LF e Sal4-LB) com purificação de desalização padrão(Tabela 1).
| Nome do primer | Descrição | Sequência (5'-3') | Comprimento (bp) |
| Sal4-F3 | Primer externo para a frente | GAACGTGTCGGAAGTC | 18 |
| Sal4-B3 | Primer externo para trás | CGGCAATAGCGTCACCTT | 18 |
| Sal4-FIP | Primer interno para a frente | GCGCGGCATCCGCATCAATA-TCTGGATGGTATGCCCGG | 38 |
| Sal4-BIP | Primer interno para trás | GCGAACGGCGAAGCGTACTG-TCGCACCGTCAAAGGAAC | 38 |
| Sal4-LF | Primer de loop para a frente | TCAAATCGGCAATACTCA-TCTG | 25 |
| Sal4-LB | Primer de loop para trás | AAAGGGAAAGCCAGCTTTACG | 21 |
Tabela 1: Primers lamp para triagem salmonela em alimentos de animais e confirmando Salmonella do isolamento cultural. Os primers são projetados com base na sequência salmonella invA (número de adesão do GenBank M90846).
- Prepare soluções de estoque de cada primer (100 μM) reidratando o primer com quantidade apropriada de água molecular estéril. Misture bem por vórtice para 10 s e armazene a -20 °C (-80 °C para armazenamento a longo prazo).
- Prepare a mistura de primer (10x) de acordo com uma planilha(Tabela 2). Adicione volumes apropriados de soluções de estoque de primer e água molecular estéril em um tubo de microcentrifuuge. Misture bem todos os reagentes com vórtice para 10 s.
| Componente | Conc. de ações (μM) | Mistura de primer conc. (μM) | Volume (μL) |
| Primer Sal4-F3 | 100 | 1 | 10 |
| Primer Sal4-B3 | 100 | 1 | 10 |
| Primer Sal4-FIP | 100 | 18 | 180 |
| Primer Sal4-BIP | 100 | 18 | 180 |
| Primer Sal4-LF | 100 | 10 | 100 |
| Primer Sal4-LB | 100 | 10 | 100 |
| Água de grau molecular | N/A | N/A | 420 |
| Total | N/A | N/A | 1000 |
Tabela 2: Planilha para a preparação do mix de primer LAMP (10x). Os primers estão listados na Tabela 1.
- Aliquot a mistura de primer de 10x a 500 μL por tubo de microcentrifuuge e armazene a -20 °C.
3. Montagem de uma reação lâmpada
NOTA: Para evitar a contaminação cruzada, é altamente recomendável separar fisicamente as áreas utilizadas para preparar a mistura mestre da LÂMPADA e adicionar modelos de DNA. A Figura 1 é um diagrama de LÂMPADA.
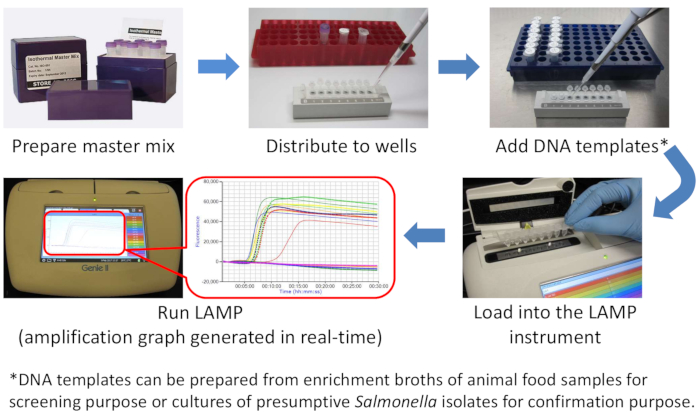
Figura 1: Um diagrama esquemático do fluxo de trabalho Salmonella LAMP. Clique aqui para ver uma versão maior desta figura.
- Preparação e execução configuração
- Banco limpo com isopropanol e uma solução degradante de DNA e DNase(Tabela de Materiais). Limpe as pipetas e os porta-tiras do tubo(Tabela de Materiais)com a solução degradante de DNA e DNase.
- Descongele a mistura isotemal master, mix de primer (10x), água de grau molecular, DNA de controle positivo e modelos de DNA à temperatura ambiente.
- Ligue o instrumento LAMP(Tabela de Materiais)e toque na tela de abertura para acessar a tela inicial. Siga estas etapas para criar uma corrida.
NOTA: Um modelo do instrumento LAMP tem 2 blocos (A e B) com 8 amostras em cada bloco e outro modelo tem um único bloco que acomoda 8 amostras(Tabela de Materiais).- Toque em LAMP+Anneal e selecione Editar para inserir informações de amostra.
NOTA: O perfil de execução padrão da lâmpada consiste em amplificação a 65 °C para 30 min e uma fase anneal de 98 °C a 80 °C com decréscreção de 0,05 °C por segundo. - Toque em cada linha de amostra para ativar o cursor e digite informações de amostra relevantes, usando o ícone do bloco AB para alternar entre os dois blocos de instrumentos LAMP.
- Toque no ícone Verificar quando todas as informações da amostra foram inseridas.
NOTA: Opcionalmente, a configuração de execução (denominada "Perfil", que contém informações de amostra, juntamente com o perfil de execução padrão do LAMP) pode ser salva para uso posterior. Toque no ícone Salvar e dê ao perfil um nome único. Ao testar este mesmo conjunto de amostras da próxima vez, uma nova execução pode ser iniciada usando o perfil salvo. Toque no ícone Pasta no canto inferior esquerdo da tela inicial e selecione Perfil para carregar perfis salvos.
- Toque em LAMP+Anneal e selecione Editar para inserir informações de amostra.
- Montagem de reação LAMP
NOTA: Ao utilizar ambos os blocos de instrumentos LAMP (A e B, um total de 16 amostras), prepare a mistura mestre da LÂMPADA para 18 amostras. Se utilizar apenas um bloco de instrumentos LAMP (8 amostras no total), prepare a mistura mestre LAMP para 10 amostras. Para outros números de amostra, ajuste o volume de acordo para acomodar a perda de pipetting. Inclua sempre um controle positivo e um NTC em cada corrida DE LÂMPADA. Recomenda-se o teste duplicado de cada amostra em corridas de LÂMPADA independentes.- Prepare a mistura mestre lampião de acordo com uma planilha(Tabela 3). Adicione volumes apropriados da mistura mestre isotemal, mistura de primer e água de grau molecular em um tubo de microcentrifuuge e vórtice suavemente para 3 s. Centrífuga brevemente.
- Coloque a tira do tubo no suporte da tira e distribua 23 μL da mistura mestre LAMP para cada poço.
- Vórtice todos os modelos de DNA e centrífuga brevemente. Adicione 2 μL de modelo de DNA ao poço apropriado e tampe firmemente.
- Remova a tira do tubo do suporte e do pulso de movimento para garantir que todos os reagentes tenham agrupado na parte inferior do tubo.
- Carregue a tira do tubo no bloco de instrumentos LAMP, garantindo que as tampas estejam seguras antes de fechar a tampa.
| Componente | Trabalhando conc. | Reação final conc. | Volume por amostra (μL) | Volume para 18 amostras (μL) | Volume para 10 amostras (μL) |
| Mix master iso-001 isotémico | 1,67x | 1x | 15 | 270 | 150 |
| Mix de primer | 10x | 1x | 2.5 | 45 | 25 |
| Água de grau molecular | N/A | N/A | 5.5 | 99 | 55 |
| Subtotal de mix mestre | N/A | N/A | 23 | 414 | 230 |
| Modelo de DNA | N/A | N/A | 2 | N/A | N/A |
Tabela 3: Planilha para preparar a mistura de reação LAMP. O mix de primer (10x) é preparado de acordo com a Tabela 2 usando soluções de estoque de primers listados na Tabela 1.
4. LAMP Run
NOTA: Durante uma execução de LÂMPADA, as leituras de fluorescência são adquiridas usando o canal FAM. Os valores de tempo-a-pico(Tmax; min) são determinados automaticamente pelo instrumento para o ponto de tempo quando a razão da fluorescência atinge o valor máximo da curva da taxa de amplificação. O Tm (°C) é a temperatura de fusão/ressarção do produto amplificado final.
- Clique no ícone Executar no canto superior direito da tela e selecione o bloco(s) contendo tiras de tubo para iniciar a execução do LAMP.
- Opcionalmente, enquanto a reação estiver em andamento, toque nas guias Temperatura, Amplificaçãoe Anneal para ver mudanças dinâmicas de vários parâmetros durante a execução da LÂMPADA.
- Uma vez concluída a execução, toque nas guias Amplificação e Anneal para ver a amplificação completa e as curvas anneal e toque na guia Resultados para ver os resultados.
- Opcionalmente, para manter o registro, registe o número de execução localizado no canto superior esquerdo da tela, usando o formato de "number_run número de number_run de instrumentos", por exemplo, "GEN2-2209_0030".
5. Interpretação dos resultados da LÂMPADA
NOTA: Os resultados da LÂMPADA podem ser visualizados diretamente no painel de instrumentos LAMP e/ou usando um software LAMP(Tabela de Materiais).
- Para interpretar os resultados do LAMP no painel de instrumentos, siga estas etapas.
- Toque no ícone Pasta no canto inferior esquerdo da tela inicial e selecione Log para navegar até o local do arquivo para carregar a execução de juros do LAMP.
NOTA: As corridas de LÂMPADA são organizadas por data, a partir do ano. - Observe as cinco guias associadas a cada execução: Perfil, Temperatura, Amplificação, Anneale Resultados.
NOTA: As guias Perfil e Temperatura mostram temperaturas programadas e reais, respectivamente, nos poços de amostra à medida que a reação da LÂMPADA prossegue. As abas amplificação e anneal mostram leituras de fluorescência e alterações na fluorescência durante as fases de amplificação e anneal, respectivamente. A guia Resultados mostra uma exibição tabular dos resultados do LAMP. - Toque na guia Resultados para observar os resultados da LÂMPADA para cada poço.
NOTA: Existem três colunas (Bem, Amplificação e Anneal). A coluna "Amplificação" mostra os valores de tempo para pico(Tmax; min:seg) para cada amostra ("Bem") e a coluna "Anneal" mostra as temperaturas de fusão/reclusão(Tm; °C) para qualquer produto amplificado naquele poço. - Interprete os resultados da LÂMPADA e informe os resultados finais da LÂMPADA da seguinte forma.
- Examine os poços de controle primeiro. O poço NTC deve ter Tmax em branco, enquanto Tm pode ser em branco (ambos modelos de instrumentos LAMP) ou < 83 °C (apenas para o modelo de instrumento LAMP com dois blocos). O bem de controle positivo deve ter Tmax entre 5 e 10 min e Tm em torno de 90 °C.
- Examine os poços de amostra. Todas as amostras com o Tm correto (aproximadamente 90 °C) e Tmax (entre 5-30 min) são consideradas positivas para Salmonella.
- Relatório resultados finais da LÂMPADA com base nos resultados das corridas duplicadas. Se as corridas duplicadas tiverem resultados consistentes, os resultados finais do LAMP poderão ser informados. Se as corridas duplicadas forem inconsistentes, repita ambas as corridas de forma independente. Se os resultados ainda forem inconsistentes, a amostra deve ser considerada presuntiva positiva para Salmonella e precisará passar pela confirmação da cultura.
- Toque no ícone Pasta no canto inferior esquerdo da tela inicial e selecione Log para navegar até o local do arquivo para carregar a execução de juros do LAMP.
- Para interpretar os resultados do LAMP usando o software, siga estas etapas.
- Clique no ícone Computador no painel esquerdo e navegue até o local do arquivo para carregar a execução de juros da LÂMPADA.
NOTA: O computador com o software instalado não precisa ser conectado ao instrumento LAMP para analisar os resultados da LÂMPADA, ou seja, o acesso remoto está disponível. As corridas LAMP são organizadas por data. - Observe as sete guias associadas a cada execução: Perfil, Temperatura, Amplificação, Taxa de Amplificação, Anneal, Derivado de Anneale Resultado.
NOTA: Semelhante à visão do painel de instrumentos, as guias Perfil e Temperatura mostram temperaturas programadas e reais, respectivamente, nos poços de amostra à medida que a reação da LÂMPADA prossegue. As abas Amplificação/Amplificação eDerivativos Anneal/ Anneal mostram leituras de fluorescência ou alterações na fluorescência durante as fases de amplificação e anneal, respectivamente. A guia Resultados mostra uma exibição tabular dos resultados do LAMP que diferem ligeiramente da exibição do painel de instrumentos. - Toque na guia Taxa de Amplificação para visualizar uma exibição gráfica das razões de fluorescência por tempo. Clique no ícone Configuração no canto superior direito da tela e ajuste a "Relação limite de detecção de pico" de 0,020 para 0,010.
NOTA: O ajuste é necessário para garantir que todos os picos válidos sejam identificados e os resultados obtidos utilizando o software correspondem aos exibidos no painel de instrumentos. - Toque na guia Resultado para observar os resultados da LÂMPADA para cada poço.
NOTA: Existem quatro colunas (Nome gráfico, número de poço, nome de poço e valor de pico). A parte superior da coluna "Peak Value" mostra "Amp Time"(Tmax; min:sec) para cada amostra ("Well Name") enquanto a parte inferior mostra "Anneal Derivative"(Tm; °C) para qualquer produto amplificado nesse poço. - Interprete os resultados do LAMP e informe os resultados finais da LÂMPADA seguindo etapas semelhantes à utilização do painel de instrumentos com uma exceção de que o bem NTC e outras amostras negativas devem ter Tm em branco, pois as configurações do software LAMP eliminam os resultados de Tm < 83 °C. Da mesma forma, todas as amostras com o Tm correto (aproximadamente 90 °C) e Tmax (entre 5-30 min) são consideradas positivas para Salmonella.
- Clique no ícone Computador no painel esquerdo e navegue até o local do arquivo para carregar a execução de juros da LÂMPADA.
Resultados
As figuras 2 e a figura 3 mostram gráficos/tabelas lampiões representativas exibidos em ambas as plataformas. Nesta execução da LÂMPADA, as amostras S1 a S6 são diluições seriais de S. enterica serovar Infantis ATCC 51741 variando de 1,1 x 106 UFC a 11 UFC por reação. Controle positivo é S. enterica serovar Typhimurium ATCC 19585 (LT2) a 1,7 x 104 UFC por reação e NTC é água de grau molecular.
Como mostrado na Figura 2E e Figura 3G,tanto os poços NTC quanto o PC são controles válidos. O poço NTC tem Tmax em branco enquanto Tm é < 83 °C no painel de instrumentos LAMP e em branco no software LAMP, sugerindo um resultado negativo. O PC bem tem Tmax de 7 min 45 seg e Tm de ~ 90 °C em ambas as plataformas, sugerindo um resultado positivo. Amostras S1 a S6 têm Tmax entre 6 min 30 seg e 12 min 15 seg, todas sendo Salmonella-positivo.
Após as duplicatas do mesmo conjunto de amostras, os resultados finais da LÂMPADA são relatados para estas amostras. Esta execução de LÂMPADA representativa mostra que a LAMP detecta com sucesso Salmonella com uma ampla gama de concentrações nas amostras.

Figura 2: Resultados representativos da LÂMPADA exibidos no painel de instrumentos LAMP. (A) A guia Perfil mostra o perfil de temperatura programado. (B) A guia temperatura mostra temperaturas reais nos poços de amostra e a reação da LÂMPADA prossegue. (C) A guia Amplificação mostra leituras de fluorescência durante a amplificação da LÂMPADA. (D) A aba Anneal apresenta alterações na fluorescência (derivada) durante a fase anneal. (E) A guia Resultados mostra uma exibição tabular dos resultados da LÂMPADA. Clique aqui para ver uma versão maior desta figura.
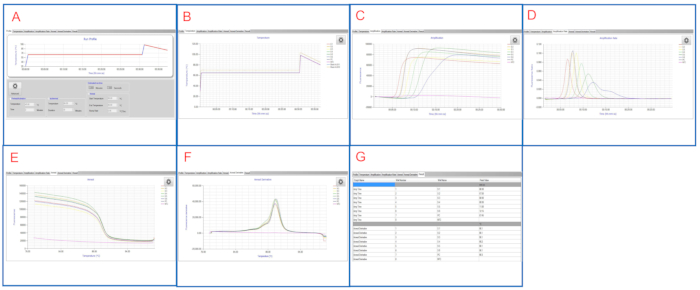
Figura 3: Resultados de LÂMPADA representativos visualizados no software LAMP. (A) A guia Perfil mostra o perfil de temperatura programado. (B) A guia temperatura mostra temperaturas reais nos poços de amostra e a reação da LÂMPADA prossegue. (C) A guia Amplificação mostra leituras de fluorescência durante a amplificação da LÂMPADA. (D) A guia Taxa de Amplificação apresenta alterações na fluorescência (relação fluorescência) durante a amplificação da LÂMPADA. (E) A aba Anneal apresenta leituras de fluorescência durante a fase anneal. (F) A aba Derivada De Anneal apresenta alterações na fluorescência (derivada) durante a fase anneal. (G) A guia Resultado mostra uma exibição tabular dos resultados do LAMP. Clique aqui para ver uma versão maior desta figura.
Discussão
Apresentamos aqui um método lâmpada simples, rápido, específico e sensível para triagem e confirmação de Salmonella em alimentos animais e cultura pura, respectivamente. Com a conveniência de uma mistura isotemal mestre que contém quatro reagentes-chave, e uma mistura de primer pronta para uso, em casa, a montagem de uma reação LAMP requer apenas alguns passos de pipetação(Figura 1). O tempo total de execução, incluindo fases de amplificação e anneal, é inferior a 38 min (Figura 2A,B e Figura 3A,B). Os resultados positivos são monitorados via fluorescência em tempo real (Figura 2C e Figura 3C,D) e podem ser detectados a partir de 5 min26. A fase anneal serve como uma confirmação extra da especificidade da LÂMPADA, uma vez que apenas amostras com Tm correto (em torno de 90 °C) são relatadas como positivas (Figura 2D,E e Figura 3E−G). Sensibilidades de 1 célula salmonela em cultura pura e < 1 UFC/25 g em alimentos de origem animal foram relatadas anteriormente26.
Como a LÂMPADA é bastante eficaz e gera uma grande quantidade de DNA1,é fundamental que as melhores práticas laboratoriais sejam usadas para evitar a contaminação cruzada, o que pode incluir separar fisicamente as áreas para preparar a mistura mestre da LÂMPADA e adicionar modelos de DNA, evitar gerar aerossóis, usar pontas de pipeta de filtro, trocar luvas com frequência e abster-se de abrir tubos de reação lampião após a amplificação.
A especificidade deste método Salmonella LAMP foi previamente testada utilizando 300 cepas bacterianas (247 Salmonella de 185 serovars e 53 não-Salmonella ) e demonstrou ser 100% específica26. Notavelmente, foram observadas diferenças significativas em Tmax entre as duas espécies Salmonella, S. enterica e Salmonella bongori, e entre as subespécies de S. enterica, especialmente subsp. arizonae (IIIa)26. No entanto, estes ainda foram resultados positivos válidos de acordo com as regras de interpretação dos resultados da LÂMPADA. Em nosso estudo colaborativo multi-laboratorial em alimentos para cães secos que envolveu 14 analistas19, amostras com resultados inconsistentes em corridas duplicadas de LÂMPADAs foram ocasionalmente observadas. Estas geralmente envolviam amostras com resultados positivos atrasados (Tmax > 15 min). Repetir ambas as corridas de forma independente geralmente resolveu o problema. Mais raramente, observamos amostras com valores corretos de Tm, mas não ou valoresmáximos Tirregulares (< 5 min). Isso geralmente era causado por bolhas de ar no tubo de reação.
Ao longo do ciclo de vida do desenvolvimento do método LAMP, avaliação, estudo pré-colaborativo e validação multi-laboratorial, observamos alta tolerância da LÂMPADA aos inibidores em diversos alimentos animais ou matrizes alimentares e mídia cultural4,19,22,23,24, destacando a robustez do método e colaborando inúmeros outros estudos em escala global8. Isso é superior em comparação com PCR ou PCR em tempo real, que geralmente requer um controle de amplificação interna para garantir que os resultados negativos não sejam devido à inibição matricial28. Além disso, lamp demonstrou especificidade e sensibilidade semelhantes (ou superiores) em comparação com PCR ou PCR em tempo real na grande maioria dos estudos8. O custo dos reagentes LAMP é de cerca de US $ 1 por reação. Os instrumentos LAMP utilizados neste protocolo são pequenos, de baixa manutenção e portáteis. Eles podem lidar com qualquer método de amplificação isoteérmica que emprega detecção de alvo por medição de fluorescência, lamp incluído. Usando o software LAMP, relatórios abrangentes podem ser gerados em vários formatos (pdf, texto e imagem).
A validação do método é um passo crítico antes que um novo método possa ser adotado para uso rotineiro. Vale ressaltar que o protocolo LAMP aqui relatado concluiu com sucesso a validação multi-laboratorial19. Com a recente incorporação deste protocolo LAMP no BAM Capítulo 5 Salmonella27da FDA dos EUA, espera-se que o método ganhe um uso muito mais amplo, tanto como um método de triagem rápida em alimentos animais quanto como um método de confirmação confiável para os presuntivos isolados salmonella de todas as categorias alimentares.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes. As opiniões expressas neste manuscrito são dos autores e não refletem necessariamente a política oficial do Departamento de Saúde e Serviços Humanos, da Administração de Alimentos e Medicamentos dos EUA ou do Governo dos EUA. A referência a quaisquer materiais comerciais, equipamentos ou processos não constitui de forma alguma aprovação, endosso ou recomendação da Food and Drug Administration.
Agradecimentos
Os autores agradecem aos membros do Subcomitê de Validação de Métodos de Microbiologia da FDA (MMVS) e do Bacteriological Analytical Manual (BAM) Council por revisar criticamente os estudos de validação do método Salmonella LAMP.
Materiais
| Name | Company | Catalog Number | Comments |
| Brain heart infusion (BHI) broth | BD Diagnostic Systems, Sparks, MD | 299070 | Liquid growth medium used in the cultivation of Salmonella. |
| Buffered peptone water (BPW) | BD Diagnostic Systems, Sparks, MD | 218105 | Preenrichment medium for the recovery of Salmonella from animal food samples. |
| DNA AWAY | Thermo Fisher Scientific, Waltham, MA | 7010 | Eliminates unwanted DNA and DNase from laboratory bench, glassware, and plasticware without affecting subsequent DNA samples. |
| Genie Explorer software | OptiGene Ltd., West Sussex, United Kingdom | Version 2.0.6.3 | Supports remote operation of Genie instruments including LAMP runs and data analysis. |
| Genie II or Genie III (LAMP instrument) | OptiGene Ltd., West Sussex, United Kingdom | GEN2-02 or GEN3-02 | A small instrument capable of temperature control up to 100 °C with ± 0.1 °C accuracy and simultaneous fluorescence detection via the FAM channel. Genie II has 2 blocks (A and B) with 8 samples in each block. Genie III has a single block that accommodates 8 samples. |
| Genie strip | OptiGene Ltd., West Sussex, United Kingdom | OP-0008 | 8-well microtube strips with integral locking caps and a working volume of 10 to 150 µl. |
| Genie strip holder | OptiGene Ltd., West Sussex, United Kingdom | GBLOCK | Used to hold Genie strips when setting up a LAMP reaction, the aluminum holder can also be used as a cool block. |
| Hydrochloric acid (HCl) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SA48-500 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Heat block | Thermo Fisher Scientific, Waltham, MA | 88-860-022 | Heats samples at 100 ± 1 oC for DNA extraction. |
| Incubator | Thermo Fisher Scientific, Waltham, MA | 3960 | Standard laboratory incubator. |
| ISO-001 isothermal master mix | OptiGene Ltd., West Sussex, United Kingdom | ISO-001 | An optimized master mix to simplify the assembly of a LAMP reaction, containing a strand-displacing GspSSD DNA polymerase large fragment from Geobacillus spp., thermostable inorganic pyrophosphatase, reaction buffer, MgSO4, dNTPs, and a double-stranded DNA binding dye (FAM detection channel). |
| Isopropanol | Thermo Fisher Scientific, Waltham, MA | A416 | Disinfects work surfaces. |
| LAMP primers | Integrated DNA Technologies Inc., Coralville, IA | Custom | LAMP primers with detailed information in Table 1. |
| Microcentrifuge | Eppendorf North America, Hauppauge, NY | 22620207 | MiniSpin plus personal microcentrifuge. |
| Microcentrifuge tubes | Thermo Fisher Scientific, Waltham, MA | 05-408-129 | Standard microcentrifuge tubes. |
| Molecular grade water | Thermo Fisher Scientific, Waltham, MA | AM9938 | Used in making primer stocks, primer mix, and LAMP reaction mix. |
| Sodium hydroxide (NaOH) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SS266-1 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Nonselective agar (e.g., blood agar, nutrient agar, and trypticase soy agar) | Thermo Fisher Scientific, Waltham, MA | R01202 | Solid growth medium used in the cultivation of Salmonella. |
| Peptone water | BD Diagnostic Systems, Sparks, MD | 218071 | Dilutes overnight Salmonella cultures to make positive control DNA. |
| Pipettes and tips | Mettler-Toledo Rainin LLC, Oakland CA | Pipet Lite LTS series | Standard laboratory pipettes and tips. |
| PrepMan Ultra sample preparation reagent | Thermo Fisher Scientific, Waltham, MA | 4318930 | A simple kit used for the rapid preparation of DNA templates for use in a LAMP reaction. |
| Salmonella reference strain LT2 | ATCC, Manassas, VA | 700720 | Salmonella reference strain used as positive control. |
| Trypticase soy broth (TSB) | BD Diagnostic Systems, Sparks, MD | 211768 | Liquid growth medium used in the cultivation of Salmonella. |
| Vortex mixer | Scientific Industries, Inc., Bohemia, NY | SI-0236 | Standard laboratory vortex mixer. |
| Whirl-pak filter bag | Nasco Sampling Brand, Fort Atkinson, WI | B01318 | Filter bags to hold animal food samples for preenrichment. |
Referências
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), 63(2000).
- Kaneko, H., Kawana, T., Fukushima, E., Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. Journal of Biochemical and Biophysical Methods. 70 (3), 499-501 (2007).
- Francois, P., et al. Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications. FEMS Immunology and Medical Microbiology. 62 (1), 41-48 (2011).
- Yang, Q., Wang, F., Prinyawiwatkul, W., Ge, B. Robustness of Salmonella loop-mediated isothermal amplification assays for food applications. Journal of Applied Microbiology. 116 (1), 81-88 (2014).
- Nagamine, K., Watanabe, K., Ohtsuka, K., Hase, T., Notomi, T. Loop-mediated isothermal amplification reaction using a nondenatured template. Clinical Chemistry. 47 (9), 1742-1743 (2001).
- Zhang, X., Lowe, S. B., Gooding, J. J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP). Biosensors & Bioelectronics. 61, 491-499 (2014).
- Nagamine, K., Hase, T., Notomi, T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and Cellular Probes. 16 (3), 223-229 (2002).
- Yang, Q., Domesle, K. J., Ge, B. Loop-mediated isothermal amplification for Salmonella detection in food and feed: Current applications and future directions. Foodborne Pathogens and Disease. 15 (6), 309-331 (2018).
- Mori, Y., Notomi, T. Loop-mediated isothermal amplification (LAMP): Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy. 26 (1), 13-17 (2020).
- Mansour, S. M., Ali, H., Chase, C. C., Cepica, A. Loop-mediated isothermal amplification for diagnosis of 18 World Organization for Animal Health (OIE) notifiable viral diseases of ruminants, swine and poultry. Animal Health Research Reviews. 16 (2), 89-106 (2015).
- Kumar, Y., Bansal, S., Jaiswal, P. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Comprehensive Reviews in Food Science and Food Safety. 16 (6), 1359-1378 (2017).
- WHO. The use of loop-mediated isothermal amplification (TB-LAMP) for the diagnosis of pulmonary tuberculosis: policy guidance. , Available from: http://www.who.int/tb/publications/lamp-diagnosis-molecular/en (2016).
- Kundapur, R. R., Nema, V. Loop-mediated isothermal amplification: Beyond microbial identification. Cogent Biology. 2, 1137110(2016).
- WHO. Salmonella (non-typhoidal) fact sheet. , Available from: http://www.who.int/mediacentre/factsheets/fs139/en (2018).
- FAO/WHO. Executive summary report of the joint FAO/WHO expert meeting on hazards associated with animal feed. , Available from: http://www.fao.org/3/a-az851e.pdf (2015).
- FDA. Compliance Policy Guide Sec. 690.800 Salmonella in Food for Animals. , Available from: https://www.fda.gov/downloads/iceci/compliancemanuals/compliancepolicyguidancemanual/ucm361105.pdf (2013).
- Bird, P., et al. Evaluation of the 3M molecular detection assay (MDA) 2 - Salmonella for the detection of Salmonella spp. in select foods and environmental surfaces: collaborative study, first action 2016.01. Journal of AOAC International. 99 (4), 980-997 (2016).
- D'Agostino, M., et al. Validation of a loop-mediated amplification/ISO 6579-based method for analysing soya meal for the presence of Salmonella enterica. Food Analytical Methods. 9 (11), 2979-2985 (2016).
- Ge, B., et al. Multi-laboratory validation of a loop-mediated isothermal amplification method for screening Salmonella in animal food. Frontiers in Microbiology. 10, 562(2019).
- D'Agostino, M., Diez-Valcarce, M., Robles, S., Losilla-Garcia, B., Cook, N. A loop-mediated isothermal amplification-based method for analysing animal feed for the presence of Salmonella. Food Analytical Methods. 8 (10), 2409-2416 (2015).
- Galan, J. E., Ginocchio, C., Costeas, P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of InvA to members of a new protein family. Journal of Bacteriology. 174 (13), 4338-4349 (1992).
- Chen, S., Wang, F., Beaulieu, J. C., Stein, R. E., Ge, B. Rapid detection of viable salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification. Applied and Environmental Microbiology. 77 (12), 4008-4016 (2011).
- Yang, Q., Chen, S., Ge, B. Detecting Salmonella serovars in shell eggs by loop-mediated isothermal amplification. Journal of Food Protection. 76 (10), 1790-1796 (2013).
- Yang, Q., et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection of Salmonella in produce. Food Microbiology. 46, 485-493 (2015).
- Yang, Q., Domesle, K. J., Wang, F., Ge, B. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time. BMC Microbiology. 16 (1), 112(2016).
- Domesle, K. J., Yang, Q., Hammack, T. S., Ge, B. Validation of a Salmonella loop-mediated isothermal amplification assay in animal food. International Journal of Food Microbiology. 264, 63-76 (2018).
- Andrews, W. H., Jacobson, A., Hammack, T. S. Bacteriological Analytical Manual. Chapter 5: Salmonella. , Available from: http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm070149.htm (2020).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados