Method Article
Amplificazione isotermica mediata ad anello per lo screening della Salmonella negli alimenti animali e conferma della Salmonella dall'isolamento della coltura
In questo articolo
Riepilogo
L'amplificazione isotermica mediata da loop (LAMP) è un test di amplificazione dell'acido nucleico isotermico (iNAAT) che ha attirato un ampio interesse nel campo del rilevamento degli agenti patogeni. Qui presentiamo un protocollo Salmonella LAMP convalidato in più laboratori come metodo rapido, affidabile e robusto per lo screening della Salmonella negli alimenti per animali e la conferma della Salmonella presuntiva dall'isolamento della coltura.
Abstract
L'amplificazione isotermica mediata ad anello (LAMP) è emersa come un potente test di amplificazione dell'acido nucleico per il rapido rilevamento di numerosi agenti batterici, fungini, parassiti e virali. La salmonella è un agente patogeno batterico di interesse mondiale per la sicurezza alimentare, compresi gli alimenti per animali. Qui è presentato un protocollo Salmonella LAMP convalidato da più laboratori che può essere utilizzato per migliorare rapidamente gli alimenti per animali per la presenza di contaminazione da Salmonella e può anche essere utilizzato per confermare presunti isolati di Salmonella recuperati da tutte le categorie alimentari. Il test LAMP si rivolge specificamente al gene di invasione della Salmonella (invA)ed è rapido, sensibile e altamente specifico. I DNA modello sono preparati con brodi di arricchimento di alimenti animali o colture pure di presunti isolati di Salmonella. La miscela di reagenti LAMP viene preparata combinando un mix di maestri isotermici, primer, modello di DNA e acqua. Il saggio LAMP funziona a una temperatura costante di 65 °C per 30 min. I risultati positivi sono monitorati tramite fluorescenza in tempo reale e possono essere rilevati già da 5 minuti. Il saggio LAMP mostra un'elevata tolleranza agli inibitori negli alimenti animali o nel mezzo di coltura, fungendo da metodo rapido, affidabile, robusto, economico e di facile utilizzo per lo screening e la conferma della Salmonella. Il metodo LAMP è stato recentemente incorporato nel Capitolo 5 del Manuale analitico batteriologico (BAM) della Food and Drug Administration degli Stati Uniti.
Introduzione
L'amplificazione isotermica mediata da loop (LAMP) è un nuovo test di amplificazione dell'acido nucleico isotermico (iNAAT) inventato nel 2000 da un gruppo di scienziatigiapponesi 1. Attraverso la formazione di una struttura del DNA ad anello stelo specifica del bersaglio durante le fasi iniziali, LAMP utilizza una DNA polimerasi che sposta il filamento per amplificare in modo efficiente questo materiale di partenza quasi esponenzialmente, con il risultato di10 9 copie di bersaglio in meno di 1 h1. Rispetto alla reazione a catena della polimerasi (PCR), un NAAT ampiamente utilizzato, LAMP possiede diversi vantaggi. In primo luogo, le reazioni LAMP vengono eseguite in condizioni isotermiche. Ciò ovvia alla necessità di un sofisticato strumento di ciclismo termico. In secondo luogo, LAMP è altamente tollerante ai mezzi di coltura e allesostanze biologiche 2 con robustezza dimostrata sia per applicazionicliniche che alimentari 3,4. Ciò semplifica la preparazione del campione e riduce al minimo i risultati falsi negativi5. In terzo luogo, LAMP è suscettibile a più piattaforme di rilevamento, come torbidità, colorimetria, bioluminescenza, fluorescenza e microfluidica6. In quarto luogo, LAMP è altamente specifico in quanto utilizza da quattro a sei primer appositamente progettati per indirizzare da sei a otto regionispecifiche 1,7. Quinto, LAMP è ultrasensibile e numerosi studi hanno riportato la sua sensibilità superiore alla PCR o al PCR 8 intempo reale. Infine, LAMP è più veloce con molti saggi che ora adottano un tempo di esecuzione standard di 30 minuti, mentre i test di tipo PCR di solito prendono 1−2 h8.
Queste caratteristiche interessanti hanno alimentato l'applicazione di LAMP in ampie aree di rilevamento di agenti patogeni, tra cui la diagnostica in vitro 9,la diagnosticadelle malattie animali 10e i testalimentari e ambientali 11. In particolare, un TB-LAMP (LAMP for Mycobacterium tuberculosis) è stato raccomandato dall'OMS come valido test sostitutivo per la microscopia a striscio di espettorato per diagnosi di tubercolosi polmonare in impostazioni periferiche12. L'applicazione LAMP si espande anche oltre l'identificazione microbica per includere il rilevamento di allergeni, specie animali, resistenza ai farmaci, organismi geneticamente modificati e pesticidi13.
La Salmonella non foidale è un agente patogeno zoonotico di notevole interesse per la sicurezza alimentare e la salute pubblica in tutto il mondo14. È stato anche identificato come un importante pericolo microbico negli alimenti per animali (cioè alimenti per animali)15,16. Per prevenire malattie/focolai di Salmonella da alimenti umani e alimenti animali contaminati, è imperativo disporre di metodi rapidi, affidabili e robusti per testare la Salmonella in una varietà di matrici. Nell'ultimo decennio, sono stati compiuti notevoli sforzi a livello internazionale per lo sviluppo e l'applicazione di saggi Salmonella LAMP in una vasta gamma di matrici alimentari, come recentemente riassunto in un'ampiarevisione 8. Diversi saggi Salmonella LAMP, tra cui quello qui presentato, hanno completato con successo la convalida multi-laboratorio seguendo le consolidate linee guida internazionali17,18,19,20.
Il nostro test Salmonella LAMP si rivolge specificamente al gene di invasione della Salmonella invA (GenBank numero di adesione M90846)21 ed è rapido, affidabile e robusto in più matricialimentari 4,22,23,24,25,26. Il metodo è stato convalidato in sei matrici di alimenti per animali in uno studio precollaborativo26 e nel cibo secco per cani in uno studio collaborativo multi-laboratorio19. Di conseguenza, il metodo Salmonella LAMP qui presentato è stato recentemente incorporato nel Manuale analitico batteriologico (BAM) della Food and Drug Administration (FDA) degli Stati Uniti (BAM) Capitolo 5 Salmonella27 per servire a due scopi, uno come metodo di screening rapido per la presenza di Salmonella negli alimenti animali e due come metodo di conferma affidabile per la Salmonella presuntiva isolata da tutti gli alimenti.
Protocollo
NOTA: Un mix di reazione LAMP contiene DNA polimerasi, tampone, MgSO4, dNTP, primer, modello di DNA e acqua. I primi quattro reagenti sono contenuti in un mix di maestri isotermici(Tabella dei materiali). I primer vengono premiscelati internamente per diventare un mix di primer (10x). I modelli di DNA possono essere preparati da brodi di arricchimento di campioni di alimenti per animali a scopo di screening o da colture di presunti isolati di Salmonella a scopo di conferma. Inoltre, un controllo positivo (DNA estratto da qualsiasi ceppi di riferimento di Salmonella, ad esempio Salmonella enterica serovar Typhimurium ATCC 19585 [LT2]) e un controllo senza modello (NTC; acqua sterile di grado molecolare) sono inclusi in ogni corsa LAMP.
1. Preparazione di modelli di DNA
- Per preparare modelli di DNA da arricchimenti di alimenti animali, segui questi passaggi.
- Pesare aseticamente 25 g di campione di alimenti per animali (ad esempio, cibo secco per gatti, cibo secco per cani, mangimi per bovini, mangimi per cavalli, mangimi per pollame e mangimi per suini) in un sacchetto filtrante sterile(tabella dei materiali)o equivalente. Posizionare il sacchetto in un grande contenitore o rack per il supporto durante l'incubazione.
- Aggiungere 225 mL di acqua peptone tamponata sterile (BPW). Mescolare bene girando e breve massaggio alle mani. Lasciare riposare a temperatura ambiente per 60 ± 5 minuti.
- Mescolare bene ruotando e determinare il pH con una carta di prova. Regolare il pH, se necessario, a 6,8 ± 0,2 con sterile 1 N NaOH o 1 N HCl. Incubare a 35 ± 2 °C per 24 ± 2 ore.
- Mescolare bene ruotando il sacchetto contenente brodi di arricchimento degli alimenti per animali. Trasferire 1 ml dal lato filtrato del sacchetto a un tubo di microcentrifugo. Vortice brevemente.
- Estrarre il DNA utilizzando un reagente per la preparazione delcampione (Tabella deimateriali) come segue.
- Centrifuga a 900 x g per 1 min per rimuovere particelle di grandi dimensioni e trasferire il supernatante su un nuovo tubo di microcentrifugo.
- Centrifuga a 16.000 x g per 2 min e scarta supernatante.
- Sospendere il pellet in 100 μL del reagente di preparazione del campione e riscaldare a 100 ± 1 °C per 10 minuti in un blocco di calore secco.
- Raffreddare a temperatura ambiente e conservare gli estratti di DNA campione a -20 °C.
- Per preparare modelli di DNA da presunte colture di Salmonella, seguire questi passaggi.
- Ottenere presunti isolati di Salmonella dall'isolamento della coltura in tutti gli alimenti a seguito della sezione D della SALMONELLA BAM Chapter 5 della FDA: Isolamento della Salmonella27.
- Inoculare la Salmonella presuntiva si isola su una piastra di agar non selezionabile (ad esempio, agar del sangue, agar nutriente e agar di soia triptatasi) e incubare a 35 ± 2 °C per 24 ± 2 ore.
- Trasferire diverse singole colonie a 5 mL di brodo di soia triptatasi (TSB) o brodo per infusione di cuore cerebrale (BHI) e incubare a 35 ± 2 °C per 16 ± 2 ore.
NOTA: Questo passaggio può essere facoltativo se la coltura presuntiva di Salmonella è pura. In tal caso, i modelli di DNA possono essere preparati sospendendo diverse singole colonie in 5 mL di TSB e riscaldando 500 μL della sospensione a 100 ± 1 °C per 10 minuti in un blocco di calore secco. Continua con il passaggio 5 qui sotto. - Trasferire 500 μL della coltura notturna in un tubo di microcentrifugo e riscaldare a 100 ± 1 °C per 10 minuti in un blocco di calore secco.
- Raffreddare a temperatura ambiente e conservare gli estratti di DNA isolati a -20 °C.
- Per preparare il DNA di controllo positivo, seguire passaggi simili a quanto sopra per preparare modelli di DNA da presunte colture di Salmonella con una fase di diluizione aggiuntiva.
- Inoculare S. Typhimurium ATCC 19585 (LT2) o qualsiasi ceppi di riferimento di Salmonella su una piastra di agar non selezionato (ad esempio, agar del sangue, agar nutriente e agar di soia triptatasi) e incubare a 35 ± 2 °C per 24 ± 2 ore.
- Trasferire diverse singole colonie a 5 mL di brodo TSB o BHI e incubare a 35 ± 2 °C per 16 ± 2 ore per raggiungere ~109 CFU/mL.
- Diluire serialmente la coltura notturna in acqua peptone allo 0,1% per ottenere ~ 107 CFU / mL.
- Trasferire 500 μL di questa diluizione in un tubo di microcentrifugo e riscaldare a 100 ± 1 °C per 10 minuti in un blocco di calore secco.
- Raffreddare a temperatura ambiente e conservare il DNA di controllo positivo a -20 °C.
2. Preparazione del mix di primer (10x)
- Ottenere primer LAMP sintetizzati commercialmente (Sal4-F3, Sal4-B3, Sal4-FIP, Sal4-BIP, Sal4-LF e Sal4-LB) con purificazione di dissalazione standard(tabella 1).
| Nome primer | Descrizione | Sequenza (5'-3') | Lunghezza (bp) |
| Sal4-F3 | Primer esterno in avanti | GAACGTGTCGCGGAAGTC | 18 |
| Sal4-B3 | Primer esterno all'indietro | CGGCAATAGCGTCACCTT | 18 |
| Sal4-FIP | Primer interno in avanti | GCGCGGCATCCGCATCAATA-TCTGGATGGTATGCCCGG | 38 |
| Sal4-BIP | Primer interno all'indietro | GCGAACGGCGAAGCGTACTG-TCGCACCGTCAAAGGAAC | 38 |
| Sal4-LF | Primer loop forward | TCAAATCGGCATCAATACTCA-TCTG | 25 |
| Sal4-LB | Primer loop all'indietro | AAAGGGAAAGCCAGCTTTACG | 21 |
Tabella 1: Primer LAMP per lo screening della Salmonella negli alimenti per animali e conferma della Salmonella dall'isolamento della coltura. I primer sono progettati sulla base della sequenza Salmonella invA (numero di adesione GenBank M90846).
- Preparare soluzioni stock di ogni primer (100 μM) reidratando il primer con una quantità appropriata di acqua sterile di grado molecolare. Mescolare bene con vortici per 10 s e conservare a -20 °C (-80 °C per lo stoccaggio a lungo termine).
- Preparare la miscela di primer (10x) in base a un foglio di lavoro(tabella 2). Aggiungere volumi appropriati di soluzioni di primer stock e acqua sterile di grado molecolare in un tubo di microcentrifugo. Mescolare bene tutti i reagenti vortice per 10 s.
| Componente | Conc. stock (μM) | Mix primer conc. | Volume (μL) |
| Primer Sal4-F3 | 100 | 1 | 10 |
| Primer Sal4-B3 | 100 | 1 | 10 |
| Primer Sal4-FIP | 100 | 18 | 180 |
| Primer Sal4-BIP | 100 | 18 | 180 |
| Primer Sal4-LF | 100 | 10 | 100 |
| Primer Sal4-LB | 100 | 10 | 100 |
| Acqua di grado molecolare | N/D | N/D | 420 |
| Totale | N/D | N/D | 1000 |
Tabella 2: Foglio di lavoro per la preparazione del mix di primer LAMP (10x). I primer sono elencati nella tabella 1.
- Aliquota la miscela di primer 10x a 500 μL per tubo di microcentrifugo e conservare a -20 °C.
3. Montaggio di una reazione LAMP
NOTA: Per prevenire la contaminazione incrociata, si consiglia vivamente di separare fisicamente le aree utilizzate per preparare il mix di master LAMP e aggiungere modelli di DNA. La figura 1 è un diagramma LAMP.
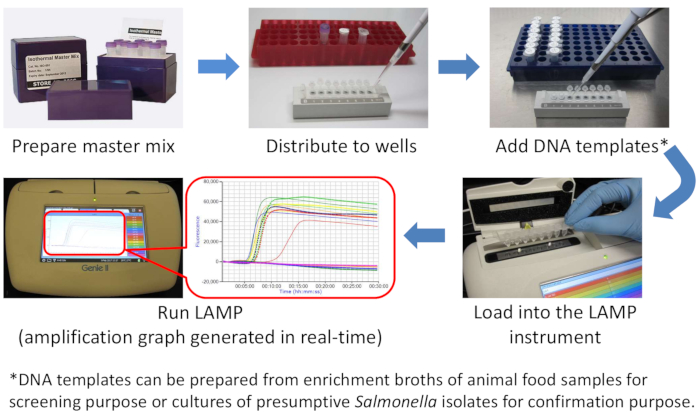
Figura 1: Diagramma schematico del flusso di lavoro Salmonella LAMP. Clicca qui per visualizzare una versione più grande di questa figura.
- Preparazione ed esecuzione del programma di installazione
- Panca pulita con isopropanolo e una soluzione degradante per DNA e DNasi(Tavolo dei Materiali). Pipette pulite e supporti per nastritubo(Table of Materials)con la soluzione degradante del DNA e della DNasi.
- Scongelare il mix di maestri isotermici, il mix di primer (10x), l'acqua di grado molecolare, il DNA di controllo positivo e i modelli di DNA a temperatura ambiente.
- Accendere lo strumento LAMP (Table of Materials) e toccare la schermata iniziale per accedere alla schermata iniziale. Seguire questa procedura per creare un'esecuzione.
NOTA: Un modello dello strumento LAMP ha 2 blocchi (A e B) con 8 campioni in ogni blocco e un altro modello ha un singolo blocco che può ospitare 8campioni (Tavolo dei Materiali).- Toccare LAMP+Ricottura e selezionare Modifica per immettere informazioni di esempio.
NOTA: Il profilo di esecuzione LAMP predefinito è costituito da amplificazione a 65 °C per 30 min e una fase ricottura da 98 °C a 80 °C con decremento di 0,05 °C al secondo. - Toccare ogni riga di esempio per attivare il cursore e immettere le informazioni di esempio pertinenti, utilizzando l'icona del blocco AB per passare da un blocco di strumenti LAMP all'altro.
- Toccare l'icona Controlla quando sono state immesse tutte le informazioni di esempio.
NOTA: facoltativamente, l'impostazione di esecuzione (chiamata "Profilo", che contiene informazioni di esempio insieme al profilo di esecuzione LAMP predefinito) può essere salvata per un uso successivo. Toccare l'icona Salva e assegnare al profilo un nome univoco. Quando si testa questo stesso set di campioni la prossima volta, è possibile avviare una nuova esecuzione utilizzando il profilo salvato. Toccare l'icona Cartella in basso a sinistra della schermata iniziale e selezionare Profilo per caricare i profili salvati.
- Toccare LAMP+Ricottura e selezionare Modifica per immettere informazioni di esempio.
- Gruppo di reazione LAMP
NOTA: Quando si utilizzano entrambi i blocchi di strumenti LAMP (A e B, per un totale di 16 campioni), preparare il mix master LAMP per 18 campioni. Se si utilizza un solo blocco di strumenti LAMP (8 campioni in totale), preparare il mix master LAMP per 10 campioni. Per altri numeri di campione, regolare il volume di conseguenza per adattarsi alla perdita di pipettazione. Includere sempre un controllo positivo e un NTC in ogni esecuzione LAMP. Si consiglia il test duplicato di ogni campione in esecuzioni LAMP indipendenti.- Preparare il master mix LAMP in base a un foglio di lavoro (Tabella 3). Aggiungere i volumi appropriati del mix di master isotermico, della miscela di primer e dell'acqua di grado molecolare in un tubo di microcentrifugo e vortice delicatamente per 3 s. Centrifugare brevemente.
- Posizionare la striscia del tubo nel supporto del nastro e distribuire 23 μL della miscela master LAMP ad ogni pozzo.
- Vortice tutti i modelli di DNA e centrifuga brevemente. Aggiungere 2 μL di modello di DNA al pozzo appropriato e cappuccio strettamente.
- Rimuovere la striscia del tubo dal supporto e scorrere il polso per assicurarsi che tutti i reagenti si siano raggruppati nella parte inferiore del tubo.
- Caricare la striscia del tubo nei blocchi dello strumento LAMP, assicurando che i tappi siano sicuri prima di chiudere il coperchio.
| Componente | Lavoro conc. | Reazione finale conc. | Volume per campione (μL) | Volume per 18 campioni (μL) | Volume per 10 campioni (μL) |
| Mix master isotermico ISO-001 | 1,67x | 1x | 15 | 270 | 150 |
| Mix primer | 30: | 1x | 2.5 | 45 | 25 |
| Acqua di grado molecolare | N/D | N/D | 5.5 | 99 | 55 |
| Totale parziale mix master | N/D | N/D | 23 | 414 | 230 |
| Modello DNA | N/D | N/D | 2 | N/D | N/D |
Tabella 3: Foglio di lavoro per la preparazione del mix di reazioni LAMP. La miscela di primer (10x) è preparata secondo la tabella 2 utilizzando soluzioni stock di primer elencate nella tabella 1.
4. CORSA LAMP
NOTA: Durante una corsa LAMP, le letture di fluorescenza vengono acquisite utilizzando il canale FAM. I valori da tempo a picco (Tmax; min) sono determinati automaticamente dallo strumento per il punto di tempo in cui il rapporto di fluorescenza raggiunge il valore massimo della curva della velocità di amplificazione. Il Tm (°C) è la temperatura di fusione/ricottura del prodotto finale amplificato.
- Fare clic sull'icona Esegui in alto a destra dello schermo e selezionare i blocchi contenenti strisce tubole per avviare l'esecuzione lamp.
- Facoltativamente, mentre la reazione è in corso, toccare le schede Temperatura, Amplificazione e Ricottura per visualizzare le modifiche dinamiche di vari parametri durante l'esecuzione lamp.
- Una volta completata l'esecuzione, toccare le schede Amplificazione e Ricottura per visualizzare le curve complete di amplificazione e ricottura e toccare la scheda Risultati per visualizzare i risultati.
- Facoltativamente, per la registrazione, registrare il numero di esecuzione situato in alto a sinistra dello schermo, utilizzando il formato "numero di number_run seriale dello strumento", ad esempio "GEN2-2209_0030".
5. Interpretazione dei risultati lamp
NOTA: I risultati della LAMPADA possono essere visualizzati direttamente sul quadro strumenti LAMP e/o utilizzando un software LAMP(Table of Materials).
- Per interpretare i risultati LAMP sul quadro strumenti, attenersi alla seguente procedura.
- Toccare l'icona Cartella in basso a sinistra della schermata iniziale e selezionare Registra per passare al percorso del file per caricare l'esecuzione lamp di interesse.
NOTA: Le corse LAMP sono organizzate per data, a partire dall'anno. - Osservare le cinque schede associate a ciascuna esecuzione: Profile, Temperature, Amplification, Anneale Results.
NOTA: Le schede Profilo e Temperatura mostrano rispettivamente le temperature programmate ed effettive nei pozzi campione man mano che la reazione LAMP procede. Le schede Amplificazione e Ricottura mostrano letture di fluorescenza e cambiamenti nella fluorescenza rispettivamente durante le fasi di amplificazione e ricottura. Nella scheda Risultati viene visualizzata una visualizzazione tabulare dei risultati LAMP. - Toccare la scheda Risultati per osservare i risultati LAMP per ogni pozzo.
NOTA: Ci sono tre colonne (Pozzo, Amplificazione e Ricottura). La colonna "Amplificazione" mostra i valori da tempo a picco (Tmax; min:sec) per ogni campione ("Pozzo") e la colonna "Ricottura" mostra le temperature di fusione/ricottura (Tm; °C) per qualsiasi prodotto amplificato in quel pozzo. - Interpretare i risultati lamp e segnalare i risultati finali di LAMP come segue.
- Esaminare prima i pozzi di controllo. Il pozzo NTC dovrebbe avere Tmax vuoto mentre T mpuò essere vuoto (entrambi i modelli di strumenti LAMP) o < 83 °C (solo per il modello di strumento LAMP con due blocchi). Il pozzo di controllo positivo dovrebbe avere Tmax tra 5 e 10 min e Tm intorno a 90 °C.
- Esaminare i pozzi campione. Tutti i campioni con il Tm corretto (circa 90 °C) e T max (tra 5−30 min) sono considerati positivi per salmonella.
- Segnalare i risultati finali di LAMP in base ai risultati di esecuzioni duplicate. Se le esecuzioni duplicate hanno risultati coerenti, è possibile riportare i risultati finali di LAMP. Se le esecuzioni duplicate non sono coerenti, ripetere entrambe le esecuzioni in modo indipendente. Se i risultati sono ancora incoerenti, il campione dovrebbe essere considerato presunto positivo per la Salmonella e dovrà passare attraverso la conferma della coltura.
- Toccare l'icona Cartella in basso a sinistra della schermata iniziale e selezionare Registra per passare al percorso del file per caricare l'esecuzione lamp di interesse.
- Per interpretare i risultati LAMP utilizzando il software, attenersi alla seguente procedura.
- Fate clic sull'icona Computer sul pannello sinistro e spostate verso il percorso del file per caricare l'esecuzione lamp di interesse.
NOTA: Il computer con il software installato non deve essere collegato allo strumento LAMP per analizzare i risultati lamp, cioè è disponibile l'accesso remoto. Le corse LAMP sono organizzate per data. - Osservare le sette schede associate a ciascuna esecuzione: Profile, Temperature, Amplification, Amplification Rate, Anneal, Anneal Derivativee Result.
NOTA: Analogamente alla vista del quadro strumenti, le schede Profilo e Temperatura mostrano, rispettivamente, le temperature programmate ed effettive nei pozzi del campione, mentre la reazione LAMP procede. Le schede Amplificazione/Amplificazionee Derivata Ricottura/DerivataRicottura mostrano letture di fluorescenza o cambiamenti nella fluorescenza rispettivamente durante le fasi di amplificazione e ricottura. La scheda Risultati mostra una vista tabulare dei risultati LAMP che differiscono leggermente dalla vista del quadro strumenti. - Toccare la scheda Frequenza amplificazione per visualizzare una visualizzazione grafica dei rapporti di fluorescenza in base al tempo. Fare clic sull'icona Impostazione in alto a destra dello schermo e regolare il "Peak Detection Threshold Ratio" da 0,020 a 0,010.
NOTA: La regolazione è necessaria per garantire che tutti i picchi validi siano identificati e che i risultati ottenuti utilizzando il software corrispondano a quelli visualizzati sul quadro strumenti. - Toccare la scheda Risultato per osservare i risultati LAMP per ogni pozzo.
NOTA: sono disponibili quattro colonne (Nome grafico, Numero pozzo, Nome pozzo e Valore massimo). La parte superiore della colonna "Valore picco" mostra "Amp Time" (Tmax; min:sec) per ogni campione ("Well Name") mentre la parte inferiore mostra "Derivata ricottura" (Tm; °C) per qualsiasi prodotto amplificato in quel pozzo. - Interpretare i risultati LAMP e segnalare i risultati finali di LAMP seguendo passaggi simili a quelli dell'utilizzo del quadro strumenti con una sola eccezione che il pozzo NTC e altri campioni negativi dovrebbero avere Tm vuoto poiché le impostazioni del software LAMP eliminano quei risultati Tm < 83 °C. Allo stesso modo, tutti i campioni con Tm corretto (circa 90 °C) e Tmax (tra 5−30 min) sono considerati positivi per salmonella.
- Fate clic sull'icona Computer sul pannello sinistro e spostate verso il percorso del file per caricare l'esecuzione lamp di interesse.
Risultati
La figura 2 e la figura 3 mostrano grafici/tabelle LAMP rappresentativi visualizzati su entrambe le piattaforme. In questa corsa LAMP, i campioni da S1 a S6 sono diluizioni seriali 10 volte di S. enterica serovar Infantis ATCC 51741 che vanno da 1,1 x 106 CFU a 11 CFU per reazione. Il controllo positivo è S. enterica serovar Typhimurium ATCC 19585 (LT2) a 1,7 x 104 CFU per reazione e NTC è acqua di grado molecolare.
Come illustrato nella figura 2E e nella figura 3G, sia i pozzi NTC che PC sono controlli validi. Il pozzo NTC ha Tmax vuoto mentre Tm è < 83 °C sul quadro strumenti LAMP e vuoto nel software LAMP, suggerendo un risultato negativo. Il PC ha T max di 7 min 45 sec e T m di ~ 90 °C su entrambe le piattaforme, suggerendo un risultato positivo. I campioni da S1 a S6 hanno Tmax tra 6 min 30 sec e 12 min 15 sec, tutti positivialla Salmonella.
A seguito di esecuzioni duplicate dello stesso set di campioni, vengono riportati i risultati finali di LAMP per questi campioni. Questa corsa LAMP rappresentativa mostra che LAMP rileva con successo salmonella con un'ampia gamma di concentrazioni nei campioni.

Figura 2: Risultati LAMP rappresentativi visualizzati sul quadro strumenti LAMP. (A) La scheda Profilo mostra il profilo di temperatura programmato. (B) La scheda Temperatura mostra le temperature effettive nei pozzi del campione mentre procede la reazione LAMP. (C) La scheda Amplificazione mostra le letture di fluorescenza durante l'amplificazione LAMP. (D) La scheda Ricottura mostra cambiamenti nella fluorescenza (derivata) durante la fase ricottura. (E) Nella scheda Risultati viene visualizzata una visualizzazione tabellare dei risultati lamp. Clicca qui per visualizzare una versione più grande di questa figura.
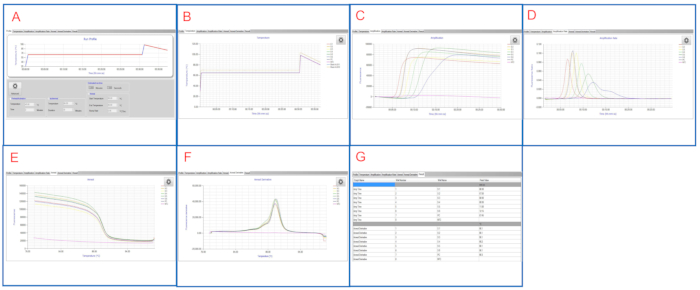
Figura 3: Risultati LAMP rappresentativi visualizzati nel software LAMP. (A) La scheda Profilo mostra il profilo di temperatura programmato. (B) La scheda Temperatura mostra le temperature effettive nei pozzi del campione mentre procede la reazione LAMP. (C) La scheda Amplificazione mostra le letture di fluorescenza durante l'amplificazione LAMP. (D) La scheda Velocità di amplificazione mostra variazioni della fluorescenza (rapporto di fluorescenza) durante l'amplificazione lamp. (E) La scheda Ricottura mostra le letture di fluorescenza durante la fase di ricottura. (F) La scheda Derivata ricottura mostra le variazioni della fluorescenza (derivata) durante la fase ricottura. (G) Nella scheda Risultato viene visualizzata una visualizzazione tabellare dei risultati lamp. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo presentato qui un metodo LAMP semplice, rapido, specifico e sensibile per lo screening e la conferma della Salmonella negli alimenti animali e nella coltura pura, rispettivamente. Con la comodità di un mix master isotermico che contiene quattro reagenti chiave e un mix di primer pronto all'uso preparato internamente, l'assemblaggio di una reazione LAMP richiede solo pochi passaggi di pipettaggio(Figura 1). Il tempo totale di esecuzione, comprese le fasi di amplificazione e ricottura, è inferiore a 38 minuti(figura 2A, B e figura 3A,B). I risultati positivi sono monitorati tramite fluorescenza in tempo reale(Figura 2C e Figura 3C,D) e possono essere rilevati già a 5 min26. La fase ricottura serve come ulteriore conferma della specificità lamp poiché solo i campioni con Tm corretto(circa 90 °C) sono riportati come positivi(Figura 2D, E e Figura 3E−G). In precedenza sono state segnalate sensibilità di 1 cellula salmonella in coltura pura e < 1 CFU/25 g negli alimenti per animali26.
Poiché LAMP è abbastanza efficace e genera una grande quantità di DNA1, è fondamentale che le migliori pratiche di laboratorio siano utilizzate per prevenire la contaminazione incrociata, che può includere la separazione fisica delle aree per la preparazione del mix principale LAMP e l'aggiunta di modelli di DNA, evitando di generare aerosol, utilizzando punte di pipetta filtrante, cambiando spesso i guanti e astenendosi dall'aprire i tubi di reazione LAMP dopo l'amplificazione.
La specificità di questo metodo Salmonella LAMP è stata precedentemente testata utilizzando 300 ceppi batterici (247 Salmonella di 185 sierovar e 53 nonSalmonella)e ha dimostrato di essere specifica al 100%26. In particolare, sono state osservate differenze significative nella Tmax tra le due specie di Salmonella, S. enterica e Salmonella bongori, e tra le sottospecie di S. enterica, in particolare la sottosp. Tuttavia, questi erano ancora validi risultati positivi secondo le regole per l'interpretazione dei risultati LAMP. Nel nostro studio collaborativo multi-laboratorio sul cibo secco per cani che ha coinvolto 14analisti 19, sono stati occasionalmente osservati campioni con risultati incoerenti in esecuzioni LAMP duplicate. Questi di solito riguardavano campioni con risultati positiviritardati (Tmax > 15 min). Ripetere entrambe le esecuzioni in modo indipendente di solito risolveva il problema. Più raramente, abbiamo osservato campioni con valori Tm correttima senza valori massimi Tirregolari (< 5 min). Questo di solito era causato da bolle d'aria nel tubo di reazione.
Durante tutto il ciclo di vita dello sviluppo del metodo LAMP, della valutazione, dello studio precollaborativo e della convalida multi-laboratorio, abbiamo osservato un'elevata tolleranza di LAMP agli inibitori in varie matrici animali o alimentari e mezzi dicoltura 4,19,22,23,24,evidenziando la robustezza del metodo e collaborando a numerosi altri studi su scala globale8. Questo è superiore rispetto alla PCR o alla PCR in tempo reale, che di solito richiede un controllo interno dell'amplificazione per garantire che i risultati negativi non siano dovuti all'inibizione dellamatrice 28. Inoltre, LAMP ha dimostrato una specificità e una sensibilità simili (o superiori) rispetto alla PCR o alla PCR in tempo reale nella stragrande maggioranza degli studi8. Il costo dei reagenti LAMP è di circa $ 1 per reazione. Gli strumenti LAMP utilizzati in questo protocollo sono piccoli, a bassa manutenzione e portatili. Sono in grado di gestire qualsiasi metodo di amplificazione isotermica che utilizza il rilevamento del bersaglio mediante misurazione della fluorescenza, LAMP incluso. Utilizzando il software LAMP, è possibile generare report completi in più formati (pdf, testo e immagine).
La convalida del metodo è un passaggio critico prima che un nuovo metodo possa essere adottato per l'uso di routine. È da notare che il protocollo LAMP qui riportato ha completato con successo la convalida multi-laboratorio19. Con la recente incorporazione di questo protocollo LAMP nel BAM Chapter 5 Salmonella27della FDA degli Stati Uniti, si prevede che il metodo o guadagnerà un uso molto più ampio, sia come metodo di screening rapido negli alimenti animali che come metodo di conferma affidabile per presunti isolati di Salmonella da tutte le categorie alimentari.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti. Le opinioni espresse in questo manoscritto sono quelle degli autori e non riflettono necessariamente la politica ufficiale del Dipartimento della Salute e dei Servizi Umani, della Food and Drug Administration degli Stati Uniti o del Governo degli Stati Uniti. Il riferimento a qualsiasi materiale, attrezzatura o processo commerciale non costituisce in alcun modo approvazione, approvazione o raccomandazione da parte della Food and Drug Administration.
Riconoscimenti
Gli autori ringraziano i membri del Microbiology Methods Validation Subcommittee (MMVS) della FDA e del Bacteriological Analytical Manual (BAM) Council per aver esaminato criticamente gli studi di convalida del metodo Salmonella LAMP.
Materiali
| Name | Company | Catalog Number | Comments |
| Brain heart infusion (BHI) broth | BD Diagnostic Systems, Sparks, MD | 299070 | Liquid growth medium used in the cultivation of Salmonella. |
| Buffered peptone water (BPW) | BD Diagnostic Systems, Sparks, MD | 218105 | Preenrichment medium for the recovery of Salmonella from animal food samples. |
| DNA AWAY | Thermo Fisher Scientific, Waltham, MA | 7010 | Eliminates unwanted DNA and DNase from laboratory bench, glassware, and plasticware without affecting subsequent DNA samples. |
| Genie Explorer software | OptiGene Ltd., West Sussex, United Kingdom | Version 2.0.6.3 | Supports remote operation of Genie instruments including LAMP runs and data analysis. |
| Genie II or Genie III (LAMP instrument) | OptiGene Ltd., West Sussex, United Kingdom | GEN2-02 or GEN3-02 | A small instrument capable of temperature control up to 100 °C with ± 0.1 °C accuracy and simultaneous fluorescence detection via the FAM channel. Genie II has 2 blocks (A and B) with 8 samples in each block. Genie III has a single block that accommodates 8 samples. |
| Genie strip | OptiGene Ltd., West Sussex, United Kingdom | OP-0008 | 8-well microtube strips with integral locking caps and a working volume of 10 to 150 µl. |
| Genie strip holder | OptiGene Ltd., West Sussex, United Kingdom | GBLOCK | Used to hold Genie strips when setting up a LAMP reaction, the aluminum holder can also be used as a cool block. |
| Hydrochloric acid (HCl) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SA48-500 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Heat block | Thermo Fisher Scientific, Waltham, MA | 88-860-022 | Heats samples at 100 ± 1 oC for DNA extraction. |
| Incubator | Thermo Fisher Scientific, Waltham, MA | 3960 | Standard laboratory incubator. |
| ISO-001 isothermal master mix | OptiGene Ltd., West Sussex, United Kingdom | ISO-001 | An optimized master mix to simplify the assembly of a LAMP reaction, containing a strand-displacing GspSSD DNA polymerase large fragment from Geobacillus spp., thermostable inorganic pyrophosphatase, reaction buffer, MgSO4, dNTPs, and a double-stranded DNA binding dye (FAM detection channel). |
| Isopropanol | Thermo Fisher Scientific, Waltham, MA | A416 | Disinfects work surfaces. |
| LAMP primers | Integrated DNA Technologies Inc., Coralville, IA | Custom | LAMP primers with detailed information in Table 1. |
| Microcentrifuge | Eppendorf North America, Hauppauge, NY | 22620207 | MiniSpin plus personal microcentrifuge. |
| Microcentrifuge tubes | Thermo Fisher Scientific, Waltham, MA | 05-408-129 | Standard microcentrifuge tubes. |
| Molecular grade water | Thermo Fisher Scientific, Waltham, MA | AM9938 | Used in making primer stocks, primer mix, and LAMP reaction mix. |
| Sodium hydroxide (NaOH) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SS266-1 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Nonselective agar (e.g., blood agar, nutrient agar, and trypticase soy agar) | Thermo Fisher Scientific, Waltham, MA | R01202 | Solid growth medium used in the cultivation of Salmonella. |
| Peptone water | BD Diagnostic Systems, Sparks, MD | 218071 | Dilutes overnight Salmonella cultures to make positive control DNA. |
| Pipettes and tips | Mettler-Toledo Rainin LLC, Oakland CA | Pipet Lite LTS series | Standard laboratory pipettes and tips. |
| PrepMan Ultra sample preparation reagent | Thermo Fisher Scientific, Waltham, MA | 4318930 | A simple kit used for the rapid preparation of DNA templates for use in a LAMP reaction. |
| Salmonella reference strain LT2 | ATCC, Manassas, VA | 700720 | Salmonella reference strain used as positive control. |
| Trypticase soy broth (TSB) | BD Diagnostic Systems, Sparks, MD | 211768 | Liquid growth medium used in the cultivation of Salmonella. |
| Vortex mixer | Scientific Industries, Inc., Bohemia, NY | SI-0236 | Standard laboratory vortex mixer. |
| Whirl-pak filter bag | Nasco Sampling Brand, Fort Atkinson, WI | B01318 | Filter bags to hold animal food samples for preenrichment. |
Riferimenti
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), 63(2000).
- Kaneko, H., Kawana, T., Fukushima, E., Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. Journal of Biochemical and Biophysical Methods. 70 (3), 499-501 (2007).
- Francois, P., et al. Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications. FEMS Immunology and Medical Microbiology. 62 (1), 41-48 (2011).
- Yang, Q., Wang, F., Prinyawiwatkul, W., Ge, B. Robustness of Salmonella loop-mediated isothermal amplification assays for food applications. Journal of Applied Microbiology. 116 (1), 81-88 (2014).
- Nagamine, K., Watanabe, K., Ohtsuka, K., Hase, T., Notomi, T. Loop-mediated isothermal amplification reaction using a nondenatured template. Clinical Chemistry. 47 (9), 1742-1743 (2001).
- Zhang, X., Lowe, S. B., Gooding, J. J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP). Biosensors & Bioelectronics. 61, 491-499 (2014).
- Nagamine, K., Hase, T., Notomi, T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and Cellular Probes. 16 (3), 223-229 (2002).
- Yang, Q., Domesle, K. J., Ge, B. Loop-mediated isothermal amplification for Salmonella detection in food and feed: Current applications and future directions. Foodborne Pathogens and Disease. 15 (6), 309-331 (2018).
- Mori, Y., Notomi, T. Loop-mediated isothermal amplification (LAMP): Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy. 26 (1), 13-17 (2020).
- Mansour, S. M., Ali, H., Chase, C. C., Cepica, A. Loop-mediated isothermal amplification for diagnosis of 18 World Organization for Animal Health (OIE) notifiable viral diseases of ruminants, swine and poultry. Animal Health Research Reviews. 16 (2), 89-106 (2015).
- Kumar, Y., Bansal, S., Jaiswal, P. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Comprehensive Reviews in Food Science and Food Safety. 16 (6), 1359-1378 (2017).
- WHO. The use of loop-mediated isothermal amplification (TB-LAMP) for the diagnosis of pulmonary tuberculosis: policy guidance. , Available from: http://www.who.int/tb/publications/lamp-diagnosis-molecular/en (2016).
- Kundapur, R. R., Nema, V. Loop-mediated isothermal amplification: Beyond microbial identification. Cogent Biology. 2, 1137110(2016).
- WHO. Salmonella (non-typhoidal) fact sheet. , Available from: http://www.who.int/mediacentre/factsheets/fs139/en (2018).
- FAO/WHO. Executive summary report of the joint FAO/WHO expert meeting on hazards associated with animal feed. , Available from: http://www.fao.org/3/a-az851e.pdf (2015).
- FDA. Compliance Policy Guide Sec. 690.800 Salmonella in Food for Animals. , Available from: https://www.fda.gov/downloads/iceci/compliancemanuals/compliancepolicyguidancemanual/ucm361105.pdf (2013).
- Bird, P., et al. Evaluation of the 3M molecular detection assay (MDA) 2 - Salmonella for the detection of Salmonella spp. in select foods and environmental surfaces: collaborative study, first action 2016.01. Journal of AOAC International. 99 (4), 980-997 (2016).
- D'Agostino, M., et al. Validation of a loop-mediated amplification/ISO 6579-based method for analysing soya meal for the presence of Salmonella enterica. Food Analytical Methods. 9 (11), 2979-2985 (2016).
- Ge, B., et al. Multi-laboratory validation of a loop-mediated isothermal amplification method for screening Salmonella in animal food. Frontiers in Microbiology. 10, 562(2019).
- D'Agostino, M., Diez-Valcarce, M., Robles, S., Losilla-Garcia, B., Cook, N. A loop-mediated isothermal amplification-based method for analysing animal feed for the presence of Salmonella. Food Analytical Methods. 8 (10), 2409-2416 (2015).
- Galan, J. E., Ginocchio, C., Costeas, P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of InvA to members of a new protein family. Journal of Bacteriology. 174 (13), 4338-4349 (1992).
- Chen, S., Wang, F., Beaulieu, J. C., Stein, R. E., Ge, B. Rapid detection of viable salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification. Applied and Environmental Microbiology. 77 (12), 4008-4016 (2011).
- Yang, Q., Chen, S., Ge, B. Detecting Salmonella serovars in shell eggs by loop-mediated isothermal amplification. Journal of Food Protection. 76 (10), 1790-1796 (2013).
- Yang, Q., et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection of Salmonella in produce. Food Microbiology. 46, 485-493 (2015).
- Yang, Q., Domesle, K. J., Wang, F., Ge, B. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time. BMC Microbiology. 16 (1), 112(2016).
- Domesle, K. J., Yang, Q., Hammack, T. S., Ge, B. Validation of a Salmonella loop-mediated isothermal amplification assay in animal food. International Journal of Food Microbiology. 264, 63-76 (2018).
- Andrews, W. H., Jacobson, A., Hammack, T. S. Bacteriological Analytical Manual. Chapter 5: Salmonella. , Available from: http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm070149.htm (2020).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon