Method Article
Loop-vermittelte isotherme Amplifikation zum Screening von Salmonellen in Tierfutter und Bestätigung von Salmonellen aus der Kulturisolierung
In diesem Artikel
Zusammenfassung
Loop-vermittelte isotherme Amplifikation (LAMP) ist ein isothermer Nukleinsäure-Amplifikationstest (iNAAT), der ein breites Interesse am Nachweisvon Erreger geweckt hat. Hier präsentieren wir ein multilaboriertes Salmonella LAMP-Protokoll als schnelle, zuverlässige und robuste Methode zum Screening von Salmonellen in Tierfutter und zur Bestätigung mutmaßlicher Salmonellen aus der Kulturisolierung.
Zusammenfassung
Loop-vermittelte isotherme Amplifikation (LAMP) hat sich als leistungsstarker Nukleinsäure-Amplifikationstest für den schnellen Nachweis zahlreicher bakterieller, Pilz-, Parasit- und Virusmittel herausgebildet. Salmonellen sind ein bakterieller Erreger, der weltweit für Lebensmittelsicherheit von Bedeutung ist, einschließlich Lebensmitteln für Tiere. Hier wird ein multilaboriertes Salmonella-LAMP-Protokoll vorgestellt, das verwendet werden kann, um Tiernahrung schnell auf das Vorhandensein von Salmonellenkontamination zu untersuchen, und kann auch verwendet werden, um mutmaßliche Salmonellenisolate zu bestätigen, die aus allen Lebensmittelkategorien gewonnen wurden. Der LAMP-Assay zielt speziell auf das Salmonella-Invasionsgen (invA) ab und ist schnell, empfindlich und hochspezifisch. Template DNAs werden aus Anreicherungsbrühen von Tierfutter oder reinen Kulturen von mutmaßlichen Salmonellenisolaten hergestellt. Die LAMP-Reagenzmischung wird durch die Kombination eines isothermen Master-Mixes, Primer, DNA-Schablone und Wasser hergestellt. Der LAMP-Assay läuft bei einer konstanten Temperatur von 65 °C für 30 min. Positive Ergebnisse werden über Echtzeitfluoreszenz überwacht und können bereits nach 5 min nachgewiesen werden. Der LAMP-Test weist eine hohe Toleranz gegenüber Inhibitoren in tierischen Lebensmitteln oder Kulturmedien auf und dient als schnelle, zuverlässige, robuste, kostengünstige und benutzerfreundliche Methode zum Screening und zur Bestätigung von Salmonellen. Die LAMP-Methode wurde vor kurzem in das Kapitel 5 der U.S. Food and Drug Administration es Bacteriological Analytical Manual (BAM) aufgenommen.
Einleitung
Loop-mediale isotherme Amplifikation (LAMP) ist ein neuartiger isothermaler Nukleinsäure-Amplifikationstest (iNAAT), der im Jahr 2000 von einer Gruppe japanischer Wissenschaftler erfunden wurde1. Durch die Bildung einer zielspezifischen Stammschleifen-DNA-Struktur in den ersten Schritten verwendet LAMP eine Strang-verdrängende DNA-Polymerase, um dieses Ausgangsmaterial quasi-exponentiell effizient zu verstärken, was zu 109 Kopien des Ziels in weniger als 1 h1führt. Im Vergleich zur Polymerase-Kettenreaktion (PCR), einem weit verbreiteten NAAT, hat LAMP mehrere Vorteile. Zunächst werden LAMP-Reaktionen unter isothermen Bedingungen durchgeführt. Dies ermuntert die Notwendigkeit eines ausgeklügelten thermischen Fahrradinstruments. Zweitens ist LAMP sehr tolerant gegenüber Kulturmedien und biologischen Substanzen2 mit Robustheit, die sowohl für klinische als auch für Lebensmittelanwendungen nachgewiesen wird3,4. Dies vereinfacht die Probenvorbereitung und minimiert falsche negative Ergebnisse5. Drittens ist LAMP für mehrere Detektionsplattformen wie Trübung, Colorimetrie, Biolumineszenz, Fluoreszenz und Mikrofluidik6zugänglich. Viertens ist LAMP sehr spezifisch, da es vier bis sechs speziell entwickelte Primer verwendet, um sechs bis acht spezifische Regionen1,7anzuvisieren. Fünftens ist LAMP ultrasensibel und zahlreiche Studien haben seine überlegene Empfindlichkeit gegenüber PCR oder Echtzeit-PCR8berichtet. Schließlich ist LAMP schneller mit vielen Assays, die jetzt eine Standardlaufzeit von 30 min anwenden, während PCR-Assays in der Regel 1-2 h8dauern.
Diese attraktiven Eigenschaften befeuerten die Anwendung von LAMP in breiten Bereichen der Pathogenerkennung, einschließlich der In-vitro-Diagnostik 9, der Tierseuchendiagnostik10und der Lebensmittel- und Umwelttests11. Insbesondere wurde eine TB-LAMP (LAMP for Mycobacterium tuberculosis) von der WHO als gültiger Ersatztest für die Sputum-Abstrichmikroskopie für Lungentuberkulose-Diagnosen in peripheren Umgebungen empfohlen12. Die LAMP-Anwendung erstreckt sich auch über die mikrobielle Identifizierung hinaus und umfasst den Nachweis von Allergenen, Tierarten, Arzneimittelresistenzen, genetisch veränderten Organismen und Pestiziden13.
Nontyphoidal Salmonella ist ein zoonotischer Erreger von erheblichem Lebensmittelsicherheit und öffentlicher Gesundheit weltweit14. Es wurde auch als eine wichtige mikrobielle Gefahr in Lebensmitteln für Tiere (d. h. Tierfutter)15,16identifiziert. Um Salmonellenkrankheiten/Ausbrüche durch kontaminierte menschliche und tierische Lebensmittel zu verhindern, ist es unerlässlich, schnelle, zuverlässige und robuste Methoden zur Prüfung von Salmonellen in einer Vielzahl von Matrizen zu haben. In den letzten zehn Jahren wurden international erhebliche Anstrengungen zur Entwicklung und Anwendung von Salmonella LAMP-Assays in einer breiten Palette von Lebensmittelmatrizen unternommen, wie kürzlich in einem ausführlichenBerichtzusammengefasst 8 . Mehrere Salmonella LAMP-Assays, darunter die hier vorgestellte, haben die Multilabor-Validierung nach etablierten internationalen Richtlinien17,18,19,20erfolgreich abgeschlossen.
Unser Salmonella LAMP-Test zielt speziell auf das Salmonella-Invasionsgen invA (GenBank-Beitrittsnummer M90846)21 ab und ist schnell, zuverlässig und robust in mehreren Lebensmittelmatrizen4,22,23,24,25,26. Die Methode wurde in sechs Tiernahrungsmatrizen in einer vorgemeinschaftlichen Studie26 und in trockener Hundefutter in einer Multilabor-Kollaborationsstudie19validiert. Infolgedessen wurde die hier vorgestellte Salmonella LAMP-Methode kürzlich in das Bacteriological Analytical Manual (BAM) Chapter 5 Salmonella27 der U.S. Food and Drug Administration (FDA) aufgenommen, um zwei Zwecken zu dienen, eine als Schnellscreening-Methode für das Vorhandensein von Salmonellen in Tiernahrung und zwei als zuverlässige Bestätigungsmethode für mutmaßliche Salmonellen, die aus allen Lebensmitteln isoliert sind.
Protokoll
HINWEIS: Ein LAMP-Reaktionsmix enthält DNA-Polymerase, Puffer, MgSO4,dNTPs, Primer, DNA-Vorlage und Wasser. Die ersten vier Reagenzien sind in einem isothermen Master-Mix enthalten (Tabelle der Materialien). Primer werden im eigenen Haus vorgemischt, um ein Primer-Mix (10x) zu werden. DNA-Vorlagen können aus Anreicherungsbrühen von Tierfutterproben zum Screening oder aus Kulturen mutmaßlicher Salmonellenisolate zur Bestätigung hergestellt werden. Darüber hinaus sind in jedem LAMP-Lauf eine positive Kontrolle (DNA, die aus Salmonellen-Referenzstämmen extrahiert wird, z. B. Salmonella enterica serovar Typhimurium ATCC 19585 [LT2]) und eine No Template Control (NTC; steriles molekulares Wasser) enthalten.
1. Erstellung von DNA-Vorlagen
- Um DNA-Vorlagen aus der Anreicherung von Tierfutter zu erstellen, folgen Sie diesen Schritten.
- Aseptisch wiegen 25 g Tierfutterprobe (z. B. trockenes Katzenfutter, trockenes Hundefutter, Rinderfutter, Pferdefutter, Geflügelfutter und Schweinefutter) in einen sterilen Filterbeutel(Materialtabelle)oder gleichwertig. Legen Sie die Tasche in einen großen Behälter oder Rack zur Unterstützung während der Inkubation.
- Fügen Sie 225 ml sterilgepuffertes Peptonwasser (BPW) hinzu. Durch Wirbeln und kurze Handmassage gut mischen. Lassen Sie bei Raumtemperatur für 60 ± 5 min stehen.
- Gut mischen und pH-Wert mit einem Testpapier bestimmen. PH ggf. auf 6,8 ± 0,2 mit sterilem 1 N NaOH oder 1 N HCl einstellen. Inkubieren bei 35 ± 2 °C für 24 ± 2 h.
- Mischen Sie gut, indem Sie den Beutel mit Tierfutter anreichern Brühen. 1 ml von der gefilterten Seite des Beutels in ein Mikrozentrifugenrohr geben. Wirbel kurz.
- Extrahieren Sie DNA mit einem Probenpräparat reagenz (Tabelle der Materialien) wie folgt.
- Zentrifuge bei 900 x g für 1 min, um große Partikel zu entfernen und Überstand in ein neues Mikrozentrifugenrohr zu übertragen.
- Zentrifuge bei 16.000 x g für 2 min und abwerfen Überstand.
- Das Pellet in 100 l des Probenpräparationsreagenz aufhängen und bei 100 ± 1 °C 10 min in einem trockenen Wärmeblock erhitzen.
- Auf Raumtemperatur abkühlen und DNA-Extrakte bei -20 °C lagern.
- Um DNA-Vorlagen aus mutmaßlichen Salmonellenkulturen zu erstellen, folgen Sie diesen Schritten.
- Besorgen Sie sich mutmaßliche Salmonellenisolate aus der Kulturisolierung in allen Lebensmitteln nach dem BAM Chapter 5 Salmonella Abschnitt D: Isolation von Salmonellen27.
- Inokulieren Sie präsumptive Salmonellenisolate auf einer nichtselektiven Agarplatte (z. B. Blutagar, Nähragar und Trypticase-Soja-Agar) und inkubieren Bei 35 ± 2 °C für 24 ± 2 h.
- Mehrere einzelne Kolonien auf 5 ml Trypticase-Sojabrühe (TSB) oder Hirnherzinfusion (BHI) brüten und bei 35 ± 2 °C für 16 ± 2 h brüten.
HINWEIS: Dieser Schritt kann optional sein, wenn die mutmaßliche Salmonellenkultur rein ist. In diesem Fall können DNA-Vorlagen hergestellt werden, indem mehrere einzelne Kolonien in 5 ml TSB aufgeblicht werden und 500 l der Suspension bei 100 ± 1 °C für 10 min in einem trockenen Wärmeblock erhitzt werden. Fahren Sie mit Schritt 5 weiter. - Übernachtkultur in ein Mikrozentrifugenrohr übertragen und bei 100 ± 1 °C 10 min in einem trockenen Wärmeblock erhitzen.
- Auf Raumtemperatur abkühlen und dna-Extrakte bei -20 °C lagern.
- Um positive Kontroll-DNA vorzubereiten, folgen Sie ähnlichen Schritten wie oben, um DNA-Vorlagen aus mutmaßlichen Salmonellenkulturen mit einem zusätzlichen Verdünnungsschritt vorzubereiten.
- Inokulat S. Typhimurium ATCC 19585 (LT2) oder irgendwelche Salmonellen-Referenzstämme auf einer nichtselektiven Agarplatte (z. B. Blutagar, Närgar und Trypticase-Soja-Agar) und bei 35 ± 2 °C für 24 ± 2 h inkubieren.
- Mehrere einzelne Kolonien auf 5 ml TSB- oder BHI-Brühe übertragen und bei 35 ± 2 °C für 16 ± 2 h bebrüten, um 109 KBE/ml zu erreichen.
- Die Nachtkultur in 0,1% Peptonwasser verdünnen, um 107 KBE/ml zu erhalten.
- Übertragen Sie 500 l dieser Verdünnung in ein Mikrozentrifugenrohr und erhitzen Sie bei 100 ± 1 °C für 10 min in einem trockenen Wärmeblock.
- Auf Raumtemperatur abkühlen und positive Kontroll-DNA bei -20 °C speichern.
2. Vorbereitung der Primermischung (10x)
- Erhalten Sie kommerziell synthetisierte LAMP-Primer (Sal4-F3, Sal4-B3, Sal4-FIP, Sal4-BIP, Sal4-LF und Sal4-LB) mit Standard-Entsalzungsreinigung (Tabelle 1).
| Primername | Beschreibung | Sequenz (5'-3') | Länge (bp) |
| Sal4-F3 | Vorwärts-Außengrundierung | GAACGTGTCGCGGAAGTC | 18 |
| Sal4-B3 | Rückwärts-Außengrundierung | CGGCAATAGCGTCACCTT | 18 |
| Sal4-FIP | Vorwärts-Innengrundierung | GCGCGGCATCCGCATCAATA-TCTGGATGGTATGCCCGG | 38 |
| Sal4-BIP | Rückwärts-Innengrundierung | GCGAACGGCGAAGCGTACTG-TCGCACCGTCAAAGGAAC | 38 |
| Sal4-LF | Loop-Forward-Primer | TCAAATCGGCATCAATACTCA-TCTG | 25 |
| Sal4-LB | Loop-Rückwärts-Primer | AAAGGGAAAGCCAGCTTTACG | 21 |
Tabelle 1: LAMP-Primer zum Screening von Salmonellen in Tierfutter und zur Bestätigung von Salmonellen aus der Kulturisolierung. Die Primer basieren auf der Salmonella-InvA-Sequenz (GenBank-Beitrittsnummer M90846).
- Bereiten Sie Lagerlösungen für jeden Primer (100 m) vor, indem Sie den Primer mit einer angemessenen Menge an sterilem molekularem Wasser rehydrieren. Durch Wirbeln für 10 s gut mischen und bei -20 °C lagern (-80 °C für Langzeitlagerung).
- Bereiten Sie die Primermischung (10x) gemäß einem Arbeitsblatt vor (Tabelle 2). Fügen Sie geeignete Volumina von Primer-Stock-Lösungen und sterilem molekularem Wasser in ein Mikrozentrifugenrohr ein. Mischen Sie alle Reagenzien gut, indem Sie für 10 s wirbeln.
| Komponente | Lagerkons. (M) | Primer-Mix conc. (m) | Volumen (L) |
| Sal4-F3-Grundierung | 100 | 1 | 10 |
| Sal4-B3-Grundierung | 100 | 1 | 10 |
| Sal4-FIP-Grundierung | 100 | 18 | 180 |
| Sal4-BIP-Grundierung | 100 | 18 | 180 |
| Sal4-LF Grundierung | 100 | 10 | 100 |
| Sal4-LB Primer | 100 | 10 | 100 |
| Molekulares Wasser | N/A | N/A | 420 |
| gesamt | N/A | N/A | 1000 |
Tabelle 2: Arbeitsblatt zur Vorbereitung des LAMP-Primer-Mix (10x). Die Primer sind in Tabelle 1aufgeführt.
- Aliquot die 10x Primer Mischung auf 500 l pro Mikrozentrifugenrohr und lagern bei -20 °C.
3. Montage einer LAMP-Reaktion
HINWEIS: Um Kreuzkontaminationen zu vermeiden, wird dringend empfohlen, die Bereiche, die für die Vorbereitung des LAMP-Master-Mix und das Hinzufügen von DNA-Vorlagen verwendet werden, physisch zu trennen. Abbildung 1 ist ein LAMP-Diagramm.
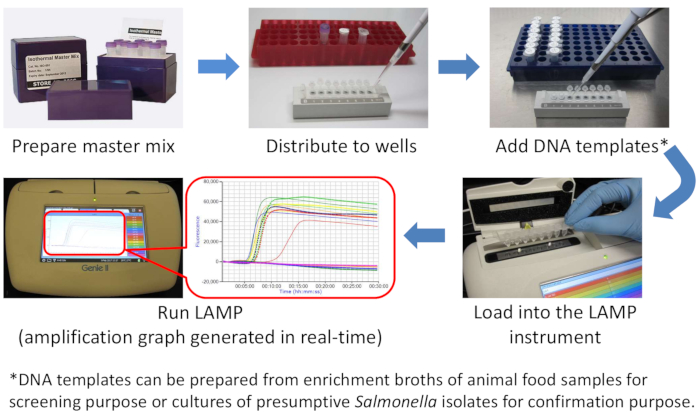
Abbildung 1: Ein schematisches Diagramm des Salmonella LAMP-Workflows. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Vorbereiten und Ausführen von Setup
- Saubere Bank mit Isopropanol und einer DNA- und DNase-abbauenden Lösung (Materialtabelle). Reinigen Sie Pipetten und Rohrstreifenhalter (Materialtabelle) mit der DNA- und DNase-abbauenden Lösung.
- Tauen Sie die isotherme Master-Mix, Primer-Mix (10x), molekularen Grad Wasser, Positive Control DNA, und DNA-Vorlagen bei Raumtemperatur.
- Schalten Sie das LAMP-Instrument (Tabelle der Materialien) ein und tippen Sie auf den Öffnungsbildschirm, um auf den Startbildschirm zuzugreifen. Führen Sie die folgenden Schritte aus, um eine Ausführung zu erstellen.
HINWEIS: Ein Modell des LAMP-Instruments hat 2 Blöcke (A und B) mit 8 Samples in jedem Block und ein anderes Modell hat einen einzigen Block, der 8 Samples(Tabelle der Materialien) aufnimmt.- Tippen Sie auf LAMP+Anneal, und wählen Sie Bearbeiten aus, um Beispielinformationen einzugeben.
HINWEIS: Das Standard-LAMP-Laufprofil besteht aus der Verstärkung bei 65 °C für 30 min und einer Nealphase von 98 °C bis 80 °C mit 0,05 °C Dekrement pro Sekunde. - Tippen Sie auf jede Beispielzeile, um den Cursor zu aktivieren, und geben Sie relevante Beispielinformationen ein, indem Sie das AB-Blocksymbol verwenden, um zwischen den beiden LAMP-Instrumentenblöcken zu wechseln.
- Tippen Sie auf das Symbol Überprüfen, wenn alle Beispielinformationen eingegeben wurden.
HINWEIS: Optional kann die Ausführungseinrichtung (als "Profil" bezeichnet, die Beispielinformationen zusammen mit dem Standard-LAMP-Laufprofil enthält) für die spätere Verwendung gespeichert werden. Tippen Sie auf das Symbol Speichern, und geben Sie dem Profil einen eindeutigen Namen. Wenn Sie beim nächsten Mal denselben Satz von Beispielen testen, kann mithilfe des gespeicherten Profils eine neue Ausführung initiiert werden. Tippen Sie auf das Ordnersymbol unten links auf dem Startbildschirm, und wählen Sie Profil aus, um gespeicherte Profile zu laden.
- Tippen Sie auf LAMP+Anneal, und wählen Sie Bearbeiten aus, um Beispielinformationen einzugeben.
- LAMP-Reaktionsbaugruppe
HINWEIS: Bei Verwendung der beiden LAMP-Instrumentenblöcke (A und B, insgesamt 16 Samples) bereiten Sie den LAMP-Master-Mix für 18 Samples vor. Wenn Sie nur einen LAMP-Instrumentenblock (insgesamt 8 Samples) verwenden, bereiten Sie den LAMP-Master-Mix für 10 Samples vor. Passen Sie bei anderen Stichprobennummern das Volumen entsprechend an, um den Pipettierverlust zu berücksichtigen. Fügen Sie in jedem LAMP-Lauf immer eine Positivsteuerung und einen NTC ein. Es wird empfohlen, jedes Beispiel in unabhängigen LAMP-Ausführungen zu testen.- Bereiten Sie den LAMP-Mastermix gemäß einem Arbeitsblatt vor (Tabelle 3). Fügen Sie geeignete Volumina der isothermen Mastermischung, Primermischung und molekularen Wasser in ein Mikrozentrifugenrohr und Wirbel sanft für 3 s. Zentrifuge kurz.
- Legen Sie den Rohrstreifen in den Streifenhalter und verteilen Sie 23 L des LAMP-Master-Mix auf jeden Brunnen.
- Wirbel alle DNA-Vorlagen und Zentrifuge kurz. Fügen Sie dem entsprechenden Brunnen 2 L DNA-Vorlage hinzu und verschließen Sie sie fest.
- Entfernen Sie den Rohrstreifen aus dem Halter und flicken Sie das Handgelenk, um sicherzustellen, dass sich alle Reagenzien an der Unterseite des Rohres gepoolt haben.
- Legen Sie den Rohrstreifen in den(n) LAMP-Instrumentenblock ein, um sicherzustellen, dass die Kappen vor dem Schließen des Deckels sicher sind.
| Komponente | Arbeitskons. | Endreaktion conc. | Volumen pro Probe (L) | Volumen für 18 Proben (L) | Volumen für 10 Proben (L) |
| ISO-001 isotherme Mastermischung | 1.67x | 1x | 15 | 270 | 150 |
| Primer-Mix | 10x | 1x | 2.5 | 45 | 25 |
| Molekulares Wasser | N/A | N/A | 5.5 | 99 | 55 |
| Master-Mix-Zwischensumme | N/A | N/A | 23 | 414 | 230 |
| DNA-Vorlage | N/A | N/A | 2 | N/A | N/A |
Tabelle 3: Arbeitsblatt zur Vorbereitung des LAMP-Reaktionsmixes. Der Primermix (10x) wird gemäß Tabelle 2 unter Verwendung von Lagerlösungen von Primern hergestellt, die in Tabelle 1aufgeführt sind.
4. LAMP-Lauf
HINWEIS: Während eines LAMP-Laufs werden Fluoreszenzwerte über den FAM-Kanal erfasst. Die Zeit-zu-Spitzenwerte (Tmax; min) werden automatisch vom Instrument für den Zeitpunkt bestimmt, an dem das Fluoreszenzverhältnis den Maximalwert der Amplifikationsrate erreicht. Der Tm (°C) ist die Schmelz-/Glühtemperatur des endverstärkten Produkts.
- Klicken Sie auf das Run-Symbol oben rechts auf dem Bildschirm und wählen Sie die Block(e) mit Rohrstreifen aus, um den LAMP-Lauf zu starten.
- Wenn die Reaktion ausgeführt wird, tippen Sie optional auf die Registerkarten Temperatur, Verstärkungund Anneal, um dynamische Änderungen verschiedener Parameter während des LAMP-Laufs anzuzeigen.
- Sobald der Lauf abgeschlossen ist, tippen Sie auf die Registerkarten Verstärkung und Anneal, um vollständige Amplifikation und Annealkurven zu sehen, und tippen Sie auf die Registerkarte Ergebnisse, um die Ergebnisse anzuzeigen.
- Für die Aufzeichnung ist optional die Run-Nummer oben links auf dem Bildschirm aufzuzeichnen, und zwar im Format "Instrument Serial number_run Number", z. B. "GEN2-2209_0030".
5. Interpretation der LAMP-Ergebnisse
HINWEIS: DIE LAMP-Ergebnisse können direkt und/oder mit einer LAMP-Software (Materialtabelle )auf der LAMP-Instrumententafel angezeigt werden.
- Führen Sie die folgenden Schritte aus, um die LAMP-Ergebnisse auf der Instrumententafel zu interpretieren.
- Tippen Sie auf das Ordnersymbol unten links auf dem Startbildschirm, und wählen Sie Protokoll aus, um zum Dateispeicherort zu navigieren, um die LAMP-Ausführung von Interesse zu laden.
HINWEIS: Die LAMP-Läufe sind nach Datum organisiert, beginnend mit dem Jahr. - Beachten Sie die fünf Registerkarten, die jedem Lauf zugeordnet sind: Profil, Temperatur, Verstärkung, Annealund Ergebnisse.
HINWEIS: Die Registerkarten Profil und Temperatur zeigen programmierte bzw. tatsächliche Temperaturen in den Probenbrunnen an, während die LAMP-Reaktion weitergeht. Die Amplifikations- und Neal-Tabs zeigen Fluoreszenzmessungen und Fluoreszenzveränderungen während der Amplifikations- bzw. Nealphasen. Auf der Registerkarte Ergebnisse wird eine tabellarische Ansicht der LAMP-Ergebnisse angezeigt. - Tippen Sie auf die Registerkarte Ergebnisse, um die LAMP-Ergebnisse für jeden Brunnen zu beobachten.
HINWEIS: Es gibt drei Spalten (Nun, Verstärkung und Anneal). Die Spalte "Verstärkung" zeigt die Zeit-zu-Spitzenwerte (Tmax; min:sec) für jede Probe ("Gut") und die Spalte "Anneal" zeigt die Schmelz-/Glühtemperaturen (Tm; °C) für jedes verstärkte Produkt in diesem Brunnen. - Interpretieren Sie die LAMP-Ergebnisse und melden Sie die endgültigen LAMP-Ergebnisse wie folgt.
- Untersuchen Sie zuerst die Kontrollbrunnen. Der NTC-Brunnen sollte leer Tmax haben, während Tm entweder leer (beide LAMP-Instrumentenmodelle) oder < 83 °C sein kann (nur für das LAMP-Instrumentenmodell mit zwei Blöcken). Der Positivkontrollbrunnen sollte Tmax zwischen 5 und 10 min und Tm um 90 °C haben.
- Untersuchen Sie die Probenbrunnen. Alle Proben mit den richtigen Tm (ca. 90 °C) und Tmax (zwischen 5-30 min) gelten als positiv für Salmonellen.
- Melden Sie die endgültigen LAMP-Ergebnisse basierend auf Ergebnissen aus doppelten Durchläufen. Wenn die doppelten Durchläufe konsistente Ergebnisse haben, können endgültige LAMP-Ergebnisse gemeldet werden. Wenn doppelte Durchläufe inkonsistent sind, wiederholen Sie beide Läufe unabhängig voneinander. Wenn die Ergebnisse noch inkonsistent sind, sollte die Probe als vermutlich positiv für Salmonellen betrachtet werden und muss durch Kulturbestätigung gehen.
- Tippen Sie auf das Ordnersymbol unten links auf dem Startbildschirm, und wählen Sie Protokoll aus, um zum Dateispeicherort zu navigieren, um die LAMP-Ausführung von Interesse zu laden.
- Führen Sie die folgenden Schritte aus, um LAMP-Ergebnisse mithilfe der Software zu interpretieren.
- Klicken Sie auf das Computersymbol im linken Bereich und navigieren Sie zum Speicherort der Datei, um den LAMP-Lauf von Interesse zu laden.
HINWEIS: Der Computer, auf dem die Software installiert ist, muss nicht mit dem LAMP-Instrument verbunden sein, um die LAMP-Ergebnisse zu analysieren, d. h. der Remote-Zugriff ist verfügbar. Die LAMP-Läufe sind nach Datum organisiert. - Beachten Sie die sieben Registerkarten, die jedem Lauf zugeordnet sind: Profil, Temperatur, Verstärkung, Verstärkungsrate, Anneal, Anneal-Derivatund Ergebnis.
HINWEIS: Ähnlich wie in der Instrumententafelansicht zeigen die Registerkarten Profil und Temperatur programmierte bzw. tatsächliche Temperaturen in den Probenbrunnen an, während die LAMP-Reaktion weitergeht. Die Amplifikations-/Amplifikationsrate und die Anneal/Anneal-Derivat-Tabs zeigen Fluoreszenzmessungen bzw. Fluoreszenzveränderungen während der Amplifikations- bzw. Nealphasen. Auf der Registerkarte Ergebnisse wird eine tabellarische Ansicht der LAMP-Ergebnisse angezeigt, die sich geringfügig von der Ansicht des Instrumentpanels unterscheiden. - Tippen Sie auf die Registerkarte Verstärkungsrate, um eine grafische Anzeige der Fluoreszenzverhältnisse nach Zeit anzuzeigen. Klicken Sie auf das Einstellungssymbol oben rechts auf dem Bildschirm und passen Sie das "Peak Detection Threshold Ratio" von 0,020 bis 0,010 an.
HINWEIS: Die Anpassung ist erforderlich, um sicherzustellen, dass alle gültigen Peaks identifiziert werden und die ergebnisse, die mit der Software erzielt wurden, mit den auf dem Instrumentenbereich angezeigten übereinstimmen. - Tippen Sie auf die Registerkarte Ergebnis, um die LAMP-Ergebnisse für jeden Brunnen zu beobachten.
HINWEIS: Es gibt vier Spalten (Graph Name, Well Number, Well Name und Peak Value). Der obere Teil der Spalte "Peak Value" zeigt "Amp Time" (Tmax; min:sec) für jede Probe ("Well Name"), während der untere Teil "Anneal Derivative" (Tm; °C) für jedes verstärkte Produkt in diesem Brunnen anzeigt. - Interpretieren Sie die LAMP-Ergebnisse und melden Sie die endgültigen LAMP-Ergebnisse nach ähnlichen Schritten wie bei der Verwendung des Instrumentenpanels, mit einer Ausnahme, dass die NTC-Bohrungen und andere negative Samples leer Tm haben sollten, da die LAMP-Softwareeinstellungen diese Tm < 83 °C-Ergebnisse eliminieren. Ebenso gelten alle Proben mit den richtigen Tm (ca. 90 °C) und Tmax (zwischen 5-30 min) als positiv für Salmonellen.
- Klicken Sie auf das Computersymbol im linken Bereich und navigieren Sie zum Speicherort der Datei, um den LAMP-Lauf von Interesse zu laden.
Ergebnisse
Abbildung 2 und Abbildung 3 zeigen repräsentative LAMP-Diagramme/Tabellen, die auf beiden Plattformen angezeigt werden. In diesem LAMP-Lauf sind die Proben S1 bis S6 10-fach serielle Verdünnungen von S. enterica serovar Infantis ATCC 51741 im Bereich von 1,1 x 106 KBE bis 11 KBE pro Reaktion. Positivist ist S. enterica serovar Typhimurium ATCC 19585 (LT2) bei 1,7 x 104 KBE pro Reaktion und NTC ist molekulares Wasser.
Wie in Abbildung 2E und Abbildung 3Gdargestellt, sind sowohl NTC- als auch PC-Bohrungen gültige Steuerungen. Der NTC-Brunnen hat leer Tmax, während Tm < 83 °C auf dem LAMP-Instrumentenpanel und leer in der LAMP-Software ist, was auf ein negatives Ergebnis hindeutet. Der PC-Brunnen hat Tmax. 7 min 45 sec und Tm von 90 °C auf beiden Plattformen, was auf ein positives Ergebnis hindeutet. Die Proben S1 bis S6 haben Tmax zwischen 6 min 30 sec und 12 min 15 sec, alle sind Salmonella-positiv.
Nach doppelten Ausführungen desselben Satzes von Stichproben werden die endgültigen LAMP-Ergebnisse für diese Stichproben gemeldet. Dieser repräsentative LAMP-Lauf zeigt, dass LAMP Salmonellen mit einer Vielzahl von Konzentrationen in den Proben erfolgreich erkennt.

Abbildung 2: Repräsentative LAMP-Ergebnisse, die auf dem LAMP-Instrumentenpanel angezeigt werden. (A) Die Registerkarte Profil zeigt das programmierte Temperaturprofil an. (B) Die Registerkarte Temperatur zeigt die tatsächlichen Temperaturen in den Probenbrunnen an, während die LAMP-Reaktion fortgesetzt wird. (C) Die Registerkarte Amplifikation zeigt Fluoreszenzwerte während der LAMP-Verstärkung. (D) Die Registerkarte Anneal zeigt Veränderungen der Fluoreszenz (Derivat) während der Nealphase. (E) Auf der Registerkarte Ergebnisse wird eine tabellarische Ansicht der LAMP-Ergebnisse angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
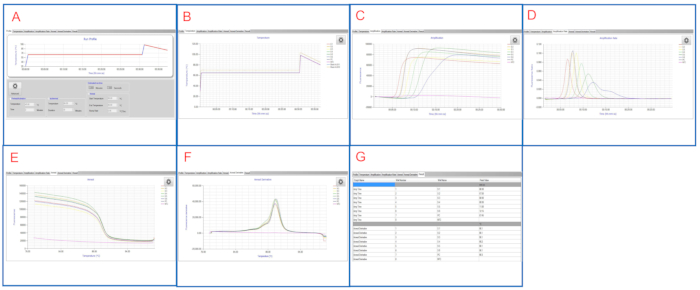
Abbildung 3: Repräsentative LAMP-Ergebnisse in der LAMP-Software angezeigt. (A) Die Registerkarte Profil zeigt das programmierte Temperaturprofil an. (B) Die Registerkarte Temperatur zeigt die tatsächlichen Temperaturen in den Probenbrunnen an, während die LAMP-Reaktion fortgesetzt wird. (C) Die Registerkarte Amplifikation zeigt Fluoreszenzwerte während der LAMP-Verstärkung. (D) Die Registerkarte Amplifikationsrate zeigt Veränderungen der Fluoreszenz (Fluoreszenzverhältnis) während der LAMP-Verstärkung. (E) Die Anneal-Registerkarte zeigt Fluoreszenzwerte während der Nealphase. (F) Die Registerkarte Anneal-Derivat zeigt Veränderungen der Fluoreszenz (Derivat) während der Nealphase. (G) Die Registerkarte Ergebnis zeigt eine tabellarische Ansicht der LAMP-Ergebnisse an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben hier eine einfache, schnelle, spezifische und empfindliche LAMP-Methode zum Screening und zur Bestätigung von Salmonellen in Tierfutter bzw. reiner Kultur vorgestellt. Mit dem Komfort eines isothermen Master-Mix, der vier Schlüsselreagenzien und einen gebrauchsfertigen, hausinternen Primer-Mix enthält, erfordert die Montage einer LAMP-Reaktion nur wenige Pipettierschritte(Abbildung 1). Die Gesamtlaufzeit einschließlich Amplifikation und Annealphase beträgt weniger als 38 min(Abbildung 2A,B und Abbildung 3A,B). Positive Ergebnisse werden über Echtzeitfluoreszenz überwacht (Abbildung 2C und Abbildung 3C,D) und können bereits in 5 min26nachgewiesen werden. Die Nealphase dient als zusätzliche Bestätigung der LAMP-Spezifität, da nur Proben mit korrektem Tm (ca. 90 °C) als positiv gemeldet werden(Abbildung 2D,E und Abbildung 3E-G). Empfindlichkeiten von 1 Salmonellenzelle in Reinkultur und < 1 KBE/25 g in Tierfutter wurden bereits26berichtet.
Da LAMP sehr effektiv ist und eine große Menge an DNA1erzeugt, ist es wichtig, dass die besten Laborpraktiken verwendet werden, um Kreuzkontaminationen zu verhindern, die die Bereiche für die Vorbereitung des LAMP-Master-Mix physisch trennen und DNA-Vorlagen hinzufügen können, die Erzeugung von Aerosolen zu vermeiden, Filterpipettenspitzen zu verwenden, Handschuhe häufig zu wechseln und auf das Öffnen von LAMP-Reaktionsröhren nach der Amplifikation zu verzichten.
Die Spezifität dieser Salmonella LAMP-Methode wurde zuvor mit 300 Bakterienstämmen (247 Salmonellen von 185 Serovars und 53 Nicht-Salmonellen) getestet und nachweislich 100% spezifisch26. Insbesondere wurden signifikante Unterschiede in Tmax zwischen den beiden Salmonellenarten S. enterica und Salmonella bongoriund zwischen s. enterica Subspecies, insbesondere subsp. arizonae (IIIa)26beobachtet. Dennoch waren dies nach wie vor gültige positive Ergebnisse nach den Regeln für die Interpretation der LAMP-Ergebnisse. In unserer multilaborativen kollaborativen Studie in trockener Hundenahrung, an der 14 Analytiker19beteiligt waren, wurden gelegentlich Proben mit inkonsistenten Ergebnissen in doppelten LAMP-Läufen beobachtet. In der Regel handelte es sich um Proben mit verzögerten positiven Ergebnissen (Tmax > 15 min). Wiederholte beide Läufe unabhängig voneinander löste das Problem in der Regel. Seltener beobachteten wir Proben mit korrekten Tm, aber keine oder unregelmäßige Tmax Werte (< 5 min). Dies wurde in der Regel durch Luftblasen im Reaktionsrohr verursacht.
Während des gesamten Lebenszyklus der Entwicklung, Evaluierung, Präkollaborativen Studie und Multilaborierung von LAMP haben wir eine hohe Toleranz von LAMP gegenüber Inhibitoren in verschiedenen Tiernahrungs- oder Lebensmittelmatrizen und Kulturmedien4,19,22,23,24beobachtet, die die Robustheit der Methode hervorhebt und zahlreiche andere Studien auf globaler Ebene8kooperiert. Dies ist besser als PCR oder Echtzeit-PCR, die in der Regel eine interne Verstärkungskontrolle erfordert, um sicherzustellen, dass negative Ergebnisse nicht auf Matrix-Hemmung28zurückzuführen sind. Darüber hinaus zeigte LAMP in der überwiegenden Mehrheit der Studien eine ähnliche (oder überlegene) Spezifität und Empfindlichkeit im Vergleich zu PCR oder Echtzeit-PCR in der überwiegenden Mehrheit der Studien8. Die Kosten für LAMP-Reagenzien belaufen sich auf ca. 1 USD pro Reaktion. Die in diesem Protokoll verwendeten LAMP-Instrumente sind klein, wartungsarm und tragbar. Sie können jede isotherme Amplifikationsmethode handhaben, die die Zieldetektion durch Fluoreszenzmessung verwendet, LAMP inklusive. Mit der LAMP-Software können umfassende Berichte in mehreren Formaten (pdf, Text und Bild) generiert werden.
Die Methodenvalidierung ist ein wichtiger Schritt, bevor eine neue Methode für die Routineanwendung übernommen werden kann. Bemerkenswert ist, dass das hier gemeldete LAMP-Protokoll die Multilabor-Validierung erfolgreich abgeschlossen hat19. Mit der kürzlicherfolgten Aufnahme dieses LAMP-Protokolls in das BAM Chapter 5 Salmonella27der US-amerikanischen FDA wird erwartet, dass die Methode viel breiter genutzt wird, sowohl als Schnellscreening-Methode in Tiernahrung als auch als zuverlässige Bestätigungsmethode für mutmaßliche Salmonellenisolate aus allen Lebensmittelkategorien.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben. Die in diesem Manuskript zum Ausdruck gebrachten Ansichten sind die der Autoren und spiegeln nicht unbedingt die offizielle Politik des Department of Health and Human Services, der U.S. Food and Drug Administration oder der US-Regierung wider. Die Bezugnahme auf kommerzielle Materialien, Ausrüstungen oder Verfahren stellt in keiner Weise eine Genehmigung, Billigung oder Empfehlung der Food and Drug Administration dar.
Danksagungen
Die Autoren danken den Mitgliedern des FDA Microbiology Methods Validation Subcommittee (MMVS) und des Bacteriological Analytical Manual (BAM) Council für die kritische Überprüfung von Salmonella LAMP-Methodenvalidierungsstudien.
Materialien
| Name | Company | Catalog Number | Comments |
| Brain heart infusion (BHI) broth | BD Diagnostic Systems, Sparks, MD | 299070 | Liquid growth medium used in the cultivation of Salmonella. |
| Buffered peptone water (BPW) | BD Diagnostic Systems, Sparks, MD | 218105 | Preenrichment medium for the recovery of Salmonella from animal food samples. |
| DNA AWAY | Thermo Fisher Scientific, Waltham, MA | 7010 | Eliminates unwanted DNA and DNase from laboratory bench, glassware, and plasticware without affecting subsequent DNA samples. |
| Genie Explorer software | OptiGene Ltd., West Sussex, United Kingdom | Version 2.0.6.3 | Supports remote operation of Genie instruments including LAMP runs and data analysis. |
| Genie II or Genie III (LAMP instrument) | OptiGene Ltd., West Sussex, United Kingdom | GEN2-02 or GEN3-02 | A small instrument capable of temperature control up to 100 °C with ± 0.1 °C accuracy and simultaneous fluorescence detection via the FAM channel. Genie II has 2 blocks (A and B) with 8 samples in each block. Genie III has a single block that accommodates 8 samples. |
| Genie strip | OptiGene Ltd., West Sussex, United Kingdom | OP-0008 | 8-well microtube strips with integral locking caps and a working volume of 10 to 150 µl. |
| Genie strip holder | OptiGene Ltd., West Sussex, United Kingdom | GBLOCK | Used to hold Genie strips when setting up a LAMP reaction, the aluminum holder can also be used as a cool block. |
| Hydrochloric acid (HCl) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SA48-500 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Heat block | Thermo Fisher Scientific, Waltham, MA | 88-860-022 | Heats samples at 100 ± 1 oC for DNA extraction. |
| Incubator | Thermo Fisher Scientific, Waltham, MA | 3960 | Standard laboratory incubator. |
| ISO-001 isothermal master mix | OptiGene Ltd., West Sussex, United Kingdom | ISO-001 | An optimized master mix to simplify the assembly of a LAMP reaction, containing a strand-displacing GspSSD DNA polymerase large fragment from Geobacillus spp., thermostable inorganic pyrophosphatase, reaction buffer, MgSO4, dNTPs, and a double-stranded DNA binding dye (FAM detection channel). |
| Isopropanol | Thermo Fisher Scientific, Waltham, MA | A416 | Disinfects work surfaces. |
| LAMP primers | Integrated DNA Technologies Inc., Coralville, IA | Custom | LAMP primers with detailed information in Table 1. |
| Microcentrifuge | Eppendorf North America, Hauppauge, NY | 22620207 | MiniSpin plus personal microcentrifuge. |
| Microcentrifuge tubes | Thermo Fisher Scientific, Waltham, MA | 05-408-129 | Standard microcentrifuge tubes. |
| Molecular grade water | Thermo Fisher Scientific, Waltham, MA | AM9938 | Used in making primer stocks, primer mix, and LAMP reaction mix. |
| Sodium hydroxide (NaOH) solution, 1 N | Thermo Fisher Scientific, Waltham, MA | SS266-1 | Adjusts pH of animal food samples after adding BPW and prior to overnight enrichment. |
| Nonselective agar (e.g., blood agar, nutrient agar, and trypticase soy agar) | Thermo Fisher Scientific, Waltham, MA | R01202 | Solid growth medium used in the cultivation of Salmonella. |
| Peptone water | BD Diagnostic Systems, Sparks, MD | 218071 | Dilutes overnight Salmonella cultures to make positive control DNA. |
| Pipettes and tips | Mettler-Toledo Rainin LLC, Oakland CA | Pipet Lite LTS series | Standard laboratory pipettes and tips. |
| PrepMan Ultra sample preparation reagent | Thermo Fisher Scientific, Waltham, MA | 4318930 | A simple kit used for the rapid preparation of DNA templates for use in a LAMP reaction. |
| Salmonella reference strain LT2 | ATCC, Manassas, VA | 700720 | Salmonella reference strain used as positive control. |
| Trypticase soy broth (TSB) | BD Diagnostic Systems, Sparks, MD | 211768 | Liquid growth medium used in the cultivation of Salmonella. |
| Vortex mixer | Scientific Industries, Inc., Bohemia, NY | SI-0236 | Standard laboratory vortex mixer. |
| Whirl-pak filter bag | Nasco Sampling Brand, Fort Atkinson, WI | B01318 | Filter bags to hold animal food samples for preenrichment. |
Referenzen
- Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research. 28 (12), 63 (2000).
- Kaneko, H., Kawana, T., Fukushima, E., Suzutani, T. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances. Journal of Biochemical and Biophysical Methods. 70 (3), 499-501 (2007).
- Francois, P., et al. Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications. FEMS Immunology and Medical Microbiology. 62 (1), 41-48 (2011).
- Yang, Q., Wang, F., Prinyawiwatkul, W., Ge, B. Robustness of Salmonella loop-mediated isothermal amplification assays for food applications. Journal of Applied Microbiology. 116 (1), 81-88 (2014).
- Nagamine, K., Watanabe, K., Ohtsuka, K., Hase, T., Notomi, T. Loop-mediated isothermal amplification reaction using a nondenatured template. Clinical Chemistry. 47 (9), 1742-1743 (2001).
- Zhang, X., Lowe, S. B., Gooding, J. J. Brief review of monitoring methods for loop-mediated isothermal amplification (LAMP). Biosensors & Bioelectronics. 61, 491-499 (2014).
- Nagamine, K., Hase, T., Notomi, T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and Cellular Probes. 16 (3), 223-229 (2002).
- Yang, Q., Domesle, K. J., Ge, B. Loop-mediated isothermal amplification for Salmonella detection in food and feed: Current applications and future directions. Foodborne Pathogens and Disease. 15 (6), 309-331 (2018).
- Mori, Y., Notomi, T. Loop-mediated isothermal amplification (LAMP): Expansion of its practical application as a tool to achieve universal health coverage. Journal of Infection and Chemotherapy. 26 (1), 13-17 (2020).
- Mansour, S. M., Ali, H., Chase, C. C., Cepica, A. Loop-mediated isothermal amplification for diagnosis of 18 World Organization for Animal Health (OIE) notifiable viral diseases of ruminants, swine and poultry. Animal Health Research Reviews. 16 (2), 89-106 (2015).
- Kumar, Y., Bansal, S., Jaiswal, P. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Comprehensive Reviews in Food Science and Food Safety. 16 (6), 1359-1378 (2017).
- Kundapur, R. R., Nema, V. Loop-mediated isothermal amplification: Beyond microbial identification. Cogent Biology. 2, 1137110 (2016).
- . Compliance Policy Guide Sec. 690.800 Salmonella in Food for Animals Available from: https://www.fda.gov/downloads/iceci/compliancemanuals/compliancepolicyguidancemanual/ucm361105.pdf (2013)
- Bird, P., et al. Evaluation of the 3M molecular detection assay (MDA) 2 - Salmonella for the detection of Salmonella spp. in select foods and environmental surfaces: collaborative study, first action 2016.01. Journal of AOAC International. 99 (4), 980-997 (2016).
- D'Agostino, M., et al. Validation of a loop-mediated amplification/ISO 6579-based method for analysing soya meal for the presence of Salmonella enterica. Food Analytical Methods. 9 (11), 2979-2985 (2016).
- Ge, B., et al. Multi-laboratory validation of a loop-mediated isothermal amplification method for screening Salmonella in animal food. Frontiers in Microbiology. 10, 562 (2019).
- D'Agostino, M., Diez-Valcarce, M., Robles, S., Losilla-Garcia, B., Cook, N. A loop-mediated isothermal amplification-based method for analysing animal feed for the presence of Salmonella. Food Analytical Methods. 8 (10), 2409-2416 (2015).
- Galan, J. E., Ginocchio, C., Costeas, P. Molecular and functional characterization of the Salmonella invasion gene invA: homology of InvA to members of a new protein family. Journal of Bacteriology. 174 (13), 4338-4349 (1992).
- Chen, S., Wang, F., Beaulieu, J. C., Stein, R. E., Ge, B. Rapid detection of viable salmonellae in produce by coupling propidium monoazide with loop-mediated isothermal amplification. Applied and Environmental Microbiology. 77 (12), 4008-4016 (2011).
- Yang, Q., Chen, S., Ge, B. Detecting Salmonella serovars in shell eggs by loop-mediated isothermal amplification. Journal of Food Protection. 76 (10), 1790-1796 (2013).
- Yang, Q., et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection of Salmonella in produce. Food Microbiology. 46, 485-493 (2015).
- Yang, Q., Domesle, K. J., Wang, F., Ge, B. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time. BMC Microbiology. 16 (1), 112 (2016).
- Domesle, K. J., Yang, Q., Hammack, T. S., Ge, B. Validation of a Salmonella loop-mediated isothermal amplification assay in animal food. International Journal of Food Microbiology. 264, 63-76 (2018).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten