Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yeni Nesil Dizileme için Murin Retinal Endotel Hücrelerinin İzolasyonu
Bu Makalede
Özet
Bu protokol, hücre verimi, saflığı ve canlılığı için optimize edilmiş murin doğum sonrası retinal endotel hücrelerinin izolasyonu için bir yöntemi açıklar. Bu hücreler yeni nesil dizileme yaklaşımları için uygundur.
Özet
Yeni nesil dizilemedeki son gelişmeler, araştırmacıların moleküler ve hücresel biyoloji hakkındaki bilgilerini ilerletmekte olup, vasküler biyolojide yeni paradigmaları ortaya koyan çeşitli çalışmalar bulunmaktadır. Bu yöntemlerin vasküler gelişim modellerine uygulanması, embriyonik ve postnatal dokulardan hücre izolasyon tekniklerinin optimizasyonunu gerektirir. Hücre verimi, canlılığı ve saflığı, yeni nesil dizileme yaklaşımlarından doğru ve tekrarlanabilir sonuçlar elde etmek için maksimum olmalıdır. Yenidoğan faresi retinal vaskülarizasyon modeli, araştırmacılar tarafından vasküler gelişim mekanizmalarını incelemek için kullanılır. Araştırmacılar bu modeli, kan damarı oluşumu ve olgunlaşması sırasında anjiyogenez mekanizmalarını ve arteriyel-venöz kader spesifikasyonunu araştırmak için kullandılar. Retinal vasküler gelişim modelini incelemek için yeni nesil dizileme tekniklerinin uygulanması, retinal endotel hücrelerinin izolasyonu için hücre verimini, canlılığını ve saflığını en üst düzeye çıkaran bir yöntemin optimizasyonunu gerektirir. Bu protokol, floresan ile aktive edilmiş hücre sıralama (FACS) kullanarak murin retinal doku izolasyonu, sindirim ve saflaştırma için bir yöntemi açıklar. Sonuçlar, FACS-saflaştırılmış CD31 + / CD45- endotel hücre popülasyonunun endotel hücre gen ekspresyonu için oldukça zenginleştirildiğini ve FACS'tan sonra 60 dakika boyunca canlılıkta bir değişiklik göstermediğini göstermektedir. Bu yöntem kullanılarak izole edilen endotel hücreleri üzerinde, toplu RNA dizilimi ve tek hücreli RNA dizilimi de dahil olmak üzere, yeni nesil dizileme yaklaşımlarının temsili sonuçları, retinal endotel hücre izolasyonu için bu yöntemin yeni nesil dizileme uygulamalarıyla uyumlu olduğunu göstermektedir. Bu retinal endotel hücre izolasyonu yöntemi, vasküler gelişimin yeni mekanizmalarını ortaya çıkarmak için ileri dizileme tekniklerine izin verecektir.
Giriş
Nükleik asitlerin yeni nesil dizileme yaklaşımlarıyla dizilenmesinin yüksek verim kapasitesi, araştırmacıların moleküler ve hücresel biyoloji hakkındaki bilgilerini büyük ölçüde geliştirmiştir. Bu ileri teknikler arasında tüm transkriptom RNA dizilimi, Tek Nükleotid Polimorfizmlerini (SNP'ler) tanımlamak için hedeflenen bölgelerin DNA dizilimi, Kromatin İmmünopresipitasyon (ChIP) dizilemesinde bağlı transkripsiyon faktörlerinin DNA dizilimi veya Transpozaz Erişilebilir Kromatin (ATAC) dizilimi için Tahlilde açık kromatin bölgeleri ve tek hücreli RNA dizilimi1 . Vasküler biyolojide, bu ilerlemeler, araştırmacıların karmaşık gelişim ve hastalık mekanizmalarını aydınlatmalarına ve değişen fenotiplerin 2,3'ünün bir sürekliliği boyunca gen ekspresyon kalıplarını ayırt etmelerine izin vermiştir. Gelecekteki deneyler, yeni nesil dizilemeyi değerlendirilmiş vasküler gelişim modelleriyle birleştirerek karmaşık mekanizmaları daha da tanımlayabilir, ancak numune hazırlama yöntemlerinin gelişmiş dizileme teknikleriyle uyumlu olması gerekir.
Yeni nesil dizileme yaklaşımlarının kalitesi, doğruluğu ve tekrarlanabilirliği, numune hazırlama yöntemine bağlıdır. Hücrelerin bir alt kümesini izole ederken veya dokulardan tek hücreli süspansiyonlar oluştururken, hücre sayısını, canlılığını ve hücre popülasyonunun saflığını en üst düzeye çıkarmak için optimal sindirim ve saflaştırma yöntemleri gereklidir 4,5. Bu, sindirim yönteminde bir denge gerektirir: hücreleri dokudan serbest bırakmak ve aşağı akış yaklaşımları için yeterli hücre elde etmek için güçlü sindirim gereklidir, ancak sindirim çok güçlüyse hücre canlılığı olumsuz yönde etkilenecektir 6,7. Ek olarak, hücre popülasyonunun saflığı, FACS aracılığıyla gerçekleştirilebilecek sağlam sonuçlar ve verilerin doğru analizi için gereklidir. Bu, yerleşik vasküler gelişim modellerine yeni nesil dizileme uygulamak için hücre izolasyon yöntemlerini optimize etmenin önemini vurgulamaktadır.
Vasküler gelişimi araştırmak için iyi karakterize edilmiş bir model murin retinal vasküler gelişim modelidir. Murin retinal vaskülatür, postnatal günde (P)3 görülebilen optik sinirden ilk anjiyojenik filizlenme, sap ve uç hücreleri ile anjiyojenik ön ve P6'da görülebilen ilk damar olgunlaşması ve P9 8,9'dan sonra görülebilen vasküler pleksus olgunlaşması ile postnatal olarak iki boyutlu yüzeysel pleksusta gelişir. İlk vasküler pleksusun yeniden şekillendirilmesi sırasında, endotel hücreleri, dolaşım ağı10,11 oluşturmak için farklı damarlardaki arteriyel, kılcal ve venöz fenotiplere doğru spesifikasyona tabi tutulur. Bu nedenle, bu yöntem araştırmacıların anjiyojenik vasküler pleksus oluşumunu ve endotelyal arteriyel-venöz spesifikasyonu ve olgunlaşmayı gelişim sırasında çeşitli zaman noktalarında görselleştirmelerini sağlar9. Ek olarak, bu model transgenik manipülasyonun anjiyogenez ve vasküler pleksus gelişimi üzerindeki etkilerini araştırmak için vasküler gelişim, arteriyel-venöz malformasyonlar ve oksijene bağlı neovaskülarizasyonun araştırılması için uygulanan bir yöntem sunmaktadır 12,13,14,15,16 . Yeni nesil dizileme yaklaşımlarını murin retinal vasküler gelişim modeli ile birleştirmek için, endotel hücrelerinin retina dokusundan izolasyonu için optimize edilmiş bir protokol gereklidir.
Bu protokol, hücre verimini, saflığını ve canlılığını en üst düzeye çıkarmak için P6'daki farelerden retina dokusunu sindirmek için optimize edilmiş bir yöntemi açıklar. Retina dokusu P6 farelerden izole edilir, 20 dakika boyunca sindirilir, CD31 ve CD45 için immünoboyalıdır ve endotel hücrelerinin tek bir hücre süspansiyonunu yaklaşık 2.5 saatte izole etmek için FACS ile saflaştırılır (Şekil 1A). Bu endotel hücrelerinin, izolasyon sonrası60 dakika boyunca yüksek canlılığı koruduğu bulundu 17 ve yeni nesil dizileme yöntemleri için kütüphane hazırlıklarına izin verdi. Ek olarak, bu izolasyon protokolünü kullanan iki ayrı yeni nesil dizileme yönteminden FACS geçit ve kalite kontrol sonuçları için temsili sonuçlar sağlanmaktadır: tüm transkriptom RNA dizilimi ve tek hücreli RNA dizilimi. Bu yöntem, vasküler gelişimin yeni mekanizmalarını aydınlatmak için retinal vaskülarizasyon modeli ile birlikte yeni nesil dizileme yaklaşımlarının kullanılmasına izin verir.
Protokol
Yale Üniversitesi ve Virginia Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komiteleri, bu protokolde listelenen tüm hayvan deneylerini onayladı.
1. Retina izolasyonu için fare gözleri elde edin
- 1x buz gibi soğuk PBS hazırlayın ve 48 delikli bir plakanın her bir oluğuna 500 μL ekleyin.
- Yenidoğan fareleri doğum sonrası altıncı günde (P6) onaylanmış kurumsal kılavuzlara göre ötenazileştirin. Bu deney için, yaklaşık 4-8 yenidoğan faresinin litreleri, solunum durmasından sonra en az üç dakika boyunca izofluran inhalasyonu yoluyla P6'da ötenazi yapılır ve ardından dekapitasyon yapılır.
- Gözleri farelerin her birinden çıkarın. Diseksiyon makası kullanarak göz kapağına dik olarak keserek göz üzerindeki cildi ve zarı kesin. Ardından, gözün soketten dışarı çıkması için gözün üstüne ve altına hafifçe bastırmak için forseps kullanın.
- Forseps ile gözün altına dikkatlice sıkıştırın ve gözü bağlı tutan optik siniri kesin. Ardından, hasat bitene kadar her bir gözü hazırlanan 1x buz gibi soğuk PBS'deki 48 delikli plakaya yerleştirin.
NOT: Fare başına bir kuyucuk kullanın, her iki gözü de tek bir fareden aynı kuyu içinde.
- Forseps ile gözün altına dikkatlice sıkıştırın ve gözü bağlı tutan optik siniri kesin. Ardından, hasat bitene kadar her bir gözü hazırlanan 1x buz gibi soğuk PBS'deki 48 delikli plakaya yerleştirin.
2. Fare retina dokusunu izole edin
- Altta bir diseksiyon pedi ile kaplı bir Petri kabını, gözleri batırmak ve 4.0x büyütmeye ayarlanmış bir diseksiyon mikroskobunun altına yerleştirmek için 500 μL 1x buz gibi soğuk PBS ile doldurun.
- Gözlere zarar vermemek için geniş uçlu bir transfer pipeti kullanarak diseksiyon pedindeki gözleri askıya alın.
NOT: Gözlerin PBS ile tamamen kaplandığından emin olun.
- Gözlere zarar vermemek için geniş uçlu bir transfer pipeti kullanarak diseksiyon pedindeki gözleri askıya alın.
- İki ince diseksiyon forseps kullanarak, optik siniri stabilizasyon için forsepslerden biriyle tutun ve ikinci forseps ile kornea ve skleranın bağlandığı ön odadan bir delik delin (Şekil 1B). Deliği, korneanın etrafındaki yolun yaklaşık% 75'inde bir daire içinde yırtın.
- Optik siniri forsepslerden biriyle tutarken, sklerayı retina dokusundan nazikçe koparmak için ikinci forsepsleri kullanın.
- Yukarıdaki gibi, retina dokusunun vitreus gövdesini nazikçe yırtmak için ikinci forsepsleri kullanın.
- Yine, ikinci forsepsleri kullanarak, vitreus gövdesi çıkarıldığında çıkmayan lens ve hyaloid pleksus damarlarını nazikçe çıkarın. Bunu yapmak için, retinaya neredeyse dokunana kadar açık forseps ile retinaya uzanın, lensi ve hyaloid pleksus damarlarını tutmak için forsepsleri kapatın ve forsepsleri retinadan çekin. Bu, tüm damarlar çıkarılana kadar tekrarlanabilir.
NOT: Hyaloid pleksus berrak, web benzeri bir yapıya benzer.
- 2 mL mikrosantrifüj tüpünü 500 μL 1x buz gibi soğuk PBS ile doldurun ve retinaları tüplere yerleştirin. Tüm retinaları gözlerden izole edin ve devam etmeden önce buz gibi soğuk PBS'ye yerleştirin.
NOT: Aynı fareden iki retina bir tüpü paylaşacak şekilde fare başına bir tüp kullanın. Retina dokusu yırtılırsa, birden fazla parçaya aktarın. Bir fare çöpü için retina dokusu diseksiyonunun toplam süresi, ötenazi ile başlayıp son retinal doku izolasyonu ile biten 15-60 dakika sürmelidir.
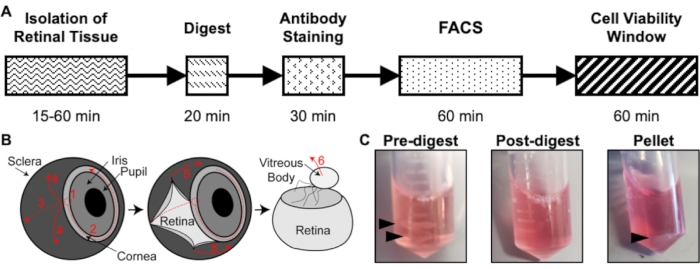
Şekil 1: İzolasyon protokolüne genel bakış. (A) Her adım için tahmini bir süre ile izolasyon zaman çizelgesinin şeması: Retina Dokusunun İzolasyonu, Özet, Antikor Boyama, FACS ve Hücre Canlılığı Penceresi. (B) Retina dokusunun gözden izolasyonu için basamak adım kılavuz, numaralandırılmış diseksiyon adımlarıyla: 1) korneayı delin, 2) gözyaşı korneası, 3) gözyaşı sklerası, 4) sklerayı retinadan uzaklaştırın, 5) sklerayı retinadan ve bağlantı dokusunu daha da uzaklaştırın, 6) vitreus gövdesini ve vitreus damarlarını retinadan çıkarın. (C) Çeşitli sindirim adımları sırasında retina dokusunun temsili görüntüleri: Sindirim öncesi, Sindirim sonrası, Pelet (siyah oklar retina dokusunu veya hücre peletini vurgular). Chavkin ve arkadaşlarının izniyle S. Karger AG, Basel17'de yayınlandı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Retina dokusunu tek hücreli bir süspansiyona sindirmek
- İzole edilmiş her iki retina için 500 μL sindirim çözeltisi hazırlayın. DMEM'e% 10 FBS ve 1 mg / mL Kollajenaz Tip II'lik son konsantrasyona FBS ve Kollajenaz Tip II ekleyin. Bir su banyosu kullanarak çözeltiyi karıştırın ve 37 ° C'ye ısıtın.
- Fazla PBS'yi 2 mL mikrosantrifüj tüplerinden dikkatlice pipetleyerek çıkarın. Retina dokusunu tamamen örtmek için yeterli PBS bırakın, her tüpte yaklaşık 100 μL.
- Retina dokusuna sahip her tüpe 500 μL sindirim çözeltisi ekleyin (Şekil 1C).
- Sindirim solüsyonundaki retina dokusunu beş kez yukarı ve aşağı pipetlemek için bir P1000 pipettör ve pipet ucu kullanın.
- Sindirim karışımını 37 °C'lik bir su banyosunda 20 dakika boyunca inkübe edin.
- Sindirim karışımını her 5 dakikada bir yukarı ve aşağı pipetlemek için bir P1000 pipettör ve pipet ucu kullanın. Kuluçkadan sonra, retina dokusu tek bir hücre süspansiyonunda çözülmüştür, bu nedenle sindirim karışımı bulanık olmalıdır (Şekil 1C).
4. Hücreleri sayın
- 4 ° C'de bir masa üstü santrifüj yerleştirin ve sindirim karışımı tüplerini içine yerleştirin. Sindirim karışımını 5 dakika boyunca 375 x g'de santrifüjleme ile pelet edin.
- Süpernatant sindirim solüsyonunu pipetle indirerek dikkatlice çıkarın. Hücre peletini rahatsız etmeyin (Şekil 1C). Pelet, pipetle hafifçe yukarı ve aşağı karıştırarak 500 μL buz gibi soğuk 1x PBS'de tekrar askıya alın.
- Hücreleri mikroskop altında bir hemositometre ile sayın.
NOT: Hücre sayımları iki retina başına yaklaşık 1 x 106 hücredir. - Hücrelerin nazikçe karıştırılarak düzgün bir şekilde yeniden askıya alındığından emin olun ve daha sonra daha önce açıklandığı ve kullanıldığı gibi kontrol boyama için üç tüpe (tüp 1: IgG kontrolü, tüp 2: CD31 kontrolü ve tüp 3: CD45 kontrolü) aliquot 20 μL hücre süspansiyonu, daha önce17,18'de tanımlandığı ve kullanıldığı gibi.
- 4 ° C'de bir masa üstü santrifüj yerleştirin ve içine hücre içeren tüpler yerleştirin. Hücreleri 5 dakika boyunca 375 x g'de santrifüjleme ile toplayın.
5. Hücreleri antikorlarla immünoboyamak
- Boyanmış iki retina ve dört kontrol tüpü başına 100 μL boyama tamponu hazırlayın. HBSS tamponuna FBS, HEPES ve D-Glikozu% 10 FBS, 10 mM HEPES ve 1 mg / mL D-Glikoz nihai konsantrasyonuna ekleyin.
- CD31 ve CD45'e karşı floresan konjuge antikorlar elde edin. Antikorları 1:100 seyreltmede boyama tamponuna ekleyin (tüp 1: Yalnızca IgG antikoru, yalnızca tüp 2: CD31 antikoru ve yalnızca tüp 3: CD45 antikoru). 2 μg / mL'lik son bir antikor konsantrasyonu için boyama tamponunun 100 μL'si başına 1 μL antikor ekleyin.
- PBS'yi yıkanmış hücre peletinden pipetle çekerek dikkatlice çıkarın.
- Pelet, 0.5 x 106 hücre başına 100 μL antikor boyama çözeltisi içinde yeniden askıya alın.
- Tek hücreli süspansiyonu antikor boyama çözeltisi ile karanlıkta buz üzerinde 30 dakika boyunca inkübe edin. Hücreleri nazikçe karıştırmak için her 10 dakikada bir tüplere dokunun.
6. Floresan ile aktive olmuş hücre sıralamaya hazırlanın
- 4 ° C'de bir masa üstü santrifüj yerleştirin ve hücreleri içeren tüpleri içine yerleştirin. 5 dakika boyunca 375 x g'de santrifüjleme ile pelet hücreleri.
- Süpernatantı çıkarın ve yıkamak için bu hücreleri 500 μL 1x PBS'de yeniden askıya alın.
- 4 ° C'de bir masa üstü santrifüj yerleştirin ve hücreleri içeren tüpleri içine yerleştirin. 5 dakika boyunca 375 x g'de santrifüjleme ile pelet hücreleri
- 1,5 mL FACS Arabelleği hazırlayın (1x PBS'de %1 FBS).
- Süpernatantı çıkarın ve bir pipetleyici ile hafifçe karıştırarak hücre peletini 300 μL FACS Tamponunda yeniden askıya alın.
- FACS tamponunu içeren numune tüplerine propidium iyodür (PI) ekleyerek 0,5 μg/mL'lik son konsantrasyona ekleyin. PI bir canlılık belirteci olarak kullanılır.
- Hücre süspansiyonlarını bir hücre süzgeci çıtçıtlı kapaktan 5 mL test tüplerine aktarın ve birleştirin. Hücre süzgeci çıtçıtlı kapağı 35 μm'lik bir filtre içermelidir ve hücre süspansiyonları doğrudan filtreye pipetlenebilir.
- FACS tüplerini karanlıkta buz üzerinde tutun ve hücre sıralayıcısına aktarın.
7. FACS cihazını kurun
- Bir FACS cihazına 100 μm'lik bir nozul takın.
NOT: Bu boyuttaki nozul, toplama hacmini en aza indirir ve izole edilmiş hücre yoğunluğunu en üst düzeye çıkarır. - FACS cihazına monte edilecek bir toplama tüpü olarak 1,5 mL'lik bir mikrosantrifüj tüpüne 250 μL 1x PBS hazırlayın.
8. Canlı endotel hücrelerini FACS ile izole edin
- FACS aygıtını ve bilgisayarı açın. FACS cihazını çalıştırmak ve çalıştırmak üzere bilgisayarda FACS yazılımını açmak için FACS yazılımı simgesine tıklayın. Rutin kalite kontrol testleri yapın.
- Eksenleri ayarlamak için kontrol lekeli numuneleri FACS cihazına yükleyin. FSC ve SSC üretmek ve ayarlamak için yalnızca IgG antikoru hücreleri ile başlayın, daha sonra CD31 oluşturmak ve ayarlamak için CD31 antikoru ve daha sonra CD45 üretmek ve ayarlamak için CD45 antikoru ile başlayın. Kontrol örneklerinden veri kaydedin.
- Lekeli numune hücrelerini FACS cihazına yükleyin ve numuneyi çalıştırın.
- İleri saçılma ve yan saçılma (sırasıyla FSC-A ve SSC-A) parametrelerine göre hücreleri kapılayın (Şekil 2A).
NOT: FSC-A ve SSC-A parametreleri, hücreleri boyuta, yoğunluğa, ayrıntılılığa, yüzey özelliklerine ve kırılma indisine göre seçmek için kullanılır. - FSC-A ve FSC-H ile hücre çiftlerini tanımlamak ve sadece tek hücreleri toplamak için kapı hücreleri (Şekil 2A).
NOT: FSC-A ve FSC-H parametreleri, ileri saçılma sırasında hücre çiftlerinin daha büyük bir alan-yükseklik oranı içeren damlacıklar olacağı ilkesine dayanarak tek hücreleri seçmek için kullanılır. - Canlı hücreleri tanımlamak için PI ve SSC-A ile kapı hücreleri (Şekil 2A).
NOT: Canlı hücreler PI-negatif olacaktır. - CD31 ve CD45 ile kontrolleri ve kapı hücreleri ile CD31+/CD45- kapısı yapın (Şekil 2A,B).
- 250 μL FACS tamponlu bir toplama tüpü takın.
- CD31 pozitif/CD45 negatif hücreleri yüklü toplama tüpüne sıralamaya başlayın.
- Daha fazla analiz için toplama tüplerini buz üzerinde tutun. Bu adım1'de yeni nesil dizileme uygulamaları için numuneler işlenebilir.
9. Uygulanabilirlik testi yapın
- Hücre canlılığını değerlendirmek için 10 μL hücreyi 10 μL% 0.4 tripan mavisi çözeltisi ile karıştırın.
- Lekeli karışımı bir hemositometre slaytına pipetleyerek canlı hücreleri sayın. Doğru canlılık sayıları için slaytı mikroskop altına yerleştirin. Mavi hücreleri canlı olmayan olarak sayın ve berrak hücreleri canlı olarak sayın.
- Canlılık yüzdesini hesaplamak için canlı hücre sayısını toplam hücre sayısına bölün.
10. Gen ekspresyon testi yapın
- Numune başına 10.000-20.000 hücre elde edin ve murin retinal endotel hücre gen ekspresyonunu analiz etmek için RNA izolasyonu gerçekleştirin. RNA izolasyonu, etanol bazlı RNA çökeltmesi kullanan ticari olarak temin edilebilen bir kit ve daha sonra saflaştırılmış RNA'yı hücre lizatından yıkamak ve elden çıkarmak için santrifüjleme ve membran sütunları kullanılarak gerçekleştirilir. Bu adım1'de bazı yeni nesil dizileme uygulamaları için numuneler işlenebilir.
- Ters transkriptaz enzimi ve destekleyici reaktifler19 kullanarak RNA'yı cDNA'ya dönüştürün.
- DNA bağlayıcı bir boya ve kantitatif PCR (qPCR) makinesi kullanarak sayısallaştırmayapın 20. İlgilenilen genleri yükseltmek için cDNA örneklerini astarlı 384 kuyucuklu bir qPCR plakasına yükleyin. Reaksiyon hacmi, gen amplifikasyonunu ölçmek için kullanılacak olan DNA bağlayıcı boya da dahil olmak üzere toplam 10 μL'ye ulaşmalıdır.
- Gen ekspresyonunu ölçmek için CD31, VE-Kadherin, CD45 ve β-aktin ileri ve geri primerleri kullanın.
- Yeni nesil sıralama uygulamaları için örneği kullanın1.
Sonuçlar
CD31 ve CD45 için retina dokusunun sindirimi ve immünoboyama, hücreler, tek hücreler ve canlılık için geçişten sonra CD31 + / CD45 endotel hücrelerinin tanımlanabilir bir popülasyonu ile sonuçlanır (Şekil 2A). CD45 immün boyaması, trombositleri ve bazı lökositleri içeren CD31 + / CD45 + hücrelerini ortadan kaldırmak için gereklidir21. Her deneyde antikor özgüllüğünü göstermek ve geçiş stratejisini yönlendirmek için kontroller yapılma...
Tartışmalar
Bu protokol, endotel hücrelerinin doğum sonrası murin retina dokusundan izole edilmesi için yüksek hücre sayısı, saflık ve canlılık için optimize edilmiş bir yöntemi açıklamaktadır. Hücre saflığı, endotel hücre popülasyonlarının CD31+/CD45- immün boyama ile sindirilmiş tek hücreli süspansiyondan FACS izolasyonu ile elde edilir. İzolasyon kalitesi, CD31, CD45 ve VE-Cadherin için qPCR ile Trypan mavi boyama ve gen ekspresyonu ile canlılık testlerinde ölçülür (VE-Cadherin immün boyama i...
Açıklamalar
Yazarların konuyla ilgili herhangi bir açıklaması yoktur.
Teşekkürler
Yale Akış Sitometri Tesisi, Virginia Üniversitesi Akış Sitometrisi Çekirdek Tesisi, Yale Genomik Analiz Merkezi ve Virginia Üniversitesi Genom Analizi ve Teknoloji Çekirdeği'ne, sunulan deneylere katkıda bulunma konusundaki çabaları, uzmanlıkları ve tavsiyeleri için teşekkür ederiz. Bu çalışma, N.W.C. (T32 HL007224, T32 HL007284), S.C. (T32 HL007284), K.W. (R01 HL142650) ve K.K.H. (R01 HL146056, R01 DK118728, UH3 EB025765) için NIH hibeleri ile finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2 mL Eppendorf safe-lock tubes | USA Scientific | 4036-3352 | |
| 5 ml Falcon Test Tubes with Cell Strainer Snap Cap | Corning | 352235 | |
| 60 mm Non TC-treated Culture Dish | Corning | 430589 | |
| APC Rat Anti-Mouse CD31 | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control | BD Biosciences | 553932 | |
| BD FACSChorus Software | BD Biosciences | FACSCHORUS | |
| BD FACSMelody Cell Sorter | BD Biosciences | FACSMELODY | |
| Collagenase Type II | Sigma-Aldrich | 234115 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| D-Glucose | Gibco | A2494001 | |
| Disposable Graduated Transfer Pipettes | Fisher Scientific | 12-711-9AM | |
| Dissecting Pan Wax | Carolina | 629100 | |
| Dissection scissors | Fine Science Tools | 14085-08 | |
| Dissection Stereo Microscope M165 FC | Leica | M165FC | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-052 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Eppendorf Flex-Tubes Microcentrifuge Tubes 1.5 mL | Sigma-Aldrich | 22364120 | |
| Fetal Bovine Serum (FBS) | Gemini Bio | 100-106 | |
| Fine dissection forceps | Fine Science Tools | 11250-00 | |
| Hank's Buffered Salt Solution (HBSS) | Gibco | 14175095 | |
| HEPES (1M) | Gibco | 15630130 | |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane, USP | Covetrus | 11695067772 | |
| Isotemp General Purpose Deluxe Water Bath | Fisher Scientific | FSGPD20 | |
| Primer: ActB_Forward: 5’- agagggaaatcgtgcgtgac -3’ | Integrated DNA Technologies | N/A | |
| Primer: ActB_Reverse: 5’- caatagtgatgacctggccgt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Forward: 5’- gagcccaatcacgtttcagttt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Reverse: 5’- tccttcctgcttcttgctagct -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Forward: 5’- gggttgttctgtgccttgtt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Reverse: 5’- ctggacggacacagttagca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Forward: 5’- tcctctgcatcctcactatcaca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Reverse: 5’- gtaagtgaccaactgctcgtgaat -3’ | Integrated DNA Technologies | N/A | |
| Propidium iodide | Sigma-Aldrich | P4864 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| Sorvall Legend Micro 21R Centrifuge, Refrigerated | ThermoFisher | 75002477 | |
| SYBR-Green iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5120 | |
| Trypan Blue Solution | ThermoFisher | 15250061 | |
| V450 Rat Anti-Mouse CD45 | BD Biosciences | 560501 | |
| V450 Rat IgG2b, κ Isotype Control | BD Biosciences | 560457 |
Referanslar
- Slatko, B. E., Gardner, A. F., Ausubel, F. M. Overview of next-generation sequencing technologies. Current Protocols in Molecular Biology. 122 (1), 59 (2018).
- Chavkin, N. W., Hirschi, K. K. Single cell analysis in vascular biology. Frontiers in Cardiovascular Medicine. 7, 42 (2020).
- Ma, F., Hernandez, G. E., Romay, M., Iruela-Arispe, M. L. Single-cell RNA sequencing to study vascular diversity and function. Current Opinion in Hematology. 28 (3), 221-229 (2021).
- Potter, A. S., Potter, S. S., S, Dissociation of tissues for single-cell analysis. Methods in Molecular Biology. 1926, 55-62 (2019).
- Braga, F. A. V., Miragaia, R. J. Tissue handling and dissociation for single-cell RNA-seq. Single Cell Methods: Methods in Molecular Biology. 1979, 9-21 (2019).
- Brink, S. C., et al. Single-cell sequencing reveals dissociatin-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Skulska, K., Wegrzyn, A. S., Chelmonska-Soyta, A., Chodaczek, G. Impact of tissue enzymatic digestion on analysis of immune cells in mouse reproductive mucosa with a focus on gammadelta T cells. Journal of Immunological Methods. 474, 112665 (2019).
- Connolly, S., Hores, T., Smith, L., D'Amore, P. Characterization of vascular development in the mouse retina. Microvascular Research. 36 (3), 275-290 (1988).
- Crist, A., Young, C., Meadows, S. Characterization of arteriovenous identity in the developing neonate mouse retina. Gene Expression Patterns: GEP. 23-24, 22-31 (2017).
- dela Paz, N. G., D'Amore, P. A. Arterial versus venous endothelial cells. Cell and Tissue Research. 335 (1), 5-16 (2009).
- Fang, J. S., Hirschi, K. K. Molecular regulation of arteriovenous endothelial cell specification. F1000Res. 8, (2019).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology and Visual Science. 35 (1), 101-111 (1994).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nature Protocols. 5 (9), 1518-1534 (2010).
- Ruiz, S., et al. A mouse model of hereditary hemorrhagic telangiectasia generated by transmammary-delivered immunoblocking of BMP9 and BMP10. Scientific Reports. 6, 37366 (2016).
- Fang, J. S., et al. Shear-induced Notch-Cx37-p27 axis arrests endothelial cell cycle to enable arterial specification. Nature Communication. 8 (1), 2149 (2017).
- Ola, R., et al. SMAD4 prevents flow induced arterial-venous malformations by inhibiting Casein Kinase 2. Circulation. 138 (21), 2379-2394 (2018).
- Chavkin, N. W., Walsh, K., Hirschi, K. K. Isolation of highly purified and viable retinal endothelial cells. Journal of Vascular Research. 58 (1), 49-57 (2020).
- Hulspas, R., O'Gorman, M. R. G., Wood, B. L., Gratama, J. W., Sutherland, D. R. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry PartB: Clinical Cytometry. 76 (6), 355-364 (2009).
- Bachman, J. Reverse-transcription PCR (RT-PCR). Methods in Enzymology. 530, 67-74 (2013).
- Green, M. R., Sambrook, J. Quantification of RNA by real-time Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Cold Spring Harbour Protocols. 2018 (10), (2018).
- Liu, L., Shi, G. P. CD31: beyond a marker for endothelial cells. Cardiovascular Research. 94 (1), 3-5 (2012).
- Zarkada, G., et al. Specialized endothelial tip cells guide neuroretina vascularization and blood-retina-barrier formation. Developmental Cell. 56 (15), 2237-2251 (2021).
- Su, X., Sorenson, C. M., Sheibani, N. Isolation and characterization of murine retinal endothelial cells. Molecular Vision. 9, 171-178 (2003).
- Benedito, R., et al. The notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis. Cell. 137 (6), 1124-1135 (2009).
- Daneman, R., et al. Wnt/beta-catenin signaling is required for CNS, but not non-CNS, angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 641-646 (2009).
- Okabe, K., et al. Neurons limit angiogenesis by titrating VEGF in retina. Cell. 159 (3), 584-596 (2014).
- Crist, A. M., Lee, A. R., Patel, N. R., Westhoff, D. E., Meadows, S. M. Vascular deficiency of Smad4 causes arteriovenous malformations: a mouse model of Hereditary Hemorrhagic Telangiectasia. Angiogenesis. 21 (2), 363-380 (2018).
- Kim, Y. H., Choe, S. W., Chae, M. Y., Hong, S., Oh, S. P. SMAD4 deficiency leads to development of arteriovenous malformations in neonatal and adult mice. Journal of the American Heart Association. 7 (21), 009514 (2018).
- Ma, W., et al. Absence of TGFbeta signaling in retinal microglia induces retinal degeneration and exacerbates choroidal neovascularization. eLife. 8, 42049 (2019).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2021).
- Lawson, N. D., Vogel, A. M., Weinstein, B. M. sonic hedgehog and vascular endothelial growth factor act upstream of the Notch pathway during arterial endothelial differentiation. Developmental Cell. 3 (1), 127-136 (2002).
- Larrivee, B., et al. ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway. Developmental Cell. 22 (3), 489-500 (2012).
- Wythe, J. D., et al. ETS factors regulate Vegf-dependent arterial specification. Developmental Cell. 26 (1), 45-58 (2013).
- Davis, D. M., Purvis, J. E. Computational analysis of signaling patterns in single cells. Seminars in Cell and Developmental Biology. , 35-43 (2015).
- Gaudet, S., Miller-Jensen, K. Redefining signaling pathways with an expanding single-cell toolbox. Trends in Biotechnology. 34 (6), 458-469 (2016).
- Aibar, S., et al. SCENIC: single-cell regulatory network inference and clustering. Nature Methods. 14 (11), 1083-1086 (2017).
- Trapnell, C., et al. The dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells. Nature Biotechnology. 32 (4), 381-386 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır