Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение эндотелиальных клеток мышиной сетчатки для секвенирования следующего поколения
В этой статье
Резюме
Этот протокол описывает метод выделения мышиных постнатальных эндотелиальных клеток сетчатки, оптимизированных для выхода клеток, чистоты и жизнеспособности. Эти клетки подходят для подходов к секвенированию следующего поколения.
Аннотация
Недавние улучшения в секвенировании следующего поколения расширили знания исследователей о молекулярной и клеточной биологии, а несколько исследований выявили новые парадигмы в сосудистой биологии. Применение этих методов к моделям развития сосудов требует оптимизации методов выделения клеток из эмбриональных и постнатальных тканей. Выход, жизнеспособность и чистота клеток должны быть максимальными, чтобы получить точные и воспроизводимые результаты от подходов к секвенированию следующего поколения. Модель васкуляризации сетчатки неонатальной мыши используется исследователями для изучения механизмов развития сосудов. Исследователи использовали эту модель для изучения механизмов ангиогенеза и спецификации артериально-венозной судьбы во время формирования и созревания кровеносных сосудов. Применение методов секвенирования следующего поколения для изучения модели развития сосудов сетчатки требует оптимизации метода выделения эндотелиальных клеток сетчатки, который максимизирует выход клеток, жизнеспособность и чистоту. Этот протокол описывает метод выделения, переваривания и очистки мышиной ткани сетчатки с использованием флуоресцентно-активированной клеточной сортировки (FACS). Результаты показывают, что очищенная FACS популяция CD31+/CD45-эндотелиальных клеток высоко обогащена экспрессией генов эндотелиальных клеток и не демонстрирует изменений жизнеспособности в течение 60 мин после FACS. Включены репрезентативные результаты подходов к секвенированию следующего поколения на эндотелиальных клетках, выделенных с использованием этого метода, включая объемное секвенирование РНК и секвенирование одноклеточной РНК, демонстрируя, что этот метод изоляции эндотелиальных клеток сетчатки совместим с приложениями секвенирования следующего поколения. Этот метод изоляции эндотелиальных клеток сетчатки позволит использовать передовые методы секвенирования для выявления новых механизмов развития сосудов.
Введение
Высокая пропускная способность секвенирования нуклеиновых кислот с помощью подходов к секвенированию следующего поколения значительно расширила знания исследователей в области молекулярной и клеточной биологии. Эти передовые методы включают секвенирование РНК всего транскриптома, секвенирование ДНК целевых областей для идентификации однонуклеотидных полиморфизмов (SNP), секвенирование ДНК связанных факторов транскрипции в секвенировании иммунопреципитации хроматина (ChIP) или открытые области хроматина в анализе для секвенирования транспозазно-доступного хроматина (ATAC) и секвенирование одноклеточной РНК1 . В сосудистой биологии эти достижения позволили исследователям прояснить сложные механизмы развития и заболевания, а также различать паттерны экспрессии генов в континууме различных фенотипов 2,3. Будущие эксперименты могут дополнительно определить сложные механизмы, объединив секвенирование следующего поколения с оцененными моделями развития сосудов, но методы подготовки образцов должны быть совместимы с передовыми методами секвенирования.
Качество, точность и воспроизводимость подходов к секвенированию следующего поколения зависят от метода подготовки образцов. При выделении подмножества клеток или генерации одноклеточных суспензий из тканей оптимальные методы пищеварения и очистки необходимы для максимизации количества клеток, жизнеспособности и чистоты клеточной популяции 4,5. Это требует баланса в методе пищеварения: сильное пищеварение необходимо для высвобождения клеток из ткани и получения достаточного количества клеток для последующих подходов, но жизнеспособность клеток будет негативно затронута, если пищеварение слишкомсильное 6,7. Кроме того, чистота клеточной популяции необходима для надежных результатов и точного анализа данных, который может быть выполнен с помощью FACS. Это подчеркивает важность оптимизации методов изоляции клеток для применения секвенирования следующего поколения к установленным моделям развития сосудов.
Хорошо охарактеризованной моделью для исследования развития сосудов является модель развития сосудов сетчатки мышей. Мышная сосудистая сетчатка развивается постнатально в двумерном поверхностном сплетении, с начальным ангиогенным прорастанием из зрительного нерва, видимым на постнатальный день (P)3, ангиогенным фронтом со стеблевыми и кончиковыми клетками и начальным созреванием сосудов, видимым при P6, и созреванием сосудистого сплетения, видимым после P9 8,9. Во время ремоделирования начального сосудистого сплетения эндотелиальные клетки подвергаются спецификации в отношении артериальных, капиллярных и венозных фенотипов в разных сосудах для создания кровеносной сети10,11. Таким образом, этот метод позволяет исследователям визуализировать формирование ангиогенного сосудистого сплетения и эндотелиальную артериально-венозную спецификацию и созревание в различные моменты времени во время развития9. Кроме того, данная модель предоставляет метод исследования влияния трансгенных манипуляций на ангиогенез и развитие сосудистого сплетения, который был применен для исследования развития сосудов, артериально-венозных мальформаций и кислород-индуцированной неоваскуляризации 12,13,14,15,16 . Чтобы объединить подходы секвенирования следующего поколения с моделью развития сосудов сетчатки мышей, необходим оптимизированный протокол выделения эндотелиальных клеток из ткани сетчатки.
Этот протокол описывает оптимизированный метод переваривания ткани сетчатки у мышей при Р6 для максимизации выхода клеток, чистоты и жизнеспособности. Ткань сетчатки выделяют у мышей P6, переваривают в течение 20 мин, иммунораступят для CD31 и CD45 и очищают через FACS для выделения одноклеточной суспензии эндотелиальных клеток примерно через 2,5 ч (рисунок 1A). Было обнаружено, что эти эндотелиальные клетки сохраняют высокую жизнеспособность в течение 60 мин после изоляции17, что позволяет подготовить библиотеку к методам секвенирования следующего поколения. Кроме того, репрезентативные результаты предоставляются для facS-мониторинга и результатов контроля качества двух отдельных методов секвенирования следующего поколения с использованием этого протокола изоляции: секвенирование РНК всего транскриптома и секвенирование одноклеточной РНК. Этот метод позволяет использовать подходы секвенирования следующего поколения в сочетании с моделью васкуляризации сетчатки для выяснения новых механизмов развития сосудов.
протокол
Институциональные комитеты по уходу за животными и их использованию Йельского университета и Университета Вирджинии одобрили все эксперименты на животных, перечисленные в этом протоколе.
1. Получите мышиные глаза для изоляции сетчатки
- Приготовьте 1x ледяного PBS и добавьте 500 мкл в каждую лунку 48-луночной пластины.
- Эвтаназия неонатальных мышей на шестой послеродовой день (P6) в соответствии с утвержденными институциональными руководящими принципами. Для этого эксперимента пометы примерно 4-8 неонатальных мышей усыпляются в P6 путем вдыхания изофлурана в течение не менее трех минут после остановки дыхания с последующим обезглавливанием.
- Удалите глаза у каждой из мышей. Отрежьте кожу и мембрану над глазом, разрезав перпендикулярно веку с помощью ножниц для рассечения. Затем используйте щипцы, чтобы мягко надавить на глаз и под глазом, чтобы глаз двигался из гнезда.
- Осторожно зажмите под глаз щипцами и перережьте зрительный нерв, который держит глаз прикрепленным. Затем поместите каждый глаз в 48-луночную пластину в подготовленный 1x ледяной PBS до окончания сбора урожая.
ПРИМЕЧАНИЕ: Используйте один колодец на мышь, с обоими глазами от одной мыши в одном колодце.
- Осторожно зажмите под глаз щипцами и перережьте зрительный нерв, который держит глаз прикрепленным. Затем поместите каждый глаз в 48-луночную пластину в подготовленный 1x ледяной PBS до окончания сбора урожая.
2. Изолируйте ткань сетчатки мыши
- Наполните чашку Петри, выложенную панелью для рассечения на дне, 500 мкл 1x ледяного PBS, чтобы погрузить глаза и поместить ее под рассеченный микроскоп, установленный на 4,0-кратное увеличение.
- Подвешивайте глаза в подушечке для рассечения с помощью переносной пипетки с широким кончиком, чтобы не повредить глаза.
ПРИМЕЧАНИЕ: Убедитесь, что глаза полностью покрыты PBS.
- Подвешивайте глаза в подушечке для рассечения с помощью переносной пипетки с широким кончиком, чтобы не повредить глаза.
- Используя два тонких рассеченных щипца, удерживайте зрительный нерв одним из щипцов для стабилизации, а вторыми щипцами прокалывайте отверстие через переднюю камеру, где соединяются роговица и склера (рисунок 1B). Разорвите отверстие по кругу примерно на 75% пути вокруг роговицы.
- Все еще удерживая зрительный нерв одним из щипцов, используйте второй щипц, чтобы аккуратно оторвать склеру от ткани сетчатки.
- Как указано выше, используйте вторые щипцы, чтобы аккуратно оторвать стекловидное тело ткани сетчатки.
- Опять же, используя вторые щипцы, аккуратно удалите хрусталик и сосуды гиалоидного сплетения, которые не оторвались при удалении стекловидного тела. Для этого доберитесь до сетчатки открытыми щипцами до почти прикосновения к сетчатке, закройте щипцы, чтобы схватить хрусталик и сосуды подъязычного сплетения, и вытащите щипцы из сетчатки. Это можно повторять до тех пор, пока не будут удалены все сосуды.
ПРИМЕЧАНИЕ: Гиалоидное сплетение напоминает четкую, похожую на паутину структуру.
- Заполните 2 мл микроцентрифужных трубок 500 мкл 1x ледяного PBS и поместите сетчатку в трубки. Изолируйте все сетчатки от глаз и поместите их в ледяной PBS, прежде чем двигаться дальше.
ПРИМЕЧАНИЕ: Используйте одну трубку на мышь, с двумя сетчатками от одной и той же мыши, разделяющей трубку. Если ткань сетчатки разорвана, перенесите ее несколькими кусками. Общее время рассечения ткани сетчатки для помета мышей должно составлять 15-60 мин, начиная с эвтаназии и заканчивая окончательным выделением ткани сетчатки.
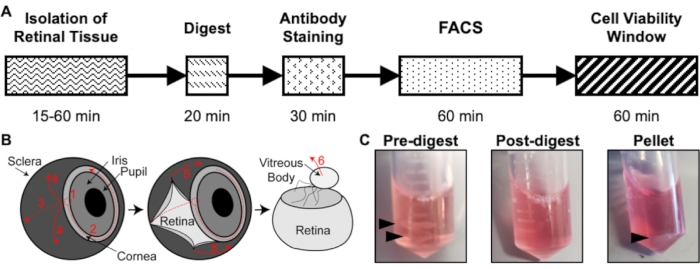
Рисунок 1: Обзор протокола изоляции. (A) Схема временной шкалы изоляции с предполагаемым временем для каждого этапа: изоляция ткани сетчатки, пищеварение, окрашивание антител, FACS и окно жизнеспособности клеток. (B) Пошаговое руководство по выделению ткани сетчатки из глаза, с пронумерованными этапами рассечения: 1) прокалывание роговицы, 2) слезная роговица, 3) слезная склера, 4) удаление склеры из сетчатки, 5) дальнейшее удаление склеры и соединительной ткани из сетчатки, 6) удаление стекловидного тела и стекловидных сосудов из сетчатки. (C) Репрезентативные изображения ткани сетчатки на различных этапах пищеварения: до пищеварения, после переваривания, гранулы (черные стрелки выделяют ткань сетчатки или клеточную гранулу). Переиздано с разрешения Чавкина и др., опубликовано в S. Karger AG, Basel17. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Переварите ткань сетчатки в одну клеточную суспензию
- Приготовьте 500 мкл раствора для пищеварения на каждые две выделенные сетчатки. Добавьте FBS и коллагеназу типа II к DMEM до конечной концентрации 10% FBS и 1 мг/мл коллагеназы типа II. Смешайте и подогрейте раствор до 37 °C с помощью водяной бани.
- Удалите излишки PBS из микроцентрифужных трубок объемом 2 мл путем тщательного пипетирования. Оставьте достаточно PBS, чтобы полностью покрыть ткань сетчатки, около 100 мкл в каждой трубке.
- Добавьте 500 мкл раствора для пищеварения в каждый пробирок с тканью сетчатки (рисунок 1С).
- Используйте пипеттор P1000 и наконечник пипетки для пипетки вверх и вниз по ткани сетчатки в растворе для пищеварения пять раз.
- Инкубируйте смесь для пищеварения на водяной бане при температуре 37 °C в течение 20 мин.
- Используйте пипетку P1000 и наконечник пипетки, чтобы пипетку смеси для пищеварения вверх и вниз каждые 5 минут. После инкубации ткань сетчатки растворилась в одноклеточную суспензию, поэтому смесь для пищеварения должна быть мутной (рисунок 1С).
4. Подсчет ячеек
- Установите настольную центрифугу при температуре 4 °C и поместите внутрь трубки смеси для пищеварения. Гранулируют смесь для сбраживания центрифугированием при 375 х г в течение 5 мин.
- Осторожно удалите раствор супернатанта для сбраживания путем пипетки. Не мешайте клетке гранулы (рисунок 1С). Повторно суспендируйте гранулу в 500 мкл ледяного 1x PBS, осторожно смешивая вверх и вниз с пипеткой.
- Подсчитайте клетки с помощью гемоцитометра под микроскопом.
ПРИМЕЧАНИЕ: Количество клеток составляет приблизительно 1 х 106 клеток на две сетчатки. - Убедитесь, что клетки должным образом повторно суспендированы путем мягкого перемешивания, а затем аликвотирование 20 мкл клеточной суспензии в три трубки для контрольного окрашивания (трубка 1: контроль IgG, трубка 2: контроль CD31 и трубка 3: контроль CD45), как описано и использовалось ранее17,18.
- Установите настольную центрифугу при 4 °C и поместите внутрь трубки, содержащие ячейки. Гранулируют клетки центрифугированием при 375 х г в течение 5 мин.
5. Иммуноокрашивание клеток антителами
- Подготовьте 100 мкл окрашивающего буфера на две окрашенные сетчатки плюс четыре контрольные трубки. Добавьте FBS, HEPES и D-глюкозу в буфер HBSS до конечной концентрации 10% FBS, 10 мМ HEPES и 1 мг/мл D-глюкозы.
- Получение флуоресцентно конъюгированных антител против CD31 и CD45. Добавьте антитела в разведении 1:100 в буфер окрашивания (трубка 1: только антитела IgG, трубка 2: только антитело CD31 и трубка 3: только антитело CD45). Добавьте 1 мкл антитела на 100 мкл окрашивающего буфера для конечной концентрации антител 2 мкг/мл.
- Осторожно извлеките ПБС из промытой ячейки гранулы путем пипетки.
- Повторно суспендируют гранулу в 100 мкл раствора для окрашивания антител на 0,5 х 106 клеток.
- Инкубировать одноклеточную суспензию с раствором для окрашивания антител в течение 30 мин на льду в темноте. Постукивайте по трубкам каждые 10 минут, чтобы аккуратно перемешать клетки.
6. Подготовьтесь к флуоресцентно-активированной сортировке клеток
- Установите настольную центрифугу при 4 °C и поместите внутрь трубки, содержащие ячейки. Пеллетные ячейки центрифугированием при 375 х г в течение 5 мин.
- Удалите супернатант и повторно суспендируйте эти клетки в 500 мкл 1x PBS для промывки.
- Установите настольную центрифугу при 4 °C и поместите внутрь трубки, содержащие ячейки. Пеллетные ячейки центрифугированием при 375 х г в течение 5 мин
- Подготовьте 1,5 мл буфера FACS (1% FBS в 1x PBS).
- Удалите супернатант и повторно суспендируйте гранулу ячейки в 300 мкл буфера FACS путем осторожного смешивания с пипеттором.
- Добавить йодид пропидия (PI) в пробирки, содержащие буфер FACS, до конечной концентрации 0,5 мкг/мл. PI используется в качестве маркера жизнеспособности.
- Перенесите и объедините клеточные суспензии в пробирки по 5 мл через защелкивающийся колпачок клеточного ситечка. Защелкивающийся колпачок клеточного сетчатого фильтра должен содержать фильтр 35 мкм, а клеточные суспензии могут быть пипетированы непосредственно на фильтр.
- Держите трубки FACS на льду в темноте и перенесите их в сортировщик ячеек.
7. Настройка инструмента СУИМ
- Установите сопло 100 мкм в прибор FACS.
ПРИМЕЧАНИЕ: Такое размерное сопло минимизирует объем сбора и максимизирует изолированную плотность ячеек. - Подготовьте 250 мкл 1x PBS в микроцентрифужную трубку объемом 1,5 мл в качестве коллекторной трубки для установки в прибор FACS.
8. Выделение жизнеспособных эндотелиальных клеток с помощью FACS
- Включите прибор FACS и компьютер. Щелкните значок программного обеспечения FACS, чтобы открыть программное обеспечение FACS на компьютере для запуска и эксплуатации прибора FACS. Выполняйте регулярные тесты контроля качества.
- Загрузите контрольные окрашенные образцы в прибор FACS для регулировки осей. Начните с клеток только с антител IgG для генерации и настройки FSC и SSC, затем CD31-антитела только для генерации и настройки CD31, а затем CD45-антитела только для генерации и настройки CD45. Запись данных из контрольных образцов.
- Загрузите окрашенные ячейки образца в прибор FACS и запустите образец.
- Затвор ячеек на основе параметров прямого рассеяния и бокового рассеяния (FSC-A и SSC-A соответственно) (рисунок 2A).
ПРИМЕЧАНИЕ: Параметры FSC-A и SSC-A используются для выбора ячеек на основе размера, плотности, зернистости, свойств поверхности и показателя преломления. - Затворные ячейки FSC-A и FSC-H для идентификации дублетов клеток и сбора только одиночных ячеек (рисунок 2A).
ПРИМЕЧАНИЕ: Параметры FSC-A и FSC-H используются для выбора одиночных ячеек на основе принципа, согласно которому во время прямого рассеяния дублеты ячеек будут представлять собой капли, содержащие большее отношение площади к высоте. - Затворные ячейки по PI и SSC-A для идентификации жизнеспособных ячеек (рисунок 2A).
ПРИМЕЧАНИЕ: Жизнеспособные клетки будут PI-отрицательными. - Изготовьте затвор CD31+/CD45- с элементами управления и затворными ячейками CD31 и CD45 (рисунок 2A,B).
- Вставьте коллекторную трубку с буфером FACS объемом 250 мкл.
- Начните сортировку cd31-положительных/CD45-отрицательных ячеек в установленной коллекторной трубке.
- Храните сборные трубки на льду для дальнейшего анализа. Образцы могут быть обработаны для приложений секвенирования следующего поколения на этом шаге1.
9. Выполните анализ жизнеспособности
- Смешайте 10 мкл клеток с 10 мкл 0,4% раствора трипана синего цвета для оценки жизнеспособности клеток.
- Подсчитайте жизнеспособные клетки, пипетируя окрашенную смесь на слайд гемоцитометра. Поместите слайд под микроскоп для точного подсчета жизнеспособности. Подсчитывайте синие клетки как нежизнеспособные и подсчитывайте прозрачные клетки как жизнеспособные.
- Разделите количество жизнеспособных клеток на общее количество клеток, чтобы рассчитать процент жизнеспособности.
10. Выполните анализ экспрессии генов
- Получите 10 000-20 000 клеток на образец и выполните выделение РНК для анализа экспрессии генов эндотелиальных клеток мышей сетчатки. Изоляция РНК выполняется с использованием коммерчески доступного набора, который использует осаждение РНК на основе этанола, а затем центрифугирование и мембранные колонны для промывки и элюирования очищенной РНК из клеточного лизата. Образцы могут быть обработаны для некоторых приложений виртуализации следующего поколения на этом шаге1.
- Преобразуйте РНК в кДНК с помощью фермента обратной транскриптазы и поддерживающих реагентов19.
- Количественная оценка с использованием ДНК-связывающего красителя и количественной машины ПЦР (qPCR)20. Загрузите образцы кДНК в 384-луночную пластину qPCR с праймерами для амплификации генов, представляющих интерес. Объем реакции должен составлять 10 мкл, включая краситель для связывания ДНК, который будет использоваться для количественной оценки амплификации генов.
- Используйте CD31, VE-Cadherin, CD45 и β-актиновые прямые и обратные праймеры для измерения экспрессии генов.
- Используйте этот пример для приложений виртуализации следующего поколения1.
Результаты
Переваривание ткани сетчатки и иммуноокрашивание CD31 и CD45 приводит к идентифицируемой популяции CD31 + / CD45- эндотелиальных клеток после обнаружения клеток, отдельных клеток и жизнеспособности (рисунок 2A). Иммуноокрашивание CD45 требуется для устранения клеток CD31 + / CD45 +, кот?...
Обсуждение
Этот протокол описывает метод выделения эндотелиальных клеток из постнатальной мышиной ткани сетчатки, который был оптимизирован для высокого количества клеток, чистоты и жизнеспособности. Чистота клеток достигается путем выделения FACS популяций эндотелиальных клеток из переваренн?...
Раскрытие информации
Авторы не имеют соответствующих раскрытий.
Благодарности
Спасибо Йельскому центру проточной цитометрии, Центру проточной цитометрии Университета Вирджинии, Йельскому центру геномного анализа и Технологическому ядру Университета Вирджинии за их усилия, опыт и советы по участию в представленных экспериментах. Это исследование финансировалось грантами NIH N.W.C. (T32 HL007224, T32 HL007284), S.C. (T32 HL007284), K.W. (R01 HL142650) и K.K.H. (R01 HL146056, R01 DK118728, UH3 EB025765).
Материалы
| Name | Company | Catalog Number | Comments |
| 2 mL Eppendorf safe-lock tubes | USA Scientific | 4036-3352 | |
| 5 ml Falcon Test Tubes with Cell Strainer Snap Cap | Corning | 352235 | |
| 60 mm Non TC-treated Culture Dish | Corning | 430589 | |
| APC Rat Anti-Mouse CD31 | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control | BD Biosciences | 553932 | |
| BD FACSChorus Software | BD Biosciences | FACSCHORUS | |
| BD FACSMelody Cell Sorter | BD Biosciences | FACSMELODY | |
| Collagenase Type II | Sigma-Aldrich | 234115 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| D-Glucose | Gibco | A2494001 | |
| Disposable Graduated Transfer Pipettes | Fisher Scientific | 12-711-9AM | |
| Dissecting Pan Wax | Carolina | 629100 | |
| Dissection scissors | Fine Science Tools | 14085-08 | |
| Dissection Stereo Microscope M165 FC | Leica | M165FC | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-052 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Eppendorf Flex-Tubes Microcentrifuge Tubes 1.5 mL | Sigma-Aldrich | 22364120 | |
| Fetal Bovine Serum (FBS) | Gemini Bio | 100-106 | |
| Fine dissection forceps | Fine Science Tools | 11250-00 | |
| Hank's Buffered Salt Solution (HBSS) | Gibco | 14175095 | |
| HEPES (1M) | Gibco | 15630130 | |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane, USP | Covetrus | 11695067772 | |
| Isotemp General Purpose Deluxe Water Bath | Fisher Scientific | FSGPD20 | |
| Primer: ActB_Forward: 5’- agagggaaatcgtgcgtgac -3’ | Integrated DNA Technologies | N/A | |
| Primer: ActB_Reverse: 5’- caatagtgatgacctggccgt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Forward: 5’- gagcccaatcacgtttcagttt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Reverse: 5’- tccttcctgcttcttgctagct -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Forward: 5’- gggttgttctgtgccttgtt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Reverse: 5’- ctggacggacacagttagca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Forward: 5’- tcctctgcatcctcactatcaca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Reverse: 5’- gtaagtgaccaactgctcgtgaat -3’ | Integrated DNA Technologies | N/A | |
| Propidium iodide | Sigma-Aldrich | P4864 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| Sorvall Legend Micro 21R Centrifuge, Refrigerated | ThermoFisher | 75002477 | |
| SYBR-Green iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5120 | |
| Trypan Blue Solution | ThermoFisher | 15250061 | |
| V450 Rat Anti-Mouse CD45 | BD Biosciences | 560501 | |
| V450 Rat IgG2b, κ Isotype Control | BD Biosciences | 560457 |
Ссылки
- Slatko, B. E., Gardner, A. F., Ausubel, F. M. Overview of next-generation sequencing technologies. Current Protocols in Molecular Biology. 122 (1), 59 (2018).
- Chavkin, N. W., Hirschi, K. K. Single cell analysis in vascular biology. Frontiers in Cardiovascular Medicine. 7, 42 (2020).
- Ma, F., Hernandez, G. E., Romay, M., Iruela-Arispe, M. L. Single-cell RNA sequencing to study vascular diversity and function. Current Opinion in Hematology. 28 (3), 221-229 (2021).
- Potter, A. S., Potter, S. S., S, Dissociation of tissues for single-cell analysis. Methods in Molecular Biology. 1926, 55-62 (2019).
- Braga, F. A. V., Miragaia, R. J. Tissue handling and dissociation for single-cell RNA-seq. Single Cell Methods: Methods in Molecular Biology. 1979, 9-21 (2019).
- Brink, S. C., et al. Single-cell sequencing reveals dissociatin-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Skulska, K., Wegrzyn, A. S., Chelmonska-Soyta, A., Chodaczek, G. Impact of tissue enzymatic digestion on analysis of immune cells in mouse reproductive mucosa with a focus on gammadelta T cells. Journal of Immunological Methods. 474, 112665 (2019).
- Connolly, S., Hores, T., Smith, L., D'Amore, P. Characterization of vascular development in the mouse retina. Microvascular Research. 36 (3), 275-290 (1988).
- Crist, A., Young, C., Meadows, S. Characterization of arteriovenous identity in the developing neonate mouse retina. Gene Expression Patterns: GEP. 23-24, 22-31 (2017).
- dela Paz, N. G., D'Amore, P. A. Arterial versus venous endothelial cells. Cell and Tissue Research. 335 (1), 5-16 (2009).
- Fang, J. S., Hirschi, K. K. Molecular regulation of arteriovenous endothelial cell specification. F1000Res. 8, (2019).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology and Visual Science. 35 (1), 101-111 (1994).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nature Protocols. 5 (9), 1518-1534 (2010).
- Ruiz, S., et al. A mouse model of hereditary hemorrhagic telangiectasia generated by transmammary-delivered immunoblocking of BMP9 and BMP10. Scientific Reports. 6, 37366 (2016).
- Fang, J. S., et al. Shear-induced Notch-Cx37-p27 axis arrests endothelial cell cycle to enable arterial specification. Nature Communication. 8 (1), 2149 (2017).
- Ola, R., et al. SMAD4 prevents flow induced arterial-venous malformations by inhibiting Casein Kinase 2. Circulation. 138 (21), 2379-2394 (2018).
- Chavkin, N. W., Walsh, K., Hirschi, K. K. Isolation of highly purified and viable retinal endothelial cells. Journal of Vascular Research. 58 (1), 49-57 (2020).
- Hulspas, R., O'Gorman, M. R. G., Wood, B. L., Gratama, J. W., Sutherland, D. R. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry PartB: Clinical Cytometry. 76 (6), 355-364 (2009).
- Bachman, J. Reverse-transcription PCR (RT-PCR). Methods in Enzymology. 530, 67-74 (2013).
- Green, M. R., Sambrook, J. Quantification of RNA by real-time Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Cold Spring Harbour Protocols. 2018 (10), (2018).
- Liu, L., Shi, G. P. CD31: beyond a marker for endothelial cells. Cardiovascular Research. 94 (1), 3-5 (2012).
- Zarkada, G., et al. Specialized endothelial tip cells guide neuroretina vascularization and blood-retina-barrier formation. Developmental Cell. 56 (15), 2237-2251 (2021).
- Su, X., Sorenson, C. M., Sheibani, N. Isolation and characterization of murine retinal endothelial cells. Molecular Vision. 9, 171-178 (2003).
- Benedito, R., et al. The notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis. Cell. 137 (6), 1124-1135 (2009).
- Daneman, R., et al. Wnt/beta-catenin signaling is required for CNS, but not non-CNS, angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 641-646 (2009).
- Okabe, K., et al. Neurons limit angiogenesis by titrating VEGF in retina. Cell. 159 (3), 584-596 (2014).
- Crist, A. M., Lee, A. R., Patel, N. R., Westhoff, D. E., Meadows, S. M. Vascular deficiency of Smad4 causes arteriovenous malformations: a mouse model of Hereditary Hemorrhagic Telangiectasia. Angiogenesis. 21 (2), 363-380 (2018).
- Kim, Y. H., Choe, S. W., Chae, M. Y., Hong, S., Oh, S. P. SMAD4 deficiency leads to development of arteriovenous malformations in neonatal and adult mice. Journal of the American Heart Association. 7 (21), 009514 (2018).
- Ma, W., et al. Absence of TGFbeta signaling in retinal microglia induces retinal degeneration and exacerbates choroidal neovascularization. eLife. 8, 42049 (2019).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2021).
- Lawson, N. D., Vogel, A. M., Weinstein, B. M. sonic hedgehog and vascular endothelial growth factor act upstream of the Notch pathway during arterial endothelial differentiation. Developmental Cell. 3 (1), 127-136 (2002).
- Larrivee, B., et al. ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway. Developmental Cell. 22 (3), 489-500 (2012).
- Wythe, J. D., et al. ETS factors regulate Vegf-dependent arterial specification. Developmental Cell. 26 (1), 45-58 (2013).
- Davis, D. M., Purvis, J. E. Computational analysis of signaling patterns in single cells. Seminars in Cell and Developmental Biology. , 35-43 (2015).
- Gaudet, S., Miller-Jensen, K. Redefining signaling pathways with an expanding single-cell toolbox. Trends in Biotechnology. 34 (6), 458-469 (2016).
- Aibar, S., et al. SCENIC: single-cell regulatory network inference and clustering. Nature Methods. 14 (11), 1083-1086 (2017).
- Trapnell, C., et al. The dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells. Nature Biotechnology. 32 (4), 381-386 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены