Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Gram-pozitif bakteriyel büyümenin küçük moleküllü bir inhibitörü olan masarimisinin sentezi
Bu Makalede
Özet
Hücre duvarı bozulmasını hedefleyerek Bacillus subtilis ve Streptococcus pneumoniae'nin büyümesini engelleyen küçük moleküllü bir prob olan bakteriyostatik diamide masarimycin'in hazırlanması için ayrıntılı bir protokol sunulmuştur. Kimyasal bir prob olarak uygulanması, sinerji / antagonizma tahlillerinde ve B. subtilis ve S. pneumoniae ile morfolojik çalışmalarda gösterilmiştir.
Özet
Bakterilerin hücre duvarındaki peptidoglikan (PG), şekil veren ve çevredeki ortamdan koruma sağlayan benzersiz bir makromoleküler yapıdır. Hücre büyümesini ve bölünmesini anlamanın merkezinde, PG bozunmasının biyosentezi ve hücre duvarı montajını nasıl etkilediği bilgisi vardır. Son zamanlarda, PG'nin modifiye şekerlerin veya amino asitlerin eklenmesiyle metabolik etiketlenmesi bildirilmiştir. Küçük molekül inhibitörleri ile biyosentetik adımların kimyasal sorgulanması mümkün olsa da, otolizinler tarafından PG bozunmasını incelemek için kimyasal biyoloji araçları az gelişmiştir. Bakteriyel otolizinler, PG'nin sıkı bir şekilde koordine edilmiş bozunmasında rol oynayan geniş bir enzim sınıfıdır. Burada, Bacillus subtilis'te N-asetilglukozamidaz LytG'nin bir inhibitörü olan küçük moleküllü bir prob olan masarimycin'in ve Streptococcus pneumoniae'de hücre duvarı metabolizmasının hazırlanması için ayrıntılı bir protokol sunulmaktadır. İnhibitörün mikrodalga yardımlı ve klasik organik sentez yoluyla hazırlanması sağlanır. Biyolojik tahlillerde Gram-pozitif fizyolojiyi incelemek için bir araç olarak uygulanabilirliği sunulmaktadır.
Giriş
Peptidoglikan (PG), hem Gram-pozitif hem de Gram-negatif bakterilerde hücre şeklini ve yapısını tanımlayan ağ benzeri bir polimerdir 1,2. Bu heteropolimer, β-(1,4)-bağlı alternatif N-asetilglukozamin (GlcNAc) ve N-asetilmuramik asit (MurNAc) kalıntılarından oluşan bir omurgaya sahip kısa peptitler 3,4,5,6 ile çapraz bağlanmış bir amino şeker matrisidir (Şekil 1)1. MurNAc'nin C-3 laktil moiety'sine bağlı kök peptididir. PG'nin metabolizması, hücre duvarına yeni materyal dahil etmek için sıkı bir şekilde koordine edilmiş bir biyosentetik ve degradatif enzim sistemini içerir 7,8. PG'nin parçalanması, topluca otolizinler9 olarak adlandırılan enzimler tarafından gerçekleştirilir ve ayrıca bölünen bağın özgüllüğüne göre sınıflandırılır. Otolizinler hücre büyümesi, hücre bölünmesi, hareketlilik, PG olgunlaşması, kemotaksis, protein sekresyonu, genetik yeterlilik, farklılaşma ve patojenite gibi birçok hücresel sürece katılır10,11. Bireysel otolizinlerin spesifik biyolojik fonksiyonlarını çözmek, kısmen fonksiyonel fazlalık nedeniyle göz korkutucu olabilir. Bununla birlikte, son biyofiziksel 8,12,13 ve hesaplamalı çalışmalar 12, PG metabolizmasındaki rolleri hakkında yeni bilgiler sağlamıştır. Ek olarak, son raporlar PG metabolizmasındaki sentez14 ve membran aracılı15,16,17 adım hakkında daha fazla bilgi sağlamıştır. PG metabolizmasının degradatif ve sentetik yolları arasındaki ilişkinin tam olarak anlaşılması, daha önce kullanılmayan antibiyotik hedeflerine yol açabilir.
Ökaryotlarda glikobiyolojiyi incelemek için metodolojide önemli ilerlemeler kaydedilmesine rağmen, bakteriyel glikobiyoloji ve özellikle PG metabolizması benzer bir oranda ilerlememiştir. PG metabolizmasını incelemek için mevcut kimyasal yaklaşımlar arasında floresan olarak etiketlenmiş antibiyotikler18, floresan problar19,20 ve metabolik etiketleme 21,22,23,24 bulunmaktadır. Bu yeni yaklaşımlar, bakteriyel hücre duvarı metabolizmasını sorgulamak için yeni yollar sunmaktadır. Bu stratejilerden bazıları PG'yi in vivo olarak etiketleyebilse de, türe özgü19 olabilir veya yalnızca belirli bir otolizin25'ten yoksun suşlarda çalışabilir. Birçok PG etiketleme stratejisi, izole hücre duvarları 26 veya in vitro yeniden yapılandırılmış PG biyosentez yolları20,27,28 ile kullanılmak üzere tasarlanmıştır. Floresan etiketli antibiyotiklerin kullanımı şu anda biyosentetik adımlar ve transpeptitasyon18 ile sınırlıdır.
Bakteriyel otolizinler ve hücre duvarı metabolizmasındaki rolleri hakkındaki güncel bilgiler genetik ve in vitro biyokimyasal analizlerden gelmektedir 11,29,30,31,32. Bu yaklaşımlar bu önemli enzim sınıfı hakkında zengin bir bilgi sağlamış olsa da, biyolojik rollerini deşifre etmek zor olabilir. Örneğin, fonksiyonel artıklık33 nedeniyle, çoğu durumda bir otolizinin silinmesi bakteriyel büyümenin durmasına neden olmaz. Bu, hücre büyümesi ve bölünme 7,12'deki zımni rollerine rağmen. Diğer bir komplikasyon ise, bakteriyel otolizinlerin genetik olarak silinmesinin meta-fenotiplere yol açabilmesidir34. Meta-fenotipler, genetik delesyondan etkilenen yol ile diğer birbirine bağlı yollar arasındaki karmaşık etkileşimden kaynaklanır. Örneğin, bir meta-fenotip, bir enzimin eksikliği gibi doğrudan bir etki veya düzenleyicilerin bozulması gibi dolaylı bir etki yoluyla ortaya çıkabilir.
Şu anda, PG'nin parçalanmasını incelemek için kimyasal problar olarak kullanılabilen N-asetilglukozaminidazlar (GlcNAcase) ve N-asetilmuramidazlar gibi glikozidaz otolizinlerinin sadece birkaç inhibitörü vardır. Bunu ele almak için, diamid masarimycin (daha önce fgkc olarak adlandırılan), GlcNAcase LytG32'yi hedef alan Bacillus subtilis büyümesinin bakteriyostatik bir inhibitörü olarak35 tanımlanmış ve karakterize edilmiştir (Şekil 1). LytG, glikozil hidrolaz ailesi 73 (GH73) içindeki küme 2'nin bir üyesi olan ekzo-etkili bir GlcNAcase36'dır. Vejetatif büyüme sırasında ana aktif GlcNAcase'dir32. Bildiğimiz kadarıyla, masarimycin, hücresel büyümeyi inhibe eden PG etkili bir GlcNAcase'in ilk inhibitörüdür. Streptococcus pneumoniae ile masarimycin üzerine yapılan ek çalışmalar, masarimycin'in muhtemelen bu organizmada hücre duvarı metabolizmasını inhibe ettiğini bulmuştur37. Burada, masarimycin'in hazırlanmasının, Gram-pozitif organizmalar B. subtilis ve S. pneumoniae'de fizyolojiyi incelemek için kimyasal bir biyoloji probu olarak kullanılması için rapor edilmiştir. Masarimisin ile minal-minimum inhibitör konsantrasyon tedavisinin morfolojik analizinin yanı sıra bir sinerji / antagonizma testi örnekleri sunulmuştur. İyi tanımlanmış etki modlarına sahip antibiyotiklerin kullanıldığı sinerji ve antagonizma testleri, hücresel süreçler arasındaki bağlantıları araştırmak için yararlı bir yol olabilir38,39,40.
Protokol
1. Genel yöntemler
NOT: Tüm bileşikler standart tedarikçilerden satın alınmış ve daha fazla saflaştırma yapılmadan kullanılmıştır.
- Silika jel XG F254 ile önceden kaplanmış bir alüminyum plaka üzerinde ince tabaka kromatografisi (TLC) gerçekleştirin. UV lambasının altındaki lekeleri, p-anisaldehit lekesine daldırarak veya I2 buharına maruz bırakarak tespit edin.
- Tüm nükleer manyetik rezonans (NMR) spektrumlarını 400 MHz spektrometreye kaydedin.
NOT: 1H- NMR ve 13C-NMR spektrumu, artık çözücü piklerine atıfta bulunulmuştur. Kaplin sabitleri [Hz] cinsinden ve kimyasal kaymalar [ppm] cinsinden verilir. - Masarimisinin atmosferik basınçlı kimyasal iyonizasyon (APCI) kütle spektrometri spektrumlarını, atmosferik katı madde analiz probu ile donatılmış kompakt bir kütle spektrometresine kaydedin.
2. Masarimisin hazırlanması için genel prosedür
NOT: Aşağıdaki adımları bir duman davlumbazında uygulayın.
- Her reaktandan metanolünde 0.1 M'lik bir çözelti hazırlayın: sikloheksilamin, sikloheksil karboksidaldehit, o-iyodobenzoik asit ve sikloheksil izosiyanür35.
DİKKAT: Sikloheksilamin, sikloheksil izosiyanür ve sikloheksil karboksaldehit yanıcıdır. Cilt korozyonuna neden olabilir ve oral, dermal, solunum veya üreme toksisitesine neden olabilirler. Bileşikleri açık alevlerden, sıcak yüzeylerden ve ateşleme kaynaklarından uzak tutun. Uygun cilt ve göz koruması kullanın, iyi havalandırılan bir alanda çalışın ve buhar veya buğu solumaktan kaçının. Depolama için, şişeleri sıkıca kapalı tutun ve serin ve kuru bir yerde saklayın. Sikloheksil karboksaldehiti N2 atmosferi altında bir kurutucuda saklayın. - Kapaklı yuvarlak tabanlı bir şişede 5 mL sikloheksilamin (metanol içinde 0,1 M çözelti) ve 5 mL sikloheksil karboksaldehit (metanol içinde 0,1 M) karıştırın ve çözeltiyi bir kum banyosunda 40 °C'de 30 dakika boyunca karıştırın/sıcak plaka üzerinde manyetik bir karıştırma çubuğu kullanarak karıştırın. Kum yüzeyinin yaklaşık 1 cm altına yerleştirilmiş bir termometre kullanarak sıcaklığı izleyin.
- 30 dakika sonra, 2.2. adımdan itibaren çözeltiye 5 mL sikloheksil izosiyanür (metanol içinde 0.1 M çözelti) ekleyin ve 50 ° C'de 20 dakika daha karıştırın. Son olarak, reaksiyon karışımına 5 mL o-iyodobenzoik asit (metanol içinde 0.1 M çözelti) ekleyin ve 3-5 saat boyunca 55 ° C'de karıştırmaya devam edin.
- Yukarıdaki reaksiyon karışımı 3 saat boyunca karıştırıldıktan sonra yaklaşık her saat önce TLC ile reaksiyonun ilerlemesini periyodik olarak izleyin.
- 3 cm x 6 cm'lik alüminyum destekli TLC plaka şeridini kesin. 2 numaralı bir kalem kullanarak, alttan yaklaşık 1 cm uzakta bir çizgi çizin. Bir cam mikrokılcal damar kullanarak, reaksiyon karışımının yaklaşık 5 μL'sini TLC plakasına yerleştirin ve kurumasını bekleyin.
- 150 mL'lik bir behere, kabın tabanını örtmek için yeterli mobil faz (90:10 hekzan: izopropanol) ekleyin. Bir çift cımbız kullanarak, yukarıdaki TLC plakasını dikkatlice beherin içine yerleştirin ve TLC plakasının mobil faza eşit şekilde girmesini sağlayın. Beherin üstünü bir parça infoil ile örtün.
NOT: Mobil fazın çizgiyi ve lekeli numuneyi örtmediğinden emin olun. - Mobil fazın, plakanın üst kısmının yaklaşık 1 cm altına gelene kadar TLC plakasından yukarı doğru hareket etmesine izin verin. TLC plakasını çıkarın ve bir kalem kullanarak, mobil fazın kat ettiği mesafeyi gösteren bir çizgi çizin. TLC plakasının bir duman davlumbazında kurumasını bekleyin.
- Kuruduktan sonra, TLC plakasını az miktarda katı I2 içeren bir beherin içine yerleştirin ve beheri bir parça teneke folyo ile örtün. TLC'yi sarı/kahverengi lekelerin gelişimi açısından izleyin. Geliştirildikten sonra, TLC plakasını çıkarın ve bir kalem kullanarak lekelerin yerini işaretleyin (Ek Şekil 1).
NOT: I2 leke işaretlenmezse, leke zamanla dağılır. Lekeler ayrıca TLC plakasında UV ışığı, p-anisaldehit boyama veya potasyum permanganat boyama ile görselleştirilebilir (Ek Bilgilere bakınız). - Aşağıdaki formülü kullanarak görselleştirilmiş tüm noktalar için Rf değerlerini hesaplayın:
Rf =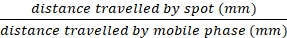
- TLC plakasında Rf = 0.3 ile sadece bir nokta göründüğünde reaksiyonun tamamlandığını düşünün. Çözücüyü düşük basınç altında döner bir evaporatörde çıkarın ve ham ürünü (sarımsı-kahverengi bir yağ olarak elde edilir) tüm metanol buharlaşana kadar yüksek bir vakum altında kurutun.
- Kurutulmuş ham ürünü 30 mL etil asetat içinde çözün ve bir ayırma hunisine aktarın. Etil asetat sırasıyla 1 M HCl (2 x 30 mL), H 2 O (30 mL), doymuş NaHCO 3 çözeltisi (2 x 30 mL), H 2O (30 mL) ve doymuş NaCl çözeltisi (2 x30 mL) ile ekstrakte edin. Sulu tabakaları atın.
NOT: Etil asetat tabakası, ekstraksiyonların her birinde üst tabakadır. Her ekstraksiyon için, etil asetat ve sulu çözelti (HCl, H2O, NaHCO3 veya NaCl) içeren ayırma hunisini kuvvetlice sallayın ve katmanların tamamen ayrılmasına izin verin. - Etil asetat tabakasını ayırıcı huniden çıkarın ve bir Erlenmeyer şişesinde toplayın. Etil asetattan kalan suyu gidermek için Na2SO4 (susuz) dolu bir spatula ekleyin.
NOT: Şişedeki Na2SO4 serbestçe çalıştığında ve kümelenmediğinde etil asetat çözeltisi kuru olarak kabul edilir. Na 2 SO4 kümeleniyorsa, ek bir Na2SO4 spatulası eklenebilir. - Na2SO 4'ü çıkarmak için kurutulmuş etil asetat çözeltisini #1 filtre kağıdındansüzün. Filtre kağıdını az miktarda etil asetat ile yıkayın. Filtrelenmiş etil asetat çözeltisini yuvarlak tabanlı bir şişeye yerleştirin ve tüm etil asetat çıkarıldıktan sonra masarimisin yağ olarak elde etmek için çözücüyü düşük basınç altında döner bir evaporatör üzerinde çıkarın.
- Yukarıda elde edilen masarimisin yağını minimum miktarda (1-2 mL) 9: 1 hekzan: izopropanol içinde çözün ve tüm bileşik çözülene kadar manyetik bir karıştırma plakası üzerinde karıştırın.
- Çözünmüş masarimycin'i 12 g normal faz silika flaş sütunu kullanarak flaş kromatografisi ile saflaştırın.
- Flaş kolonunu 10 sütun hacimli mobil fazla (99:1 hekzan: izopropanol) dengeleyin ve cihaz 15 mL/dak akış hızına ayarlayın.
NOT: Dengeleme tamamlandıktan sonra, akışı durdurun ve sütunun üst kısmını sistemden ayırın. - 5 mL'lik bir şırınga kullanarak çözünmüş masarimycin hazırlayın. Şırıngayı doğrudan dengelenmiş flaş sütununun üstüne bağlayın ve çözeltiyi sütuna enjekte edin. Yüklenen sütunu flaş kromatografisi sistemine yeniden bağlayın ve gradyan elüsyonunu başlatın.
- Gradyan elüsyonu kullanarak kolondan 10:90 hekzanlı son mobil faz konsantrasyonuna kadar masarimycin'i elute: 12 sütun hacmi üzerinde izopropanol. Masarimisin elüsyonunu 230 ve 254 nm'de absorpsiyon yoluyla izleyin.
- Kolondan salınan bileşikleri, fraksiyon başına 20 mL çözücü toplayan bir fraksiyon toplayıcı ile toplayın.
NOT: Bir flaş kromatografi sistemi mevcut değilse, masarimisin saflaştırılması 3: 1 (hekzan: etil asetat) mobil fazlı bir yerçekimi silika sütunu aracılığıyla gerçekleştirilebilir. Masarimisin içeren fraksiyonlar, aynı mobil faz kullanılarak TLC ile tanımlanabilir. TLC lekelerinin görselleştirilmesi UV ışığı, I2 buharı veya potasyum permanganat boyama ile yapıldı. - Atmosferik katı madde analiz probu ile donatılmış kompakt bir kütle spektrometresinde TLC (adım 2.5-2.9) veya kütle spektrometresi içeren fraksiyonları tanımlayın. Nihai ürünü vakum altında (~ 0,3 mbar) kurutun.
NOT: Masarimisin rutin olarak renksiz bir yağ veya katı olarak, reaksiyona eklenen sikloheksil karboksaldehit mmol ile ilgili olarak% 55-70 verim ile elde edilir. Saflaştırılmış masarimycin'in kütlesini elde ederek ve aşağıdaki formülü kullanarak reaksiyonun teorik verimini hesaplayarak masarimycin'in nihai verimini hesaplayın:
% verim = x %100
x %100
- Flaş kolonunu 10 sütun hacimli mobil fazla (99:1 hekzan: izopropanol) dengeleyin ve cihaz 15 mL/dak akış hızına ayarlayın.
- NMR tarafından masarimycin'in yapısını onaylayın.
- ~ 10 mg masarimisin örneğini 0.5 mL CDCl3 içinde çözün. Bir Pasteur pipet kullanarak, çözeltiyi 5 mm'lik bir NMR tüpüne aktarın ve tüpü kapatın. NMR tüpünü spektrometreye yerleştirin.
- Üretici tarafındanönceden ayarlanmış deneyleri kullanarak 1 H ve 13C NMR spektrumları elde edin. Kimyasal kayma atamaları ve temsili spektrumlar Ek Şekil 3-4'te verilmiştir.
- Masarimisin kuru veya DMSO'da (25 mM son konsantrasyon) çözünmüş olarak -20 °C'de kullanıma kadar saklayın.
3. Masarimisin hazırlanması için mikrodalga prosedürü
- Asetonitrilde 0.6 M sikloheksilamin, sikloheksil karboksaldehit, sikloheksil izosiyanür ve o-iyodobenzoik asit çözeltileri hazırlayın.
- Bir cam mikrodalga reaksiyon şişesine bir karıştırma çubuğu ve 10 mL asetonitril ekleyin.
- Şişeye 2 mL sikloheksilamin (asetonitrilde 0.6 M), 2 mL sikloheksil karboksaldehit (asetonitrilde 0.6 M) ve 7 mL asetonitril ekleyin.
- Mikrodalga reaksiyon şişesini mikrodalga karuseline yerleştirin. Karışımı karıştırın, 400 W'lık bir güç ayarında 50 ° C'de 30 dakika ısıtın ve oda sıcaklığına soğumasını bekleyin.
- Şişeye 2 mL o-iyodobenzoik asit (metanosolda 0.6 M) ve 2 mL sikloheksil izosiyanür (asetonitrilde 0.6 M) ekleyin. Karışımı karıştırın, mikrodalgada 400 W'lık bir güç ayarında 40 dakika boyunca 100 ° C'ye ısıtın ve oda sıcaklığına soğumasını bekleyin.
- Adım 3.5'in tamamlanmasından sonra I2 buharı kullanarak TLC (90:10 hekzan: izopropanol) ile reaksiyonun ilerlemesini izleyin.
NOT: TLC, reaksiyonun eksik olduğunu gösteriyorsa (yani, TLC üzerinde birden fazla nokta), reaksiyon şişesini mikrodalgaya geri yerleştirin ve adım 3.5'te açıklanan mikrodalga koşullarını ayarlayın. - Reaksiyon tamamlandıktan sonra, çözeltiyi 100 mL'lik yuvarlak tabanlı bir şişeye dökün ve döner bir evaporatör kullanarak kuruluğa kadar buharlaştırın.
- Masarimisinin sulu çalışmasını, saflaştırılmasını ve karakterizasyonunu tamamlamak için yukarıdaki 2.6-2.16 adımlarını izleyin.
4. Sinerji ve antagonizma testi
- Streptococcus pneumoniae R6'yı, anaerobik koşullar altında 37 ° C'de% 5 (v / v) koyun kanı içeren Mueller-Hinton (MH) agar plakalarında büyütün. Tüm deneylerde, OD600 ~ 0.4 olana kadar anaerobik koşullar altında 37 ° C'de 5 mL MH suyunda yetiştirilen ikinci geçiş hücrelerini kullanın.
- Masarimisin ve optochin inhibitörlerini ilgili çözücülerde seri 1: 2 seyreltmelere maruz bırakın, elde edilen konsantrasyonlar her bir inhibitörün minimum inhibitör konsantrasyonu (MIC) değerlerini çevreler.
- 100 μM'lik bir konsantrasyona ulaşılana kadar masarimisin dimetil sülfoksit (DMSO) içindeki ilk seyreltmesini yapın. Bu noktadan itibaren, MH suyunda masarimycin seyreltmeleri yapın. Ticari olarak temin edilebilen optochin'i (bakınız Malzeme Tablosu) steril MH et suyunda eriterek optochin stok çözeltisi (3,5 mM) hazırlayın.
NOT: Masarimisin stok çözümleri DMSO'da 25 mM'de yapılmıştır.
- 100 μM'lik bir konsantrasyona ulaşılana kadar masarimisin dimetil sülfoksit (DMSO) içindeki ilk seyreltmesini yapın. Bu noktadan itibaren, MH suyunda masarimycin seyreltmeleri yapın. Ticari olarak temin edilebilen optochin'i (bakınız Malzeme Tablosu) steril MH et suyunda eriterek optochin stok çözeltisi (3,5 mM) hazırlayın.
- Steril bir 96 kuyucuklu mikrotitre plakasına, plakanın her sırasına her optochin seyreltmesinin 2 μL alikotunu ekleyin. Aynı plakaya, plaka üzerinde bir dizi optoksin ve masarimisin konsantrasyonu oluşturmak için her sütuna her masarimycin seyreltmesinin 2 μL alikotunu ekleyin (Şekil 2).
- Yukarıdaki inhibitörleri içeren her bir oyuğa steril MH suyu (93 μL) ekleyin. Mikrotitre plakalarını adım 4.1'den itibaren 5 μL kültür (OD600 ~ 0.4) ile aşılayın.
NOT: 96 delikli plakanın aşılanması tipik olarak anaerobik bir iş istasyonunda anaerobik koşullar altında yapılır. Kuyudaki son hacim 100 μL'dir. - Anaerobik koşullar altında 37 ° C'de 18 saat boyunca kültürleri büyütün, ardından 30 μL% 0.01 (m / v) resazurin sodyum tuzu çözeltisi ilavesi yapılır. Renk oluşumuna ve stabilizasyonuna izin vermek için plakayı oda sıcaklığında 15 dakika boyunca inkübe edin.
NOT: Resizrin çözeltisi, bileşiğin damıtılmış suda çözülmesiyle hazırlanır ve iki haftaya kadar 4 ° C'de saklanabilir. - Konsantrasyon değerlerini doğrudan plakadan okuyun ve bakteriyel büyümenin gözlenmediği en düşük inhibitör konsantrasyonunu (mavi renk) [X] olarak atayın (bkz. adım 4.7.1), yani yardımcı ilacın varlığında ilacın en düşük inhibitör konsantrasyonu.
NOT: Pozitif bakteri büyümesi, pembeye dönüşen resazurin boyası ile kuyucuklarda tanımlanır. Tek başına her ilacın MIC değerleri (yani, yardımcı ilacın yokluğunda), her bir ilaçla ayrı ayrı resazurin MIC testi35 kullanılarak benzer şekilde belirlenir (Ek Şekil 5). S. pneumoniae'deki MIC'ler, masarimycin ve optochin için sırasıyla 7.8 μM ve 15.85 μM'dir. - Aşağıdaki denklemleri kullanarak fraksiyonel inhibitör konsantrasyonunu (FIC) ve FIC indeksini (FICI) belirleyin.
- FIC= [X]/MIC x, burada [X] (adım 4.6'dan itibaren), yardımcı ilacın varlığında ilacın en düşük inhibitör konsantrasyonudur ve MICx, yardımcı ilacın yokluğunda ilacın en düşük inhibitör konsantrasyonudur.
- FICI = FICmasarimycin + FICantibiyotik
NOT: FIC I < 0.5 = sinerjik, 0.5 < FIC I < 1 = katkı maddesi, 1 < FIC I < 4 = kayıtsız, FIC I > 4 = antagonistik.
5. Morfolojik çalışma
- 37 °C'de %1,5 Bacto agar içeren Luria-Bertani (LB) agar plakalarında (10 g/L tripton, 5 g/L maya ekstresi ve 5 g/L NaCl) Bacillus subtilis 11774 yetiştirin. Tüm deneylerde, OD600 = 1'e kadar 37 ° C'de 5 mL LB suyunda yetiştirilen ikinci geçiş hücrelerini kullanın. S.pneumoniae'yi adım 4.1'deki gibi büyütün.
- B. subtilis için OD 600nm = 1 veya S. pneumoniae için OD600nm = 0.4 ile bir hücre kültürü yoğunluğu elde ettikten sonra, 3.8 μM (B.subtilis için 0.75x MIC) veya 5.85 μM (S.pneumoniae için 0.75x MIC) nihai konsantrasyonuna "işlenmiş" etiketli kültür tüpüne bir pipet kullanarak masarimycin ekleyin. "Kontrol" etiketli ikinci kültür tüpüne eşdeğer bir DMSO hacmi ekleyin.
- B.subtilis için, numuneleri 150 rpm'de çalkalama ile 90 dakika boyunca 37 ° C'de bir inkübatöre yerleştirin. S. pneumoniae için, anaerobik koşullar altında titremeden hücreleri inkübe edin.
- 90 dakika sonra, kültürleri 1:10 karışım (v / v) kültür ortamı ve sabitleme tamponunda (20 mM HEPES,% 1 formaldehit (pH 6.8)) gece boyunca 4 ° C'de kimyasal olarak sabitleyin. Sabitleme tamamlandıktan sonra, pipet kullanarak cam mikroskop slaytlarına 10-20 μL numune uygulayın ve havanın kurumasını bekleyin. Cam slaytları bir Bunsen brülörü kullanarak ısıtarak hava ile kurutulmuş numuneleri sabitleyin.
- Isıl sabitlemeden sonra, numuneleri% 0.1 (m / v) metilen mavisi (% 20 (v / v) etanolde çözelti) 100 μL ilavesiyle lekeleyin. Lekeli slaytları 10 dakika boyunca inkübe edin ve fazla boyayı dH2O ile yıkayın. Daha sonra, hücreleri ortak bir odak düzlemine getirmek için lekeli slaytları bir fırında 15-20 dakika boyunca 60 ° C'ye hafifçe ısıtın.
- Lekeli numuneleri, lekeli hücrelerin üzerine mikroskop kapağı yerleştirerek kapatın. Ardından, mikroskop slayt çimentosu kullanarak kenarları kapatın. Kapalı mikroskop slaytını mikroskop aşamasına yerleştirin ve parlak alan mikroskobu kullanarak görüntüyü 100x büyütmede odaklayın.
- Mikroskop slaytına bir damla daldırma yağı yerleştirin ve 1000x büyütme kullanarak görüş alanını odaklamaya getirin. Mikroskopa ve ilgili yazılıma bağlı bir kamera kullanarak mikrograflar edinin. Yazılımdaki otomatik beyaz dengesi ve diyafram ayarlarını kullanarak görüntüler elde edin.
NOT: Alternatif olarak, görüntüler açık kaynaklı ImageJ yazılımı kullanılarak işlenebilir.
Sonuçlar
Masarimisin, B. subtilis ve S. pneumoniae'nin küçük moleküllü bakteriyostatik inhibitörüdür ve B. subtilis35,37'de ekzo-etkili GlcNAcase LytG'yi inhibe ettiği ve S. pneumoniae37'de hücre duvarını hedef aldığı gösterilmiştir. Masarimisin, klasik veya mikrodalga destekli organik sentez ile% 55 -% 70 aralığında verimlerle verimli bir şekilde hazırlanabilir. Mikrodalga destekli sentez,...
Tartışmalar
Masarimisin, B. subtilis35 ve S. pneumoniae37 büyümesinin tek bir mikromolar bakteriyostatik inhibitörüdür. B. subtilis'te , masarimycin'in GlcNAcase LytG35'i inhibe ettiği gösterilirken, S. pneumoniae'nin hücre duvarındaki kesin moleküler hedef tanımlanmamıştır37. Klasik organik sentez veya mikrodalga prosedürü kullanılarak masarimisin sentezi, inhibitörün iyi verim ve yüksek saf...
Açıklamalar
Reid, C. W., masarimycin'in belirli uygulamalarını içeren fikri mülkiyete sahiptir.
Teşekkürler
Araştırma, Ulusal Bilim Vakfı tarafından 2009522 hibe numarası altında desteklenmiştir. Masarimisin'in NMR analizi, Ulusal Bilim Vakfı büyük araştırma enstrümantasyon programı ödülü tarafından 1919644 hibe numarası altında desteklenmiştir. Bu materyalde ifade edilen herhangi bir görüş, bulgu ve sonuç veya öneri yazarlara aittir ve mutlaka Ulusal Bilim Vakfı'nın görüşlerini yansıtmaz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-Iodobenzoic acid | SIGMA-ALDRICH | I7675-25G | corrosive, irritant, light yellow to orange-brown powder |
| 2-Propanol | SIGMA-ALDRICH | 109827-4L | flammable, irritant, colorless liquid |
| Acetonitrile | SIGMA-ALDRICH | 34851-4L | flammable, irritant, colorless liquid |
| Aluminum backed silica plates | Sorbtech | 4434126 | silica gel XG F254 on aluminum backed plates |
| chloroform-d | SIGMA-ALDRICH | 151823-50G | solvent for NMR |
| Compact Mass Spectrometer | Advion-Interchim | Advion CMS | compact mass spectrometer equiped with APCI source and atmospheric solids analysis probe |
| Corning Costar 96 well flat bottom plates-sterile | fisher chemical | 07-200-90 | for synergy/antagonism assays |
| cover slips | fisher chemical | 12-547 | for microscopy |
| Cyclohexanecarboxaldehyde | CHEM-IMPEX INT'L INC. | 24451 | flammable, irritant, colorless to pink liquid |
| Cyclohexyl isocyanide | SIGMA-ALDRICH | 133302-5G | irritant, colorless liquid, extremly unpleasant odor |
| Cyclohexylamine | SIGMA-ALDRICH | 240648-100ML | corrosive, flammable, irritant, colorless liquid unless contaminated |
| Ethyl acetate | SIGMA-ALDRICH | 537446-4L | flammable, irritant, colorless liquid |
| flash silica cartridge (12g) | Advion-Interchim | PF-50SIHP-F0012 | pack of flash silica columns (12g) for purification of masarimycin |
| formaldehyde | SIGMA-ALDRICH | F8775-25ML | fixing agent for microscopy |
| HEPES | SIGMA-ALDRICH | H8651-25G | buffer for microscopy fixing solution |
| Hexane, mixture of isomers | SIGMA-ALDRICH | 178918-4L | environmentally damaging, flammable, irritant, health hazard, colorless liquid |
| High performance compact mass spectrometer | Advion | expression | Atmospheric Solids Analysis Probe (ASAP), low resolution |
| High Vac | eppendorf | Vacufuge plus | vacuum aided by centrifugal force and temperature |
| Hydrochloric acid | SIGMA-ALDRICH | 258148-2.5L | corrosive, irritant, colorless liquid |
| hydrochloric acid | SIGMA-ALDRICH | 320331-2.5L | strong acid |
| immersion oil | fisher chemical | 12-365-19 | for microscopy |
| Iodine, resublimed crystals | Alfa Aesar | 41955 | environmentally damaging, irritant, health hazard, dark grey/purple crystals |
| Mestre Mnova | MestreLab Research | software for processing NMR spectra | |
| Methanol | SIGMA-ALDRICH | 439193-4L | flammable, toxic, health hazard, colorless liquid |
| methylene blue | SIGMA-ALDRICH | M9140-25G | microscopy stain for staining cell walls |
| meuller-hinton agar plates + 5% sheep blood | fisher chemical | B21176X | growth media for Streptococcus pneumoniae |
| meuller-hinton broth | fisher chemical | DF0757-17-6 | growth media for Streptococcus pneumoniae |
| microscope slides | fisher chemical | 22-310397 | for microscopy |
| Microwave Synthesis Labstation | MILESTONE | START SYNTH | device that requires the ventilation of a fume hood, equipped with synthesis carousel |
| NMR tubes | SIGMA-ALDRICH | Z562769-5EA | 5mm NMR tubes 600 MHz |
| Nuclear Magnetic Resonance (NMR) | Bruker | Ascend 400 | large superconducting magnet (400MHz) |
| optochin | fisher chemical | AAB21627MC | ethylhydrocupreine hydrochloride |
| petrie plates | Celltreat | 229695 | for preparing agar plates for bacterial growth |
| Primo Star Bright field/Phase contrast Microscope with ERc5s camera | Zeiss | for morphology studies | |
| puriFlash | interchim | XS520plus | flash chromatography purification system |
| resazurin | SIGMA-ALDRICH | R7017-1G | for synergy/antagonism assays |
| Rotary Evaporator | Heidolph | Hei-VAP Value "The Collegiate" | solvent evaporator |
| Sodium bicarbonate | SIGMA-ALDRICH | S6014-500G | irritant, white powder |
| Sodium chloride | fisher chemical | S271-1 | crystalline, colorless |
| Sodium chloride | SIGMA-ALDRICH | S5886-500G | for growth of B.subtilis and preparation of LB media |
| Sodium sulfate | SIGMA-ALDRICH | 7985592-500G | anhydrous, granular, white |
| tryptone | fisher chemical | BP1421-500 | for growth of B.subtilis and preparation of LB media |
| Whitney DG250 Workstation | Microbiology International | DG250 | anaerobic workstation. Anaerobic gas mixture used: 5% hydrogen, 10% carbon dioxide, balance nitrogen |
| yeast extract | fisher chemical | BP1422-500 | for growth of B.subtilis and preparation of LB media |
| Zen Lite (blue) software | Zeiss | for acquiring micrographs |
Referanslar
- Vollmer, W., Blanot, D., de Pedro, M. A. Peptidoglycan structure and architecture. FEMS Microbiology Review. 32 (2), 149-167 (2008).
- Munita, J. M., Bayer, A. S., Arias, C. A. Evolving resistance among Gram-positive pathogens. Clinical Infectious Diseases. 61, 48-57 (2015).
- Vollmer, W., Bertsche, U. Murein (peptidoglycan) structure, architecture and biosynthesis in Escherichia coli. Biochimica Biophysica Acta. 1778 (9), 1714-1734 (2008).
- Vollmer, W., Höltje, J. -. V. The architecture of the murein (peptidoglycan) in Gram-negative bacteria: vertical scaffold or horizontal layer(s). Journal of Bacteriology. 186 (18), 5978-5987 (2004).
- Clarke, A. J. Compositional analysis of peptidoglycan by high-performance anion-exchange chromatography. Analytical Biochemistry. 212 (2), 344-350 (1993).
- Kim, S. J., Chang, J., Singh, M. Peptidoglycan architecture of Gram-positive bacteria by solid-state NMR. Biochimica Biophysica Acta. 1848, 350-362 (2014).
- Koch, A. L., Doyle, R. J. Inside-to-outside growth and turnover of the wall of gram-positive rods. Journal of Theoretical Biology. 117 (1), 137-157 (1985).
- Beeby, M., Gumbart, J. C., Roux, B., Jensen, G. J. Architecture and assembly of the Gram-positive cell wall. Molecular Microbiology. 88 (4), 664-672 (2013).
- Shockman, G. D., Daneo-Moore, L., Kariyama, R., Massidda, O. Bacterial walls, peptidoglycan hydrolases, autolysins, and autolysis. Microbial Drug Resistance. 2 (1), 95-98 (1996).
- Dijkstra, A. J., Keck, W. Peptidoglycan as a barrier to transenvelope transport. Journal of Bacteriology. 178 (19), 5555-5562 (1996).
- Blackman, S. A., Smith, T. J., Foster, S. J. The role of autolysins during vegetative growth of Bacillus subtilis 168. Microbiology. 144, 73-82 (1998).
- Misra, G., Rojas, E. R., Gopinathan, A., Huang, K. C. Mechanical consequences of cell-wall turnover in the elongation of a Gram-positive bacterium. Biophysical Journal. 104 (11), 2342-2352 (2013).
- Wheeler, R., et al. Bacterial cell enlargement requires control of cell wall stiffness mediated by peptidoglycan hydrolases. mBio. 6 (4), 00660 (2015).
- Taguchi, A., Kahne, D., Walker, S. Chemical tools to characterize peptidoglycan synthases. Current Opinion in Chemical Biology. 53, 44-50 (2019).
- Welsh, M. A., Schaefer, K., Taguchi, A., Kahne, D., Walker, S. Direction of chain growth and substrate preferences of shape, elongation, division, and sporulation-family peptidoglycan glycosyltransferases. Journal of the American Chemial Society. 141 (33), 12994-12997 (2019).
- Rubino, F. A., et al. Detection of transport intermediates in the peptidoglycan flippase MurJ identifies residues essential for conformational cycling. Journal of the American Chemical Society. 142 (12), 5482-5486 (2020).
- Sjodt, M., et al. Structure of the peptidoglycan polymerase RodA resolved by evolutionary coupling analysis. Nature. 556 (7699), 118-121 (2018).
- Tiyanont, K., et al. Imaging peptidoglycan biosynthesis in Bacillus subtilis with fluorescent antibiotics. Proceedings of the National Academy of Science U S A. 103 (29), 11033-11038 (2006).
- Lebar, M. D., et al. Reconstitution of peptidoglycan cross-linking leads to improved fluorescent probes of cell wall synthesis. Journal of the American Chemical Society. 136 (31), 10874-10877 (2014).
- Do, T., Page, J. E., Walker, S. Uncovering the activities, biological roles, and regulation of bacterial cell wall hydrolases and tailoring enzymes. Journal of Biological Chemistry. 295 (10), 3347-3361 (2020).
- Liang, H., et al. Metabolic labelling of the carbohydrate core in bacterial peptidoglycan and its applications. Nature Communications. 8, 15015 (2017).
- DeMeester, K. E., et al. Metabolic incorporation of N-acetyl muramic acid probes into bacterial peptidoglycan. Current Protocol in Chemical Biology. 11 (4), 74 (2019).
- Lazor, K. M., et al. Use of Bioorthogonal N-acetylcysteamine (SNAc) analogues and peptidoglycan O-acetyltransferase B (PatB) to label peptidoglycan. The FASEB Journal. 32, 630 (2018).
- Wang, Y., Leimkuhler-Grimes, C. Fluorescent labeling of the carbohydrate backbone of peptidoglycan to track degradation in vivo. The FASEB Journal. 29, (2015).
- Kuru, E., et al. In probing of newly synthesized peptidoglycan in live bacteria with fluorescent D-amino acids. Angewandte Chemie International Edition. 51 (50), 12519-12523 (2012).
- Zhou, R., Chen, S., Recsei, P. A dye release assay for determination of lysostaphin activity. Analytical Biochemistry. 171 (1), 141-144 (1988).
- Qiao, Y., et al. Lipid II overproduction allows direct assay of transpeptidase inhibition by β-lactams. Nature Chemical Biology. 13 (7), 793-798 (2017).
- Lebar, M. D., et al. Forming cross-linked peptidoglycan from synthetic Gram-negative lipid II. Journal of the American Chemical Society. 135 (12), 4632-4635 (2013).
- Chen, R., Guttenplan, S. B., Blair, K. M., Kearns, D. B. Role of the D-dependent autolysins in Bacillus subtilis population heterogeneity. Journal of Bacteriology. 191 (18), 5775-5784 (2009).
- Yukie, S., Miki, K., Yoshio, N., Kuniaki, T., Yoshihisa, Y. Identification and characterization of an autolysin-encoding gene of Streptococcus mutans. Infection and Immunity. 73 (6), 3512-3520 (2005).
- Domenech, M., García, E., Moscoso, M. In vitro destruction of Streptococcus pneumoniae biofilms with bacterial and phage peptidoglycan hydrolases. Antimicrobial Agents and Chemotherapy. 55 (9), 4144-4148 (2011).
- Horsburgh, G. J., Atrih, A., Williamson, M. P., Foster, S. J. LytG of Bacillus subtilis is a novel peptidoglycan hydrolase: the major active glucosaminidase. Biochemistry. 42 (2), 257-264 (2003).
- Vermassen, A., et al. Cell wall hydrolases in bacteria: insight on the diversity of cell wall amidases, glycosidases and peptidases toward peptidoglycan. Frontiers in Microbiology. 10, 331 (2019).
- Martin-Galiano, A. J., Yuste, J., Cercenado, M. I., de la Campa, A. G. Inspecting the potential physiological and biomedical value of 44 conserved uncharacterised proteins of Streptococcus pneumoniae. BMC Genomics. 15, 652 (2014).
- Nayyab, S., et al. Diamide inhibitors of the Bacillus subtilis N-acetylglucosaminidase LytG that exhibit antibacterial activity. ACS Infectioius Diseases. 3 (6), 421-427 (2017).
- Lipski, A., et al. Structural and biochemical characterization of the β-N-acetylglucosaminidase from Thermotoga maritima: Toward rationalization of mechanistic knowledge in the GH73 family. Glycobiology. 25 (3), 319-330 (2014).
- Haubrich, B. A., et al. Inhibition of Streptococcus pneumoniae autolysins highlight distinct differences between chemical and genetic inactivation. bioRxiv. , 300541 (2020).
- Farha, M. A., et al. Inhibition of WTA synthesis blocks the cooperative action of PBPs and sensitizes MRSA to β-lactams. ACS Chemical Biology. 8 (1), 226-233 (2013).
- Lehár, J., et al. Chemical combination effects predict connectivity in biological systems. Molecular Systems Biology. 3 (1), 80 (2007).
- Farha, M. A., et al. Antagonism screen for inhibitors of bacterial cell wall biogenesis uncovers an inhibitor of undecaprenyl diphosphate synthase. Proceedings of the National Academy of Science U S A. 112 (35), 11048-11053 (2015).
- Palomino, J. C., et al. Resazurin microtiter assay plate: simple and inexpensive method for detection of drug resistance in Mycobacterium tuberculosis. Antimicrobial Agents and Chemotherapy. 46 (8), 2720-2722 (2002).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. Journal of Antimicrobial Chemotherapy. 52 (1), 1 (2003).
- Arrigucci, R., Pozzi, G. Identification of the chain-dispersing peptidoglycan hydrolase LytB of Streptococcus gordonii. PLoS One. 12 (4), 0176117 (2017).
- Bai, X. -. H., et al. Structure of pneumococcal peptidoglycan hydrolase LytB reveals insights into the bacterial cell wall remodeling and pathogenesis. of Biological Chemistry. 289 (34), 23403-23416 (2014).
- Garcia, P., Gonzalez, M. P., Garcia, E., Lopez, R., Garcia, J. L. LytB, a novel pneumococcal murein hydrolase essential for cell separation. Molecular Microbiology. 31 (4), 1275-1281 (1999).
- Giladi, M., Altman-Price, N., Levin, I., Levy, L., Mevarech, M. FolM, a new chromosomally encoded dihydrofolate reductase in Escherichia coli. Journal of Bacteriology. 185 (23), 7015-7018 (2003).
- Chua, P. R., et al. Effective killing of the human pathogen Candida albicans by a specific inhibitor of non-essential mitotic kinesin Kip1p. Molecular Microbiology. 65 (2), 347-362 (2007).
- Rico-Lastres, P., et al. Substrate recognition and catalysis by LytB, a pneumococcal peptidoglycan hydrolase involved in virulence. Scientific Reports. 5, 16198 (2015).
- Vollmer, W., et al. The cell wall of Streptococcus pneumoniae. Microbiology Spectrum. 7 (3), (2019).
- Massidda, O., Nováková, L., Vollmer, W. From models to pathogens: how much have we learned about Streptococcus pneumoniae cell division. Environmental Microbiology. 15 (12), 3133-3157 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır