Method Article
Yetişkin Anofeller gambiae Sivrisineklerine Etkili Oral RNA İnferferi (RNAi) Uygulaması
Bu Makalede
Özet
Caenorhabditis elegans'ta rutin olarak kullanılan RNA girişimi (RNAi) için bir dağıtım yöntemi olan bakteriler tarafından üretilen dsRNA'nın oral yoldan uygulanması, burada yetişkin sivrisineklere başarıyla uygulanmıştır. Yöntemimiz, enjeksiyon kullanmadan sağlam ters genetik çalışmalarına ve iletimi engelleyen vektör çalışmalarına izin verir.
Özet
RNA girişimi, yirmi yıldır ters genetik analiz için yoğun olarak kullanılan bir araç olmuştur. Yetişkin sivrisineklerde, çift sarmallı RNA (dsRNA) uygulaması, öncelikle önemli ölçüde zaman gerektiren ve saha uygulamaları için uygun olmayan enjeksiyon yoluyla gerçekleştirilmiştir. Bu sınırlamaların üstesinden gelmek için, burada dsRNA'nın yetişkin Anopheles gambiae'ye oral yoldan verilmesi yoluyla RNAi'nin sağlam aktivasyonu için daha etkili bir yöntem sunuyoruz. HT115 (DE3) Escherichia coli suşunda uzun dsRNA'lar üretildi ve yetişkin sivrisineklere pamuk topları ad-libitum üzerinde% 10 sakarozda ısıdan öldürülen dsRNA içeren bakterilerin konsantre bir süspansiyonu sunuldu. Pamuk topları tedavi süresince her 2 günde bir değiştirildi. Bu yöntemin doublesex'i (cinsiyet farklılaşmasında rol oynayan bir gen) veya çatal kafasını (tükürük bezi transkripsiyon faktörünü kodlayan) hedeflemek için kullanılması, sırasıyla kantitatif Gerçek Zamanlı PCR (qRT-PCR) veya floresan konfokal mikroskopi ile ölçüldüğü gibi, hedef gen ekspresyonunun ve / veya protein immünofloresan sinyalinin azalmasına neden olmuştur. Tükürük bezi morfolojisinde de defektler gözlendi. Bu son derece esnek, kullanıcı dostu, düşük maliyetli, zaman verimli dsRNA dağıtım yöntemi, böcek vektör fizyolojisi ve ötesi için önemli olan hedef genlere geniş çapta uygulanabilir.
Giriş
Birçok hastalık sivrisinekler tarafından bulaşır, bu da sivrisinek fizyolojisi ve genetiğinin incelenmesini önemli bir girişim haline getirir. RNAi'nin bu organizmalarda kullanımı son 20 yılda öne çıkmış ve birçok sivrisinek geninin 1,2,3,4,5 fonksiyonel karakterizasyonuna izin vermiştir. DsRNA dağıtımı için en yaygın kullanılan teknik, sivrisineklere zarar verebileceği ve önemli zaman ve çaba gerektiren dezavantajları olan mikroenjeksiyon olmuştur. RNAi için oral dağıtım yöntemleri test edilmiştir, ancak esas olarak sivrisineklerin larva aşamasında 6,7,8,9. Yetişkin sivrisineklerde dsRNA'nın oral yoldan verilmesi tam olarak araştırılmamıştır ve vektör biyolojisi ve vektör kontrolünün incelenmesi için yararlı bir araç olabilir.
Sıtma, enfekte bir dişi sivrisinek enfekte olmamış bir konakçıdan kan unu aldığında ve sıtma parazitleri içeren tükürük enjekte ettiğinde Anopheles sivrisinekleri tarafından bulaşır10. Nihayetinde bir sivrisinek tükürüğünde bulaşması için, parazit sivrisinek bağışıklık sisteminden kaçma, midgut bariyerinin geçişi ve tükürük bezlerinin istilası da dahil olmak üzere birçok engelin üstesinden gelmelidir11. Sivrisinek tükürük bezi (SG) mimarisi parazit invazyonunun anahtarıdır ve bu mimari hem anahtar tükürük bezi eksprese edilen transkripsiyon faktörleri hem de cinsel dimorfizmin belirleyicileri tarafından kontrol edilir. Tükürük bezlerinin hücresel spesifikasyonu ve homeostatik bakımı ve kan beslenmesinde işlev gören tükürük proteinlerinin üretimi ve sekresyonu için çeşitli yüksek oranda korunmuş transkripsiyon faktörleri gereklidir12,13,14. Çatal başı (Fkh), böcek SG yapısının ve işlevinin önemli bir düzenleyicisi olarak işlev gören kanatlı bir sarmal transkripsiyon faktörüdür (meyve sinekleri ve ipekböceği güvesi üzerindeki çalışmalara dayanarak)15,16,17,18,19,20. Drosophila SG'lerde Fkh, SG sağkalımını ve tükürük üretimini teşvik etmek için SG'ye özgü bir temel sarmal-döngü-sarmal (bHLH) transkripsiyon faktörü olan Adaçayı ile birlikte işlev görür19. Drosophila'da tükürük üretiminin önemli, pozitif bir eş düzenleyicisi, salgı yolu genlerinin ekspresyonunu düzenleyen iyi çalışılmış bir lösin fermuar transkripsiyon faktörü olan CrebA'dır21,22,23. Ayrıca, kadın tükürük bezlerinde, sadece kan beslenmesinde değil, aynı zamanda parazitlerin bu dokuyu istila etme kabiliyetinde de önemli bir rol oynayan güçlü bir morfolojik farklılaşma derecesi vardır24.
Tükürük bezi sağkalımını, yapısını, fizyolojisini ve cinsel dimorfizmini belirlemede rol oynayan genlerin çoğu, karmaşık uzaysal zamansal ekspresyon profillerine sahiptir25,26,27 ve RNAi'yi indüklemek için dsRNA'nın geleneksel dağıtım yöntemleri, bu veya diğer dokulardaki bu tür genleri hedeflemede her zaman etkili değildir. Bununla birlikte, larva evresinde dsRNA'nın oral yoldan verilmesi Aedes aegypti ve An. gambiae sivrisinekleri, dsx geninin 9,28 dişiye özgü formunu susturmak için başarıyla kullanılmıştır. Sivrisinek tükürük bezlerinde dsRNA kullanan önceki çalışmalar, büyük miktarlarda dsRNA'ya ihtiyaç duyulmasına rağmen, susturma etkisinin nispeten uzun süreli (en az 13 gün) olduğunu bulmuştur29. Burada, dsx, fkh veya CrebA için diziye özgü dsRNA'yı eksprese eden ısıdan öldürülmüş E. coli suşu HT115'in (DE3) yetişkin dişi sivrisineklerde bu genlerin RNAi susturulmasını indükleme yeteneği test edilmiştir. An. gambiae'de dsRNA kaynaklı gen yıkımının oral yoldan uygulanması, mRNA seviyelerinde belirgin azalmalar ve bu genlerin fonksiyon kaybı ile tutarlı fenotiplerle. Bu nedenle, bu yaklaşım muhtemelen çeşitli tükürük bezi genlerinin işlevini yıkmak için çalışacaktır.
Protokol
1. DsRNA'nın E. coli ekspresyon vektörüne klonlanması
- dsRNA'nın ekspresyonu için uygun bir vektöre eklenecek hedef gen dizisini seçin. Aşağıdaki yöntemi kullanarak Vectorbase.org ifade değerlerini alın.
- Ana sayfa arama kutusunda ilgilendiğiniz bir geni (örneğin, Tablo 1) arayın.
- Ortaya çıkan gen sayfasında, 8. Transkriptomik bölümü.
- Listelenen ilgili RNA-seq ve mikroarray gen ekspresyon deneylerini arayın.
- İlgilenilen değerleri elektronik tablo yazılımına aktarın ve bir veri tablosu oluşturun.
- Kullanılacak en az bir T7 promotörü ile piyasada satılan bir plazmid seçin. Seçilen plazmidin sadece bir T7 promotörü varsa (çoğu ticari plazmidin yaptığı gibi), ilgilenilen gen için dsDNA'nın amplifikasyonunda kullanılmak üzere ters astara ikinci bir T7 promotörü ekleyin.
NOT: Hedef genler için dsRNA dizisi, RNAi reaktiflerinin tasarımı için E-RNAi web uygulaması kullanılarak seçilebilir30. Uzun dsRNA (yaklaşık 400 bp) veya kısa saç tokası dsRNA (shRNA), spesifik gen dizilerine dayanarak tasarlanabilir. Bu diziler, klonlamadan önce kimlik doğrulaması için yükseltilmeli ve sıralanmalıdır. Bu çalışmada kullanılan seçilmiş gen bölgeleri, plazmidler ve promotörler Ek Dosya 1'de listelenmiştir. - Daha önce 9,31'de açıklanan basit bir tek adımlı prosedüre göre klonlama yapın. Bu amaçla, PCR ürününü saflaştırın ve doğrusallaştırılmış plazmid DNA'sına bağ yapın. Yetkili E. coli hücrelerinin ısı-şok dönüşümü için ligasyon ürününü kullanın32. Dönüştürülen hücreleri mavi/beyaz tarama yoluyla seçin. T7-primer PCR kullanarak kesici ucun yönünü onaylayın ve M13 astarları kullanarak sırayı onaylayın.
NOT: Beyaz/mavi taramalar, transformasyon için seçilen plazmid, β-galaktosidazı kodlayan lakZ genini taşıdığında kullanılabilir. Beyaz koloniler lacZ içinde istenen eki içermelidir ve hedef dizi33'ün varlığını ve yönünü daha da doğrulamak için seçilebilir. - Plazmidi ilk dönüşümden arındırın ve daha önce tarif edildiği gibi yetkin E. coli HT115'i (DE3) dönüştürmek için kullanın34. Kesici uçlu plazmidin yetkili E. coli HT115'te (DE3) bulunduğunu doğruladıktan sonra, tek kullanım için gliserol bakteri stokları yapın.
NOT: Her deneyde kullanılmak üzere uygun bir ilişkili olmayan kontrol dsRNA'sı edinilmeli veya hazırlanmalıdır. Bu durumda, Arabidopsis thaliana'dan ilgisiz gen aintegumenta (karınca) dizisi kullanılır.
2. dsRNA'yı eksprese eden ısıda öldürülen bakterilerin hazırlanması
- 100 μg / mL ampisilin ve 12.5 μg / mL tetrasiklin içeren 50 mL Luria Broth (LB) içinde plazmidi ifade eden dsRNA'yı içeren E. coli suşu HT115'in (DE3) tek bir bakteri kolonisinden, 12 saat boyunca 37 ° C'de bir platform çalkalayıcıda (180 rpm) bir kültür büyütün.
- Bakteri kültürünü (1:1000), 100 μg / mL ampisilin ve 12.5 μg / mL tetrasiklin içeren 2x Maya Tripton (2x YT) ortamına seyreltin.
- 40 μM (son konsantrasyon) izopropil β-D-1-tiyogalaktopiranosid (IPTG) ekleyerek dsRNA üretimini indükleyin.
- Hücreler bir O.D.600 = 0.4'e ulaştığında, yaklaşık 2 saat indüksiyondan sonra, 37 ° C'de 180 rpm'de ajitasyon ile, Taracena ve ark. 9 tarafından tanımlandığı gibi ısıda öldürülen bakterilerin konsantre bir süspansiyonunu hazırlayın. Hücreleri santrifüjleme (4000 x g, 4 °C, 10 dakika) ile pelet edin ve hücreleri bir hacim sodyum fosfat tamponunda (PBS) yıkayın.
- Aynı koşullar altında tekrar döndürün, PBS'de başlangıç hacminin 1 / 100'üne kadar tekrar askıya alın ve 1 saat boyunca 70 ° C'ye yerleştirin.
- Isı ile öldürülen bakterilerin 400 μL alikotunu yapın ve bu alikotları daha fazla kullanıma kadar -20 ° C'de saklayın (bir haftadan fazla saklamayın). Isı ile öldürülen bakterilerin bu süspansiyonu, RNAi deneyleri için spesifik dsRNA'yı içerir. Bu prosedürü hem hedef gen dsRNA-bakterileri hem de her deneyde kullanılacak ilişkisiz dsRNA-kontrolü için uygulayın.
3. Sivrisinekleri dsRNA'yı eksprese eden ısıdan öldürülmüş bakterilerle beslemek
- Bir dsRNA aliquotunu (HT115 (DE3) bakteri süspansiyonu) defrost edin ve% 0.2 metilparaben içeren 1.6 mL% 12 şeker çözeltisi ile karıştırın.
- Bu çözeltiye küçük bir pamuk topu batırın ve ıslatılmış pamuk topunu 5 günlük sivrisinekler içeren bir kafesin içine yerleştirin. Sivrisineklerin bu çözelti ile beslendiğinden emin olun, hem şekeri hem de dsRNA içeren bakterileri aynı anda toplayın.
- dsRNA-şeker çözeltisine batırılmış pamuk topunu art arda 8 gün boyunca her gün değiştirin.
- Sivrisinek kafeslerini sabit koşullar altında, yani 27 °C ve% 80 bağıl nemde, 12 saat ışıkta fotoperiyotta tutun: karanlık fotosiklus, 30 dakikalık şafak ve 30 dakikalık alacakaranlık periyodu ile ayrılmış.
4. Hedef gen ekspresyon seviyelerini test edin
- Kabı bir dakika boyunca veya sivrisinekler hareket etmeyi bırakana kadar buz üzerine yerleştirerek sivrisinekleri soğuk anestezi altına alın. Sivrisinekler anestezi uygulandıktan sonra, diseksiyon için dişileri izole etmek için onları soğuk bir yüzeye yerleştirin.
- Sivrisineklere% 70 etanol püskürtün ve PBS ile cam bir yüzeye yerleştirin. Bir çift forseps ile, sivrisinek kafasını sabit bir şekilde sabitleyin ve göğüs kafesini çok yavaş çekin, tükürük bezlerinin PBS'ye salınmasına izin verin.
- Tükürük bezlerini, 10 kişi diseke edilene kadar buz gibi soğuk PBS'de tutun. Guanidinyum tiyosiyanat-fenol-kloroform yöntemini kullanarak RNA ekstraksiyonu için Havuz On SG'ler. RNA peletini 30 μL RNaz içermeyen suda askıya alın.
- 260 ve 280 nm'de absorbansı okumak ve seyreltme faktörü ile çarparak her numunenin RNA konsantrasyonunu hesaplamak için önceki adımda SG'den ekstrakte edilen RNA'nın 1 μL aliquot'unu kullanın. ~2.0'lık bir 260/280 oranı, iyi kalitede RNA'yı gösterir.
- Ticari bir ters transkripsiyon kiti kullanarak tamamlayıcı DNA'yı (cDNA) sentezlemek için 1 μg saflaştırılmış RNA kullanın.
- Üreticinin tavsiyelerine göre bir RT-PCR reaksiyonu hazırlamak için cDNA'nın 1:10 seyreltilmesini yapın. Her örnek için, hedef gen için bir reaksiyon hazırlayın ve paralel olarak, temizlik (HK) geni ile bir reaksiyon ayarlayın. Yöntemden rastgele varyasyonun etkisini ortadan kaldırmak için her gen reaksiyonunu teknik bir üçlüye ayarlayın.
NOT: Burada, HK genleri olarak An. gambiae ribozomal S7 geni (GeneBank: L20837.1) ve aktin (VectorBase: AGAP000651) kullanılmıştır. - Tüm primerleri, SYBR-green üreticisinin endikasyonlarını takip ederek 300 nM'lik son konsantrasyonda kullanın. Standart PCR koşullarıyla yükseltin: 10 dakika boyunca 95 °C, ardından 95 °C'de 15 sn ve 60 °C'de 60 s'lik 40 döngü.
NOT: Gen ekspresyonunu ölçmek için delta-delta-Ct yöntemi (ΔΔCt) kullanılır. Delta Ct (ΔCt), hedef genin Ct ile temizlik geninin Ct arasındaki farktır. ΔΔCt, deney grubunun ΔCt'si ile kontrol grubu35'in ΔCt'si arasındaki farktır.
5. Fenotipik değerlendirme: başarılı kan besleme
- Kan besleme yeteneğini değerlendirmek için, hedef ile tedavi edilen 15 dişi sivrisinek gruplarını ayarlayın ve dsRNA'yı küçük kafeslerde (12 cm çapında) kontrol edin ve 4 saat boyunca aç bırakın.
- 37 ° C'ye ayarlanmış bir sirkülasyon suyu banyosu kullanarak, cam sivrisinek besleyiciler (24 mm çapında) ve parafilm membranı, sivrisineklere defibrinlenmiş koyun kanı sunar.
NOT: Kan, ABD menşeli sağlıklı, donör hayvanlardan aseptik olarak çeken ve antikoagülanlar veya katkı maddeleri olmadan manuel olarak defibrinasyon yapan ticari bir satıcıdan alınabilir. - Doğrudan gözlemle, her gruba tamamen dahil olmak için ilk beş dişiden başarılı bir şekilde kan unu elde etmek için yapılan sondalama girişimlerinin sayısını sayın ve kaydedin.
NOT: Sivrisineklerde, kan arama davranışını etkileyen enerji kaynaklarına müdahale edebilecek önemli metabolik değişikliklerden kaçınmak için, açlık minimumda tutuldu (4 saat). Sonuç olarak, her sivrisinek hevesle kan unu aramaz ve insan kokusuna maruz kalma, odalar ve beslenme yüzeyleri arasındaki sıcaklık değişimi gibi zaman değişkenlerinin etkisini azaltmak için engorged dişilerin sayısını beşle (her grubun toplamının üçte biri) sınırladık.
6. Fenotipik değerlendirme: Tükürük bezi morfolojisi ve ilgili proteinlerin aşağı regülasyonu
- Taze dokuyu adım 4.2'de açıklandığı gibi 1x Fosfat tamponlu salin (PBS) içinde izole edin ve 90 saniye boyunca buz gibi soğuk asetonda sabitleyin. Asetonu çıkardıktan sonra 1x PBS'de birkaç kez durulayın. 1x PBS'ye seyreltilmiş antiserum ile 4 ° C'de gece boyunca birincil antikorlarla inkübe edin (Malzeme Tablosuna bakınız).
NOT: Tükürük proteinleri için kullanılan birincil antikorların tanımlanması için Malzemeler Tablosuna bakınız (Anopheles anti-platelet protein, AAPP; Müsin 2, MUC2), SG transkripsiyon faktörleri (Çatal Kafası, fkh; Adaçayı, adaçayı; Siklik-AMP yanıt elemanı bağlayıcı protein A, CrebA) ve salgı veziküllerinin bir belirteci (Rab11). Bu antikorlar SG formu ve fonksiyonu için okuma olarak kullanılır. Bununla birlikte, immünofloresan için uygun herhangi bir antikor bu protokol için uygun olmalıdır. - 1x PBS'de birkaç kez yıkayın. 1x PBS'de seyreltilmiş ikincil antikorlar (floresan) ekleyin ve karanlıkta oda sıcaklığında 2 saat boyunca inkübe edin. Herhangi bir karşı leke ekleyin [örneğin 4′,6-diamidino-2-fenilindol (DAPI; DNA), buğday tohumu aglutinin (WGA; kitin için), falloidin (F-aktin için) ve / veya Nil Kırmızısı (lipitler için)] 2 saatlik inkübasyonun bitiminden 30 dakika önce.
- 1x PBS'de üç kez yıkayın. Daha sonra, dokuları% 100 gliserol içine 1 mm kalınlığında bir kapak kayması ile standart bir mikroskop slaydına monte edin ve floresan konfokal mikroskop kullanarak görüntülemeye kadar -20 ° C'de saklayın.
NOT: Kantitatif veriler elde etmek için, görüntüleme ayarları sabit tutulmalıdır. Burada, dokunun tüm 3D hacmi boyunca yalnızca maksimum yoğunluk projeksiyon görüntüleri dahil edildi ve tüm görüntü niceliği, SG olmayan doku kalıntılarındaki (yağ gövdesi, kütikül veya kafa) DAPI sinyaline dayanan tedaviler arasında (bir deney dahilinde) normalleştirildi. slaytta da bulunur.
Sonuçlar
Başlamak için, mevcut çalışmayla ilgili tüm genlerin ekspresyon durumunu belirlemek için gelişimsel aşamalar36,37 boyunca potansiyel hedefleri taramak için VectorBase'den mikroarray ekspresyon verileri kullanılmıştır (Tablo 1). Beklendiği gibi, seçtiğimiz tüm hedef genler yetişkin SG'lerde ekspresyon gösterdi. aapp ve adaçayı seviyeleri özellikle yüksekti (Tablo 1). Ayrıca, yetişkin dişi SG'lerde f-Agdsx'in yüksek ekspresyon seviyeleri de dikkat çekiciydi9.
RNAi reaktiflerinin tasarımı için E-RNAi web uygulaması kullanılarak dsRNA olarak kullanılmak üzere her genden spesifik segmentler değerlendirildi 30. Her bir hedef gene özgü diziler içeren ~ 400 bp bölgeleri daha sonra klonlandı (Şekil 1A), uygun bakteri suşlarına dönüştürüldü ve dsRNA üretmek için indüklenen ısıda öldürülen bakterilerin süspansiyonlarını hazırlamak için kullanıldı. Yetişkin sivrisinekler, f-Agdsx, fkh veya karınca (ilgisiz negatif kontrol) için dsRNA'nın bakteriyel süspansiyonlarını içeren sakkarozla ıslatılmış pamuk topları üzerinde 8 gün boyunca beslendi.
Dişi sivrisineklerin RNAi beslemesinin analizi için, ilk önce f-Agdsx veya fkh dsRNA beslemelerinin gen susturmaya neden olup olmadığı belirlendi. fkh-dsRNA ile beslenen grupta fkh-dsRNA düzeylerinde %98.8'lik bir azalma (±2.1) gözlenmiştir (Şekil 1B), dsRNA'nın SG'lerde fkh transkriptlerinin bolluğunu çok etkili bir şekilde azalttığını göstermektedir. Şaşırtıcı bir şekilde, fkh mRNA seviyeleri, f-Agdsx için dsRNA ile tedavi edilen sivrisineklerde% 89.86 (±4.48) oranında f-Agdsx indirgemesine sahip olan% 82.0 (±18.9) oranında azalmıştır. fkh'nin tükürük bezinde F-Dsx'in hedefi olabileceğini düşündürmektedir. Fkh ekspresyon seviyelerindeki önemli azalma ile birlikte, fkh-knockdown sivrisinekleri, kan beslemek için gereken sondalama girişimlerinin sayısında önemli bir artış göstermiştir. Bu sivrisinekler, ortalama olarak, kontrol grubundan veya f-Agdsx dsRNA ile beslenen sivrisineklerden beş kat daha fazla beslenme girişimi sergilediler (Şekil 1C). Bu, fkh knockdown RNAi tedavilerinin anahtar transkripsiyonel düzenleyicilerin (SG TF'ler Adaçayı ve CrebA) (Şekil 2), salgılanan proteinlerin (AAPP ve müsin) (Şekil 3) ve salgı makinelerinin [Nil Kırmızısı (lipitler) ve Rab11 (salgı vezikülleri)] (Şekil 4) lokalizasyonunda ve / veya dağılımında değişikliklere neden olup olmadığını sormaya yol açtı. Önemli olarak, farklı lob bölgelerinde, loblarda ve bireysel SG'lerde boyama yoğunluğunda önemli farklılıklar gözlenmiştir.
Tahmin edildiği gibi, adaçayı ve CrebA boyama seviyeleri, fkh RNAi'yi (Şekil 2B) takiben tüm SG loblarında, karınca kontrol RNAi'sine kıyasla belirgin şekilde azalmıştır (Şekil 2A). Çizgi tarama profillerinde hem en yüksek maksimum yoğunluk değerlerinde (kırmızı kesikli çizgiler ve sayısal etiketler) hem de en düşük maksimum yoğunluk değerlerinde (mavi kesikli çizgiler ve sayısal etiketler) azalmalar, doku içindeki hem yüksek hem de düşük sinyal alanlarında azalmalar olduğunu göstermiştir (Şekil 2A, B). Bu veriler, An. gambiae fkh RNAi'nin etkili olduğunu ve fkh'nin, Drosophila SGs 19,38,39'daki genetik ilişkilerine benzer şekilde, An. gambiae'deki SG TF'ler Sage ve CrebA'nın üretimini ve / veya stabilitesini düzenlediğini göstermektedir.
Çok bol tükürük bileşeni proteinleri göz önüne alındığında, kontrol RNAi tedavisine kıyasla, fkh RNAi'yi takip eden üç SG lobunda da Anofel anti-trombosit proteini (AAPP)40,41 seviyeleri azalmıştır (Şekil 3A, B; yeşil). Öte yandan, Müsin düzeylerinde herhangi bir değişiklik gözlenmemiştir (Şekil 3A,B; mor). Bu veriler, Fkh'nin farklı tükürük protein genlerinin ekspresyonuna farklı şekilde katkıda bulunduğunu göstermektedir.
Son olarak, iki salgı belirteci gözlenmiştir (Şekil 4A,B): Rab11 (apikal geri dönüşüm endozomları ile ilişkili veziküller)42 ve Nil Kırmızısı (lipitler). Fkh RNAi tedavisini takiben distal lateral (DL) loblarda azalmış Rab11 floresansı gözlendi (Şekil 4A v ve 4B v; yeşil). Bununla birlikte, medial (M) ve proksimal lateral (PL) loblarda artmış Rab11 sinyali de meydana gelmiştir (Şekil 4A vii, ix vs. 4B vii, ix; yeşil) meydana gelmiştir. Fkh RNAi sonrası Nil Kırmızısı sinyalinde (Şekil 4A,B; mor) kontrol RNAi tedavisine göre fark edilebilir bir fark gözlenmedi. Bu veriler, fkh indirgemesinin bazı salgı makineleri eylemlerini SG lobları arasında farklılık gösteren karmaşık bir şekilde değiştirebileceğini düşündürmektedir.
| Dataset: | Goltsev · | Neira Oviedo | Neira Oviedo | Fırıncı | Fırıncı | Fırıncı | Fırıncı | ||
| gen sembolü | fonksiyon | AGAP Kimliği | embriyo (25 saat) | L3 larvaları | L3 SG | yetişkin kadın vücut (3 gün) | yetişkin erkek vücut (3 gün) | yetişkin kadın SG (3 gün) | yetişkin erkek SG (3 gün) |
| AAPP | tükürük proteini | AGAP009974 | 3.92 | 4.38 | 4.33 | 3.81 | 2.46 | 11.92 | 2.69 |
| CrebA | txn faktörü | AGAP001464 | 6.28 | 5.22 | 5.92 | 2.99 | 2.96 | 3.27 | 3.13 |
| " | txn faktörü | AGAP011038 | 4.50 | 4.46 | 5.23 | 2.96 | 2.86 | 3.05 | 2.88 |
| dsx | txn faktörü | AGAP004050 | 4.91 | 5.39 | 5.55 | 3.72 | 4.00 | 4.57 | 4.01 |
| fkh | txn faktörü | AGAP001671 | 5.18 | 4.67 | 5.25 | 2.99 | 3.09 | 3.21 | 3.05 |
| MUC2 | tükürük proteini | AGAP012020 | 4.59 | 5.53 | 5.63 | 2.96 | 3.07 | 3.08 | 3.26 |
| Rab11 | veziküler kaçakçılık | AGAP004559 | 10.21 | 7.47 | 8.60 | 4.90 | 3.79 | 3.38 | 2.96 |
| akıllı | txn faktörü | AGAP013335 | 5.32 | 5.96 | 8.89 | 3.40 | 3.33 | 7.37 | 7.23 |
Tablo 1: An için ortalama log2 mikroarray ifade profilleri. gambiae ilgi çekici genler. Gösterilen gen adları, fonksiyonel kategori, Vectorbase (AGAP) tanımlayıcıları ve Vectorbase'den toplanan ortalama log2 mikroarray ekspresyon verileridir. Bu veriler, ilgilendiğimiz genlerin (tükürük bezi (SG) hücre biyolojisi ve sekresyonunda yer alan), larva evre 3 (L3) ve yetişkin SG'lerde, tüm bireylere kıyasla eksprese edildiğini ve zenginleştirildiğini göstermektedir.
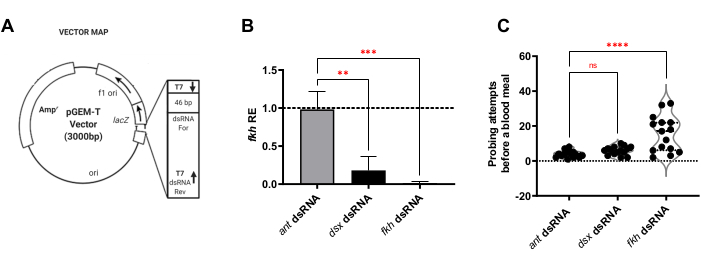
Şekil 1: Yetişkin An. gambiae'de f-Agdsx ve fkh knockdown, SG'lerdeki fkh mRNA seviyelerini azaltır ve kadınların kan besleme yeteneğini etkiler. (A) Bu metodolojide dsRNA üretimi için kullanılan plazmid tasarımının temsili görüntüsü. İkinci T7 promotör dizisi, pGEMT plazmidine klonlanacak kesici ucu yükseltmek için kullanılan 3' astarına dahil edilerek plazmid'e eklenir. Plazmid daha sonra E. coli HT115 (DE3) bakterilerine dönüştürülür ve% 10 şekerli suda indüklenmiş ısıdan öldürülmüş bakterilerin süspansiyonundan bir besleme çözeltisi yapılır. (B) F-Agdsx veya fkh için bir dsRNA besleme çözeltisi ile beslenen hayvanlar, önemli ölçüde daha düşük fkh transkript seviyeleri gösterdi (çoklu karşılaştırmalı tek yönlü ANOVA; n = 15). Bununla birlikte, sadece fkh dsRNA (C) ile beslenen grup, bir kan unu elde etmek için gereken ısırma girişimlerinin sayısında önemli bir fark göstermiştir. Bu gruptaki sivrisinekler, ortalama olarak, kontrol veya dsx-dsRNA ile beslenen grupların ihtiyaç duyduğundan daha başarılı bir kan unu elde etmek için yapılan sondalama girişimlerinin sayısının beş katına ihtiyaç duyuyordu (çoklu karşılaştırmalı tek yönlü ANOVA; n = 15). Hata çubukları, Ortalama Standart Hata'yı (SEM) gösterir. Her deney üç ayrı biyolojik kopyada gerçekleştirildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
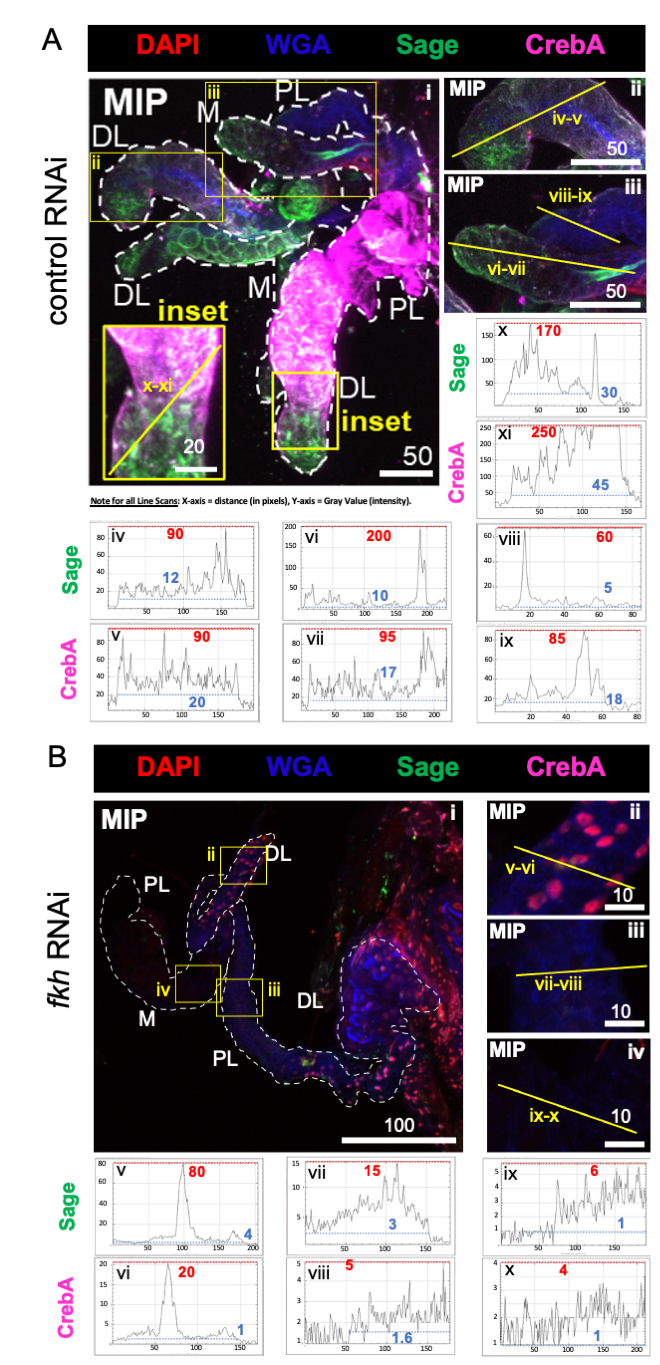
Şekil 2: Erişkin An. gambiae tükürük bezlerinde fkh knockdown, SG transkripsiyon faktörü düzeylerini azaltır. Gösterilen 13. gün yetişkin dişi An. gambiae SG'lerden 8 gün (5-13 gün) sonra (A) ilişkili olmayan dsRNA kontrolüne (karınca) veya (B) SG TF çatal kafasını (fkh, AGAP001671) hedef alan dsRNA'ya oral maruziyetten sonra% 10 sakarozda DAPI (DNA; kırmızı), etiketli buğday tohumu agglutinin (WGA, kitin / O-GlcNAsilasyon; mavi), SG TFs Sage (yeşil) ve CrebA'ya (mor) karşı antiserum. Gösterilen ölçek çubuğu uzunlukları mikronlardır. SG'ler (i) beyaz çizgilerle özetlenmiştir. Yakınlaştırılmış lob görüntülerindeki sarı çizgiler (sarı kutularla çevrili ve "giriş" etiketli bölgelerin), sinyal yoğunluğunun hat taramalarının nerede yapıldığını gösterir. Her yakınlaştırılmış lob için çizgi taramalarına karşılık gelen yeşil ve mor kanal yoğunlukları, görüntülerin altındaki grafiklerde (SG'de her zaman soldan sağa) çizilir; X ekseni = mesafe (piksel cinsinden) ve Y ekseni = gri birim (piksel yoğunluğu). Piksel yoğunluğunun dinamik aralığı kırmızı (maksimum) ve mavi (minimum) noktalı çizgilerle sınırlandırılır ve karşılık gelen değerler her grafikte gösterilir. MIP = tüm SG derinliği boyunca maksimum yoğunluklu 3D projeksiyon. DL: distal lateral lob; M: medial lob; PL: proksimal lateral lob; SD: tükürük kanalı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
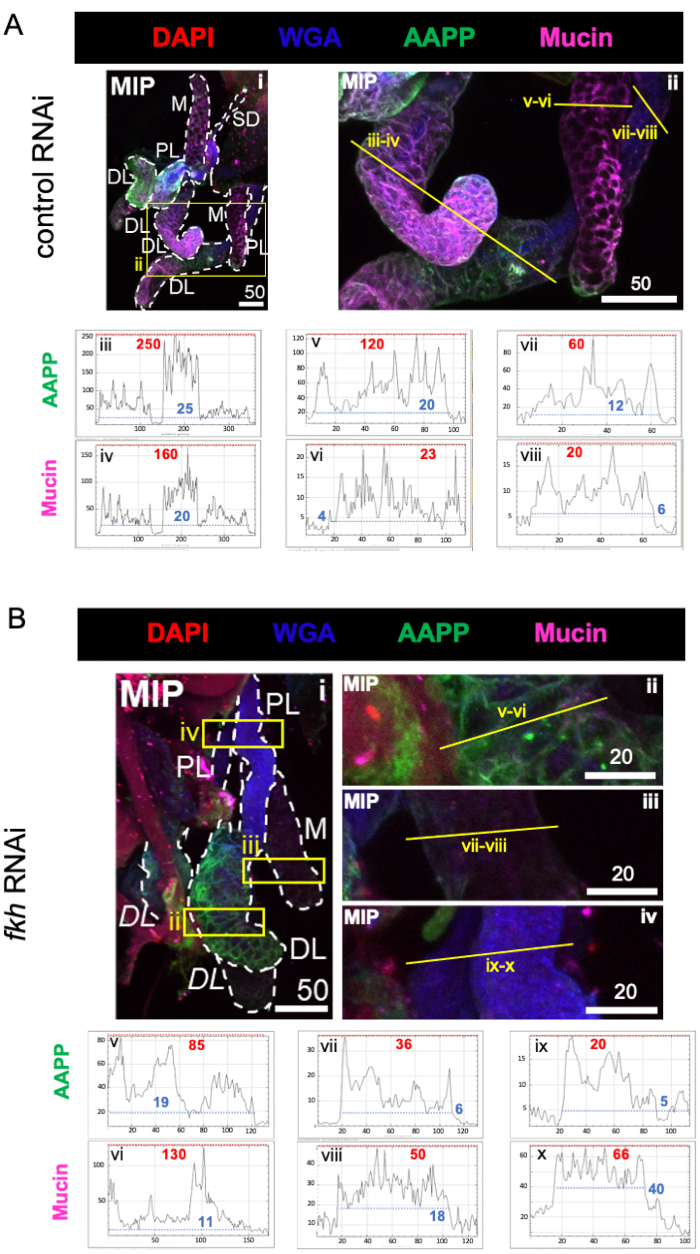
Şekil 3: Yetişkin An. gambiae tükürük bezlerinde fkh knockdown, SG salgılanan protein seviyelerini azaltır. Gösterilen 13. gün yetişkin dişi An. gambiae SG'lerden 8 gün (5-13 gün) sonra (A) ilişkili olmayan dsRNA kontrolüne (karınca) veya (B) SG TF çatal kafasını (fkh, AGAP001671) hedef alan dsRNA'ya oral maruziyetten sonra, DAPI (DNA; kırmızı) boyaları ile boyanmış% 10 sakkarozda, etiketli buğday tohumu agglutinin (WGA, kitin / O-GlcNAsilasyon; mavi), ve tükürük proteinleri AAPP (yeşil) ve Müsin (MUC2, mor). Gösterilen ölçek çubuğu uzunlukları mikronlardır. SG'ler (i) beyaz çizgilerle özetlenmiştir. Yakınlaştırılmış lob görüntülerindeki sarı çizgiler (sarı kutularla çevrili bölgelerin), sinyal yoğunluğunun hat taramalarının nerede yapıldığını gösterir. Her lob için çizgi taramalarına karşılık gelen yeşil ve mor kanal yoğunlukları, görüntülerin altındaki grafiklerde (SG'de her zaman soldan sağa) çizilir; X ekseni = mesafe (piksel cinsinden) ve Y ekseni = gri birim (piksel yoğunluğu). Piksel yoğunluğunun dinamik aralığı kırmızı (maksimum) ve mavi (minimum) kesikli çizgilerle sınırlandırılır ve karşılık gelen değerler her grafikte gösterilir. MIP = tüm SG derinliği boyunca maksimum yoğunluklu 3D projeksiyon. DL: distal lateral lob; M: medial lob; PL: proksimal lateral lob; SD: tükürük kanalı. İtalik "DL" etiketleri (Bi), aynı DL lobunun iki görünür bölgesini gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
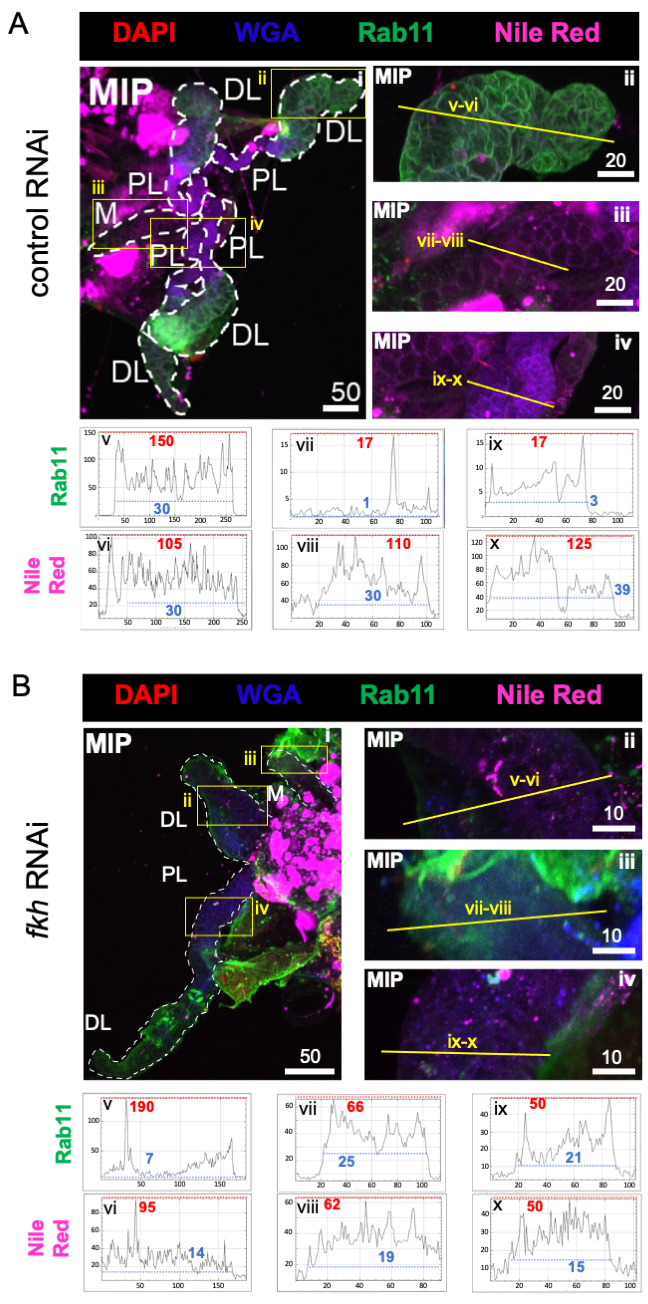
Şekil 4: Erişkin An. gambiae tükürük bezlerinde fkh knockdown, SG sekresyon belirteçlerini azaltır. Gösterilen temsili görüntüler 13. gün yetişkin dişi An. gambiae SG'lerden 8 gün (5-13 gün) oral maruziyetten sonra (A) ilişkili olmayan dsRNA kontrolüne (karınca) veya (B) SG TF çatal kafasını (fkh, AGAP001671) hedef alan dsRNA'ya% 10 sakkarozda DAPI (DNA; kırmızı), etiketli buğday tohumu agglutinin (WGA, kitin / O-GlcNAsilasyon; mavi) boyaları ile boyanmış, Nil Kırmızısı (lipitler; mor) ve geri dönüşüm endozom vezikül işaretleyicisi Rab11'e (yeşil) karşı antiserumlar. Gösterilen ölçek çubuğu uzunlukları mikronlardır. SG'ler (i) beyaz çizgilerle özetlenmiştir. Yakınlaştırılmış lob görüntülerindeki sarı çizgiler (sarı kutularla çevrili bölgelerin), sinyal yoğunluğunun hat taramalarının nerede yapıldığını gösterir. Her lob için çizgi taramalarına karşılık gelen yeşil ve mor kanal yoğunlukları, görüntülerin altındaki grafiklerde çizilir (SG'de her zaman soldan sağa); X ekseni = mesafe (piksel cinsinden) ve Y ekseni = gri birim (piksel yoğunluğu). Piksel yoğunluğunun dinamik aralığı kırmızı (maksimum) ve mavi (minimum) kesikli çizgilerle sınırlandırılır ve karşılık gelen değerler her grafikte gösterilir. MIP = tüm SG derinliği boyunca maksimum yoğunluklu 3D projeksiyon. DL: distal lateral lob; M: medial lob; PL: proksimal lateral lob; SD: tükürük kanalı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
DsRNA'yı An. gambiae sivrisineklerine oral besleme yoluyla etkili bir şekilde verme yeteneği, hem laboratuvarda hem de sahada vektör biyolojisi çalışmaları için geniş etkilere sahiptir. Mikroenjeksiyon uzun zamandır sivrisineklerde kimyasalların, antikorların, RNAi'nin ve genetik modifikasyon stratejilerinin tercih edilen dağıtım şekli olarak kabul edilmektedir43,44. Önemli fiziksel manipülasyonun, hücresel hasarın ve stresin sonucu, büyük ölçekli veya saha uygulamaları için potansiyel olarak uygun olabilecek oral teslimatın kullanılmasıyla önlenebilir. Önceki çalışmalar, RNAi'nin bireysel bir yetişkin sivrisinek29 içinde her yerde hareket ettiğini ve tükürük bezleri de dahil olmak üzere tüm dokularda etkilere izin verdiğini öne sürmüştür. Sivrisinekleri, uzun bir zaman dilimi boyunca asenkron olarak sindirilen çok sayıda dsRNA eksprese eden E. coli ile besleyerek, bir kafesteki tüm bireyler arasında RNAi'ye tutarlı ve düzgün bir şekilde maruz kalma potansiyeli elde edilebilir. Bu yöntem, çok sayıda sivrisinek beslemeye ve hedef gene bağlı olarak ortaya çıkan fenotiplerin potansiyel değişkenliğini analiz etmeye izin verir. Bununla birlikte, önemli bir husus, pamuk lifinde bakterilerin ve dolayısıyla dsRNA'nın heterojen dağılımı olasılığıdır. Sivrisinek şekeri beslemesi için günlük olarak kullanılan 400 μL bakteri, daha önce9 tarif edildiği ve hesaplandığı gibi yaklaşık ≤4.6 μg dsRNA içerecektir, ancak her bir sivrisinek tarafından yutulan dsRNA miktarı ayrı ayrı belirlenmemiştir. dsRNA yapılarının oluşturulması rutin hale gelirse, bu basit tedavi protokolü bu tekniğin herhangi bir sivrisinek araştırmacısı tarafından hızlı bir şekilde asimilasyonuna izin verir. A priori, tedavi sırasında harcanan zaman (günde 30 dakika), benzer numune boyutlarına mikroenjeksiyon öğrenmek ve uygulamak için geçen zamana kıyasla önemsizdir.
Beslenme dsRNA, model organizma Caenorhabditis elegans45'te ters genetik çalışmalar için rutin olarak kullanılmaktadır. Bu yoğun kullanım seviyesi, oral dağıtım yaklaşımının değerini vurgulamaktadır. Dönüştürülmüş E. coli'de, C. elegans46,47'de var olana benzer şekilde, An. gambiae genom çapında bir kütüphanenin oluşturulması, sivrisineklerde artan bir ölçekte hızlı ters genetik taramaya izin verecektir. Bununla birlikte, yöntemin etkinliğinin büyük ölçüde transkriptin endojen seviyelerine ve ekspresyonun hedef doku ile sınırlı kalmayıp daha geniş bir şekilde ifade edilip edilmediğine bağlı olduğunu belirtmek önemlidir 4,8,44. Ek olarak, bazı insektisitlerin sivrisineklerden davranışsal kaçınmaya neden olabileceğine dair kanıtlar vardır48 ve içlerinde potansiyel olarak olumsuz etkilere neden olan bakterilerle beslenmek benzer kaçınma modellerini tetikleyebilir. Sivrisineklerin alternatif bir besin kaynağına sahip olmadığı laboratuvarın kontrollü ortamında, E. coli ile şekerli sudan kaçınma seçenekleri yoktu ve besleyici bir kaynağa duyulan ihtiyaç muhtemelen bakterilerden kaçınma içgüdüsünü geçersiz kılacaktı. Bununla birlikte, stratejinin daha az kontrollü ortamlarda kullanılması amaçlanıyorsa bu dikkate alınmalıdır.
Aynı anda birden fazla geni hedeflemek mümkün olabilir (bir yapı, birden fazla yapı veya dönüştürülmüş bakteriyel izolatların bir karışımını kullanarak), ancak etkinliği değerlendirmek için daha ileri çalışmalara ihtiyaç vardır. Bu noktada dikkat edilmesi gereken bir diğer önemli nokta, tek veya birden fazla hedef kullanıldığında olası hedef dışı veya sinerjik etkilerin değerlendirilmesidir. Uygun kontrol genlerinin ve gruplarının oluşturulması deney tasarımının önemli bir parçasıdır. Ayrıca, bu yaklaşımın diğer patojenleri veya virüsleri hedeflemek için kullanılabileceğini tahmin etmek caziptir49. Sivrisineklerde RNAi indüksiyonuna yönelik önceki çalışmalar, reaktifin doğrudan enjekte edildiği koşullar altında gerçekleştirildi, bu nedenle E. coli mevcut değildi. E. coli , zaman içinde dsRNA'nın daha yavaş salınmasına izin veren koruyucu bir bölme sağlayabilir ve maruz kalmanın çok daha uzun bir süre boyunca az ya da çok sürekli olmasını sağlar29.
Son olarak, bu sonuçlar, bu tekniğin etkilerinin, maruz kalmanın zaman dilimini (uzunluk ve başlangıç günü) ve kullanılan E. coli miktarını ayarlayarak ayarlanabilir olduğunu göstermektedir. Bu özellik, deneme yanılma yoluyla optimal nakavt koşullarını tanımlayarak temel genlerin (dsx ve fkh) işlevlerini incelememizi sağladı. Bu, ilgilenilen hedef genlerin bu teknik kullanılarak araştırılma olasılığını büyük ölçüde artırır.
Özetle, RNAi'nin yetişkin sivrisineklere oral yoldan verilmesinin basit, çok yönlü ve sivrisinek gen fonksiyonunu incelemek ve sivrisinek kaynaklı hastalıkların vektör kontrolü için yeni ve dövülebilir araçların oluşturulması için güçlü bir yaklaşım olabileceği bulunmuştur.
Açıklamalar
Yazarlar, açıklayacak çıkar çatışmaları olmadığını bildirmektedir.
Teşekkürler
Yazarlar, Entomoloji Şubesi ve CDC'deki Paraziter Hastalıklar ve Sıtma Bölümü içindeki personele ve bilim insanlarına ve Brian Trigg ve Michelle Chiu'ya JHU'daki bakteri hazırlama konusundaki yardımları ve / veya bu çalışmanın yararlı tartışmaları için teşekkür etmek istemektedir. JHMRI Insectary ve yöneticisi Chris Kizito'ya An. gambiae sivrisineklerine erişim ve yetiştirme için teşekkür ederiz. Wei Huang'a (JHSPH) bu çalışmada kullanılmak üzere plazmidler PJet GFP ve pPB47 GFP elde etmedeki yardımı için teşekkür ederiz. Bu çalışma için finansman şu kişiler tarafından sağlanmıştır: NIH R21AI153588 (DJA'ya), Johns Hopkins Sıtma Araştırma Enstitüsü Doktora Sonrası Bursu (MW'ye); ve Good Ventures Vakfı ve Açık Hayırseverlik Projesi'nden CDC Vakfı'na sıtma araştırmalarına yardımcı olmak için sivrisineklerde kadın gelişiminin kriyoprezervasyonunu ve bastırılmasını destekleme, Açık Hayırseverlik Projesi, 2017. JHU Mikroskop Tesisi personelinin yardımını ve kullanılan mikroskop için geçerli NIH hibe desteğini derinden takdir ediyoruz (NIH Hibe No: S10OD016374). Bu makaledeki bulgular ve sonuçlar yazarlara aittir ve CDC'nin görüşlerini temsil etmek zorunda değildir. Ticari adların kullanımı yalnızca tanımlama amaçlıdır ve Hastalık Kontrol ve Önleme Merkezleri, Halk Sağlığı Hizmeti veya ABD Sağlık ve İnsani Hizmetler Bakanlığı tarafından onaylandığı anlamına gelmez.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 Kb Plus DNA Ladder | Thermo Fisher Scientific | 10787018 | |
| 2x Yeast Extract Tryptone (2xYT) Medium | BD Difco | DF0440-17 | |
| AAPP | n/a | n/a | Antisera. 1:50 dilution (rabbit); gift from Fabrizio Lombardo |
| AccuStart II PCR Supermix | Quantabio | 95137-100 | |
| Agarose | Millipore Sigma | A9539 | |
| Ampicillin | Millipore Sigma | A5354 | |
| Anopheles gambiae G3 | BioDefense and Emerging Infections (BEI) Malaria Research and Reference Reagent Resource Center (MR4) | MRA-112 | |
| BugDorm | BioQuip | 1452 | |
| Centrifuge 5810R | Eppendorf | P022628181 | |
| CrebA | DSHB | CrebA Rbt-PC | Antisera. 1:50 dilution (rabbit); generated by the Andrew Lab |
| Damiens diet | BioServ | ||
| DAPI | Life Technologies | n/a | 4′,6-diamidino-2-phenylindole; 1:200 dilution. |
| Defibrinated sheep blood | HemoStat | DSB050 | |
| Escherichia coli HT115 (DE3) | |||
| Ethidium bromide | Millipore Sigma | E7637 | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher Scientific | 4368814 | |
| Isopropyl β-D-1-thiogalactopyranoside | Millipore Sigma | I5502 | |
| JM109 Competent cells | Promega | L2005 | |
| Luria Broth Media | Thermo Fisher Scientific | 10855001 | |
| Mucin 2 | Proteintech | Muc2; 27 675-1-AP | Antisera. 1:100 dilution (mouse). |
| Nanodrop 2000 | Thermo Fisher Scientific | ||
| Nile Red | Sigma | n/a | Lipid dye; 1:50 dilution. |
| Owl EasyCast B2 Mini Gel Horizontal Electrophoresis | Thermo Fisher Scientific | Model B2 | |
| pGEMT easy | Promega | A3600 | |
| Power SYBR-green PCR master MIX | Applied Biosystems | 4367659 | |
| PureLink PCR purification kit | Thermo Fisher Scientific | K31001 | |
| QuantaStudio 6 | Applied Biosystems | ||
| QuantStudio6 Real Time PCR System | Applied Biosystems | ||
| Rab11 | n/a | n/a | Antisera. 1:100 dilution (rabbit); generated by the Andrew Lab |
| Rh-WGA | Vector Labs | n/a | Rhodamine-conjugated wheat germ agglutinin (chitin, O-GlcNAcylation dye); 1:40 dilution |
| Sage | n/a | n/a | Antisera. 1:50 dilution (rat); generated by the Andrew Lab |
| T4 DNA ligase | Promega | M1801 | |
| Tetracycline | Millipore Sigma | 87128 | |
| Trizol | Thermo Fisher Scientific | 15596018 | |
| Zeiss LSM700 fluorescence confocal microscope | Zeiss | ||
| ANTIBODIES | |||
| Chicken anti-Rat IgG (H+L), Alexa Fluor 647 | Thermo Fisher Scientific | A21472 | |
| Goat anti-Mouse IgG (H+L), Alexa Fluor 647 | Thermo Fisher Scientific | A28181 | |
| IgG (H+L) Goat anti-Rabbit, Alexa Fluor 488 | Thermo Fisher Scientific | A27034 | |
| Rabbit anti-Goat IgG (H+L), Alexa Fluor 488 | Thermo Fisher Scientific | A27012 | |
| PRIMERS | |||
| ACT-2f: TACAACTCGATCATGAAGTGCGA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| ACT-3r: CCCGGGTACATGGTGGTACCGC CGGA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| FKH_RNAi_F: GCCGACTTATGCTTAGCCCA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| FKH_RNAi_R: TAGCCGTCAATTCCTCCTGC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| newDSX-f: AGAGGGCGGGGAAATTCTAGT | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| newDSX-r: GGGCTTGTGGCAGTACGAATA | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| S7qf1: AGAACCAGCAGACCACCATC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
| S7qr1: GCTGCAAACTTCGGCTATTC | CDC Biotechnology Core Facility Branch | n/a | qRT-PCR primer |
Referanslar
- Hoa, N. T., Keene, K. M., Olson, K. E., Zheng, L. Characterization of RNA interference in an Anopheles gambiae cell line. Insect Biochemistry and Molecular Biology. 33, 949-957 (2003).
- Caplen, N., Zheng, Z., Falgout, B., Morgan, R. Inhibition of viral gene expression and replication in mosquito cells by dsRNA-triggered RNA interference | Elsevier enhanced reader. Molecular Therapy. 6, 243-251 (2002).
- Brown, A. E., Catteruccia, F. Toward silencing the burden of malaria: progress and prospects for RNAi-based approaches. BioTechniques. , 38-44 (2006).
- Airs, P. M., Bartholomay, L. C. RNA interference for mosquito and mosquito-borne disease control. Insects. 8, (2017).
- Blandin, S., et al. Reverse genetics in the mosquito Anopheles gambiae: targeted disruption of the Defensin gene. EMBO Reports. 3 (9), 852-856 (2002).
- Garver, L., Dimopoulos, G. Protocol for RNAi assays in adult mosquitoes (A. gambiae). Journal of Visualized Experiments: JoVE. (5), e230 (2007).
- Whyard, S., et al. Silencing the buzz: a new approach to population suppression of mosquitoes by feeding larvae double-stranded RNAs. Parasites & Vectors. 8, 96 (2015).
- Wiltshire, R. M., Duman-Scheel, M. Advances in oral RNAi for disease vector mosquito research and control. Current Opinion in Insect Science. 40, 18-23 (2020).
- Taracena, M. L., Hunt, C. M., Benedict, M. Q., Pennington, P. M., Dotson, E. M. Downregulation of female doublesex expression by oral-mediated RNA interference reduces number and fitness of Anopheles gambiae adult females. Parasites & Vectors. 12, 170 (2019).
- Grassi, B. Studi di uno zoologo sulla malaria. Real Accademia dei Lincei. 3, 229 (1901).
- Smith, R. C., Jacobs-lorena, M. Plasmodium - Mosquito interactions: A tale of roadblocks and detours. Advances in Insect Physiology. 39, (2010).
- Das, S., et al. Transcriptomic and functional analysis of the Anopheles gambiae salivary gland in relation to blood feeding. BMC Genomics. 11, 1-14 (2010).
- Francischetti, I. M. B., Valenzuela, J. G., Pham, V. M., Garfield, M. K., Ribeiro, J. M. C. Toward a catalog for the transcripts and proteins (sialome) from the salivary gland of the malaria vector Anopheles gambiae. Journal of Experimental Biology. 205, 2429-2451 (2002).
- Henderson, K. D., Isaac, D. D., Andrew, D. J. Cell fate specification in thedrosophila salivary gland: The integration of homeotic gene function with the DPP signaling cascade. Developmental Biology. 205, 10-21 (1999).
- Mach, V., Ohno, K., Kokubo, H., Suzuki, Y. The Drosophila fork head factor directly controls larval salivary gland-specific expression of the glue protein gene Sgs3. Nucleic Acids Research. 24 (12), 2387-2394 (1996).
- Weiserova, M., et al. Mini-Mu transposition of bacterial genes on the transmissible plasmid. Folia Microbiologica. 32 (5), 368-375 (1987).
- Abrams, E. W., Mihoulides, W. K., Andrew, D. J. Fork head and Sage maintain a uniform and patent salivary gland lumen through regulation of two downstream target genes, PH4αSG1 and PH4αSG2. Development. 133, 3517-3527 (2006).
- Myat, M. M., Isaac, P. P., Andrew, D. J. Early genes required for salivary gland fate determination and morphogenesis in Drosophila melanogaster. Advances in Dental Research. 14, 89-98 (2000).
- Fox, R. M., Vaishnavi, A., Maruyama, R., Andrew, D. J. Organ-specific gene expression: the bHLH protein Sage provides tissue specificity to Drosophila FoxA. Development of Cell Biology. 140, 2160-2171 (2013).
- Maruyama, R., Grevengoed, E., Stempniewicz, P., Andrew, D. J. Genome-wide analysis reveals a major role in cell fate maintenance and an unexpected role in endoreduplication for the Drosophila FoxA gene fork head. PLOS ONE. 6, 20901 (2011).
- Johnson, D. M., et al. CrebA increases secretory capacity through direct transcriptional regulation of the secretory machinery, a subset of secretory cargo, and other key regulators. Traffic. 21, 560-577 (2020).
- Fox, R. M., Hanlon, C. D., Andrew, D. J. The CrebA/Creb3-like transcription factors are major and direct regulators of secretory capacity. Journal of Cell Biology. 191, 479-492 (2010).
- Abrams, E. W., Andrew, D. J. CrebA regulates secretory activity in the Drosophila salivary gland and epidermis. Development. 132, 2743-2758 (2005).
- Wells, M. B., Andrew, D. J. Anopheles salivary gland architecture shapes plasmodium sporozoite availability for transmission. mBio. 10 (4), 01238 (2019).
- Pei-Wen, L., Xiao-Cong, L., Jin-Bao, G., Yan, L., Xiao-Guang, C. Molecular cloning, characterization and expression analysis of sex determiantion gene doublesex from Anopheles gambiae (Diptera: Culicidae). Acta Entomologica Sinica. 58 (2), 122-131 (2015).
- Scali, C., Catteruccia, F., Li, Q., Crisanti, A. Identification of sex-specific transcripts of the Anopheles gambiae doublesex gene. The Journal of Experimental Biology. 208, 3701-3709 (2005).
- Price, D. C., Egizi, A., Fonseca, D. M. Characterization of the doublesex gene within the Culex pipiens complex suggests regulatory plasticity at the base of the mosquito sex determination cascade. BMC Evolutionary Biology. 15, 1-13 (2015).
- Mysore, K., et al. siRNA-mediated silencing of doublesex during female development of the dengue vector mosquito Aedes aegypti. PLoS Neglected Tropical Diseases. 9, 1-21 (2015).
- Boisson, B., et al. Gene silencing in mosquito salivary glands by RNAi. FEBS Letters. 580, 1988-1992 (2006).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents-2010 update. Nucleic Acids Research. 38, 332-339 (2010).
- Taracena, M. L., et al. Genetically modifying the insect gut microbiota to control chagas disease vectors through systemic RNAi. PLoS Neglected Tropical Diseases. 9, (2015).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory Manual. , (1989).
- Ullmann, A., Jacob, F., Monod, J. Characterization by in vitro complementation of a peptide corresponding to an operator-proximal segment of the β-galactosidase structural gene of Escherichia coli. Journal of Molecular Biology. 24, 339-343 (1967).
- Timmons, L. Bacteria-mediated RNAi-General outline. Carnegie Institution of Washington. , (2000).
- Pfaffl, M. W. Relative quantification. Real-time PCR. , 63-82 (2004).
- Neira-Oviedo, M., et al. The RNA-Seq approach to studying the expression of mosquito mitochondrial genes. Insect Molecular Biology. 20, 141-152 (2011).
- Baker, D. A., et al. A comprehensive gene expression atlas of sex- and tissue-specificity in the malaria vector, Anopheles gambiae. BMC Genomics. 12, (2011).
- Loganathan, R., Hoon, J., Wells, M. B., Andrew, D. J. Secrets of secretion - How studies of the Drosophila salivary gland have informed our understanding of the cellular networks underlying secretory organ form and function. Cellular Networks in Development. , 143 (2021).
- Chung, S., Hanlon, C. D., Andrew, D. J. Building and specializing epithelial tubular organs: The Drosophila salivary gland as a model system for revealing how epithelial organs are specified, form and specialize. Wiley Interdisciplinary Reviews: Developmental Biology. 3, 281-300 (2014).
- Yoshida, S., et al. Inhibition of collagen-induced platelet aggregation by anopheline antiplatelet protein, a saliva protein from a malaria vector mosquito. Blood. 111, 2007-2014 (2008).
- Wells, M. B., Villamor, J., Andrew, D. J. Salivary gland maturation and duct formation in the African malaria mosquito Anopheles gambiae. Scientific Reports. 7 (1), 601 (2017).
- Takahashi, S., et al. Rab11 regulates exocytosis of recycling vesicles at the plasma membrane. Journal of Cell Science. 125, 4049-4057 (2012).
- Catteruccia, F., Levashina, E. A. RNAi in the malaria vector, Anopheles gambiae. Methods in Molecular Biology. 555, 63-75 (2009).
- Balakrishna Pillai, A., et al. RNA interference in mosquito: understanding immune responses, double-stranded RNA delivery systems and potential applications in vector control. Insect Molecular Biology. 26, 127-139 (2017).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Kamath, R. S., et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Carrasco, D., et al. Behavioural adaptations of mosquito vectors to insecticide control. Current Opinion in Insect Science. 34, 48-54 (2019).
- Magalhaes, T., et al. Induction of RNA interference to block Zika virus replication and transmission in the mosquito Aedes aegypti. Insect Biochemistry and Molecular Biology. , 111 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır