Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akış Sitometrisi ile Yaşlanan Tümör Hücrelerinin Tanımlanması ve Zenginleştirilmesi için Uzak Kırmızı Floresan Yaşlanma İlişkili β-Galaktosidaz Probu
Bu Makalede
Özet
Kemoterapi ilaçlarının hücre kültüründe veya murin tümör modellerinde indüklediği yaşlanan kanser hücrelerinin floresan, akım sitometrik nicelleştirilmesi için bir protokol sunulmuştur. İsteğe bağlı prosedürler arasında ko-immün boyama, büyük parti veya zaman noktası analizini kolaylaştırmak için numune fiksasyonu ve akış sitometrik sıralama ile canlı yaşlanan hücrelerin zenginleştirilmesi yer almaktadır.
Özet
Hücresel yaşlanma, normalde yaşlanan hücrelerde yıllar içinde tahakkuk eden, ancak çeşitli kanser tedavilerinin neden olduğu hasara yanıt olarak tümör hücrelerinde hızla ortaya çıkabilen biyolojik hasarın neden olduğu proliferatif bir arrest durumudur. Tümör hücresi yaşlanması genellikle istenmeyen olarak kabul edilir, çünkü yaşlanan hücreler ölüme dirençli hale gelir ve tümör malignitesini ve tedavi direncini şiddetlendirirken tümör remisyonunu bloke eder. Bu nedenle, yaşlanan tümör hücrelerinin tanımlanması, kanser araştırma topluluğuna sürekli ilgi duymaktadır. Birçoğu iyi bilinen yaşlanma belirteci olan yaşlanma ile ilişkili beta-galaktosidaz (SA-β-Gal) aktivitesine dayanan çeşitli yaşlanma testleri mevcuttur.
Tipik olarak, SA-β-Gal testi, sabit hücreler üzerinde kromojenik bir substrat (X-Gal) kullanılarak, "mavi" yaşlanan hücrelerin ışık mikroskobu ile yavaş ve öznel sayımı ile gerçekleştirilir. C12-FDG (yeşil) ve DDAO-Galaktosid (DDAOG; uzak kırmızı) dahil olmak üzere hücre geçirgen, floresan SA-β-Gal substratları kullanılarak geliştirilmiş analizler, canlı hücrelerin analizini mümkün kıldı ve akış sitometreleri de dahil olmak üzere yüksek verimli floresan analiz platformlarının kullanılmasına izin verdi. C12-FDG, SA-β-Gal için iyi belgelenmiş bir probdur, ancak yeşil floresan emisyonu, lipofussin agregalarının birikmesi nedeniyle yaşlanma sırasında ortaya çıkan içsel hücresel otofloresan (AF) ile örtüşür. Uzak kırmızı SA-β-Gal probu DDAOG kullanılarak, yeşil hücresel otofloresan, yaşlanmayı doğrulamak için ikincil bir parametre olarak kullanılabilir ve tahlil için güvenilirlik katar. Kalan floresan kanallar, hücre canlılığı boyama veya isteğe bağlı floresan immünoetiketleme için kullanılabilir.
Akış sitometrisini kullanarak, yaşlanan tümör hücrelerinin tanımlanması için çift parametreli bir test olarak DDAOG ve lipofussin otofloresansının kullanımını gösteriyoruz. Canlı yaşlanan hücrelerin yüzdesinin kantitasyonu gerçekleştirilir. İstenirse, ilgilenilen hücre yüzey antijenlerini değerlendirmek için isteğe bağlı bir immünoetiketleme adımı eklenebilir. Tanımlanan yaşlanan hücreler ayrıca akış sitometrik olarak sıralanabilir ve aşağı akış analizi için toplanabilir. Toplanan yaşlanan hücreler hemen lize edilebilir (örneğin, immünotahliller veya 'omik analizler için) veya daha fazla kültürlenebilir.
Giriş
Yaşlanan hücreler normalde normal biyolojik yaşlanma sırasında organizmalarda yıllar içinde birikir, ancak radyasyon ve kemoterapi de dahil olmak üzere çeşitli kanser tedavilerinin neden olduğu hasara yanıt olarak tümör hücrelerinde hızla gelişebilir. Artık çoğalmamasına rağmen, tedaviye bağlı yaşlanan (TIS) tümör hücreleri tedavi direncine katkıda bulunabilir ve nüksetmeyi tetikleyebilir 1,2,3. TIS hücreleri tarafından salgılanan faktörler, immün kaçamağı veya metastazı teşvik ederek tümör malignitesini şiddetlendirebilir 4,5. TIS hücreleri karmaşık, bağlama özgü fenotipler, değişmiş metabolik profiller ve benzersiz immün yanıtlar geliştirir 6,7,8. Bu nedenle, çeşitli kanser tedavisi yaklaşımları tarafından indüklenen TIS tümör hücrelerinin tanımlanması ve karakterizasyonu, kanser araştırma topluluğunun sürekli ilgi duyduğu bir konudur.
TIS tümör hücrelerini tespit etmek için, öncelikle yaşlanma belirteci enzimi lizozomal beta-galaktosidaz GLB19'un artan aktivitesini tespit etmeye dayanan geleneksel yaşlanma testleri yaygın olarak kullanılmaktadır. Nötre yakın (asidik değil) lizozomal pH'ta tespit, yaşlanma ile ilişkili beta-galaktosidaz (SA-β-Gal)10'un spesifik tespitine izin verir. Birkaç on yıldır kullanılan standart bir SA-β-Gal testi, ışık mikroskobu11 ile sabit hücrelerde SA-β-Gal'i tespit etmek için mavi bir kromojenik beta-galaktosidaz substratı olan X-Gal (5-bromo-4-kloro-3-indolil-β-D-galaktopiranosid) kullanır. X-Gal testi, yaygın olarak bulunan reaktifler ve laboratuvar ekipmanlarını kullanarak TIS'in kalitatif görsel doğrulamasını sağlar. Temel bir iletilen ışık mikroskobu, mavi kromojenin varlığını değerlendirmek için gereken tek enstrümantasyondur. Bununla birlikte, X-Gal boyama prosedürü hassasiyetten yoksun olabilir, bazen rengin gelişmesi için 24 saatten fazla zaman gerekir. Boyama, bir ışık mikroskobu altında mavi kromojen yoğunluğunun bir miktar seviyesini sergileyen hücrelerin sayılmasına dayanan bireysel yaşlanan hücrelerin düşük verimli, öznel skorlaması ile takip edilir. X-Gal hücre geçirimsiz olduğundan, bu tahlil, aşağı akış analizi için geri kazanılamayan çözücü sabit hücreler gerektirir. Hayvanlardan veya hastalardan sınırlı örneklerle çalışırken, bu büyük bir dezavantaj olabilir.
C 12-FDG (5-dodekanoylaminofluorescein Di-β-D-Galactopyranoside, yeşil) ve DDAOG (9H-(1,3-dichloro-9,9-dimethylacridin-2-one-7-yl) β-D-Galactopyranoside, far-red) dahil olmak üzere hücre geçirgen, floresan enzim substratları kullanılarak geliştirilmiş SA-β-Gal testleri daha önce literatür12,13,14,15'te ortaya çıkmıştır. DDAOG'un kimyasal prob yapısı ve optik özellikleri Ek Şekil S1'de gösterilmiştir. Bu hücre perkastlı problar, canlı (sabit değil) hücrelerin analizine izin verir ve kromojenik problar yerine floresan, yüksek içerikli tarama cihazları ve akış sitometreleri de dahil olmak üzere hızlı yüksek verimli floresan analiz platformlarının kullanımını kolaylaştırır. Akış sitometrelerinin sıralanması, aşağı akış analizi için hücre kültürlerinden veya tümörlerden (örneğin, batı lekelenmesi, ELISA veya 'omikler) zenginleştirilmiş canlı yaşlanan hücre popülasyonlarının geri kazanılmasını sağlar. Floresan analizi ayrıca belirli bir numunedeki yaşlanan hücrelerin yüzdesinin daha doğru bir şekilde belirlenmesini sağlayan nicel bir sinyal sağlar. Canlılık probları ve florofor etiketli antikorlar dahil olmak üzere ek floresan problar, SA-β-Gal'in ötesindeki hedeflerin çoklanmış analizi için kolayca eklenebilir.
DDAOG'a benzer şekilde, C12-FDG, SA-β-Gal için bir floresan probdur, ancak yeşil floresan emisyonu,hücre 16'da lipofuscin agregalarının birikmesi nedeniyle yaşlanma sırasında ortaya çıkan içsel hücresel AF ile örtüşür. Uzak kırmızı DDAOG probu kullanılarak, yeşil hücresel AF, yaşlanma17'yi doğrulamak için ikincil bir parametre olarak kullanılabilir. Bu, yaşlanma18 için tek bir belirteç olarak genellikle güvenilmez olabilen SA-β-Gal'e ek olarak ikinci bir belirteç kullanarak tahlil güvenilirliğini artırır. Yaşlanan hücrelerde endojen AF'nin tespiti etiketsiz bir yaklaşım olduğundan, DDAOG tabanlı tahlilimizin özgüllüğünü genişletmenin hızlı ve basit bir yoludur.
Bu protokolde, DDAOG ve AF'nin, in vitro kültürlerden veya farelerde kurulan ilaçla tedavi edilen tümörlerden izole edilmiş canlı TIS tümör hücrelerinin tanımlanması için hızlı, çift parametreli bir akış sitometri testi olarak kullanımını gösteriyoruz (Şekil 1). Protokol, çok çeşitli standart ticari akış sitometri analizörleri ve ayıklayıcıları ile uyumlu floroforlar kullanır (Tablo 1). Standart akış sitometri analizi kullanılarak canlı yaşlanan hücrelerin yüzdesinin kantitasyonu sağlanır. İstenirse, yaşlanma ile eşzamanlı olarak ilgilenilen hücre yüzey antijenlerini değerlendirmek için isteğe bağlı bir immünoetiketleme adımı gerçekleştirilebilir. Tanımlanan yaşlanan hücreler, standart floresan aktive hücre sıralama (FACS) metodolojisi kullanılarak da zenginleştirilebilir.
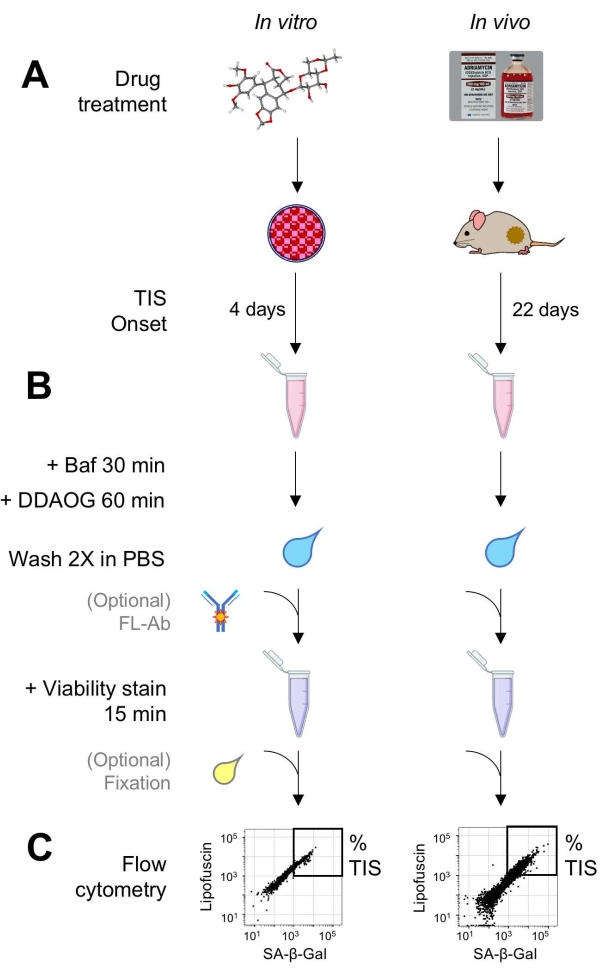
Şekil 1: Deneysel iş akışı. DDAOG testinin kilit noktalarını özetleyen şematik bir özetleme. (A) TIS'e neden olan bir ilaç, memeli kültürlü hücrelere eklenir veya tümör taşıyan farelere uygulanır. Daha sonra TIS'in başlangıcı için zamana izin verilir: hücreler için, tedaviden 4 gün sonra; fareler için, toplam 22 gün, her 5 günde bir üç tedavi artı 7 gün iyileşme. Hücreler toplanır veya tümörler süspansiyona ayrılır. (B) Numuneler, 30 dakika boyunca SA-β-Gal'in tespiti için lizozomal pH'ı ayarlamak üzere Baf ile muamele edilir; Daha sonra, SA-β-Gal'i tespit etmek için 60 dakika boyunca DDAOG probu eklenir. Numuneler PBS'de 2 kat yıkanır ve kısaca bir canlılık lekesi eklenir (15 dakika). İsteğe bağlı olarak, numuneler açık floresan kanallarında floresan antikorları ile boyanabilir ve / veya daha sonra analiz edilmek üzere sabitlenebilir. (C) Numuneler standart bir akış sitometresi kullanılarak analiz edilir. Canlı hücreler, yeşil otofloresansa (lipofussin) karşı kırmızı DDAOG (SA-β-Gal'i gösteren) gösteren nokta grafiklerinde görselleştirilir. TIS hücrelerinin yüzdesini belirlemek için bir kapı, işlenmemiş kontrol örneklerine dayanarak oluşturulur (gösterilmemiştir). Bir sıralama sitometresi (FACS) kullanılırsa, TIS hücreleri toplanabilir ve daha fazla in vitro tahlil için kültüre geri yerleştirilebilir veya moleküler biyoloji tahlilleri için lize edilebilir ve işlenebilir. Kısaltmalar: DDAO = 9H-(1,3-dikloro-9,9-dimetilakridin-2-one); DDAOG = DDAO-Galaktosit; TIS = tedaviye bağlı yaşlanma; FL-Ab = florofor konjuge antikor; Baf = Bafilomisin A1; SA-β-Gal = yaşlanma ile ilişkili beta-galaktosidaz; PBS = fosfat tamponlu salin; FACS = floresan ile aktive edilmiş hücre sıralama. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Florofor | Algı -lar | Eski/Em (nm) | Sitometre lazer (nm) | Sitometre dedektörü / bandpass filtresi (nm) |
| cesaret | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscin (Lipofussin) | < 600 | 488 | 525 / 50 |
| CV450 Serisi | Canlılık | 408/450 | 405 | 450 / 50 |
| PE | Antikor/yüzey işaretleyici | 565/578 | 561 | 582 / 15 |
Tablo 1: Floroforlar ve sitometre optik özellikleri. Bu protokolde kullanılan sitometre özellikleri, toplam 4 lazer ve 15 emisyon dedektörü içeren bir cihaz için listelenmiştir. 645/660 nm'de tespit edilen DDAOG, SA-β-Gal1 tarafından parçalanan probun şeklidir. Amcalı DDAOG, 460/610 nm'de düşük seviyeli floresan gösterebilir, ancak protokoldeki yıkama adımlarıyla çıkarılır. Kısaltmalar: DDAO = 9H-(1,3-dikloro-9,9-dimetilakridin-2-one); DDAOG = DDAO-Galaktosit; AF = otofloresan; PE = fikoeritrin; SA-β-Gal = yaşlanma ile ilişkili beta-galaktosidaz.
Protokol
Açıklanan tüm hayvan çalışmaları, Chicago Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
1. Stok çözümlerinin hazırlanması ve depolanması
NOT: Hücreler akış halinde sıralanacaksa, tüm çözeltiler steril teknikler kullanılarak hazırlanmalı ve 0,22 μm'lik bir filtre cihazından filtrelenmelidir.
- DMSO'da 5 mg / mL'de bir DDAO-Galaktosid stok çözeltisi hazırlayın. Tüp başına 50 μL'de (veya istenen hacimde) Aliquot. Karanlıkta 1 yıla kadar −20 °C'de saklayın.
- DMSO'da 1 mM'de bir Bafilomisin A1 stok çözeltisi hazırlayın. Tüp başına 50 μL'de (veya istenen hacimde) Aliquot. 6 aya kadar -20 ° C'de saklayın.
- DMSO'da 1 mM'de Calcein Violet 450'nin bir stok çözeltisini hazırlayın. Tüp başına 50 μL'de (veya istenen hacimde) Aliquot. Karanlıkta 1 yıla kadar −20 °C'de saklayın.
- Kültürlenmiş hücrelerin in vitro tedavisi için, uygun çözücüde yaşlanmaya neden olan ajanların 10 mM konsantre stok çözeltilerini hazırlayın ve 0,2 μm şırınga filtreleri kullanarak sterilize edin. −20 °C'de veya üretici tarafından yönlendirildiği şekilde saklayın.
NOT: Yaşlanmaya neden olan kemoterapi ajanlarının in vivo olarak verilmesi için (yerleşik tümörleri olan farelere), ajanlar USP derecesinde olmalı ve enjeksiyondan hemen önce konsantre stoktan salin içine seyreltilmelidir. - Kullanılan hücre hattı (ları) için tam kültür ortamı hazırlayın.
NOT: Örneğin, DMEM 1x +% 10 FBS + 1x glutamin ikamesi + 1x penisilin / streptomisin içeren B16-F10 veya A549 hücreleri için ortam hazırlayın. Medya steril tutulmalıdır. Diğer hücre hattına özgü ortam formülasyonları kullanılabilir. Glutatyon gibi bazı bileşenler, bazı durumlarda, yaşlanmanın başlangıcına müdahale edebilir. Çeşitli ortam formülasyonlarının ampirik testleri, yaşlanma başlangıcının beklenenden düşük olması veya kontrol kemoterapi ajanları ile gözlenmemesi durumunda yapılmalıdır. - Boyama hazırlayın ve tamponları yıkayın.
- Boyama prosedürlerinde kullanılmak üzere 1x PBS'de %1 sığır serum albümini (BSA) hazırlayın. 2 g BSA'yı 200 mL PBS içinde çözün ve oda sıcaklığında 10 dakika veya tamamen çözünene kadar karıştırın.
- Yıkama tamponu olarak 1x PBS'de %0,5 BSA hazırlayın. Adım 1.6.1'de hazırlanan %1 BSA'nın 100 mL'sini %0,5 BSA için 100 mL 1x PBS'ye seyreltin.
- Tamponları 4 °C'de 1 aya kadar saklayın.
- 1x PBS'de% 4 paraformaldehit hazırlayın. Kolaylık ve stabilite için piyasada bulunan, sızdırmaz paraformaldehit ampulleri (örneğin, %16 v/v) kullanın: 2,5 mL %16 PFA + 7,5 mL 1x PBS (= %4 PFA'nın 10 mL'si). Hazırlanan ses seviyesini, deneme başına gereken toplam ses düzeyine bağlı olarak ayarlayın.
NOT: Yalnızca hücre fiksasyonu için gerektiği gibi hazırlanın; her seferinde taze hazırlayın. - FACS ayıklama tamponunu hazırlayın: 1x PBS, 1 mM EDTA, 25 mM HEPES, %1 BSA (pH 7,2). 0,22 μm'lik bir filtreleme cihazından steril filtre uygulayın ve 4 °C'de 1 aya kadar saklayın.
NOT: Yalnızca FACS ayıklaması için gerektiği gibi hazırlanın. Akış sıralama tampon formülasyonları FACS cihazları arasında farklılık gösterebilir. Yukarıdaki formülasyon, bu çalışmada kullanılan aletle uyumludur (bakınız Malzeme Tablosu). Üreticinin yönergelerine bakın. - Tümör ayrışma solüsyonu hazırlayın: RPMI-1640 ortamında 20 μg / mL Liberaz TL + 100 μg / mL DNAse I (FBS veya diğer takviyeler olmadan). Stok çözeltileri, Liberase TL (üretici tarafından yönlendirildiği şekilde hazırlanır ve saklanır) ve DNAse I'i (çift damıtılmış suda [ddH 2 O], -20° C'de depolanan 100 mg / mL) elde tutmak için yararlıdır.
NOT: Sadece tümörleri kullanıyorsanız gerektiği gibi hazırlayın; her seferinde taze hazırlayın.
2. Kültürlenmiş kanser hücrelerinde kemoterapi ilaçları ile yaşlanmanın indüklenmesi
NOT: Bu bölümdeki tüm hücre manipülasyon adımları, steril uygulamalar kullanılarak bir biyogüvenlik kabininde gerçekleştirilmelidir. Bu bölüm yapışık hücre tipleri için yazılmıştır. Süspansiyon hücreleri, belirtildiği gibi uygun modifikasyonlarla kullanılabilir.
- Kanser hücresi hatlarını, tedarikçiden veya kullanılan spesifik hücre hatlarını sağlayan laboratuvardan gelen standart protokole göre büyütün.
NOT: Düşük geçişli hücreler (p < 10) genellikle tercih edilir, çünkü işlenmemiş hücre örneklerinde daha düşük replikatif yaşlanma seviyeleri, yani daha düşük arka plan olacaktır. - İlaçlarla yaşlanma indüksiyonundan bir gün önce,% 0.25 (veya önerildiği gibi) tripsin-EDTA ile hücreleri hasat edin. Tripsini eşit miktarda tam kültür ortamı ekleyerek nötralize edin ve hücre süspansiyonunu steril bir konik tüpe aktarın.
NOT: Bu adım, süspansiyon hücreleri için gerekli değildir. - Standart hemasitometre yöntemini kullanarak hücreleri sayın ve hücreleri / mL'yi kaydedin. Standart 6 delikli plastik kültür kaplarında 1 × 10 3-10 × 103 hücre/cm2 plaka hücreleri.
NOT: Optimum kaplama yoğunluğu, hücrelerin çoğalma hızına bağlıdır ve kullanıcı tarafından belirlenmelidir. Hücreler, tedavi sırasında yaklaşık% 10-20 oranında log faz büyümesinde olmalıdır (yani, kaplamadan sonra 18-24 saatlik inkübasyonu takiben). Süspansiyon hücrelerinin başlangıç yoğunluğu (hücreler/mL) kullanıcı tarafından belirlenmelidir. Altı kuyucuklu plakalar tipik olarak bir standart akış sitometri analiz örneği için kuyucuk başına yeterli yaşlanan hücre verir. Akış sıralaması yapılıyorsa, aşağı akış analizleri için yeterli sayıda yaşlanan hücrenin geri kazanılmasını sağlamak için çok daha büyük bir yüzey alanı (örneğin, çoklu P150 plakaları) kullanılmalıdır (≥1 × 106). - Kaplanmış hücreleri% 5 CO 2 ve bir nem tavası ile 37 ° C'lik bir inkübatörde gece boyunca (18-24 saat) inkübe edin.
- Kaplanmış hücreleri yaşlanmaya neden olan kemoterapi ilaçlarıyla tedavi edin. En az bir pozitif kontrol ekleyin, örneğin etoposid (ETO) veya bleomisin (BLM). İlaç başına yinelenen kuyucuklar hazırlayın. Kontrol olarak yalnızca araç ile muamele görmüş bir set ekleyin.
NOT: Kullanılan hücre hattında yaşlanma indüksiyonu için en uygun konsantrasyonu belirlemek üzere her deneysel ajan için bir doz eğrisi kullanıcı tarafından test edilmelidir. - Yaşlanmanın başlamasına izin vermek için% 5 CO2 ve bir nem tavası ile 37 ° C'lik bir inkübatörde hücreleri 4 gün boyunca inkübe edin. Bir ışık mikroskobu kullanarak beklenen morfoloji değişiklikleri için günlük olarak inceleyin.
NOT: 3-5 gün arasındaki kuluçka süreleri, yaşlanma başlangıç hızına bağlı olarak kabul edilebilir. Medya değiştirilebilir ve ajan, yaşlanan hücrelerin kabul edilebilir bir yüzdesini elde ederken sağlıklı büyüme koşullarını teşvik etmek için istenildiği gibi yeniden uygulanabilir (veya uygulanamaz). - Yaşlanmanın başlamasından sonra, 37 ° C'de 5 dakika boyunca% 0.25 tripsin-EDTA ekleyerek hücreleri toplayın. Hücreler süspansiyona ayrıldığında, tripsini eşit hacimli bir tam ortam ile nötralize edin.
NOT: Bu adım, süspansiyonda büyüyen hücreler için gerekli değildir. Yüzey belirteci boyama yapılacaksa, tripsin-EDTA kullanımından kaçının, çünkü hücrelerdeki yüzey antijenlerini geçici olarak tahrip edebilir. Bunun yerine, steril bir plastik hücre kazıyıcı (veya yüzey antijenlerini korumak için tasarlanmış alternatif bir ayrışma reaktifi) kullanarak tek katmanı nazikçe ayırın. - Bir hemasitometre kullanarak her numunedeki hücreleri sayın. Her örnek için hücreleri/mL'yi hesaplayın.
NOT: Bu noktada ölü hücrelerin yüzdesini değerlendirmek için tripan mavisi eklenebilir (yani, ilaç tedavisi nedeniyle), ancak hücre ölümü DDAOG boyama iş akışı sırasında floresan canlılık boyası ile de belirlenecektir. - Aliquot ≥0.5 × numune başına 106 hücreyi 1.7 mL mikrosantrifüj tüplerine dönüştürür.
NOT: Numune başına düşen hücre sayısı tüm numunelerde standartlaştırılmalıdır. - Tüpleri 1.000 × g'da 5 dakika boyunca 4 ° C'de bir mikrosantrifüjde santrifüj yapın. Süper natantı çıkarın.
NOT: Soğutulmuş bir mikrosantrifüj mevcut değilse, belirli esnek hücre tipleri için ortam sıcaklığında santrifüjleme yapmak kabul edilebilir olabilir. - Bölüm 4'teki DDAOG boyamaya geçin.
3. Farelerde yerleşen tümörlerde kemoterapi ilaçları ile yaşlanmanın indüklenmesi
NOT: Tümör hücreleri FACS'e göre sıralanacaksa, bir biyogüvenlik kabininde çalışarak ve steril aletler, prosedürler ve reaktiflerle çalışarak her adımda sterilite sağlayın.
- Standart yöntemlere göre kanser hücrelerini deri altından enjekte ederek fare tümörü modelleri oluşturun (örneğin, Appelbe ve ark.19).
NOT: Enjekte edilecek kanser hücrelerinin sayısı, enjeksiyon bölgesi ve uygun fare suşu her protokol için optimize edilmelidir. Burada, B16-F10 hücreleri, 0.1 mL salin (1 × 107 hücre / mL) içinde 1 × 106 hücrede deri altından enjekte edildi.- Enjeksiyonları yapmadan önce tripan mavisi kullanan hücrelerin yaşayabilirliğinin% >90 olduğunu doğrulayın. Fareleri izofluran ile uyuşturun.
- 6-7 haftalık dişi C57 / BL6 farelerini% 3 izofluran ve hava karışımı ile anestezi altına alın ve steril bir biyogüvenlik kabini içine yerleştirilmiş bir indüksiyon odasında bu koşullar altında muhafaza edin. Farenin ayağını hafifçe sıkıştırarak anesteziyi onaylayın. İşlem sırasında kornea kurumasını önlemek için her iki göze de steril veteriner merhem uygulayın. İşlem sırasında, bir ısıtma lambası kullanarak fare vücut ısısını koruyun.
- Steril bir biyogüvenlik kabini içinde çalışırken, fareyi indüksiyon odasından çıkarın ve% 3'lük bir izofluran kaynağı sağlayan bir burun konisi ile temas ettirin. Enjeksiyon bölgesindeki yan bölgeyi temiz bir elektrikli tıraş bıçağı kullanarak tıraş edin. Hazırlanan hücre süspansiyonunu, enjeksiyondan hemen önce tüpü manuel olarak ters çevirerek kısa bir süre karıştırın ve steril bir 27 G iğne ile donatılmış steril bir 0,5 mL şırınga kullanarak hücre süspansiyonunu deri altından tıraş edilmiş kanatlara enjekte edin. Fareyi davlumbazdan çıkarın ve kurtarma kafesine aktarın.
- İyileşme kafesinde, göğüs yatışmasını korumak, doğru refleksi göstermek ve kafeste güvenli bir şekilde hareket edebilmek için yeterli bilinci yeniden kazanana kadar farelerin hayati belirtilerini sürekli olarak izleyin. Fareleri gözetimsiz bırakmayın veya tümör hücresi aşılaması geçiren hayvanları tamamen iyileşene kadar diğer hayvanların şirketine iade etmeyin. Kilo kaybı, azalmış aktivite / hareketlilik ve nörolojik semptomlar için tüm aşılanmış fareleri günlük olarak izleyin; Herhangi bir kategoride ciddi semptomlar gösteren ötazi fareleri. Aşılamayı takiben ağrı semptomları gösteren fareler için, deri altından bir kez buprenorfin (0.1-0.2 mg / kg) uygulayın.
NOT: Buprenorfin sonrası kalıcı ağrı gösteren fareler ötenazi yapılmalıdır.
- Kanser hücresi aşılamasından 5-7 gün sonra başlayarak, her 2-3 günde bir kumpaslarla tümör büyümesini ölçün. Tümör hacimce 50 mm3 ± 10mm3'e ulaştığında prosensansan tedaviyi başlatın.
NOT: Bu çalışmada, USP sınıfı doksorubisin hidroklorür (DOX) veya PEGile lipozomal doksorubisin (PLD) dozları% 0.9 sodyum klorür enjeksiyonunda (USP) 10 mg / kg'da uygulanmıştır. İlaçlar, tümörler 50 mm3 ± 10mm3'e ulaştığında başlayarak, her 5 günde bir, intraperitoneal olarak3x enjekte edildi. Fareler, tümörlerde TIS'in başlamasına izin vermek için son tedaviyi takiben 7 gün boyunca iyileşti. Yaşlanma indüksiyon dozajları ve diğer tedaviler ve / veya tümör modelleri için koşullar optimize edilmelidir. - Son ilaç tedavisinden 7 gün sonra, fareleri CO2 doz aşımı ve servikal çıkık veya laboratuvar hayvanı çalışma kılavuzlarına uygun olarak diğer onaylanmış yöntemlerle feda edin. Tümörleri tüketin ve steril tüplerde veya steril RPMI büyüme ortamı ile doldurulmuş 6 delikli plakalarda toplayın (işleme sırasında canlılığı korumak için).
NOT: Histolojik bir inceleme yapılırsa (örneğin, X-Gal veya immünohistokimya), tümörler burada ikiye bölünebilir, bir yarısı O.C.T.'de dondurularak gömülebilir ve dondurulmuş doku histolojisi için standart prosedürler kullanılarak kriyoseksiyon yapılabilir. Kalan tümör yarısı dissosiyasyon ve DDAOG boyama için bol miktarda materyal vermelidir. - Bir tümörü 5 mL RPMI ortamı içeren bir P100 plastik kabına aktarın. Bir neşter kullanarak tümörü parçalara ayırın.
- Asılı hücreler ve döküntüler içeren tümör parçalarının süspansiyonunun 5 mL'sini 15 mL'lik bir konik tüpe aktarın. Büyük döküntüler varsa bu süspansiyonu aktarmak için 25 mL'lik bir serolojik pipetin daha geniş ucunu kullanın. Malzemeleri toplamak için tabağı ek miktarda steril RPMI ile durulayın. Konik tüpü kapatın ve buzun üzerine yerleştirin.
- Kalan tümörler için 3.45-3.5 arasındaki adımları tekrarlayın. Çapraz kontaminasyonu önlemek için her tümör için ayrı bir plaka ve neşter kullanın veya tümörler arasında PBS ile iyice durulayın. Her tümörü kıymak için 5 mL taze ortam kullanın.
- Tümör ayrışma solüsyonunu hazırlayın: RPMI-1640 ortamında (FBS olmadan) 20 μg / mL Liberaz TL + 100 μg / mL DNAse I.
NOT: Tümör ayrışma çözeltileri için birçok etkili formülasyon mevcuttur ve farklı üreticilerin çeşitli enzimlerini ve diğer bileşenlerini içerebilir. Optimal bileşen konsantrasyonları tümör tipleri arasında büyük farklılıklar gösterebilir. Kırmızı kan hücreleri tümörde yüksek oranda mevcutsa, kırmızı kan hücresi lizisi ek olarak yapılabilir; ölü hücreler bir sorunsa, ölü hücre çıkarma kiti kullanılabilir. Kullanıcının, yüksek canlılık ve düşük kirletici hücrelerin, bağ materyalinin ve döküntülerin varlığını sağlayan optimal tümör ayrışma koşullarını bağımsız olarak belirlemesi şiddetle tavsiye edilir. - Tüm tümör örneklerini konik tüplerde 1.000 × g'da (4 ° C) 5 dakika boyunca santrifüj yapın. Süper natantı çıkarın.
- Tümör materyalinin hacmine bağlı olarak her tümör örneğine 1-5 mL tümör ayrışma çözeltisi ekleyin. Tüpteki tümör materyali peletinden 1-2 mL'yi aştığından emin olun. Vorteks karıştırmak için ılımlı bir hızda.
- Numuneleri 45 dakika boyunca hızlı dönüşlü 37 °C'lik bir inkübatöre yerleştirin. Vorteks kısaca her 15 dakikada bir.
- Her numuneyi 100 μm'lik bir hücre süzgecinden 50 mL'lik konik bir tüpe filtreleyin. Numuneler filtreden geçemeyecek kadar viskoz ise, seyreltmek için 10 mL RPMI-1640 ortamı ekleyin. Artık hücreleri toplamak için filtreleri RPMI ortamıyla durulayın.
- Her örnek için hücreleri / mL'yi saymak için bir hemasitometre kullanın.
- Aliquot, tümör örneği başına 5 × 106 hücrenin iki veya daha fazla replikasını yapar.
- 1.000 × g'da (4 °C) 5 dakika santrifüj. Süper natantı çıkarın.
- (İsteğe bağlı) İstenirse daha sonra DDAOG boyama için tümör örneklerini kriyoproteksiyon.
- Ayrışmış tümör hücresi peletini kriyoprezervasyon ortamında yeniden askıya alın: %50 FBS, %40 RPMI-1640, %10 DMSO, steril koşullar altında 5 × 106 hücre/mL'de hazırlanır.
- Aliquot Her kriyovyal içine 1 mL hücre süspansiyonu.
- Kriyovalleri -80 °C'de bir izopropanol hücre dondurma kabında 24 saat boyunca dondurun; Daha sonra, daha uzun süreli depolama için sıvı azot kriyodepolamaya aktarın (>1 hafta).
- Boyama istendiğinde, kriyovalleri buz üzerinde çözün ve bölüm 4'te DDAOG boyamasına devam edin.
NOT: Bazı tümörler kriyoprezervasyon yoluyla canlı kalamayabilir ve bu sürece karşı direnç, kullanıcı tarafından ilgilenilen tümör modeli için değerlendirilmelidir.
- DDAOG boyama için bölüm 4'e geçin.
4. Hücre veya tümör örneklerinde SA-β-Gal'in DDAOG boyanması
- 1 μM'lik son konsantrasyon için 1 mM Bafilomisin A1 stoğunu 1:1.000x'te DMEM ortamına (FBS'siz) seyreltin.
- 1 × 106 hücre/mL konsantrasyonu için hücre pelet numunelerine (adım 2.11 veya adım 3.16'dan) hazırlanmış Baf-DMEM çözeltisini ekleyin.
NOT: Örneğin, numune başına 0,5 × 106 hücre kullanılıyorsa, 0,5 mL Baf-DMEM ekleyin. Tümörler için, 5 × 106 hücre, 5 mL'lik Baf-DMEM'de boyanabilir. - Yavaş bir hızda ayarlanmış bir döndürücü/çalkalayıcı üzerinde 37 °C'de (CO2 olmadan) 30 dakika boyunca inkübe edin.
NOT: Boyama işlemi için, çözeltileri asitleştirebilen ve böylece Baf ve DDAOG boyamasına müdahale edebilen CO2 inkübatörlerinden kaçının. - Yıkamadan, DDAOG stok çözeltisini (5 mg/mL) 1:500x'te (10 μg/mL final) her numuneye ekleyin. Karıştırılacak pipet. 37 °C'de (CO2 olmadan) bir döndürücü/çalkalayıcı üzerinde 60 dakika boyunca değiştirin. Doğrudan ışıktan koruyun.
- Tüpleri 4 °C'de 1.000 x g'de 5 dakika boyunca santrifüj yapın. Süper natantı çıkarın.
- Karıştırmak için tüp ve pipet başına 1 mL buz gibi soğuk% 0,5 BSA ile yıkayın. Tüpleri 4 ° C'de 1.000 x g'de 5 dakika boyunca santrifüj yapın ve süpernatanı çıkarın. Hücreleri iyice yıkamak için bu adımı 2 kat tekrarlayın. Süpernatantı çıkarın ve devam edin.
NOT: İstenmeyen floresan emisyonu (460/610 nm) gösterebilen amcalı DDAOG'u çıkarmak için adım 4.6'daki yıkama adımlarını gerçekleştirmek önemlidir.
NOT: Hücre yüzeyi belirteçleri için immün boyama yapılıyorsa, aşağıdaki bölüm 5'e geçin. - (İsteğe bağlı) DDAOG boyalı hücrelerin daha sonra analiz edilmek üzere sabitlenmesi ve depolanması
- Yıkanan her numuneye damla damla 0,5 mL buz gibi soğuk% 4 paraformaldehit ekleyin. Karıştırılacak pipet.
- Oda sıcaklığında 10 dakika kuluçkaya yatırın.
- Hücreleri 1 mL PBS ile 2 kat yıkayın.
- Akış sitometri analizinden önce numuneleri 4 °C'de 1 haftaya kadar saklayın.
NOT: Sabit numuneler için adım 4.8'i atlayın.
- Calcein Violet 450 stokunu (1 mM) 1:1.000x'te %1 BSA-PBS'ye (1 μM final) seyreltin. Adım 4.6'dan itibaren yıkanmış hücre peletlerine 300 μL (kültürlenmiş hücre örnekleri için) veya 1.000 μL (tümör örnekleri için) ekleyin. Karanlıkta buz üzerinde 15 dakika kuluçkaya yatın.
- Akış sitometrisi kurulumuna ilerleyin (bölüm 6).
5. (İsteğe bağlı) DDAOG ile kombinasyon halinde hücre yüzey belirteçleri için immün boyama
NOT: Herhangi bir akış sitometrisi deneyinde olduğu gibi, floresan kanalları boyunca çapraz konuşmayı (varsa) belirlemek için yalnızca DDAOG ve floresan antikoru içeren tek lekeli kontrol örnekleri hazırlanmalıdır. Çapraz konuşma gözlenirse, standart akım sitometri kompanzasyonu yapılmalıdır20.
- Adım 4.6'da elde edilen hücre peletlerini 100 μL boyama tamponunda (1x PBS'de %1 BSA) yeniden askıya alın.
- Üretici tarafından önerilen titrasyonda hücre türlerine (fare veya insan) uygun Fc reseptörü bloke edici reaktifi ekleyin. 24 °C'de 10 dakika boyunca inkübe edin.
- Florofor konjuge antikorları, üretici tarafından önerilen (veya kullanıcı tarafından belirlenen) titrasyona ekleyin. Işıktan korunan buz üzerinde 20 dakika kuluçkaya yatın.
- Tüpleri 1.000 × g'de 4 °C'de 5 dakika santrifüj yapın. Süper natantı çıkarın.
- Karıştırmak için tüp ve pipet başına 1 mL buz gibi soğuk yıkama tamponu (%0,5 BSA-PBS) ile yıkayın. Tüpleri 4 ° C'de 1.000 × g'de 5 dakika boyunca santrifüj yapın ve süpernatanı çıkarın. Hücreleri iyice yıkamak için bu adımı 2 kat tekrarlayın.
- 1 mM Calcein Violet 450 saat 1:1,000x'te %1 BSA-PBS olarak seyreltin. Adım 5.5'ten itibaren yıkanmış hücre peletlerine 300 μL ekleyin. Karanlıkta buz üzerinde 15 dakika kuluçkaya yatın.
- Akış sitometri analizine geçin (bölüm 6-7).
6. Akış sitometresi kurulumu ve veri toplama
- Hücre örneklerini akış sitometri cihazı ile uyumlu tüplere aktarın. Tüpleri buzun üzerine yerleştirin ve ışıktan koruyun.
NOT: Hücre süspansiyonlarında agregalar gözlenirse, analizden önce süspansiyonu 70-100 μm hücre süzgeçlerinden geçirin. 40 μm süzgeç kullanmayın, çünkü daha büyük yaşlanan hücrelerin bazılarını dışlayabilirler. - Başvurulan yazılımda ( Malzeme Tablosuna bakın), aşağıdaki grafikleri açın: 1) FSC-A vs SSC-A nokta grafiği, 2) mor kanal histogramı, 3) uzak kırmızı kanal (örneğin, APC-A) ve yeşil kanal (örneğin, FITC-A) nokta grafiği.
NOT: Çift dışlama grafikleri ve tek kanallı histogramlar da kullanılabilir, ancak bunlar kesinlikle gerekli değildir. - Sitometre veri toplamayı başlatın.
- DDAOG ile lekelenmiş yalnızca araca özel kontrol numunesini giriş portuna yerleştirin. Düşük bir alım hızında, örnek veriler elde etmeye başlayın.
- FSC ve SSC voltajlarını, olayların %>90'ını grafik içinde içerecek şekilde ayarlayın. Hücreler çizime iyi uymuyorsa, alan ölçeklendirme ayarını 0,33-0,5 birime düşürün.
- Veri kaydetmeden yalnızca araç örneğini kaldırın.
- (İsteğe bağlı) 1 mL PBS içeren bir sitometre tüpüne bir damla gökkuşağı kalibrasyon mikrosferi ekleyin. Tüpü sitometre giriş portuna yerleştirin. Örnek verileri almaya başlayın.
- Menekşe, yeşil ve uzak kırmızı kanal voltajlarını, gökkuşağı mikrosferinin üst zirvesi her kanalda 104-10 5 birim göreceli floresan aralığında olacak şekilde ayarlayın ve tüm pikler her kanalda iyi bir şekilde ayrılır. 10.000 etkinlik kaydedin. Tüpü çıkarın.
- DDAOG ile boyanmış pozitif kontrol numunesini (örneğin, BLM, ETO) giriş portuna yerleştirin. Düşük bir hızda, örnek verileri alın. FSC, SSC, mor, yeşil ve uzak kırmızı kanallardaki olayları gözlemleyerek olayların %90'ından fazlasının tüm arazilerde yer almasını sağlayın. AF ve DDAOG sinyalinde yalnızca araç kontrolüne kıyasla bir artış olup olmadığına bakın.
- Bir sıralama sitometresi kullanıyorsanız, sıralamayı bu adımda başlatın.
- Kayıt tutma amacıyla, kontrol örneği ve sıralanmış her örnek için 10.000 hücre kaydedin.
- İstenilen hücre miktarını (≥1 × 106 tipik olarak uygundur) 3-5 mL kültür ortamına sahip cihaza uygun bir toplama tüpüne ayırın.
- Sıralamadan sonra, aşağı akış kültürüne veya analizine geçin.
- Sıralanmış numunelerin rutin analizi için bölüm 7'ye atlayın.
- Floresan antikorlar kullanıyorsanız, bölüm 5'te hazırlanan lekesiz, tek lekeli ve çift lekeli numuneleri kullanarak kanal voltajlarını burada optimize edin.
NOT: Burada kullanılan kalibre edilmiş akış sitometresi için, optimum kanal voltajları tipik olarak 250 ila 600 (orta aralık) arasında düşmüştür, ancak optimum voltajlar ve kanal voltaj aralıkları cihazlar arasında değişecektir. Sinyali bastırabilecek veya gürültüyü artırabilecek çok düşük veya yüksek aralıklarda voltaj kullanmaktan kaçının. - Adım 6.1-6.5'i tamamladıktan ve gerektiğinde sitometre ayarlarında ayarlamalar yaptıktan sonra, tüm numuneler için verileri kaydedin. Ayarların tüm örnek kayıtlar için tek tip kaldığından emin olun. Kültürlenmiş hücre örneği başına ≥10.000 olay veya tümör hücresi örneği başına ≥100.000 olay kaydedin.
NOT: Geçit ve analiz, veri toplama yazılımı (örneğin, FACSDiva) kullanılarak gerçekleştirilebilse de, ayrı bir analiz yazılımı (FlowJo) kullanılarak edinme sonrası gerçekleştirilecek eksiksiz bir geçit ve analiz iş akışı aşağıdaki bölüm 7'de açıklanmıştır. Sitometre iş istasyonundaki zamanı azaltmak ve özel analiz yazılımında bulunan ek araçlardan yararlanmak için satın alma sonrası analiz tercih edilir. - Örnek verileri .fcs dosya biçiminde kaydedin. Dosyaları akış sitometrisi analiz yazılımı (örneğin, FlowJo) ile donatılmış bir iş istasyonu bilgisayarına aktarın. Bölüm 7'ye geçin.
7. Akış sitometrisi veri analizi
NOT: Sunulan iş akışı FlowJo yazılımını kullanır. Alternatif akış sitometrisi veri analizi yazılımı, bu bölümde açıklanan temel adımlar benzer şekilde izlenirse kullanılabilir.
- FlowJo yazılımını kullanarak adım 6.7'den itibaren .fcs veri dosyalarını açın.
- Mizanpaj penceresini açın.
- Tüm örnekleri mizanpaj penceresine sürükleyip bırakın.
- Kapı canlı hücreleri.
- İlk olarak, yalnızca araç denetiminin örnek verilerine çift tıklayarak veri penceresini açın.
- Verileri mor kanal histogramı olarak görselleştirin. CV450 tarafından boyanan canlı hücreleri, ölü hücrelerden daha parlak floresanlarına dayanarak tanımlayın.
- Yalnızca uygulanabilir hücreleri dahil etmek için tek kapılı histogram aracını kullanarak bir kapı çizin. Kapıyı uygulanabilir olarak adlandırın.
- Ardından, örnek düzen penceresinden, kapıyı düzgün bir şekilde uygulamak için uygun geçidi diğer hücre örneklerinin üzerine sürükleyin.
- Mizanpaj penceresinde, tüm örnekleri menekşe kanal (canlılık) histogramları olarak görselleştirin. Devam etmeden önce canlı hücre geçidinin numuneler arasında uygun olduğunu doğrulayın; değilse, gerektiğinde ayarlamalar yapın.
NOT: Canlılık boyaması, tedaviler veya tümörler arasında farklılıklar gösterebilir.
- Kapı yaşlanan hücreler.
- Veri penceresini açmak için yalnızca araç kontrolü için kapılı uygulanabilir hücre verilerine çift tıklayın.
- Verileri uzak kırmızı kanal (DDAOG) ve yeşil kanal (AF) için nokta grafiği olarak görselleştirin.
- DDAOG+ ve AF+ (sağ üst kadran) hücrelerinin %<5'ini dahil etmek için dikdörtgen geçit aracını kullanarak bir kapı çizin. Kapıyı eski olarak adlandırın.
- Ardından, örnek düzen penceresinden, yaşlanan kapıyı diğer hücre örneklerinin uygulanabilir alt kümelerine sürükleyerek kapıyı düzgün bir şekilde uygulayın.
- Mizanpaj penceresine, bölüm 7.4'te yer alan tüm uygun hücre alt kümelerini sürükleyip bırakın. Tüm uygulanabilir numuneleri uzak kırmızı (örneğin, APC-A) ve yeşil kanal (örneğin, FITC-A) nokta grafikleri olarak görselleştirin.
- Adım 7.5.3'te çizilen yaşlanan kapının tüm arazilerde görünür olduğundan ve yalnızca araç kontrolü için kapının %≤5-%10 yaşlanan hücreler sergilediğinden emin olun.
- Yaşlanan hücrelerin yüzdesi yukarıdaki adımlar kullanılarak belirlendikten sonra, elde edilen verileri bir veri tablosunda özetlenen ve / veya standart yazılım kullanılarak istatistiksel olarak analiz edilen FlowJo grafiklerini kullanarak sunun.
Sonuçlar
SA-β-Gal tarafından yaşlanmanın tespiti için DDAOG'un X-Gal ve C12-FDG ile karşılaştırılabilirliğini göstermek için çeşitli deneyler yapılmıştır. İlk olarak, X-Gal, ETO tarafından indüklenen yaşlanan B16-F10 melanom hücrelerini boyamak için kullanıldı (Şekil 2A). ETO-ile tedavi edilen hücrelerin bir alt kümesinde yoğun bir mavi renk gelişirken, diğer hücreler daha az yoğun mavi boyama sergiledi. Morfoloji, ETO-ile tedavi edilen hücrelerin çoğu...
Tartışmalar
Son on yılda, akış sitometrisi, tümör immünolojisinin ortaya çıkan popülaritesi, daha düşük maliyetli akış sitometrelerinin geliştirilmesi ve akademik kurumlarda paylaşılan enstrümantasyon tesislerinin iyileştirilmesi nedeniyle kanser araştırmalarında daha yaygın bir tahlil platformu haline gelmiştir. Çok renkli analizler artık standarttır, çünkü çoğu yeni enstrüman menekşe, mavi-yeşil ve kırmızıdan kırmızıya optik dizilerle donatılmıştır. Bu nedenle, bu DDAOG protokolünün ?...
Açıklamalar
Yazarların bu çalışma için beyan edecekleri çıkar çatışmaları yoktur.
Teşekkürler
Chicago Üniversitesi'ndeki Sitometri ve Antikor Çekirdek Tesisi'ne akış sitometrisi enstrümantasyonu konusundaki desteği için teşekkür ederiz. Chicago Üniversitesi'ndeki Hayvan Araştırma Merkezi, hayvan barınağı sağladı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
Referanslar
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells - modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır