É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Sonda de β-Galactosidase Associada à Senescência Fluorescente Vermelha Distante para Identificação e Enriquecimento de Células Tumorais Senescentes por Citometria de Fluxo
Neste Artigo
Resumo
Um protocolo para quantificação citométrica de fluxo fluorescente de células cancerígenas senescentes induzidas por drogas quimioterápicas em cultura de células ou em modelos de tumores murinos é apresentado. Os procedimentos opcionais incluem co-imunocoloração, fixação de amostras para facilitar a análise de grandes lotes ou pontos de tempo e o enriquecimento de células senescentes viáveis por classificação citométrica de fluxo.
Resumo
A senescência celular é um estado de parada proliferativa induzido por danos biológicos que normalmente se acumula ao longo de anos em células envelhecidas, mas também pode surgir rapidamente em células tumorais como resposta a danos induzidos por vários tratamentos contra o câncer. A senescência das células tumorais é geralmente considerada indesejável, pois as células senescentes tornam-se resistentes à morte e bloqueiam a remissão do tumor, exacerbando a malignidade do tumor e a resistência ao tratamento. Portanto, a identificação de células tumorais senescentes é de interesse contínuo para a comunidade de pesquisa do câncer. Existem vários ensaios de senescência, muitos baseados na atividade do conhecido marcador de senescência, a beta-galactosidase associada à senescência (SA-β-Gal).
Normalmente, o ensaio SA-β-Gal é realizado usando um substrato cromogênico (X-Gal) em células fixas, com a enumeração lenta e subjetiva de células senescentes "azuis" por microscopia de luz. Ensaios aprimorados usando substratos SA-β-Gal fluorescentes e permeantes a células, incluindo C12-FDG (verde) e DDAO-Galactoside (DDAOG; vermelho-distante), permitiram a análise de células vivas e permitiram o uso de plataformas de análise fluorescente de alto rendimento, incluindo citômetros de fluxo. C12-FDG é uma sonda bem documentada para SA-β-Gal, mas sua emissão fluorescente verde se sobrepõe à autofluorescência celular intrínseca (FA) que surge durante a senescência devido ao acúmulo de agregados de lipofuscina. Ao utilizar a sonda SA-β-Gal DDAOG de vermelho distante, a autofluorescência celular verde pode ser usada como um parâmetro secundário para confirmar a senescência, adicionando confiabilidade ao ensaio. Os canais de fluorescência restantes podem ser usados para coloração de viabilidade celular ou imunomarcação fluorescente opcional.
Usando citometria de fluxo, demonstramos o uso de DDAOG e autofluorescência de lipofuscina como um ensaio de duplo parâmetro para a identificação de células tumorais senescentes. A quantificação da porcentagem de células senescentes viáveis é realizada. Se desejado, uma etapa opcional de imunomarcação pode ser incluída para avaliar antígenos de superfície celular de interesse. As células senescentes identificadas também podem ser classificadas citometricamente e coletadas para análise a jusante. As células senescentes coletadas podem ser imediatamente lisadas (por exemplo, para imunoensaios ou análise ômica) ou cultivadas posteriormente.
Introdução
As células senescentes normalmente se acumulam em organismos ao longo de anos durante o envelhecimento biológico normal, mas também podem se desenvolver rapidamente em células tumorais como resposta a danos induzidos por vários tratamentos contra o câncer, incluindo radiação e quimioterapia. Embora não proliferem mais, as células tumorais senescentes induzidas pela terapia (TIS) podem contribuir para a resistência ao tratamento e impulsionar a recorrência 1,2,3. Fatores secretados pelas células TIS podem exacerbar a malignidade tumoral, promovendo evasão imune ou metástase 4,5. As células TIS desenvolvem fenótipos complexos e específicos do contexto, perfis metabólicos alterados e respostas imunes únicas 6,7,8. Portanto, a identificação e caracterização de células tumorais TIS induzidas por várias abordagens de tratamento do câncer é um tópico de interesse contínuo para a comunidade de pesquisa do câncer.
Para detectar células tumorais TIS, ensaios de senescência convencionais são amplamente utilizados, principalmente baseados na detecção de aumento da atividade da enzima marcadora de senescência, a beta-galactosidase lisossômica GLB19. A detecção em um pH lisossômico quase neutro (em vez de ácido) permite a detecção específica de beta-galactosidase associada à senescência (SA-β-Gal)10. Um ensaio padrão SA-β-Gal que tem sido usado por várias décadas usa X-Gal (5-bromo-4-cloro-3-indolyl-β-D-galactopyranoside), um substrato cromogênico azul beta-galactosidase, para detectar SA-β-Gal em células fixas por microscopia de luz11. O ensaio X-Gal permite a confirmação visual qualitativa do TIS utilizando reagentes comumente disponíveis e equipamentos de laboratório. Um microscópio básico de luz transmitida é a única instrumentação necessária para avaliar a presença do cromogênio azul. No entanto, o procedimento de coloração X-Gal pode não ter sensibilidade, às vezes exigindo mais de 24 horas para que a cor se desenvolva. A coloração é seguida por uma pontuação subjetiva de baixo rendimento de células senescentes individuais com base na contagem das células que exibem algum nível de intensidade do cromogênio azul sob um microscópio de luz. Como o X-Gal é impermeável a células, este ensaio requer células fixas com solvente, que não podem ser recuperadas para análise a jusante. Ao trabalhar com amostras limitadas de animais ou pacientes, isso pode ser uma grande desvantagem.
Ensaios melhorados de SA-β-Gal utilizando substratos enzimáticos fluorescentes e permeantes a células, incluindo C 12-FDG (5-dodecanoilaminofluoresceína Di-β-D-Galactopyranoside, verde) e DDAOG (9H-(1,3-dicloro-9,9-dimetilacridina-2-ona-7-il) β-D-Galactopyranoside, far-red) já apareceram na literatura12,13,14,15. A estrutura da sonda química e as características ópticas do DDAOG são mostradas na Figura Suplementar S1. Essas sondas perfeitas por células permitem a análise de células vivas (em vez de fixas), e as sondas fluorescentes, em vez de cromogênicas, facilitam o uso de plataformas de análise fluorescente rápidas de alto rendimento, incluindo instrumentos de triagem de alto conteúdo e citômetros de fluxo. Os citômetros de fluxo de triagem permitem a recuperação de populações enriquecidas de células senescentes vivas de culturas celulares ou tumores para análise a jusante (por exemplo, western blotting, ELISA ou 'omics'). A análise de fluorescência também fornece um sinal quantitativo, permitindo uma determinação mais precisa da porcentagem de células senescentes dentro de uma determinada amostra. Sondas fluorescentes adicionais, incluindo sondas de viabilidade e anticorpos marcados com fluoróforos, podem ser prontamente adicionadas para análise multiplexada de alvos além de SA-β-Gal.
Semelhante ao DDAOG, o C12-FDG é uma sonda fluorescente para SA-β-Gal, mas sua emissão fluorescente verde se sobrepõe à FA celular intrínseca, que surge durante a senescência devido ao acúmulo de agregados de lipofuscina nas células16. Utilizando a sonda DDAOG vermelho-distante, a FA celular verde pode ser utilizada como parâmetro secundário para confirmar a senescência17. Isso melhora a confiabilidade do ensaio com o uso de um segundo marcador, além do SA-β-Gal, que muitas vezes pode não ser confiável como um único marcador de senescência18. Como a detecção de FA endógena em células senescentes é uma abordagem livre de rótulos, é uma maneira rápida e simples de expandir a especificidade do nosso ensaio baseado em DDAOG.
Neste protocolo, demonstramos o uso de DDAOG e FA como um ensaio rápido de citometria de fluxo de dois parâmetros para a identificação de células tumorais TIS viáveis de culturas in vitro ou isoladas de tumores tratados com drogas estabelecidos em camundongos (Figura 1). O protocolo utiliza fluoróforos compatíveis com uma ampla gama de analisadores e classificadores de citometria de fluxo comercial padrão (Tabela 1). A quantificação da porcentagem de células senescentes viáveis usando a análise de citometria de fluxo padrão é habilitada. Se desejado, uma etapa opcional de imunomarcação pode ser realizada para avaliar antígenos de superfície celular de interesse concomitantemente com a senescência. As células senescentes identificadas também podem ser enriquecidas usando a metodologia padrão de classificação celular ativada por fluorescência (FACS).
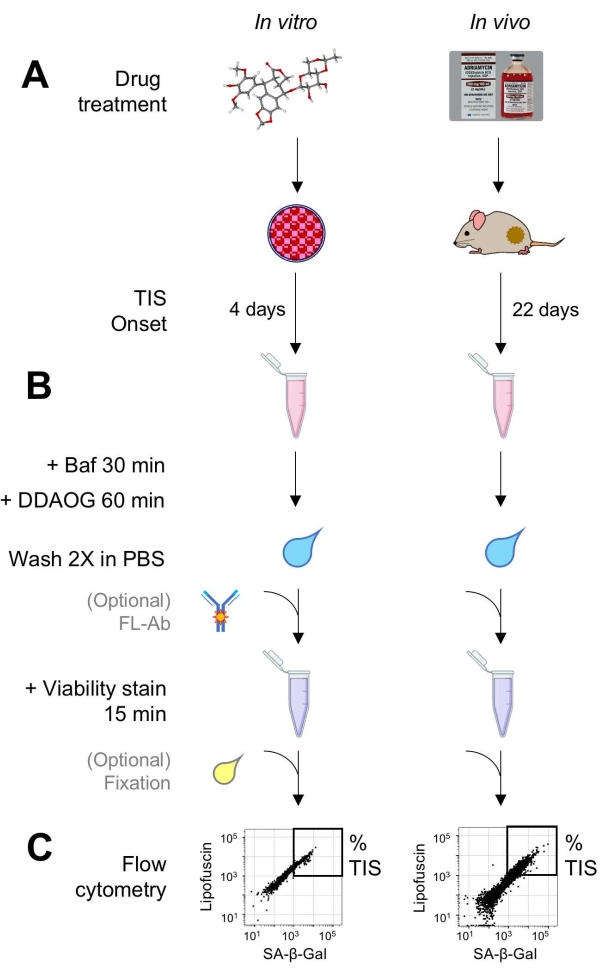
Figura 1: Fluxo de trabalho experimental. Um esquema que resume os pontos-chave do ensaio DDAOG. (A) Uma droga indutora de TIS é adicionada a células cultivadas de mamíferos ou administrada a camundongos portadores de tumores. O tempo é então permitido para o início do TIS: para as células, 4 dias após o tratamento; para camundongos, 22 dias no total, com três tratamentos a cada 5 dias mais 7 dias de recuperação. As células são colhidas ou os tumores são dissociados em suspensão. (B) As amostras são tratadas com Baf para ajustar o pH lisossômico para detecção de SA-β-Gal por 30 min; em seguida, a sonda DDAOG é adicionada por 60 min para detectar SA-β-Gal. As amostras são lavadas 2x em PBS, e uma mancha de viabilidade é brevemente adicionada (15 min). Opcionalmente, as amostras podem ser coradas com anticorpos fluorescentes em canais de fluorescência abertos e/ou fixadas para análise posterior. (C) As amostras são analisadas usando um citômetro de fluxo padrão. Células viáveis são visualizadas em gráficos de pontos mostrando DDAOG vermelho (indicando SA-β-Gal) versus autofluorescência verde (lipofuscina). Uma porta para determinar a porcentagem de células TIS é estabelecida com base em amostras de controle não tratadas (não mostradas). Se um citômetro de classificação (FACS) for usado, as células TIS podem ser coletadas e colocadas de volta em cultura para ensaios in vitro adicionais ou lisadas e processadas para ensaios de biologia molecular. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactoside; TIS = senescência induzida pela terapia; FL-Ab = anticorpo conjugado com fluoróforo; Baf = Bafilomicina A1; SA-β-Gal = beta-galactosidase associada à senescência; PBS = solução salina tamponada com fosfato; FACS = classificação celular ativada por fluorescência. Por favor, clique aqui para ver uma versão maior desta figura.
| Fluoróforo | Detecta | Ex/Em (nm) | Citômetro a laser (nm) | Detector de citômetro / filtro passa-banda (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscina | < 600 | 488 | 525 / 50 |
| CV450 | Viabilidade | 408/450 | 405 | 450 / 50 |
| PE | Anticorpo/marcador de superfície | 565/578 | 561 | 582 / 15 |
Tabela 1: Fluoróforos e especificações ópticas do citômetro. As especificações do citômetro utilizadas neste protocolo são listadas para um instrumento com um total de 4 lasers e 15 detectores de emissão. DDAOG detectado a 645/660 nm é a forma da sonda clivada por SA-β-Gal1. O Uncleaved DDAOG pode apresentar fluorescência de baixo nível a 460/610 nm, mas é removido por etapas de lavagem no protocolo. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactoside; FA = autofluorescência; EP = ficoeritrina; SA-β-Gal = beta-galactosidase associada à senescência.
Protocolo
Todo o trabalho com animais descrito foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Chicago.
1. Preparação e armazenagem de soluções-mãe
NOTA: Se as células forem classificadas por fluxo, todas as soluções devem ser preparadas usando técnicas estéreis e filtradas através de um dispositivo de filtro de 0,22 μm.
- Preparar uma solução-mãe de DDAO-Galactoside a 5 mg/ml em DMSO. Alíquota a 50 μL por tubo (ou volume desejado). Conservar a -20 °C no escuro até 1 ano.
- Preparar uma solução-mãe de Bafilomicina A1 a 1 mM em DMSO. Alíquota a 50 μL por tubo (ou volume desejado). Conservar a -20 °C até 6 meses.
- Preparar uma solução de estoque de Calcein Violet 450 AM a 1 mM em DMSO. Alíquota a 50 μL por tubo (ou volume desejado). Conservar a -20 °C no escuro até 1 ano.
- Para o tratamento de células cultivadas in vitro, preparar soluções-mãe concentradas de 10 mM de agente(s) indutor(es) de senescência no solvente apropriado e esterilizar utilizando filtros de seringa de 0,2 μm. Conservar a -20 °C ou conforme indicado pelo fabricante.
NOTA: Para a administração de agentes quimioterápicos indutores de senescência in vivo (para camundongos com tumores estabelecidos), os agentes devem ser de grau USP e diluídos em solução salina a partir de estoque concentrado imediatamente antes da injeção. - Preparar o meio de cultura completo para a(s) linha(s) celular(is) que está a ser utilizada.
NOTA: Por exemplo, prepare o meio para células B16-F10 ou A549 com DMEM 1x + 10% FBS + 1x substituto de glutamina + 1x penicilina/estreptomicina. Os meios devem ser mantidos estéreis. Outras formulações de meios específicos de linhagem celular podem ser usadas. Certos componentes, como a glutationa, podem, em alguns casos, interferir no início da senescência. Testes empíricos de várias formulações de meios devem ser realizados se o início da senescência for menor do que o esperado ou não observado com agentes quimioterápicos de controle. - Prepare os amortecedores de coloração e lave.
- Preparar 1% de albumina sérica bovina (BSA) em 1x PBS para uso em procedimentos de coloração. Dissolver 2 g de BSA em 200 ml de PBS e agitar durante 10 min, ou até dissolver totalmente, à temperatura ambiente.
- Prepare 0,5% de BSA em 1x PBS como um tampão de lavagem. Diluir 100 mL da ASC a 1% preparada na etapa 1.6.1 em 100 mL de 1x PBS para ASC a 0,5%.
- Armazenar os buffers a 4 °C por até 1 mês.
- Prepare 4% de paraformaldeído em 1x PBS. Use ampolas de paraformaldeído seladas disponíveis comercialmente (por exemplo, 16% v/v) para conveniência e estabilidade: 2,5 mL de PFA a 16% + 7,5 mL de PBS 1x (= 10 mL de PFA a 4%). Ajuste o volume preparado dependendo do volume total necessário por experimento.
NOTA: Prepare-se conforme necessário apenas para a fixação da célula; preparar fresco cada vez. - Prepare o tampão de classificação FACS: 1x PBS, 1 mM EDTA, 25 mM HEPES, 1% BSA (pH 7,2). Filtro estéril através de um dispositivo de filtração de 0,22 μm e conservar a 4 °C até 1 mês.
NOTA: Prepare-se conforme necessário apenas para a classificação FACS. As formulações de tampão de classificação de fluxo podem variar entre os instrumentos FACS. A formulação acima é compatível com o instrumento utilizado neste estudo (ver Tabela de Materiais). Consulte as diretrizes do fabricante. - Preparar solução de dissociação tumoral: 20 μg/mL de Liberase TL + 100 μg/mL de DNAse I em meio RPMI-1640 (sem FBS ou outros suplementos). As soluções de reserva são úteis para manter à mão a Liberase TL (preparada e armazenada conforme indicado pelo fabricante) e a DNAse I (100 mg/ml em água duplamente destilada [ddH2O], armazenada a -20 °C).
NOTA: Prepare-se conforme necessário se estiver usando apenas tumores; preparar fresco cada vez.
2. Indução da senescência por quimioterápicos em células cancerígenas cultivadas
NOTA: Todas as etapas de manipulação celular nesta seção devem ser executadas em um gabinete de biossegurança usando práticas estéreis. Esta seção foi escrita para tipos de células aderentes. As células de suspensão podem ser utilizadas com as modificações adequadas, tal como indicado.
- Cultivar linha(s) de células cancerígenas(s) de acordo com o protocolo padrão do fornecedor ou do laboratório que forneceu a(s) linha(s) celular(is) específica(s) utilizada(s).
NOTA: Células de baixa passagem (p < 10) são geralmente preferidas, pois haverá níveis mais baixos de senescência replicativa, ou seja, fundo inferior, em amostras de células não tratadas. - Um dia antes da indução da senescência por drogas, colha as células com tripsina-EDTA a 0,25% (ou conforme recomendado). Neutralize a tripsina adicionando um volume igual de meio de cultura completo e transfira a suspensão celular para um tubo cônico estéril.
NOTA: Este passo não é necessário para células de suspensão. - Conte as células usando o método padrão do hemacitômetro e registre as células/mL. Células de placa a 1 × 10 3-10 × 103 células/cm2 em pratos de cultura plástica padrão de 6 poços.
NOTA: A densidade de revestimento ideal depende da taxa de proliferação de células e deve ser determinada pelo usuário. As células devem estar em fase logarítmica de crescimento com aproximadamente 10%-20% de confluência no momento do tratamento (ou seja, após 18-24 h de incubação após o plaqueamento). A densidade inicial (células/ml) das células em suspensão deve ser determinada pelo utilizador. Placas de seis poços normalmente produzem células senescentes suficientes por poço para uma amostra de análise de citometria de fluxo padrão. Se a classificação de fluxo, uma área de superfície muito maior (por exemplo, várias placas P150) deve ser usada para permitir a recuperação de um número suficiente de células senescentes para ensaios a jusante (≥1 × 106). - Incubar células chapeadas durante a noite (18-24 h) em uma incubadora de 37 °C com 5% de CO2 e uma panela de umidade.
- Trate as células chapeadas com droga(s) quimioterápica indutora de senescência. Inclua pelo menos um controle positivo, por exemplo, etoposídeo (ETO) ou bleomicina (BLM). Prepare poços duplicados por medicamento. Inclua um conjunto tratado apenas com veículo como controle.
NOTA: Uma curva de dose para cada agente experimental deve ser testada pelo usuário para determinar a concentração ideal para a indução de senescência na(s) linha(s) celular(is) que está sendo usada(s). - Incubar as células durante 4 dias numa incubadora a 37 °C com 5% de CO2 e uma bandeja de humidade para permitir o aparecimento de senescência. Examine diariamente as mudanças morfológicas esperadas usando um microscópio de luz.
NOTA: Os tempos de incubação de 3-5 dias podem ser aceitáveis, dependendo da taxa de início da senescência. A mídia pode ser alterada e o agente reaplicado (ou não), conforme desejado, para promover condições de crescimento saudáveis, alcançando uma porcentagem aceitável de células senescentes. - Após o início da senescência, colher as células adicionando tripsina-EDTA a 0,25% por 5 min a 37 °C. Quando as células são dissociadas em suspensão, neutralize a tripsina com um volume igual de meio completo.
Observação : esta etapa não é necessária para células que crescem em suspensão. Se a coloração do marcador de superfície for realizada, evite o uso de tripsina-EDTA, pois pode destruir temporariamente os antígenos de superfície nas células. Em vez disso, dissociar suavemente a monocamada usando um raspador de células de plástico estéril (ou um reagente de dissociação alternativo projetado para preservar antígenos de superfície). - Conte as células em cada amostra usando um hemacitômetro. Calcular as células/ml para cada amostra.
NOTA: O azul de tripano pode ser adicionado para avaliar a porcentagem de células mortas neste momento (ou seja, devido ao tratamento medicamentoso), mas a morte celular também será determinada com um corante de viabilidade fluorescente durante o fluxo de trabalho de coloração DDAOG. - Alíquota ≥0,5 × 106 células por amostra em tubos de microcentrífuga de 1,7 mL.
NOTA: O número de células por amostra deve ser padronizado em todas as amostras. - Centrifugar os tubos durante 5 min a 1.000 × g numa microcentrífuga a 4 °C. Remova o sobrenadante.
NOTA: Se uma microcentrífuga refrigerada não estiver disponível, pode ser aceitável realizar centrifugações à temperatura ambiente para certos tipos de células resilientes. - Prossiga para a coloração DDAOG na secção 4.
3. Indução da senescência por quimioterápicos em tumores estabelecidos em camundongos
NOTA: Se as células tumorais forem classificadas pelo FACS, garanta a esterilidade em cada etapa, trabalhando em um gabinete de biossegurança e trabalhando com instrumentos, procedimentos e reagentes estéreis.
- Criar modelos tumorais de camundongos injetando células cancerígenas por via subcutânea, de acordo com métodos padrão (por exemplo, Appelbe et al.19).
NOTA: O número de células cancerosas a serem injetadas, o local de injeção e a cepa apropriada do camundongo devem ser otimizados para cada protocolo. Aqui, as células B16-F10 foram injetadas por via subcutânea a 1 × 106 células em 0,1 mL de solução salina (1 × 107 células/mL).- Verifique se a viabilidade das células que utilizam azul de tripano é de >90% antes de realizar as injeções. Anestesiar os camundongos com isoflurano.
- Anestesiar camundongos C57/BL6 fêmeas de 6-7 semanas de idade com uma mistura de isoflurano a 3% e ar e manter sob essas condições em uma câmara de indução colocada dentro de um gabinete de biossegurança estéril. Confirme a anestesia apertando suavemente o pé do rato. Aplique pomada veterinária estéril em ambos os olhos para evitar a secagem da córnea durante o procedimento. Durante o procedimento, mantenha a temperatura do corpo do mouse usando uma lâmpada de aquecimento.
- Trabalhando dentro de um gabinete de biossegurança estéril, remova o rato da câmara de indução e coloque-o em contacto com um cone nasal que forneça um fornecimento de isoflurano a 3%. Raspe a área do flanco no local da injeção usando uma navalha elétrica limpa. Misture brevemente a suspensão celular preparada invertendo manualmente o tubo imediatamente antes da injeção e injete a suspensão celular por via subcutânea no(s) flanco(s) raspado(s) utilizando uma seringa estéril de 0,5 ml equipada com uma agulha estéril de 27 G. Remova o mouse do capô e transfira-o para a gaiola de recuperação.
- Na gaiola de recuperação, monitore os sinais vitais dos ratos continuamente até que eles tenham recuperado a consciência suficiente para manter a retração esternal, demonstrar o reflexo de endireitamento e sejam capazes de se mover com segurança na gaiola. Não deixe ratos sozinhos ou devolva animais que tenham sido submetidos à inoculação de células tumorais para a companhia de outros animais até que estejam totalmente recuperados. Monitorar todos os camundongos inoculados diariamente para perda de peso, atividade reduzida / mobilidade e sintomas neurológicos; eutanasiar ratos que apresentam sintomas graves em qualquer categoria. Para camundongos que apresentam sintomas de dor após a inoculação, administrar buprenorfina (0,1-0,2 mg/kg) uma vez por via subcutânea.
NOTA: Os ratos que apresentam dor persistente após a buprenorfina devem ser sacrificados.
- Começando 5-7 dias após a inoculação de células cancerígenas, meça o crescimento do tumor com paquímetros a cada 2-3 dias. Iniciar o tratamento prosenescente quando o tumor tiver atingido 50 mm 3 ± 10 mm3 em volume.
NOTA: Neste trabalho, doses de cloridrato de doxorrubicina (DOX) grau USP ou doxorrubicina lipossomal PEGylated (PLD) a 10 mg/kg foram administradas em injeção de cloreto de sódio a 0,9% (USP). Os fármacos foram injetados por via intraperitoneal 3x, uma vez a cada 5 dias, iniciando-se quando os tumores atingiram 50 mm 3 ± 10 mm3. Os ratos se recuperaram por 7 dias após o tratamento final para permitir o início do TIS em tumores. As dosagens de indução de senescência e as condições para outros tratamentos e/ou modelos tumorais devem ser otimizadas. - Aos 7 dias após o tratamento medicamentoso final, sacrifique os ratos por overdose de CO2 e luxação cervical ou outros métodos aprovados em conformidade com as diretrizes de trabalho em animais de laboratório. Excise os tumores e colete-os em tubos estéreis ou placas de 6 poços preenchidas com meio de crescimento RPMI estéril (para preservar a viabilidade durante o processamento).
NOTA: Se estiver realizando um exame histológico (por exemplo, X-Gal ou imuno-histoquímica), os tumores podem ser bissectados aqui, com metade do snap-frozen em meio de incorporação O.C.T. e criosseccionados usando procedimentos padrão para histologia de tecido congelado. A metade tumoral restante deve produzir material abundante para dissociação e coloração DDAOG. - Transfira um tumor para um prato de plástico P100 contendo 5 mL de meio RPMI. Pice o tumor em pedaços usando um bisturi.
- Transfira 5 mL da suspensão de pedaços tumorais contendo células suspensas e detritos para um tubo cônico de 15 mL. Use a ponta mais larga de uma pipeta sorológica de 25 mL para transferir esta suspensão se grandes detritos estiverem presentes. Lave o prato com um volume adicional de RPMI estéril para coletar materiais. Tampa e coloque o tubo cônico no gelo.
- Repita os passos 3.45-3.5 para os tumores restantes. Use uma placa e bisturi separados para cada tumor para evitar a contaminação cruzada ou enxágue bem com PBS entre os tumores. Use 5 mL de meio fresco para picar cada tumor.
- Preparar a solução de dissociação tumoral: 20 μg/mL de Liberase TL + 100 μg/mL de DNAse I em meio RPMI-1640 (sem FBS).
NOTA: Existem muitas formulações eficazes para soluções de dissociação tumoral que podem incluir uma variedade de enzimas e outros componentes de diferentes fabricantes. As concentrações ideais de componentes podem variar muito entre os tipos de tumores. Se os glóbulos vermelhos estiverem altamente presentes no tumor, a lise dos glóbulos vermelhos pode ser conduzida adicionalmente; se as células mortas forem um problema, um kit de remoção de células mortas pode ser usado. É altamente recomendável que o usuário determine de forma independente as condições ideais de dissociação tumoral que proporcionam alta viabilidade e baixa presença de células contaminantes, material conjuntivo e detritos. - Centrifugar todas as amostras tumorais em tubos cônicos por 5 min a 1.000 × g (4 °C). Remova o sobrenadante.
- Adicione 1-5 mL de solução de dissociação tumoral a cada amostra de tumor, dependendo do volume de material tumoral. Certifique-se de que há 1-2 mL em excesso do material tumoral no tubo. Vórtice a uma velocidade moderada para misturar.
- Colocar as amostras numa incubadora a 37 °C com rotação rápida durante 45 min. Vórtice brevemente a cada 15 minutos.
- Filtrar cada amostra através de um filtro celular de 100 μm para um tubo cónico de 50 ml. Se as amostras estiverem muito viscosas para passar pelo filtro, adicione 10 mL de meio RPMI-1640 para diluir. Lave os filtros com meio RPMI para coletar as células residuais.
- Use um hemacitômetro para contar as células/mL para cada amostra.
- Aliquot duas ou mais repetições de 5 × 106 células por amostra tumoral.
- Centrífuga durante 5 min a 4 °C (1.000 × g). Remova o sobrenadante.
- (Opcional) Criopreservar as amostras de tumor para coloração DDAOG posterior, se desejado.
- Ressuspender o pellet de células tumorais dissociadas em meio de criopreservação: 50% FBS, 40% RPMI-1640, 10% DMSO, preparado em condições estéreis a 5 × 106 células/mL.
- Aliquot 1 mL de suspensão celular em cada criovial.
- Congelar os criovios durante 24 h num recipiente de congelamento de células isopropanol a -80 °C; em seguida, transferir para o crioarmazenamento de nitrogênio líquido para armazenamento a longo prazo (>1 semana).
- Quando a coloração for desejada, descongele os criovios no gelo e prossiga para a coloração DDAOG na secção 4.
NOTA: Alguns tumores podem não permanecer viáveis através da criopreservação, e a resiliência a esse processo deve ser avaliada pelo usuário para o modelo tumoral de interesse.
- Prossiga para a secção 4 para coloração DDAOG.
4. Coloração DDAOG de SA-β-Gal em amostras celulares ou tumorais
- Diluir 1 mM de Bafilomicina A1 em 1:1.000x em meio DMEM (sem FBS) para uma concentração final de 1 μM.
- Adicionar a solução preparada de Baf-DMEM às amostras de pellets de células (das etapas 2.11 ou 3.16) para uma concentração de 1 × 106 células/ml.
NOTA: Por exemplo, se estiver usando 0,5 × 106 células por amostra, adicione 0,5 mL de Baf-DMEM. Para tumores, 5 × 106 células podem ser coradas em 5 mL de Baf-DMEM. - Incubar durante 30 min a 37 °C (sem CO2) num rotador/agitador regulado a uma velocidade lenta.
NOTA: Evite incubadoras de CO2 para o processo de coloração, que podem acidificar as soluções e, assim, interferir com a coloração Baf e DDAOG. - Sem lavagem, adicionar a solução-mãe de DDAOG (5 mg/ml) a 1:500x (10 μg/ml final) a cada amostra. Pipeta para misturar. Substituir num rotador/agitador a 37 °C (sem CO2) durante 60 minutos. Proteja da luz direta.
- Centrifugar os tubos durante 5 min a 1.000 x g a 4 °C. Remova o sobrenadante.
- Lave com 1 mL de BSA gelado a 0,5% por tubo e pipeta para misturar. Centrifugar os tubos durante 5 minutos a 1.000 x g a 4 °C e remover o sobrenadante. Repita este passo 2x para lavar bem as células. Remova o sobrenadante e prossiga.
NOTA: É importante executar as etapas de lavagem na etapa 4.6 para remover o DDAOG tioved, que pode exibir emissão de fluorescência indesejada (460/610 nm).
NOTA: Se a imunocoloração para marcadores da superfície celular, avance para a secção 5 abaixo. - (Opcional) Fixação e armazenamento de células coradas com DDAOG para posterior análise
- Adicionar 0,5 mL de paraformaldeído gelado a 4% gota a gota a cada amostra lavada. Pipeta para misturar.
- Incubar por 10 min à temperatura ambiente.
- Lave as células 2x com 1 mL de PBS.
- Conservar as amostras até 1 semana a 4 °C antes da análise da citometria de fluxo.
Observação : para amostras fixas, ignore a etapa 4.8.
- Diluir o estoque Calcein Violet 450 AM (1 mM) a 1:1.000x em 1% BSA-PBS (1 μM final). Adicionar 300 μL (para amostras de células cultivadas) ou 1.000 μL (para amostras tumorais) aos pellets de células lavadas a partir da etapa 4.6. Incube por 15 minutos no gelo no escuro.
- Prossiga para a configuração da citometria de fluxo (secção 6).
5. (Opcional) Imunocoloração para marcadores de superfície celular em combinação com DDAOG
NOTA: Tal como acontece com qualquer experimento de citometria de fluxo, amostras de controle de coloração única com DDAOG apenas e apenas anticorpo fluorescente devem ser preparadas para determinar o crosstalk (se houver) através dos canais de fluorescência. Se for observada conversa cruzada, a compensação da citometria de fluxo padrão deve ser realizada20.
- Ressuspender os pellets celulares obtidos na etapa 4.6 em 100 μL de tampão de coloração (1% BSA em 1x PBS).
- Adicione o reagente bloqueador do receptor Fc apropriado para a espécie celular (rato ou humano) na titulação recomendada pelo fabricante. Incubar durante 10 min a 24 °C.
- Adicione anticorpos conjugados com fluoróforos na titulação recomendada pelo fabricante (ou determinada pelo utilizador). Incubar por 20 min no gelo, protegido da luz.
- Centrifugar os tubos durante 5 minutos a 1.000 × g a 4 °C. Remova o sobrenadante.
- Lave com 1 mL de tampão de lavagem gelado (0,5% BSA-PBS) por tubo e pipeta para misturar. Centrifugar os tubos durante 5 minutos a 1.000 × g a 4 °C e remover o sobrenadante. Repita este passo 2x para lavar bem as células.
- Diluir 1 mM Calcein Violet 450 AM em 1:1.000x em 1% BSA-PBS. Adicionar 300 μL aos pellets de células lavadas a partir do passo 5.5. Incube por 15 minutos no gelo no escuro.
- Prossiga para a análise da citometria de fluxo (seções 6-7).
6. Configuração do citômetro de fluxo e aquisição de dados
- Transfira as amostras celulares para tubos compatíveis com o instrumento de citometria de fluxo. Coloque os tubos no gelo e mantenha-os protegidos da luz.
NOTA: Se forem observados agregados nas suspensões celulares, passe a suspensão através de filtros celulares de 70-100 μm antes da análise. Não use filtros de 40 μm, pois eles podem excluir algumas das células senescentes maiores. - No software referenciado (consulte a Tabela de Materiais), abra os seguintes gráficos: 1) gráfico de pontos FSC-A vs SSC-A, 2) histograma de canal violeta, 3) canal vermelho distante (por exemplo, APC-A) versus gráfico de pontos de canal verde (por exemplo, FITC-A).
NOTA: Gráficos de exclusão de dubleto e histogramas de canal único também podem ser usados, mas não são estritamente necessários. - Inicie a aquisição de dados do citômetro.
- Coloque a amostra de controlo apenas para veículos corada com DDAOG na porta de admissão. Em uma baixa velocidade de admissão, comece a adquirir dados de amostra.
- Ajuste as tensões FSC e SSC para que >90% dos eventos estejam contidos no gráfico. Se as células não se ajustarem bem no gráfico, diminua a configuração de dimensionamento de área para 0,33-0,5 unidades.
- Remova a amostra apenas para veículos sem registar dados.
- (Opcional) Adicione uma gota de microesferas de calibração do arco-íris a um tubo citômetro com 1 mL de PBS. Coloque o tubo na porta de entrada do citômetro. Comece a adquirir dados de exemplo.
- Ajuste as tensões dos canais violeta, verde e vermelho distante para que o pico superior da microesfera do arco-íris esteja na faixa de 104-10 5 unidades de fluorescência relativa em cada canal e todos os picos estejam bem separados em cada canal. Registre 10.000 eventos. Remova o tubo.
- Coloque a amostra de controle positivo (por exemplo, BLM, ETO) corada com DDAOG na porta de admissão. Em baixa velocidade, adquira dados de amostra. Observe os eventos nos canais FSC, SSC, violeta, verde e vermelho distante para garantir que mais de 90% dos eventos estejam contidos em todas as parcelas. Procure um aumento no sinal AF e DDAOG versus controle somente do veículo.
- Se estiver usando um citômetro de classificação, inicie a classificação nesta etapa.
- Para fins de manutenção de registros, registre 10.000 células para a amostra de controle e cada amostra classificada.
- Classifique a quantidade desejada de células (≥1 × 106 é tipicamente adequada) em um tubo de coleta apropriado para o instrumento com 3-5 mL de meio de cultura.
- Após a classificação, prossiga para a cultura ou análise a jusante.
- Vá para a seção 7 para a análise de rotina de amostras classificadas.
- Se estiver usando anticorpos fluorescentes, otimize as tensões de canal aqui usando as amostras não coradas, de coloração simples e de dupla coloração preparadas na seção 5.
NOTA: Para o citômetro de fluxo calibrado usado aqui, as tensões de canal ideais normalmente caem entre 250 e 600 (faixa média), mas as tensões ideais e as faixas de tensão de canal variam entre os instrumentos. Evite usar tensões em faixas muito baixas ou altas, que podem suprimir o sinal ou amplificar o ruído. - Depois de concluir as etapas 6.1-6.5 e fazer ajustes nas configurações do citômetro, conforme necessário, registre os dados de todas as amostras. Certifique-se de que as configurações permaneçam uniformes para todas as gravações de amostra. Registre ≥ 10.000 eventos por amostra de células cultivadas ou ≥ 100.000 eventos por amostra de células tumorais.
NOTA: Embora o gating e a análise possam ser realizados usando software de aquisição de dados (por exemplo, FACSDiva), um fluxo de trabalho completo de gating e análise a ser conduzido após a aquisição usando software de análise separado (FlowJo) é descrito na seção 7 abaixo. A análise pós-aquisição é preferível para reduzir o tempo na estação de trabalho do citômetro e aproveitar as ferramentas adicionais incluídas no software de análise dedicado. - Salve dados de exemplo no formato de arquivo .fcs. Exporte os arquivos para um computador de estação de trabalho equipado com software de análise de citometria de fluxo (por exemplo, FlowJo). Prossiga para a seção 7.
7. Análise dos dados da citometria de fluxo
NOTA: O fluxo de trabalho apresentado utiliza o software FlowJo. Um software alternativo de análise de dados de citometria de fluxo pode ser usado se as principais etapas descritas nesta seção forem seguidas de forma semelhante.
- Usando o software FlowJo, abra arquivos de dados .fcs da etapa 6.7.
- Abra a janela de layout.
- Arraste e solte todas as amostras na janela de layout.
- Células viáveis de portão.
- Primeiro, clique duas vezes nos dados de amostra para o controle somente do veículo para abrir sua janela de dados.
- Visualize os dados como um histograma de canal violeta. Identifique as células viáveis coradas por CV450 com base em sua fluorescência mais brilhante do que as células mortas.
- Desenhe uma porta usando a ferramenta de histograma de porta única para incluir apenas células viáveis. Nomeie o portão viável.
- Em seguida, a partir da janela de layout de amostra, arraste a porta viável para as outras amostras de célula para aplicar a porta uniformemente.
- Na janela de layout, visualize todas as amostras como histogramas de canal violeta (viabilidade). Verificar se o controle celular viável é apropriado em todas as amostras antes de prosseguir; caso contrário, faça os ajustes necessários.
NOTA: A coloração de viabilidade pode apresentar variações entre tratamentos ou tumores.
- Células senescentes do portão.
- Clique duas vezes nos dados da célula viável fechada para que o controle somente do veículo abra sua janela de dados.
- Visualize os dados como um gráfico de pontos para canal vermelho distante (DDAOG) versus canal verde (AF).
- Desenhe uma porta usando a ferramenta de bloqueio de retângulo para incluir <5% das células DDAOG+ e AF+ (quadrante superior direito). Nomeie o portão senescente.
- Em seguida, a partir da janela de layout da amostra, arraste a porta senescente para os subconjuntos viáveis das outras amostras de células para aplicar a porta uniformemente.
- Na janela de layout, arraste e solte todos os subconjuntos de células viáveis fechados na seção 7.4. Visualize todas as amostras viáveis como gráficos de pontos vermelhos distantes (por exemplo, APC-A) versus canais verdes (por exemplo, FITC-A).
- Certifique-se de que o portão senescente desenhado na etapa 7.5.3 esteja visível em todas as parcelas e que o portão para o controle somente do veículo exiba células senescentes de ≤5%-10%.
- Uma vez determinada a porcentagem de células senescentes usando as etapas acima, apresente os dados resultantes usando os gráficos FlowJo, resumidos em uma tabela de dados e/ou analisados estatisticamente usando o software padrão.
Resultados
Vários experimentos foram realizados para demonstrar a comparabilidade do DDAOG com X-Gal e C12-FDG para a detecção de senescência por SA-β-Gal. Primeiramente, o X-Gal foi utilizado para corar células senescentes de melanoma B16-F10 induzidas por ETO (Figura 2A). Uma cor azul intensa se desenvolveu em um subconjunto de células tratadas com ETO, enquanto outras células exibiram coloração azul menos intensa. A morfologia foi aumentada na maioria das células tratadas com E...
Discussão
Na última década, a citometria de fluxo tornou-se uma plataforma de ensaio mais comum na pesquisa do câncer devido à popularidade emergente da imunologia tumoral, ao desenvolvimento de citômetros de fluxo de baixo custo e à melhoria das instalações de instrumentação compartilhadas em instituições acadêmicas. Ensaios multicoloridos são agora padrão, já que a maioria dos instrumentos mais recentes são equipados com matrizes ópticas violeta, azul-verde e vermelho a vermelho-distante. Assim, é provável qu...
Divulgações
Os autores não têm conflitos de interesse a declarar para este estudo.
Agradecimentos
Agradecemos ao Cytometry and Antibody Core Facility da Universidade de Chicago pelo apoio na instrumentação da citometria de fluxo. O Centro de Pesquisa Animal da Universidade de Chicago forneceu alojamento para animais.
Materiais
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
Referências
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells - modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados