A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العصب البصري Transection : نموذج من موت الخلايا المبرمج الخلية العصبية الكبار في الجهاز العصبي المركزي
* These authors contributed equally
In This Article
Summary
العصب البصري transection هو النموذج المستخدم على نطاق واسع من اصابة الجهاز العصبي المركزي للبالغين. تسعين في المئة من خلايا الشبكية العقدة (RGCs) التي هي محاور عصبية مقطوع تماما (axotomy) يموت في غضون 14 يوما بعد axotomy. هذا النموذج هو قابل للتلاعب بسهولة تجريبية وقابلة للتكرار للغاية.
Abstract
خلايا الشبكية العقدة (RGCs) هي الجهاز العصبي المركزي الخلايا العصبية التي خرج المعلومات البصرية من الشبكية إلى الدماغ عبر العصب البصري. يمكن الوصول إلى العصب البصري ضمن المدار من العين ومقطوع تماما (axotomized) ، قطع المحاوير من سكان RGC بأكمله. العصب البصري transection هو نموذج يمكن استنساخه من خلية موت مبرمج العصبية في الجهاز العصبي المركزي للبالغين 1-4. هذا النموذج هو جاذبية خاصة لأن الغرفة الزجاجية للعين بمثابة كبسولة لتسليم المخدرات إلى شبكية العين ، مما يتيح التلاعب التجريبية عن طريق الحقن داخل المقلة. نشر المواد الكيميائية من خلال السائل الزجاجي يضمن أن تعمل على السكان RGC بأكمله. وعلاوة على ذلك ، يمكن RGCs transfected بشكل انتقائي من خلال تطبيق قصيرة الرناوات التدخل (siRNAs) ، وبلاسميدات وناقلات فيروسية أو إلى نهاية قطع من الناقلة العصب البصري أو عن طريق الحقن 5-7 في هدفهم ، وأكيمة متفوقة 8. هذا يسمح للباحثين لدراسة آليات أفكارك في عدد سكان العصبية المرجوة دون آثار الخلط المارة على الخلايا العصبية الأخرى أو الدبقية المحيطة بها. فائدة إضافية هي سهولة ودقة التي يمكن قياسها كميا بقاء الخلية بعد الاصابة. والشبكية هي عبارة عن شقة ، والأنسجة والطبقات المترجمة RGCs في الطبقة الأعمق ، وطبقة الخلايا العقدية. يمكن تتبع بقاء RGCs على مر الزمن من خلال تطبيق التتبع فلوري (3 ٪ Fluorogold) إلى نهاية قطع العصب البصري في وقت axotomy ، أو عن طريق حقن التتبع في أكيمة متفوقة (RGC المستهدف) قبل أسبوع واحد axotomy. ويتم نقل retrogradely والتتبع ، ووضع العلامات على جميع السكان RGC. لأن طبقة الخلايا العقدية هي أحادي الطبقة (خلية واحدة سميكة) ، يمكن كميا RGC كثافة الأنسجة في شقة المركبة ، دون الحاجة إلى التجسيم. العصب البصري transection يؤدي إلى موت مبرمج من 90 ٪ من المصابين RGCs في غضون 14 يوما postaxotomy 9-11. RGC موت الخلايا المبرمج كانت فيه خصلة الوقت طبعا حيث يتم تأخير موت الخلية 3-4 أيام postaxotomy ، وبعد ذلك تتحول هذه الخلايا بسرعة. هذا يوفر الإطار الزمني لتلاعب تجريبية موجهة ضد المتورطين في مسارات موت الخلايا المبرمج.
Protocol
1. تقنية جراحية
- وينبغي إجراء تجارب على استخدام تقنية العقيم والبروتوكولات التالية استخدام الحيوانات لمؤسسة معينة. ويجب أن الأدوات والمواد (المحاليل والمواد اختبار ، واستشفاف والإبر وغيرها) ملامسة الأنسجة الحية تكون معقمة لمنع العدوى والآثار السلبية على رفاهية الحيوان والتأثيرات السلبية المحتملة على هذه الدراسة.
2. خدر
- وسوف تكون مخدرة الفئران باستخدام نظام المرذاذ isoflurane البيطرية. استخدام الطبي الأكسجين الصف بمعدل 0.8 لتر / دقيقة لتبخير الغاز isoflurane. وضع الحيوانات في المربع التخدير المرفقة والطلب في تركيز isoflurane من 4 ٪ حتى التنفس قد تباطأ والحيوان هو رزين.
- المقبل ، والتبديل تدفق الغاز الى غاز مرفق قناع للإطار التجسيمي ووضع الحيوان في الجهاز التجسيمي. تحويل تركيز isoflurane أسفل إلى 2 ٪ ورصد التخدير. قد الحيوانات الكبيرة (> 300g) تتطلب تركيز أعلى من isoflurane. وينبغي رصد تخدير خلال الجراحة والدواء isoflurane تبعا لذلك. وينبغي أن عمق ومعدل التنفس تقييم مستمر ، ويجب أن يتم تنفيذ إصبع التقييم قرصة (كل 5 دقائق) لعدم وجود الألم العميق.
- بمجرد اكتمال عملية جراحية ، إيقاف isoflurane والسماح للحيوان للأوكسجين التنفس لعدة دقائق قبل إزالة من الجهاز التجسيمي. ينبغي الحفاظ على درجة حرارة الجسم من خلال تغطية الحيوانية ببطانية جراحية و / أو استخدام بطانية تنظيم التدفئة أثناء الجراحة.
3. النهج الجراحية
- الفراء الرطب على أعلى الرأس مع الإيثانول 70 ٪ لجعل الفراء أسهل للقطع. إزالة الفراء من بين العينين باستخدام المقص أو مقص حاد. تنظيف المنطقة شق ثلاث مرات بالتناوب مع تطبيقات الحل المنظفات اليود (Proviodine ، Betadine ، الخ) ، يليه الايثانول 70 ٪. الحفاظ على القرنية رطبة طوال جراحة العيون من خلال تطبيق مرهم العين (دموع Naturale PM) إلى القرنية. انتشار المرهم على سطح القرنية عن طريق فتح يدويا وإغلاق الجفون.
- باستخدام شفرة رقم 11 ، وجعل شق على طول خط الوسط من الرأس من نحو 0.5 سم أمام أعين إلى 1 سم وراء العينين. التراجع رفرف من الجلد فوق العين باستخدام ملقط ومشط برفق بعيدا النسيج الضام الكامنة مع الجزء الخلفي من مشرط. ثم يتراجع رفرف من الجلد والهبوط أفقيا وعقد في مكان مع مبعاد الجراحية التي يمكن أن تكون مسجلة على قاعدة وثيقة التجسيمي.
- إجراء شق على طول الحافة العلوية للعظم المداري بينما سحب على لفافة المغطي بالملقط حادة. هذا وسوف تسحب المغطي اللفافة المدار من العين. يمكن حافة عظم المدارية ترسيمها بوضوح باستخدام ملقط لدفع حملة على اللفافة التي تغمر المدار. باستخدام جهاز الكي أو مشرط ، ومواصلة شق الوراء نحو الحد الخلفي من المدار من العين. استخدام عظام المدار متفوقة كدليل على شق. تواصل المقبل المهاجمين شق نحو الحد الأمامي من المدار. ويتم ذلك أفضل من الشق العلوي للمدار باستخدام جهاز الكي الصغيرة من أجل منع حدوث نزيف من الأوعية الأساسية التي تتصل مع الجيوب الوريدية.
- يمكن أن يحدث إذا كان النزيف عدة خطوات يمكن اتخاذها. أولا ، والضغط باستخدام مسحات الجراحية معقمة أو قطعة قطن. إذا كان لا يزال ينزف ، وتطبيق الباردة ، العازلة الفوسفات العقيمة المالحة (PBS) إلى المنطقة باستخدام القطارة ، والحفاظ على الضغط. وسوف يتوقف النزيف طفيفة بعد عدة ثوان باستخدام هذا الإجراء. إذا استمر النزيف ، وتطبيق الجر إلى النسيج مع مسحة القطن الجراحي أو مسحة من أجل تحديد مصدر النزيف ويكوي بسرعة السفينة للخطر. ويرد بعد النزيف واستخدام الباردة العقيمة PBS لتنظيف منطقة العمليات الجراحية في الدم. يجب تنظيف المنطقة الجراحية دوريا في هذا الشكل من أجل رؤية أفضل الهياكل في المدار من العين.
- مرة واحدة وقد تم تنظيف الجرح ، واستخدام الملقط والجزء الخلفي من مشرط لتنظيف النسيج الضام في الجزء الخلفي من العين الذي يعتلي محتويات المدارية. الجزء الخلفي من مشرط رقم 11 يعمل كذلك الطرف على ما يرام. هذا وسوف تفتح أعمق أجزاء من جوف الحجاج وتوفير إطار أوسع للعمل الجراحي فيها 7B استخدم # دومون حادة منحنية ، ملقط مسنن عند العمل في العين وانحناء ونصائح الغرامة هي مثالية لمعالجة الهياكل في المدار. علاوة على ذلك ، تساعد التسنين مع الهياكل التي تجتاح.
- المقبل ، إزالة النسيج الضام الذي يحيط تقسيم العيون من العصب الثلاثي التوائم التي تقع بالقرب من خط الوسط ، وإزالة العصب باستخدام ملقط. هذه الخطوة غير ضرورية ، ومع ذلك فإن إزالة العصب توفير أكبر نافذة القليالي في العصب البصري في وقت لاحق.
- بعد إزالة العصب ، واستخدام الملقط لسحب السفينة الدم أدناه ويكوي تماما السفينة. هذه الخطوة هي أيضا ليست ضرورية ، ولكن مكواة للسفينة يسمح نقله الأمامية ، وبالتالي خلق أكبر النافذة مرة واحدة يتم الوصول إلى العصب البصري.
- استخدام زوج من حادة الملقط ، أو ملقط والتي كان لها عازمة الداخل نصائح لاختيار بعناية وإزالة طبقة رقيقة من النسيج الضام عبر العضلات خارج المقلة والغدة الدمعية. سحب عضلات العين اضافية من الأمامي إلى الخلفي من المدار. قبضة الجزء القريب من العضلات مع زوج من الملقط واستخدام الزوج الثاني من منحني ملقط مسنن تضميد العين لتطبيق الجر الخارج على العضلات. تأكد من أن ملقط ضماد العين هي موجهة في الاتجاه نفسه مثل العضلات عند سحب للحيلولة دون تمزيق. إزالة معظم العضلات الأمامية للمدار (فخمة المائل) بهذه الطريقة. سوف تتحرر من العضلات العميقة داخل المدار ، ويمكن أن تراجع طول المتبقية من أجل تدوير العين إلى الخارج.
- كرر الخطوة مع 3.8 في عضلة المقبل (المستقيمة الإنسي) التي تقع بين فصوص من الغدة الدمعية والغدة هاردر بالقرب من خط الوسط من السطح الظهري للعين. الشريط أسفل مبعاد للحفاظ على عضلات الجر.
- إزالة أي نوع من الأنسجة المتبقية بلطف الضام على سطح الغدة الدمعية ورفع الغدة التصاعدي باستخدام ملقط. لا ضغط أو الضغط على الغدة. من أجل التراجع عن غدة ، سوى سفينة واحدة في القطب الخلفي يحتاج إلى أكتوي. رفع نهاية الخلفي للغدة التصاعدي ، ثم كوى السفينة.
- المقبل ، رفرف الغدة الدمعية إلى الأمام لفتح الجزء الخلفي من المدار والسماح بالوصول دون عوائق الى العضلات التي علا في العصب البصري. إبقاء المنطقة رطبة باستمرار باستخدام برنامج تلفزيوني العقيمة ، وتجفيف مع مسحات الجراحية أو مسحات القطن.
- باستخدام الملقط حادة مرة أخرى إزالة النسيج الضام الذي يحيط رقيقة عضلات المدار الخلفي (الرافعة للجفن العلوي والمستقيمة العلوية) وفصل حزم الكامنة والعضلات. سحب العضلات بشكل مستقل أو في انسجام تام ، وذلك باستخدام ملقط مسنن تضميد العين المنحني ، مرة أخرى ، وسحب وفقا لألياف العضلات. نعلق أطوال العضلات المتبقية إلى مبعاد مع العضلات التي كانت تراجع في خطوات 3.8 و 3.9 والشريط أسفل مبعاد لتطبيق الجر. والآن ما مجموعه 4 العضلات تكون موصولة إلى ضام. وهذا تدوير العين إلى الأمام وإلى الخارج من أجل الكشف عن الدهون التي تحتوي على غمد الذي يحيط العصب البصري.
4. الوصول إلى العصب البصري
- استخدام الملقط حادة (غيض دومون الجميلة) لسحب تصاعدية على النسيج الضام الذي يحيط الغمد الدهنية من العصب البصري. اجراء خفض طولية باستخدام مقص صغير Vannas الربيع. توسيع خفض حسب الضرورة. فإن الدهون التي تضمنتها غمد يبدأ انتفاخ لمرة يتم قطع. إزالة اللوحات القادمة من النسيج الضام من خلال سحب التصاعدي بعناية من على حافة وقطع اللوحات على شكل هلال من الأنسجة.
- إزالة الدهون المغطي في العصب البصري باستخدام الملقط لسحب على الدهون ، في حين قطع مع مقص Vannas الربيع. إبقاء المنطقة نظيفة معقمة باستخدام برنامج تلفزيوني ومسحات الجراحية لتنظيف كميات صغيرة من الدم التي تنشأ من إزالة الأنسجة.
- العصب البصري هو الآن مرئية. من أجل الوصول إلى العصب ، لا بد من إزالة غمد السحائي الذي يحيط العصب دون الإضرار الشريان الذي يغذي العيون والشبكية الداخلية. دراسة نمط الأوعية الدموية في غمد السحائي باستخدام ملقط لتدوير بلطف غمد. ابحث عن مساحة خالية من الأوعية الدموية ، والسماح لقطع طولية يجب القيام بها في غمد السحائي.
- تلميح باستخدام غرامة دومون الملقط ، قرصة الجافية وسحب التصاعدي. بالقرب من قاعدة إسفين في شكل الثلاثي الجافية التي يتم إنشاؤها ، استخدم مقص Vannas الربيع لإجراء شق صغير في غمد. إدراج شفرة أقل من مقص في شق وقطع غمد مواز لاتجاه العصب البصري ، الحرص على عدم تلف الأوعية الدموية مع تخفيضات الجانبية. استخدام ملقط ومقص لثنى على الجافية إلى جانبي في العصب البصري.
- وتغطي الوحيد المتبقي من العصب هو الغشاء العنكبوتي. انها رقيقة جدا وشفافة. من أجل تحديد ما إذا كان الغشاء لا يزال قائما ، واستخدام الملقط حادة لقرصة سطح العصبية. عليه العنكبوتي هو الحاضر ، قرصة الغشاء وسحب التصاعدي لخلق إسفين الثلاثي من الأنسجة. إجراء شق صغير مع غيض من مقص مماثلة إلى الخطوة 4.4. ثم ، تضاف شفرة أقل من مقص واجراء خفض طولية في العنكبوتية. المقبل ، واستخدام المقص والملقط الخاص لثنى على العنكبوتي إلى جانبي في العصب البصري.
- باستخدام سور الصغيرةالخطاف gical ، رفع العصب البصري من غمد السحائي. تمرير غيض من الخطاف حول الحافة الخارجية للعصب ، وتأكد من أن يبقى في ربط الاتصال مع العصب بحيث لا يمسك الأغشية السحائية مع هوك والقطع غير قصد منهم. رفع بلطف العصب البصري من غمد السحائي والقطع كليا في العصب وراء نقطة بدعم من ورطتها. سوف مقطوع جدعة العصب البصري لديها الآن نهاية مجانا ، مما يتيح لإزالة هوك.
- إذا RGCs ستكون المسمى retrogradely من أجل البقاء على قيد الحياة كميا ، وضع قطعة صغيرة من جلفوم غارقة في Fluorogold 3 ٪ (أو آخر التتبع الوراء) على جذع العصب البصري مقطوع (انظر إن الرب بروتوكول 2261 ).
5. إغلاق والاسترداد
- تخفيف الشد على عضلات العين اضافية وعودة العين إلى موقف محايد. عند القيام بذلك ، تأكد من دفع جلفوم أسفل إلى المدار من العين للتأكد من أن ما يتم استدارة العين مرة أخرى إلى مكان ، لا يزال حوالي جلفوم الجدعة العصب البصري. عودة الغدة الدمعية وعضلات العين إضافية إلى مواقعها الطبيعية.
- عودة رفرف من الجلد إلى خط الوسط وخياطة الجرح. تطبيق مرهم للعين العين لكلتا العينين. ثم ، إيقاف مصدر isoflurane والسماح للحيوان للأوكسجين التنفس لعدة دقائق. وضع الحيوانات في قفص قفص ساخنة أو تحتها مصباح الحرارة لاسترداد. لا تضع أي الفراش في قفص الانتعاش للقضاء على فرصة الشفط الفراش خلال فترة الانتعاش.
- ينبغي إيواء الحيوانات بشكل مستقل بعد الجراحة. وينبغي أن تدار العمليات الجراحية المسكنات آخر وفقا لتوجيهات السلطات في بلدكم رعاية الحيوانات ، وينبغي رصدها بعناية الحيوانات بعد الجراحة.
6. ممثل النتائج :
Transection من نتائج في العصب البصري وفقدان 90 ٪ من المصابين RGCs في غضون 14 يوما postaxotomy 9-11. الآلية الرئيسية للوفاة RGC هو موت الخلايا المبرمج 9 و 12. كثافة العادي RGCs ما يقرب من 2500 خلية / مم 2. ويمكن استخدام التصوير Epifluorescence مبائر أو لتصور RGCs المسمى retrogradely axotomy بعد. تأخر RGC موت الخلايا المبرمج من قبل حوالي 4 أيام بعد axotomy ، تاركا نافذة الوقت للتلاعب التجريبية. في 1 بعد يوم والتوسيم axotomy الوراء مع Fluorogold والهيئات الخلية RGC في طبقة الخلايا العقدية للشبكية وكراسات محوار في العصب طبقة من الألياف من شبكية العين هي واضحة للعيان عند التصوير استعدادا flatmounted (الشكل 1A). قبل 14 يوما بعد axotomy ، لقي غالبية RGCs ، ويتخلل a RGCs القليلة المتبقية بين الخلايا الدبقية الصغيرة في شبكية العين (الشكل 1B). عندما RGCs الخضوع موت الخلايا المبرمج ، الدبقية الصغيرة يبلعم الخلايا الميتة ، ونتيجة ليصبح المسمى transcellularly مع التتبع الفلورسنت التي كانت تستخدم لتسمية RGCs 13 و 14. مظهر التتبع في phagosomes من الخلايا الدبقية الصغيرة وهو يختلف عن ذلك في RGCs على قيد الحياة. الخلايا الدبقية الصغيرة تحتوي على التتبع في phagosomes تتركز بشكل كبير ومشرق للغاية أن تكون كبيرة نسبيا ، والمنتشرة في جميع أنحاء السيتوبلازم بها (الشكل 1C). RGCs يكون له نمط أكثر انتشارا من تلطيخ (الشكل 1C) مع حويصلات صغيرة منقط التي تم نقلها إلى أسفل retrogradely المحاوير بهم الايداع السيتوبلازم الخلية. هذه الحويصلات هي أصغر بكثير وأقل كثافة ومضان يسمح احد لتمييز RGCs على قيد الحياة من الخلايا الدبقية الصغيرة. علاوة على ذلك ، الخلايا الدبقية الصغيرة وأجسام الخلايا أصغر حجما وتميل إلى أن تكون التشكل أو النجمية amoeboid مقابل RGCs الهيئات التي لديها خلية كبيرة نسبيا وتقريبه. لا يمكن للأشجار شجيري من RGCs يساعد أيضا تمييزها عن العمليات مشرق قصيرة من الخلايا الدبقية الصغيرة ، عند قياس بقاء الخلية. ويمكن قياس بقاء الخلايا في مناطق مختلفة من شبكية العين ، ويمكن استقراء الكثافة (خلايا / مم 2) من منطقة micrographs المقابلة ، حيث تم العثور على RGCs في المونولاير داخل طبقة الخلايا العقدية.
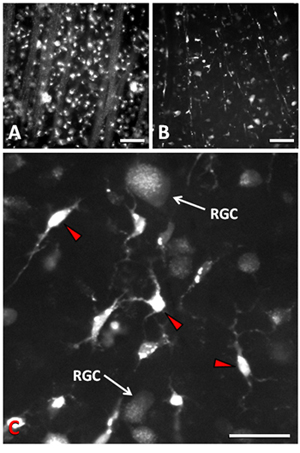
الشكل 1. micrographs Epifluorescence من Fluorogold RGCs المسمى بعد axotomy وتطبيق التتبع إلى جذع العصب البصري. (أ) وصفت 1 بعد يوم وكراسات RGCs axotomy محوار بهم مع التتبع المنقط بطريقة جيدة. (ب) من 14 يوما بعد axotomy ، توفي 90 ٪ من RGCs الزاهية وصفت الخلايا الدبقية الصغيرة التي يطلق عليها أيضا phagocytosed الخلايا الميتة مع التتبع. (C) التكبير العالي توضح الفرق بين RGCs والخلايا الدبقية الصغيرة (السهام الحمراء) في postaxotomy 14 يوما. شريط النطاق في A و B هو 50 ميكرومتر. شريط النطاق في C هو 25 ميكرومتر.
Discussion
هناك اختلافات كثيرة من هذا الإجراء الجراحي والعديد من الخطوات في هذا البروتوكول ليست ضرورية. فمن الضرورة فقط لسحب العضلات التي علا في العصب البصري من أجل الوصول إلى العصب. ومع ذلك ، فإن هذه النتائج في مساحة محدودة جدا العمل حول العصب جعل المراحل الحرجة النهائية transectio...
Disclosures
Acknowledgements
ويؤيد حزب كوسوفو الديمقراطي بمنحة التشغيل CIHR (MOP 86523)
Materials
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Fluorogold -(Hydroxystilbamidine bis(methanesulfonate) | Sigma-Aldrich | 39286 | |
| Gelfoam | Pharmacia Corporation (Pfizer) | ||
| Tears Naturale P.M. | Alcon | ||
| Proviodine | Medline Industries | MDS093945H | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| Micro surgical hook | Fine Science Tools | 10062-12 | |
| Eye dressing serrated forceps | Fine Science Tools | 11152-10 | |
| Dumont #7b sharp curved serrated forceps | Fine Science Tools | 11270-20 | |
| Cauterizer | Fine Science Tools | 18010-00 |
References
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. a. r. c. i. a., E, S. C. S. h. a. r. m. a. Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved