Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Section du nerf optique: un modèle de l'apoptose neuronale des adultes dans le système nerveux central
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Section du nerf optique est un modèle largement utilisé de lésion du SNC adulte. Quatre-vingt dix pour cent des cellules ganglionnaires de la rétine (CGR) dont les axones sont complètement sectionné (axotomie) meurent dans les 14 jours après axotomie. Ce modèle est facilement prêter à des manipulations expérimentales et hautement reproductibles.
Résumé
Les cellules ganglionnaires rétiniennes (CGR) sont des neurones du système nerveux central que l'information de sortie visuelle de la rétine au cerveau, via le nerf optique. Le nerf optique peut être consulté dans l'orbite de l'oeil et complètement sectionné (axotomisés), couper les axones de toute la population RGC. Section du nerf optique est un modèle reproductible de la mort cellulaire par apoptose neuronale dans le SNC adulte 1-4. Ce modèle est particulièrement intéressant car la chambre vitrée de l'œil agit comme une capsule pour l'administration de médicaments à la rétine, ce qui permet des manipulations expérimentales par des injections intraoculaires. La diffusion de produits chimiques dans le corps vitré assure qu'ils se fondent sur l'ensemble de la population RGC. En outre, RGC peut être sélectivement transfectées par l'application de courtes ARN interférents (ARNsi), des plasmides ou des vecteurs viraux, de l'extrémité coupée des vecteurs du nerf optique ou 5-7 injecter dans leur cible, le colliculus supérieur 8. Cela permet aux chercheurs d'étudiermécanismes apoptotiques dans la population neuronale souhaitée sans effets confondants sur les neurones ou des cellules gliales autres spectateurs environnant. Un autre avantage est la facilité et la précision avec laquelle la survie des cellules peut être quantifié après une blessure. La rétine est un plat, tissu couches et CGR sont localisés dans la couche la plus profonde, la couche des cellules ganglionnaires. La survie des RGC peut être suivie dans le temps par l'application d'un traceur fluorescent (3% Fluorogold) à l'extrémité coupée du nerf optique au moment de l'axotomie, ou par injection du traceur dans le colliculus supérieur (cible RGC) une semaine avant l' axotomie. Le traceur est transporté par voie rétrograde, l'étiquetage de toute la population RGC. Parce que la couche des cellules ganglionnaires est une monocouche (une cellule d'épaisseur), la densité du CJR peuvent être quantifiés dans le tissu plat monté, sans la nécessité d'stéréologie. Section du nerf optique conduit à la mort par apoptose de 90% des CGR blessés dans les 14 jours postaxotomy 9-11. Apoptose RGC a une caractéristique temps-cours whereby mort cellulaire est retardé 3-4 postaxotomy jours, après quoi les cellules dégénèrent rapidement. Ceci permet d'obtenir une fenêtre de temps pour les manipulations expérimentales dirigés contre les voies de l'apoptose.
Protocole
1. Technique chirurgicale
- Les expériences doivent être effectuées en utilisant une technique aseptique et en suivant les protocoles d'utilisation d'animaux de votre institution spécifique. Instruments et matériel (solutions, des substances d'essai, traceurs, aiguilles, etc) entrant en contact avec des tissus vivants doivent être stériles pour prévenir l'infection et les effets néfastes sur le bien-être animal et les impacts négatifs potentiels sur l'étude.
2. Anesthésie
- Les rats anesthésiés sera en utilisant un système de vaporisateur vétérinaire isoflurane. Utiliser l'oxygène de qualité médicale à un débit de 0,8 L / min pour vaporiser le gaz isoflurane. Placez l'animal dans la boîte ci-joint l'anesthésie et de composer dans une concentration d'isoflurane de 4% jusqu'à ce que la respiration s'est ralentie et l'animal est calme.
- Ensuite, changer le débit de gaz à la fixation du masque à gaz pour cadre stéréotaxique et placer l'animal dans l'appareil de stéréotaxie. Tournez la concentration d'isoflurane à 2% et lun.anesthésie moniteur. Les plus gros animaux (> 300 g) peut exiger une plus forte concentration d'isoflurane. L'anesthésie doit être surveillée pendant la chirurgie et la posologie ajustée en conséquence l'isoflurane. Profondeur et la vitesse de la respiration doit être constamment évaluée, et l'évaluation pincement de l'orteil (toutes les 5 min) pour l'absence de douleur profonde doit être effectuée.
- Une fois que l'opération est terminée, éteignez l'isoflurane et permettre à l'animal à l'oxygène respiration pendant plusieurs minutes avant de le retirer de l'appareil stéréotaxique. La température du corps doit être maintenu en couvrant l'animal avec une couverture chirurgicale et / ou à l'aide d'une couverture chauffante régulée pendant la chirurgie.
3. Abord chirurgical
- Mouiller la fourrure sur le dessus de la tête avec de l'éthanol 70% pour rendre le plus facile à couper la fourrure. Enlever les poils d'entre les yeux à l'aide d'une tondeuse ou des ciseaux bien aiguisés. Nettoyez la zone d'incision à trois reprises avec des applications alternatives de solution détergente iode (Proviodine, bétadine, etc) followed par l'éthanol à 70%. Maintenir la cornée humide tout au long de l'opération en appliquant une pommade ophtalmique oeil (Tears Naturale PM) à la cornée. Propager la pommade sur la surface de la cornée par l'ouverture manuelle et de fermeture des paupières.
- N ° 11 l'aide d'une lame, faire une incision le long de la ligne médiane de la tête d'environ 0,5 cm à l'avant des yeux à 1 cm derrière les yeux. Rétracter le lambeau de peau sur l'œil en utilisant une pince et doucement taquiner le mouchoir sous-jacente conjonctif avec le dos du scalpel. Ensuite, retirer le lambeau de peau latéralement et vers le bas et maintenez en place avec un écarteur chirurgical qui peut être collé sur la base de l'instrument stéréotaxique.
- Faire une incision le long du bord supérieur de l'os orbital tout en tirant sur le fascia recouvrant avec des pinces acérées. Cela retirer le fascia l'orbite de l'œil. Le bord de l'os orbital peut être clairement délimitées à l'aide de pinces pour pousser vers le bas sur le fascia recouvrantl'orbite. L'utilisation d'un dispositif de cautérisation ou un scalpel, continuer l'incision en arrière vers la limite postérieure de l'orbite de l'œil. Utiliser l'os de l'orbite supérieure comme un guide pour l'incision. Suivant poursuivre les attaquants incision vers la limite antérieure de l'orbite. L'incision de l'orbite supérieure mieux est d'utiliser un dispositif de cautérisation de petite taille afin de prévenir l'hémorragie des vaisseaux sous-jacents qui communiquent avec les sinus veineux.
- Si le saignement se produit plusieurs mesures peuvent être prises. Tout d'abord, appliquer une pression à l'aide des écouvillons stériles chirurgicaux ou des cotons-tiges. Si le saignement continue, appliquer du froid, une solution saline stérile de tampon phosphate (PBS) à la surface en utilisant un compte-gouttes, et maintenir la pression. Des saignements mineurs s'arrête après quelques secondes en utilisant cette procédure. Si le saignement persiste, appliquer une traction sur le tissu avec le tampon chirurgical ou coton-tige afin d'identifier la source du saignement et rapidement cautériser le vaisseau compromise. Après la saignée est contenu, utilisez stérile à froide PBS pour nettoyer la zone chirurgicale de sang. La zone chirurgicale doit être régulièrement nettoyé de cette façon afin de mieux visualiser les structures dans l'orbite de l'œil.
- Une fois l'incision a été nettoyé, utiliser des forceps et le dos du scalpel pour nettoyer le tissu conjonctif à l'arrière de l'œil qui recouvre le contenu orbitales. L'arrière de la n ° 11 de scalpel fonctionne bien comme la pointe est fine. Cela permettra d'ouvrir des portions plus profondes de la cavité orbitaire fournissant une plus grande fenêtre chirurgicale pour travailler po utilisation Dumont # 7b arêtes dentelées pince courbée lorsque vous travaillez dans l'œil que leur courbure et pointes fines sont idéales pour manipuler les structures de l'orbite. En outre, les dentelures aider avec les structures de préhension.
- Ensuite, retirez le tissu conjonctif qui entoure la division ophtalmique du nerf trijumeau, qui se trouve près de la ligne médiane, et enlever le nerf aide d'une pince. Cette étape n'est pas nécessaire, cependant enlever le nerf offrira une plus grande fenêtre d'accèss vers le nerf optique plus tard.
- Après l'élimination du nerf, utilisez une pince pour retirer le vaisseau sanguin ci-dessous et complètement cautériser le vaisseau. Cette étape n'est pas non plus nécessaire, cependant cautérisation du navire lui permet d'être déplacé en avant, créant ainsi une plus grande fenêtre une fois que le nerf optique est atteint.
- Utilisez une paire de pinces, forte ou une pince qui ont eu leurs conseils courbées vers l'intérieur à choisir soigneusement et enlever la mince couche de tissu conjonctif des muscles extra-oculaires et la glande lacrymale. Rentrez les muscles oculaires supplémentaires d'avant en arrière de l'orbite. Saisir la partie proximale du muscle avec une paire de pinces et en utilisant une deuxième paire de pinces dentelées courbes de pansements oculaires à exercer une traction vers l'extérieur sur le muscle. Faire en sorte que les pinces à pansement oculaire sont orientées dans la même direction que lors de l'extraction du muscle, afin d'éviter la déchirure. Retirer le muscle le plus antérieur de l'orbite (Superior oblique) de cette manière. Le muscle sera libéraliséATED au plus profond de l'orbite et la longueur restante peut être rétracté afin de faire tourner l'oeil vers l'extérieur.
- Répétez l'étape 3.8 avec le muscle suivante (rectus médial) qui se trouve entre les lobes de la glande lacrymale et la glande de Harder près de la ligne médiane de la face dorsale de l'œil. Bande vers le bas l'enrouleur pour maintenir la traction sur les muscles.
- Retirez doucement le tissu conjonctif restant sur la surface de la glande lacrymale et soulevez la glande vers le haut en utilisant une pince. Ne pas compresser ou de presser la glande. Pour rétracter la glande, seulement un seul récipient au pôle postérieur doit être cautérisé. Soulever l'extrémité postérieure de la glande vers le haut, et ensuite cautériser le vaisseau.
- Ensuite, battre la glande lacrymale avant d'ouvrir la partie postérieure de l'orbite et de permettre un accès sans entrave aux muscles qui recouvrent le nerf optique. Gardez la zone humide en permanence à l'aide du PBS stérile et séchage avec des tampons chirurgicaux ou des cotons-tiges.
- Utilisation sharpe Pince à nouveau enlever le tissu conjonctif qui entoure mince muscles de l'orbite postérieure (releveur paupière supérieure et droit supérieur) et de séparer les faisceaux de muscles sous-jacents. Rentrez les muscles indépendamment ou à l'unisson, à l'aide des pinces courbes dentelées pansements oculaires, encore une fois, en tirant dans le sens des fibres musculaires. Fixez les longueurs musculaires restantes à l'enrouleur avec les muscles qui ont été rachetées dans les étapes 3.8 et 3.9 et la bande vers le bas l'enrouleur pour appliquer une traction. Un total de 4 muscles vont maintenant être attaché à l'enrouleur. Cela fera tourner les yeux vers l'avant et vers l'extérieur dans le but de révéler la gaine contenant la graisse qui entoure le nerf optique.
4. Accès au nerf optique
- Utilisez une pince fine pointe pointus (Dumont) pour tirer vers le haut sur le tissu conjonctif qui entoure la gaine graisseuse du nerf optique. Faites une coupe longitudinale à l'aide de petits ciseaux à ressort Vannas. Développer la coupe si nécessaire. Thmatière grasse contenue e par la gaine va commencer à gonfler une fois la coupe terminée. Prochaine enlever les pans de tissu conjonctif en tirant avec précaution vers le haut à partir du bord coupant et les rabats de tissu en forme de croissant.
- Retirez la graisse recouvrant le nerf optique à l'aide d'une pince pour tirer sur la graisse, tout en coupant avec des ciseaux à ressort Vannas. Garder la zone propre en utilisant du PBS stérile et tampons chirurgicaux pour nettoyer les petites quantités de sang qui découlent de l'ablation du tissu.
- Le nerf optique est maintenant visible. Pour accéder au nerf, la gaine méningée qui entoure le nerf doit être enlevé sans endommager l'artère ophtalmique qui nourrit la rétine interne. Examinez le motif de la gaine vasculaire méningée aide d'une pince à tourner doucement la gaine. Recherchez une zone dépourvue de vaisseaux sanguins et en permettant une coupe longitudinale à faire dans la gaine méningée.
- Utilisation pointe fine pince Dumont, pincer la dure-mère et tirer vers le haut. Près de la base ee coin triangulaire en forme de durée qui est créé, utilisez des ciseaux à ressort Vannas de faire une petite incision dans la gaine. Insérez la lame inférieure des ciseaux dans l'incision et couper la gaine parallèle à la direction du nerf optique, veillez à ne pas endommager le système vasculaire avec découpes latérales. Utiliser les pinces et des ciseaux à draper la durée de chaque côté du nerf optique.
- La seule couverture restante du nerf est la membrane arachnoïde. Il est très mince et transparente. Afin de déterminer si la membrane est toujours présent, l'utilisation de pinces pointues pour pincer la surface du nerf. Il l'arachnoïde est présent, pincer la membrane et tirer vers le haut pour créer un coin triangulaire de tissu. Effectuer une petite incision avec la pointe des ciseaux similaires à l'étape 4,4. Ensuite, insérez la lame inférieure des ciseaux et faire une coupe longitudinale dans l'arachnoïde. Ensuite, utilisez vos ciseaux et des pinces à draper l'arachnoïde de chaque côté du nerf optique.
- En utilisant un micro sur-gique crochet, élever le nerf optique de la gaine méningée. Passez la pointe du crochet autour du bord externe du nerf et assurez-vous que le crochet reste en contact avec le nerf de sorte que vous n'avez pas attraper les membranes méningées avec le crochet et accidentellement transect. Soulevez délicatement le nerf optique de la gaine méningée et complètement sectionner le nerf derrière le point pris en charge par le crochet. Le moignon du nerf sectionné optique auront désormais une extrémité libre, permettant le retrait de l'hameçon.
- Si les CGR vont être marqués de façon rétrograde dans le but de quantifier la survie, placez un petit morceau de gelfoam trempé dans Fluorogold 3% (ou un autre traceur rétrograde) sur le moignon du nerf optique sectionné (voir JoVE protocole de 2261 ).
5. De clôture et de récupération
- Soulager la traction sur les muscles oculaires supplémentaires et retourner l'oeil à une position neutre. Ce faisant, assurez-vous que les to pousser le gelfoam vers le bas dans l'orbite de l'œil pour s'assurer que l'œil est tourné le remettre en place, le reste gelfoam autour du moignon du nerf optique. Retour la glande lacrymale et les muscles oculaires supplémentaires à leurs positions naturelles.
- Retournez le lambeau de peau sur la ligne médiane et suturer la plaie. Appliquer une pommade ophtalmique à l'œil les deux yeux. Ensuite, éteignez la source de l'isoflurane et permettre à l'animal à l'oxygène respiration pendant plusieurs minutes. Placer l'animal dans une cage ou une cage chauffé sous une lampe chauffante à récupérer. Ne placez pas de linge de lit dans la cage de récupération pour éliminer le risque d'aspiration de literie lors de la récupération.
- Les animaux doivent être logés de façon indépendante après la chirurgie. Analgésiques post-opératoire doit être administré selon les directives de votre administration de soins aux animaux, et les animaux doivent être surveillés attentivement après la chirurgie.
6. Les résultats représentatifs:
Transection des résultats du nerf optique dansla perte de 90% des CGR blessés dans les 14 jours postaxotomy 9-11. Le principal mécanisme de la mort RGC est l'apoptose 9, 12. La densité normale des CGR est d'environ 2500 cellules / mm 2. D'imagerie à épifluorescence ou confocale peut être utilisé pour visualiser CGR marqués de façon rétrograde après axotomie. RGC apoptose est retardé d'environ 4 jours après axotomie, en laissant une fenêtre de temps pour les manipulations expérimentales. Moins 1 jour après axotomie et marquage rétrograde avec Fluorogold, les corps cellulaires RGC dans la couche des cellules ganglionnaires de la rétine et fascicules axones dans la couche des fibres nerveuses de la rétine sont clairement visibles lorsque l'imagerie une préparation flatmounted (figure 1a). En 14 jours après axotomie, la majorité des CGR sont morts, et un CGR quelques autres sont intercalées entre la rétine microglie (figure 1b). Lorsque CGR apoptose, les microglies phagocytose des cellules mortes et, par conséquent deviennent transcellularly étiqueté avec le traceur fluorescent qui a été utilisé pour étiqueter le CGR 13, 14 </ Sup>. L'apparition du traceur dans les phagosomes de cellules microgliales est différente de celle de CGR survivants. La microglie contenir le traceur dans les phagosomes très concentrés et très lumineux qui sont relativement grands et dispersés dans le cytoplasme (figure 1c). CGR ont un modèle plus diffuse de la coloration (figure 1c) avec ponctuées de petites vésicules qui ont été transportés par voie rétrograde vers le bas leurs axones classeurs cytoplasme de la cellule. Ces vésicules sont beaucoup plus petites et ont moins intense fluorescence permettant de différencier CGR survivants de la microglie. En outre, les microglies ont des corps cellulaires beaucoup plus petites et ont tendance à avoir une morphologie stellaire ou amiboïdes, par opposition à RGC qui ont un corps cellulaires relativement grandes et arrondies. Les arbres dendritiques de CGR peut aussi aider à les différencier des processus courts vives de la microglie, lors de la quantification survie cellulaire. La survie des cellules peut être quantifié dans les différentes régions de la rétine et de la densité (cellules / mm 2) peut être EXTRAPOLés de la zone des micrographies correspondantes, depuis RGC se trouvent dans une monocouche à l'intérieur de la couche des cellules ganglionnaires.
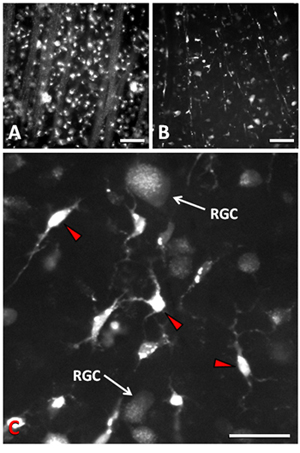
Figure 1. Micrographies épifluorescence de Fluorogold CGR marquées après axotomie et l'application du traceur sur le moignon du nerf optique. (A) 1 jour après axotomie CGR et leurs fascicules axones sont étiquetés avec le traceur d'une manière bien ponctuée. (B) En 14 jours après axotomie, 90% des CGR sont mortes et vives étiquetés microglies qui ont phagocyté les cellules mortes sont également marqués avec le traceur. (C) Grossissement supérieur montrant la différence entre CGR et la microglie (flèches rouges) à 14 postaxotomy jours. La barre d'échelle en A et B est de 50 um. La barre d'échelle en C est de 25 um.
Discussion
Il existe de nombreuses variantes de cette intervention chirurgicale et plusieurs des étapes de ce protocole ne sont pas nécessaires. Il est seulement nécessaire de rétracter les muscles qui recouvrent le nerf optique, afin d'avoir accès au nerf. Toutefois, cela se traduit par un espace très limité de travail autour du nerf rendant les phases critiques finales de transection plus difficile. Dans certaines situations, il est souhaitable de transfecter les cellules de la souche du nerf optique et l'espace d...
Déclarations de divulgation
Remerciements
PDK est soutenu par une subvention de fonctionnement des IRSC (MOP 86523)
matériels
| Nom du produit | Type | Entreprise | Numéro de catalogue | Commenter |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Cadre stéréotaxique | Stoelting, Kopf, WPI | |||
| Masque à gaz Rat | Stoelting, Kopf, WPI | |||
| Système d'anesthésie | VetEquip | 901806 | ||
| L'isoflurane (Pr AErrane) | Baxter Corp | DIN 02225875 | ||
| Microscope chirurgical | WPI, Zeiss, Leica | |||
| Fluorogold - (Hydroxystilbamidine bis (methanesulfonate) | Sigma | 39286 | ||
| Gelfoam | Pharmacia & Upjohn | |||
| Tears Naturale PM | Alcon | |||
| Proviodine | Medline | MDS093945H | ||
| Vannas ciseaux à ressort | Outils Fine Science | 15000-00 | ||
| Pointe fine pince Dumont | Outils Fine Science | 11252-00 | ||
| Micro crochet chirurgical | Outils Fine Science | 10062-12 | ||
| Eye pansement dentelé pince | Outils Fine Science | 11152-10 | ||
| Dumont # 7b forte courbe en dents de scie pince | Outils Fine Science | 11270-20 | ||
| Cauterizer | Outils Fine Science | 18010-00 |
Références
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. a. r. c. i. a., E, S. C. S. h. a. r. m. a. Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon