需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
视神经横断:一个成人在中枢神经系统的神经元凋亡模型
摘要
视神经横断是一个成人中枢神经系统损伤的广泛使用的模型。视网膜神经节细胞的90%(视网膜神经节细胞),其轴突完全横断(干切断)干切断后14天之内死亡。这种模式很容易经得起实验操作和高度重现。
摘要
视网膜神经节细胞(RGC的)是中枢神经系统的神经元,输出的视觉信息从视网膜到大脑,通过视神经。视神经眼轨道内可以访问,并完全切断(axotomized),切割研资局在整个人口的轴突。视神经横断重现模型在1-4成人中枢神经系统的细胞凋亡的神经细胞死亡。这种模式是特别有吸引力,因为眼睛的玻璃体腔行为作为药物输送到视网膜的胶囊,允许通过人工注射的实验操作。通过玻璃体液体化学品的扩散,确保他们的行为后,整个研资局人口。此外,视网膜神经节细胞可以选择性地转用短干扰RNA(siRNAs)的质粒或病毒载体的视神经5-7或注入自己的目标,上丘8向量的切端。这使研究人员能够学习所需的神经元群的细胞凋亡的机制,没有其他旁观者神经元或神经胶质细胞周围的混杂影响。另外一个好处是与细胞的存活,可在伤后量化的易用性和准确性。视网膜是一个平面,分层组织和RGC的是在最里层,神经节细胞层的本地化。随着时间的推移,可跟踪的视网膜神经节细胞的生存,申请时间干切断视神经切开结束了荧光示踪(3%荧光金),或上丘(研资局的目标)前一周注入示踪剂干切断。示踪逆行运输,标签研资局在整个人口。由于神经节细胞层是单层(一个细胞厚),研资局的密度可量化的扁平式的组织中,无体视需要。视神经横断导致的90%受伤的视网膜神经节细胞的凋亡,14天以内 postaxotomy 9-11。研资局凋亡有一个特点的时间进程,使细胞死亡是推迟3-4天postaxotomy后,这些细胞迅速退化。这提供了一个针对在细胞凋亡有关的途径的实验操作的时间窗口。
研究方案
1。外科技术
- 使用无菌技术操作,并按照您的特定机构的动物使用协议,应进行实验。活体组织接触到的工具和材料(解决方案,测试物质,示踪剂,针等)必须是无菌的,以防止感染动物福利和研究的潜在的负面影响和不利影响。
2。麻醉
- 老鼠将被麻醉的兽医异氟醚蒸发器系统。使用医疗级氧气在0.8 L / min的异氟醚气体蒸发的速度。放置在附加麻醉中的动物和异氟醚浓度在4%拨号,直到呼吸速度减慢和动物是稳重。
- 接下来,气体流量开关防毒面具附件立体框架,放置在立体定位仪上的动物。关闭异氟醚的浓度下降到2%,并监测麻醉。大型动物(> 300克),可能需要较高浓度的异氟醚。麻醉手术过程中应监测和异氟醚用量相应调整。应不断评估的深度和呼吸频率,并应脚趾捏评价了深深的痛苦的情况下(每5分钟)。
- 手术完成后,关闭异氟醚和切除脑立体定位装置前的几分钟,让动物呼吸的氧气。涵盖动物用手术毯和/或使用在手术过程中的受规管的加热毯,应保持体温。
3。手术方式
- 湿用70%乙醇使皮草更容易削减的头顶部的皮毛。取出使用剪或锋利的剪刀的眼睛之间的毛皮。碘洗涤剂溶液交替应用(Proviodine,优碘,等),其次是70%的乙醇,清洁切口面积的三倍。保持角膜湿润,整个眼科眼膏(泪Naturale PM)角膜手术。遍布手动打开和关闭眼睑对角膜表面的药膏。
- 使用11号刀片,沿头部中线在前面的眼睛后面的眼睛1厘米约0.5厘米的切口。在使用产钳的眼睛缩回皮瓣,轻轻梳理,手术刀背面底层的结缔组织。然后,收回皮瓣横向和向下,并在同一个手术牵开,可贴在立体定位仪的基础的地方。
- 同时用锋利的钳拉覆筋膜,沿眼眶骨的优越RIM切口。这将退出筋膜覆盖在眼睛的轨道。眼眶骨的边缘,可以清楚地划分使用钳推覆轨道上的筋膜。使用烧灼设备或手术刀,继续切口向后走向的眼轨道后的限制。使用骨切口指南优越的轨道。下一步继续切口向前走向前极限轨道。最好的做法是用一个小的烧灼设备,以防止从通信的底层血管,静脉窦出血切口优越的轨道。
- 如果出血发生时,可以采取以下几个步骤。首先,使用无菌手术拭子或棉签施加压力。如果继续出血,适用于冷,无菌磷酸盐缓冲液(PBS)的区域使用滴管,并保持压力。轻微出血停止使用此程序后的几秒钟。如果出血持续,适用于牵引与手术棉签或棉棒组织,以确定出血源,并迅速烧灼受损船只。载后出血,使用冷无菌PBS清洁血液的手术区。手术区应定期清洗,以这种方式,以便更好地可视化轨道的眼睛结构。
- 一旦切口已清理,使用产钳和手术刀背面清洁的结缔组织在后面的眼睛,覆盖在眶内容。回的第11号手术刀以及提示是罚款。这将打开眶腔提供一个更大的手术窗口工作时,其曲率和罚款提示眼操纵在轨道结构的理想工作。使用杜蒙#7B尖锐弯曲的锯齿钳的更深的部分。此外,锯齿帮助夹持结构。
- 接下来,删除的结缔组织包围位于中线附近的三叉神经眼科部,并使用镊子取出神经。这一步是没有必要的,但是消除神经,将提供一个ACCES更大的窗口s到视神经稍后。
- 去除神经后,用钳收回血管完全烧灼船只。这一步也是没有必要的,然而烧灼允许的船只,它向前移动,从而创造一个更大的窗口,一旦达到视神经。
- 使用的镊子一双锐利,或有他们的秘诀弯曲向内,仔细挑选并删除在眼外肌,泪腺的一层薄的结缔组织钳。额外的眼部肌肉收回由前到后的轨道。一双镊子夹住近端的肌肉部分,并使用一个弧形的锯齿眼敷料钳的第二对适用于肌肉向外牵引。确保眼敷料钳导向,在同一个方向的肌肉时,拉,以防止撕裂。取出的最前部的肌肉,以这种方式的轨道(上斜肌)。肌肉会从深中解放出来的轨道内,以旋转的眼睛向外,其余的长度可回缩。
- 与未来肌(内直肌)位于眼睛的背水面的中线附近的泪腺和哈氏腺叶之间重复步骤3.8。牵带下来,以保持肌肉的牵引。
- 在泪腺表面上轻轻地取下任何剩余的结缔组织和腺体向上抬起,使用产钳。不要压缩或挤压腺体。为了收回的腺体,只有在单船后极需要被烧灼。电梯向上的腺体后结束,然后烧灼的船只。
- 接下来,皮瓣泪腺开放轨道后,允许不受阻碍地进入肌肉覆盖在视神经。保持不断潮湿的地区使用无菌PBS,并与手术拭子或棉签干燥。
- 再次使用尖锐镊子删除薄的结缔组织后轨道(提肌Palpebrae Superioris和上直肌)周围的肌肉和肌肉分开的基本捆绑。独立或异口同声地缩回肌肉,利用弯曲的锯齿状眼敷料钳,再次,在与肌纤维的拉动。将剩余的肌肉长度牵一起缩回步骤3.8和3.9上下牵带,适用于牵引肌肉。现在共有4肌肉牵。这将向前和向外转动眼球,以揭示视神经周围的脂肪含有鞘。
4。访问视神经
- 使用锋利的钳(精尖杜蒙)向上拉结缔组织视神经周围的脂肪鞘。作一纵形切开,用小Vannas弹簧剪刀。展开削减必要的。鞘中的脂肪将开始凸出,一旦削减。接下来删除小心从边缘向上提拉,切断新月形皮瓣组织结缔组织的襟翼。
- 取出使用产钳拉脂肪Vannas弹簧剪刀切割,而脂肪覆视神经。保持该地区的清洁使用无菌PBS和手术棉签清洁切除组织中出现少量的血液。
- 视神经是现在可见。为了访问的神经,周围神经脑膜鞘必须拆除而损坏的眼动脉,饲料视网膜内层。检查,脑膜使用镊子轻轻旋转鞘鞘血管格局。寻找一个没有血管的区域,并允许一个纵向切开脑膜鞘。
- 使用精尖杜蒙钳,捏硬脑膜,向上拉。近创建硬脑膜形的三角楔的基础上,使用Vannas弹簧剪刀做一个小切口鞘。插入切口较低的刀片和剪刀切断鞘视神经,注意不要损伤血管横向切割方向平行。使用镊子和剪刀,悬垂性硬脑膜视神经两侧。
- 唯一的剩余的神经覆盖蛛网膜。这是非常薄的和透明的。为了确定如果膜仍然存在,用锋利的钳捏面神经。蛛网膜是目前的,捏膜和上拉,以创建一个组织的三角楔。做一个小切口用类似剪刀步4.4的尖端。然后,插入下刀片,剪刀和一个纵行剪开蛛网膜。接下来,使用您的剪刀和镊子,悬垂性蛛网膜视神经两侧。
- 使用微河畔gical挂钩,提高视神经的脑膜鞘。外缘周围的神经传递的钩提示,确保钩停留在接触与神经,使你没有赶上与此挂钩的脑膜膜和意外样。轻轻抬起视神经脑膜鞘和完全样钩支持点背后的神经。切断视神经残端现在有自由端,允许拆除的钩。
- 如果RGC的是逆标,以量化的生存,地方的明胶海绵小块,浸泡在3%荧光金(或其他逆行示踪)在切断视神经残端( 见朱庇特的协议 ,2261 )。
5。关闭和恢复
- 减轻额外的眼部肌肉牵引,并返回眼到一个中立的立场。虽然这样做,确保推入轨道的眼睛明胶海绵,以确保,映入眼帘的是旋转回原位,明胶海绵周围视神经残端仍然的。泪腺和额外的眼部肌肉返回到它们的自然位置。
- 返回中线皮瓣,缝合伤口。眼科眼膏双眼。然后,关闭异氟醚源,并允许几分钟的动物呼吸的氧气。放置在一个加热灯恢复了激烈的笼或下方一个笼子里的动物。不要放置任何在回收笼的床上用品,以消除在恢复过程中的吸床上用品的机会。
- 手术后的动物应设独立。手术后止痛药应根据动物保健当局的指引,管理,和动物手术后应仔细监测。
6。代表性的成果:
横断postaxotomy 9-11受伤的视网膜神经节细胞的90%,14天之内的损失,视神经,结果。研资局死亡的主要机制是细胞凋亡的9,12 。正常的视网膜神经节细胞的密度大约是2500个细胞/ mm 2 。 Epifluorescence或共焦成像可用于可视化逆行标记视网膜神经节细胞后,干切断。研资局凋亡延迟约4天,干切断后,留下了实验操作的时间窗口。在干切断,并用荧光金逆行标记后1天,研资局在视网膜和视网膜神经纤维层的轴突分册的神经节细胞层细胞体都清晰可见时成像flatmounted准备(图1A)。后干切断了14天,大部分的视网膜神经节细胞已经死亡,和几个剩余的视网膜神经节细胞是视网膜小胶质细胞(图1b)之间穿插。当视网膜神经节细胞发生凋亡,小胶质细胞吞噬死亡细胞和结果成为transcellularly荧光示踪标记,用来标记的视网膜神经节细胞13,14。示踪剂在小胶质细胞的吞噬体的外观,是尚存的视网膜神经节细胞的不同。小胶质细胞含有示踪剂,在高度集中和极其明亮的吞噬体比较大,散落在整个细胞质(图1C)。视网膜神经节细胞的染色更加分散的模式已逆行运其轴突备案细胞质中的小点状囊泡(图1C)。这些囊泡要小得多,有那么强烈的荧光,允许一个区别于小胶质细胞尚存的视网膜神经节细胞。此外,小胶质细胞胞体小得多,而且往往有星状或变形虫而不是有比较大的圆形胞体的视网膜神经节细胞的形态。视网膜神经节细胞的树突状树木还可以帮助他们从明亮的短流程的小神经胶质细胞分化时,量化细胞的存活。在视网膜的不同区域细胞的存活,可量化的和相应的显微面积密度(细胞/ 毫米 2)可推知,因为视网膜神经节细胞内神经节细胞层单层。
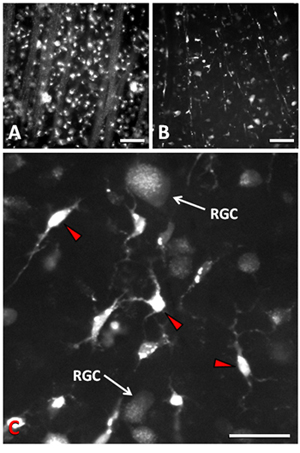
图1。Epifluorescence显微荧光金标记后视网膜神经节细胞和视神经残端示踪干切断应用。 (一)标记与示踪干切断视网膜神经节细胞和其轴突分册后1天,在细点状的方式。 (二)干切断后14天,90%的视网膜神经节细胞死亡,明亮的标记的小胶质细胞,吞噬死亡细胞示踪标记。 (三)说明了更高的放大倍率之间的视网膜神经节细胞和小胶质细胞(红色箭头)在14天postaxotomy的差别。 A和B的比例尺为50μm。规模在C栏是25微米。
讨论
这个手术过程中有许多变化,在本议定书中的几个步骤是没有必要的。它是只需要收回,覆盖在视神经以获得神经肌肉。然而,这个结果在一个非常有限的工作空间周围神经的横断关键的最后阶段更加困难。在某些情况下是可取的转染细胞和视神经残端回缩所有眼外肌,泪腺是有利于在这种情况下所提供的增加的存取空间。
在协议中最重要的步骤是步骤4.3-4.6。重要的是,不?...
披露声明
致谢
PDK是支持由CIHR经营授予(澳门币86523)
材料
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Fluorogold -(Hydroxystilbamidine bis(methanesulfonate) | Sigma-Aldrich | 39286 | |
| Gelfoam | Pharmacia Corporation (Pfizer) | ||
| Tears Naturale P.M. | Alcon | ||
| Proviodine | Medline Industries | MDS093945H | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| Micro surgical hook | Fine Science Tools | 10062-12 | |
| Eye dressing serrated forceps | Fine Science Tools | 11152-10 | |
| Dumont #7b sharp curved serrated forceps | Fine Science Tools | 11270-20 | |
| Cauterizer | Fine Science Tools | 18010-00 |
参考文献
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. a. r. c. i. a., E, S. C. S. h. a. r. m. a. Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。