È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Resezione del nervo ottico: un modello di apoptosi Neuron adulti nel Sistema Nervoso Centrale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Resezione del nervo ottico è un modello ampiamente utilizzato degli adulti lesioni del SNC. Il novanta per cento delle cellule gangliari della retina (RGCs) i cui assoni sono completamente recisi (assotomia) muoiono entro 14 giorni dopo assotomia. Questo modello è facilmente suscettibile di manipolazioni sperimentali e altamente riproducibile.
Abstract
Cellule gangliari della retina (RGCs) sono i neuroni del SNC che in uscita le informazioni visive dalla retina al cervello attraverso il nervo ottico. Il nervo ottico si può accedere nell'orbita dell'occhio e completamente sezionato (axotomized), tagliando gli assoni di tutta la popolazione RGC. Resezione del nervo ottico è un modello riproducibile di apoptosi morte delle cellule neuronali del sistema nervoso centrale adulto 1-4. Questo modello è particolarmente interessante perché la camera vitreo dell'occhio agisce come una capsula per la somministrazione di farmaci alla retina, permettendo manipolazioni sperimentali attraverso iniezioni intraoculari. La diffusione di sostanze chimiche attraverso il fluido vitreo assicura che agiscono su tutta la popolazione RGC. Inoltre, RGCs possono essere selettivamente trasfettate mediante l'applicazione di breve RNA interferenti (siRNA), plasmidi o vettori virali per la fine taglio dei vettori nervo ottico 5-7 o iniettando nelle loro target, il collicolo superiore 8. Questo permette ai ricercatori di studiare i meccanismi apoptotici nella popolazione neuronale desiderato senza effetti confondenti sui neuroni spettatore o glia circostante. Un ulteriore vantaggio è la facilità e la precisione con cui sopravvivenza cellulare può essere quantificato dopo l'infortunio. La retina è un piatto, tessuto stratificato e RGCs sono localizzate nello strato più interno, lo strato di cellule gangliari. La sopravvivenza di RGCs possono essere monitorati nel tempo mediante l'applicazione di un tracciante fluorescente (3% Fluorogold) alla fine taglio del nervo ottico al momento della assotomia, o iniettando il tracciante nel collicolo superiore (target RGC) una settimana prima assotomia. Il tracciante è retrogrado trasportato, etichettatura l'intera popolazione RGC. Poiché lo strato di cellule gangliari è un monostrato (una cella di spessore), densità RGC può essere quantificato in tessuto piatto montato, senza la necessità di stereologia. Resezione del nervo ottico conduce alla morte apoptotica del 90% dei feriti RGCs entro 14 giorni postaxotomy 9-11. RGC apoptosi è una caratteristica tempo-corso in cui viene ritardata la morte delle cellule postaxotomy 3-4 giorni, dopo di che le cellule degenerano rapidamente. Questo fornisce una finestra temporale per manipolazioni sperimentali diretti contro meccanismi coinvolti nella apoptosi.
Protocollo
1. Tecnica chirurgica
- Gli esperimenti deve essere effettuata usando tecniche asettiche e seguendo i protocolli di uso di animali della vostra istituzione specifica. Strumenti e materiali (soluzioni, sostanze in esame, traccianti, aghi, ecc), entrando in contatto con tessuti vivi, devono essere sterili per prevenire l'infezione e impatti negativi sul benessere degli animali e il potenziale impatto negativo sullo studio.
2. Anestesia
- I ratti saranno anestetizzati con un sistema veterinario vaporizzatore isoflurano. Usare l'ossigeno per uso medico a una velocità di 0,8 L / min per vaporizzare il gas isoflurano. Posto l'animale nella casella di anestesia attaccato e comporre in una concentrazione di isoflurano del 4% fino a quando il respiro si è rallentato e l'animale è calmo.
- Quindi, interruttore il flusso di gas per l'attaccamento maschera antigas per il telaio stereotassico e posto l'animale in dell'apparato stereotassico. Girare la concentrazione di isofluorano al 2% e monitorare l'anestesia. Animali più grandi (> 300g) può richiedere una maggiore concentrazione di isoflurano. L'anestesia deve essere monitorata durante l'intervento chirurgico e il dosaggio isoflurano aggiustato di conseguenza. La profondità e la velocità di respirazione deve essere costantemente valutata e un pizzico di valutazione tep (ogni 5 minuti) per l'assenza di dolore profondo deve essere eseguito.
- Una volta che l'operazione è completata, spegnere l'isoflurano e permettere all'animale di respirare ossigeno per alcuni minuti prima della rimozione dal dispositivo stereotassico. La temperatura corporea deve essere mantenuta coprendo l'animale con una coperta chirurgico e / o utilizzando una coperta riscaldamento regolabile durante l'intervento.
3. Approccio chirurgico
- Bagnare il pelo sulla parte superiore della testa con il 70% di etanolo per rendere il pelo più facile da tagliare. Rimuovere la pelliccia dal mezzo agli occhi con un clipper o forbici taglienti. Pulire l'area di incisione per tre volte con applicazioni alternate di soluzione di iodio detergente (Proviodine, Betadine, ecc), seguito da etanolo al 70%. Mantenere la cornea umida per tutta la chirurgia dell'occhio applicando pomata oftalmica (Tears Naturale PM) alla cornea. Stendere l'unguento sulla superficie della cornea manualmente l'apertura e la chiusura delle palpebre.
- Utilizzando una lama n ° 11, fare un'incisione lungo la linea mediana della testa di circa 0,5 cm davanti agli occhi a 1 cm dietro gli occhi. Ritrarre il lembo di pelle sopra l'occhio con pinze e delicatamente stuzzicare via il tessuto connettivo sottostante, con la parte posteriore del bisturi. Poi, ritirare il lembo di pelle lateralmente e verso il basso e tenere in posizione con un divaricatore chirurgico che può essere registrata alla base dello strumento stereotassico.
- Fare un'incisione lungo il bordo superiore dell'osso orbitale mentre si tira su la fascia sovrastante con una pinza tagliente. Questo ritirerà la fascia sovrastante l'orbita dell'occhio. Il bordo dell'osso orbitale può essere chiaramente delimitato utilizzando pinze a spingere verso il basso la fascia sovrastante l'orbita. Utilizzando un dispositivo di cauterizzazione o bisturi, continuare l'incisione a ritroso verso il limite posteriore dell'orbita dell'occhio. Utilizzare l'osso dell'orbita superiore come una guida per l'incisione. Avanti continuare l'incisione in avanti verso il limite anteriore dell'orbita. L'incisione dell'orbita superiore è meglio farlo con un piccolo dispositivo cauterizzazione al fine di prevenire le emorragie dai vasi sottostanti che comunicano con i seni venosi.
- Se l'emorragia si verifica diversi passaggi possono essere prese. In primo luogo, applicare una pressione utilizzando tamponi sterili chirurgici o tamponi di cotone. Se l'emorragia continua, si applica a freddo, sterile, soluzione salina tampone fosfato (PBS) per l'area con un contagocce, e mantenere la pressione. Sanguinamenti minori si fermerà dopo alcuni secondi con questa procedura. Se il sanguinamento persiste, applicare la trazione ai tessuti con il tampone chirurgico o tampone di cotone al fine di identificare la fonte di sanguinamento e rapidamente cauterizzare la nave compromessa. Dopo che il sanguinamento è contenuto, utilizzare freddo PBS sterile per pulire l'area chirurgica di sangue. L'area chirurgica dovrebbe essere periodicamente puliti in questo modo al fine di visualizzare meglio le strutture nell'orbita dell'occhio.
- Una volta che l'incisione è stata pulita, utilizzare forcipe e la parte posteriore del bisturi per pulire il tessuto connettivo nella parte posteriore dell'occhio che ricopre il contenuto orbitale. Il retro del n. 11 bisturi funziona bene come la punta va bene. Si aprirà porzioni più profonde della cavità orbitale che fornisce una finestra più grande chirurgico per lavorare in Usa 7b Dumont # sharp-curve-seghettato pinze quando si lavora in un occhio come il loro curvatura e suggerimenti multa sono ideali per la manipolazione di strutture in orbita. Inoltre, le scanalature aiutano con le strutture di presa.
- Quindi, rimuovere il tessuto connettivo che circonda la branca oftalmica del nervo trigemino che si trova nei pressi della linea mediana, e rimuovere il nervo utilizzando pinze. Questo passaggio non è necessario, tuttavia la rimozione del nervo fornirà una finestra più grande di accessos al nervo ottico in seguito.
- Dopo la rimozione del nervo, usare il forcipe per ritirare il vaso sanguigno sotto e completamente cauterizzare la nave. Questo passo non è inoltre necessario, tuttavia cauterizzazione del vaso permette di essere spostato anteriormente, creando così una finestra più grande una volta che il nervo ottico viene raggiunto.
- Utilizzare un paio di pinze taglienti, pinze o che hanno avuto le loro punte piegate verso l'interno per scegliere bene e togliere il sottile strato di tessuto connettivo sui muscoli extraoculari e la ghiandola lacrimale. Ritrarre i muscoli oculari extra da anteriore a posteriore dell'orbita. Afferrare la parte prossimale del muscolo con un paio di pinze e usare un secondo paio di pinze curve vestirsi occhio seghettata per applicare la trazione verso l'esterno sul muscolo. Assicurarsi che la pinza occhio spogliatoio sono orientate nella stessa direzione in cui tira il muscolo, per evitare strappi. Rimuovere il muscolo più anteriore dell'orbita (obliquo superiore) in questo modo. Il muscolo verrà liberato dal profondo l'orbita e la lunghezza rimanente può essere ritratto in modo da ruotare l'occhio verso l'esterno.
- Ripetere il passaggio con il muscolo 3,8 successivo (retto mediale) che si trova tra i lobi della ghiandola lacrimale e Gland Harderian vicino alla linea mediana della superficie dorsale dell'occhio. Nastro lungo il divaricatore per mantenere la trazione sui muscoli.
- Rimuovere delicatamente qualsiasi tessuto connettivo rimanenti sulla superficie della ghiandola lacrimale e sollevare la ghiandola verso l'alto con pinze. Non comprimere o spremere la ghiandola. Al fine di ritirare la ghiandola, ma solo una nave unica al polo posteriore deve essere cauterizzato. Sollevare l'estremità posteriore della ghiandola verso l'alto, e poi cauterizzare la nave.
- Successivamente, lembo della ghiandola lacrimale in avanti per aprire la parte posteriore dell'orbita e consentire il libero accesso ai muscoli che si sovrappongono al nervo ottico. Mantenere l'area costantemente umido con PBS sterile, e asciugatura con tamponi chirurgici o tamponi di cotone.
- Utilizzando pinze taglienti ancora una volta, rimuovere il tessuto connettivo sottile che circonda i muscoli dell'orbita posteriore (elevatore della palpebra superiore e retto superiore) e separare i fasci del muscolo sottostante. Ritrarre i muscoli in modo indipendente o all'unisono, usando la curva seghettato Pinza medicazione occhio, ancora una volta, tirando in linea con le fibre muscolari. Fissare le lunghezze muscolari restanti, il riavvolgitore con i muscoli che sono stati ritratta nei passaggi 3.8 e 3.9 e nastro in basso, il riavvolgitore per applicare la trazione. Un totale di 4 muscoli sarà ora allegata al riavvolgitore. Questo ruoterà l'occhio in avanti e verso l'esterno al fine di rivelare la guaina che contiene grassi che circonda il nervo ottico.
4. Accesso al nervo ottico
- Utilizzare pinze taglienti (Fine punta Dumont) per tirare verso l'alto sul tessuto connettivo che circonda la guaina grassa del nervo ottico. Fare un taglio longitudinale con piccole forbici primavera Vännäs. Espandere il taglio, se necessario. Il grasso contenuto dalla guaina inizierà a gonfiarsi una volta il taglio è fatto. Avanti rimuovere i lembi di tessuto connettivo con attenzione tirando verso l'alto dal bordo e tagliare i lembi di tessuto a forma di mezzaluna.
- Togliere il grasso sovrastante il nervo ottico utilizzando forcipe per tirare su il grasso, mentre il taglio con le forbici a molla il Vännäs. Mantenere l'area pulita utilizzando PBS sterile e tamponi chirurgici per pulire le piccole quantità di sangue che derivano dalla rimozione del tessuto.
- Il nervo ottico è ora visibile. Per accedere al nervo, la guaina che circonda meningea il nervo deve essere rimosso senza danneggiare l'arteria oftalmica che alimenta la retina interna. Esaminare il motivo della guaina vascolare meningeo con pinze a ruotare delicatamente la guaina. Cercare una zona priva di vasi sanguigni e permettendo un taglio longitudinale da effettuare nel fodero meningea.
- Utilizzando multa punta Dumont pinza, stringere la dura e tirare verso l'alto. Vicino alla base del cuneo di forma triangolare di durata che si crea, usare le forbici primavera Vännäs di fare una piccola incisione nel fodero. Inserire la lama inferiore della forbice nel incisione e taglio parallelo alla direzione guaina del nervo ottico, attenzione a non danneggiare la vascolarizzazione con tagli laterali. Utilizzare le pinze e forbici per coprire la dura su entrambi i lati del nervo ottico.
- L'unica copertura rimanente del nervo è la membrana aracnoide. E 'molto sottile e trasparente. Al fine di determinare se la membrana è ancora presente, utilizzare pinze taglienti per pizzicare la superficie del nervo. E 'l'aracnoide è presente, pizzicare la membrana e tirare verso l'alto per creare un cuneo triangolare di tessuto. Fai una piccola incisione con la punta delle forbici simili alla Fase 4.4. Poi, inserire la lama inferiore delle forbici e fare un taglio longitudinale nella aracnoide. Successivamente, utilizzare le forbici e pinze a drappeggio l'aracnoide su entrambi i lati del nervo ottico.
- Utilizzando una micro-surgancio gico, elevare il nervo ottico dalla guaina meningea. Passare la punta del gancio intorno al bordo esterno del nervo e assicurarsi che il gancio rimane in contatto con il nervo in modo che non cattura le membrane meningee con il gancio e accidentalmente transetto. Sollevare delicatamente il nervo ottico dalla guaina meningea e completamente transetto il nervo dietro il punto supportato dal gancio. Il moncone transected nervo ottico avrà ora un estremità libera, consentendo la rimozione del gancio.
- Se il RGCs stanno per essere retrogrado etichettati al fine di quantificare la sopravvivenza, posto un piccolo pezzo di Gelfoam imbevuto nel 3% Fluorogold (o un altro tracciante retrogrado) sul ceppo transected nervo ottico (vedi JOVE protocollo 2261 ).
5. Di chiusura e recupero
- Alleviare la trazione sui muscoli oculari in più e tornare l'occhio ad una posizione neutra. Nel farlo, assicuratevi di spingere il Gelfoam giù nell'orbita dell'occhio per garantire che l'occhio non viene riportato in posizione, il Gelfoam rimane attorno al moncone del nervo ottico. Ritorna la ghiandola lacrimale e muscoli oculari in più per le loro posizioni naturali.
- Restituire il lembo di pelle alla linea mediana e suturare la ferita. Applicare occhio pomata oftalmica in entrambi gli occhi. Poi, spegnere la fonte isoflurano e permettere all'animale di respirare ossigeno per alcuni minuti. Posto l'animale in una gabbia riscaldata o una gabbia sotto una lampada di calore per recuperare. Non appoggiare letto nella gabbia di recupero per eliminare la possibilità di aspirare letto durante il recupero.
- Animali dovrebbero essere accolti in modo indipendente dopo l'intervento chirurgico. Messaggio analgesici chirurgici deve essere somministrato secondo le linee guida della vostra autorità cura degli animali e gli animali devono essere attentamente monitorati dopo l'intervento chirurgico.
6. Rappresentante dei risultati:
Transezione dei risultati nervo ottico la perdita del 90% dei feriti RGCs entro 14 giorni postaxotomy 9-11. Il meccanismo principale di morte RGC è apoptosi 9, 12. La densità normale di RGCs è circa 2500 cellule / mm 2. Immagini epifluorescenza o confocale può essere utilizzato per visualizzare RGCs retrogrado etichettati dopo assotomia. Apoptosi RGC è ritardato di circa 4 giorni dopo assotomia, lasciando una finestra temporale per le manipolazioni sperimentali. Al 1 giorno dopo assotomia e marcatura retrograda con Fluorogold, corpi cellulari RGC nello strato di cellule gangliari della retina e fascicoli degli assoni nello strato delle fibre nervose della retina sono chiaramente visibili quando immagini una preparazione flatmounted (Fig. 1a). Con 14 giorni dopo assotomia, la maggior parte dei RGCs sono morti, e un RGCs pochi rimasti si alternano tra retina microglia (Fig. 1b). Quando RGCs apoptosi, microglia fagocitare le cellule morte e, quindi, sia transcellularly etichettati con il tracciante fluorescente che è stato usato per etichettare il RGCs 13, 14. L'aspetto del tracciante nel fagosomi della microglia è diverso da quello in RGCs sopravvivere. Microglia contenere il tracciante in fagosomi altamente concentrato e molto luminosi che sono relativamente grandi e sparse in tutta la loro citoplasma (Fig. 1c). RGCs hanno un modello più diffuso della colorazione (Fig. 1c) con piccole vescicole puntata retrogrado che sono stati trasportati i loro assoni deposito del citoplasma cellulare. Queste vescicole sono molto più piccole e hanno meno intensa fluorescenza permettendo di differenziare RGCs superstiti microglia. Inoltre, microglia hanno corpi cellulari molto più piccolo e tendono ad avere una morfologia stellata o ameboide in contrasto con RGCs che hanno corpi cellulari relativamente grande e arrotondata. Gli alberi dendritici di RGCs può anche aiutare a distinguerli dai processi breve brillante della microglia, nel quantificare la sopravvivenza delle cellule. Sopravvivenza delle cellule può essere quantificato in diverse regioni della retina e la densità (cellule / mm 2) può essere estrapolata dalla zona del micrografie corrispondente, dal momento che RGCs si trovano in un monostrato all'interno dello strato di cellule gangliari.
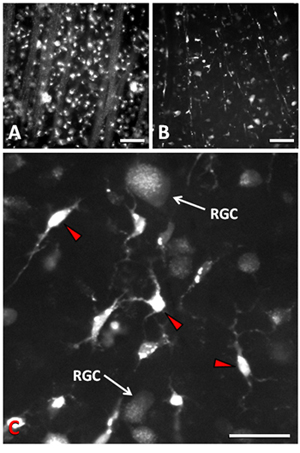
Figura 1. Micrografie epifluorescenza di Fluorogold RGCs etichettati dopo assotomia e l'applicazione del tracciante al moncone del nervo ottico. (A) 1 giorno dopo RGCs assotomia ed i loro fascicoli assone sono etichettati con il tracciante in un modo sottile puntata. (B) Entro il 14 assotomia giorni dopo, il 90% di RGCs sono morti e brillantemente etichettato microglia che hanno fagocitato le cellule morte sono etichettati con il tracciante. (C) superiore di ingrandimento che illustra la differenza tra RGCs e microglia (punte di freccia rossa) a 14 postaxotomy giorni. Barra di scala in A e B è di 50 micron. Barra di scala in C è di 25 micron.
Access restricted. Please log in or start a trial to view this content.
Discussione
Ci sono molte varianti di questa procedura chirurgica e parecchi dei passi in questo protocollo non sono necessari. E 'solo necessario ritirare i muscoli che si sovrappongono al nervo ottico al fine di ottenere l'accesso al nervo. Tuttavia, questo si traduce in uno spazio molto limitato di lavoro intorno al nervo rendendo le fasi critiche finale di transezione più difficile. In certe situazioni è auspicabile trasfezione delle cellule dal tronco del nervo ottico e lo spazio maggiore accesso offerta dalla scompa...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Il PDK è supportato da un sistema operativo CIHR sovvenzione (MOP 86523)
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Fluorogold -(Hydroxystilbamidine bis(methanesulfonate) | Sigma-Aldrich | 39286 | |
| Gelfoam | Pharmacia Corporation (Pfizer) | ||
| Tears Naturale P.M. | Alcon | ||
| Proviodine | Medline Industries | MDS093945H | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| Micro surgical hook | Fine Science Tools | 10062-12 | |
| Eye dressing serrated forceps | Fine Science Tools | 11152-10 | |
| Dumont #7b sharp curved serrated forceps | Fine Science Tools | 11270-20 | |
| Cauterizer | Fine Science Tools | 18010-00 |
Riferimenti
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. arcia, E, S. C. S. harma Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon