A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
עצב הראייה חיתוך רוחב: מודל של אפופטוזיס Neuron למבוגרים במערכת העצבים המרכזית
* These authors contributed equally
In This Article
Summary
חיתוך רוחב עצב הראייה הוא מודל בשימוש נרחב של פגיעה במערכת העצבים המרכזית מבוגר. תשעים אחוז של תאים הגנגליון ברשתית (RGCs) הם אשר אקסונים transected לחלוטין (axotomy) למות בתוך 14 ימים לאחר axotomy. מודל זה מקובל בקלות מניפולציות ניסיוני לשעתקו מאוד.
Abstract
בתאי גנגליון רשתית (RGCs) הם נוירונים במערכת העצבים המרכזית, כי פלט מידע חזותי מהרשתית אל המוח, באמצעות עצב הראייה. העצב האופטי ניתן לגשת בתוך מסלולו של העין transected לחלוטין (axotomized), חיתוך האקסונים של האוכלוסייה RGC כולו. חיתוך רוחב עצב הראייה הוא מודל לשחזור של מוות תאים אפופטוטיים נוירונים ב CNS הבוגרת 1-4. מודל זה הינו אטרקטיבי במיוחד מאחר קאמרית הזגוגית של העין פועלת כמו כמוסה עבור משלוח הסמים אל הרשתית, המתיר מניפולציות ניסיוני באמצעות זריקות התוך עיני. דיפוזיה של חומרים דרך הנוזל הזגוגי מבטיחה כי הם פועלים על האוכלוסייה RGC כולו. יתר על כן, RGCs ניתן transfected סלקטיבי על ידי יישום RNAs התערבות קצר (siRNAs), פלסמידים, או וקטורים ויראליים לסוף חתך של וקטורים עצב הראייה 5-7 או הזרקה לתוך היעד שלהם, colliculus מעולה 8. הדבר מאפשר לחוקרים לבחון מנגנונים אפופטוטיים באוכלוסייה העצבית הרצויה ללא תופעות בלבול על נוירונים אחרים או עובר אורח גליה שמסביב. יתרון נוסף הוא הקלות והדיוק שבה הישרדות התא ניתן לכמת לאחר פציעה. הרשתית היא רקמה שטוח, שכבות RGCs מרוכזים בשכבה הפנימית ביותר, השכבה תא גנגליון. ההישרדות של RGCs ניתן לעקוב לאורך זמן על ידי יישום נותב ניאון (3% Fluorogold) בסוף לחתוך של עצב הראייה בזמן axotomy, או על ידי הזרקת נותב אל colliculus מעולה (יעד RGC) שבוע לפני axotomy. נותב מועבר retrogradely, תיוג האוכלוסייה RGC כולו. מאחר השכבה תא גנגליון הוא monolayer (תא אחד עבה), צפיפות RGC ניתן לכמת ברקמות שטוח רכוב, ללא צורך stereology. חיתוך רוחב עצב הראייה מוביל למוות אפופטוטיים של 90% RGCs פצוע בתוך 14 ימים postaxotomy 9-11. RGC אפופטוזיס יש מאפיין זמן כמובן לפיה מוות של תאים מתעכב postaxotomy 3-4 ימים, אחרי אשר התאים להידרדר במהירות. זה מספק חלון הזמן מניפולציות ניסיוני נגד מסלולים מעורב אפופטוזיס.
Protocol
1. טכניקה כירורגית
- ניסויים אמור להתבצע באמצעות הטכניקה aseptic ובעקבות השימוש בבעלי חיים פרוטוקולים של המוסד הספציפי שלך. כלים וחומרים (פתרונות, חומרים הבדיקה, קליעים נותבים, מחטים וכו '), לבוא במגע עם רקמה חיה חייב להיות סטרילי כדי למנוע זיהום משפיע לרעה על רווחת בעלי החיים ואת ההשפעות השליליות האפשריות של המחקר.
2. הרדמה
- חולדות יהיה מורדם באמצעות מערכת אידוי isoflurane וטרינרי. השתמש חמצן כיתה רפואי בשיעור של 0.8 L / min כדי לאדות את הגז isoflurane. מניחים את החיה בתיבת הרדמה מצורף חיוג בריכוז isoflurane של 4% עד הנשימה הואט ובעלי חיים הוא שקט ורגוע.
- לאחר מכן, לעבור את זרימת הגז המצורף מסיכת הגז למסגרת stereotaxic והמקום חיה במנגנון stereotaxic. הפעל את הריכוז isoflurane עד 2% ולפקח הרדמה. בעלי חיים גדולים יותר (> 300 גרם) עשוי לדרוש ריכוז גבוה של isoflurane. הרדמה צריכה להיות במעקב במהלך הניתוח מינון isoflurane בהתאם. עומק וקצב הנשימה יש להעריך כל הזמן, קמצוץ הערכה הבוהן (כל 5 דקות) על היעדרו של כאב עמוק יש לבצע.
- לאחר הניתוח הושלם, לכבות את isoflurane ולאפשר את בעל החיים חמצן נשימה למשך מספר דקות לפני הסרת מהמכשיר stereotaxic. טמפרטורת הגוף צריך להיות מתוחזק על ידי מכסה את חיה עם שמיכה כירורגי ו / או באמצעות שמיכה חימום מוסדר במהלך הניתוח.
3. כירורגי בגישה
- להרטיב את הפרווה מעל הראש עם אתנול 70% לעשות הפרווה קל יותר לחתוך. הסר את הפרווה מן בין העיניים באמצעות גוזז או במספריים חדים. נקו את שטח החתך שלוש פעמים לסירוגין עם יישומים של פתרון אבקת יוד (Proviodine בבטאדין, וכו ') ואחריו אתנול 70%. שמירה על הקרנית לחה לאורך כל הניתוח על ידי יישום עין עיניים משחה (דמעות Naturale PM) אל הקרנית. מורחים את המשחה על פני השטח של הקרנית באופן ידני על ידי פתיחה וסגירה של העפעפיים.
- בעזרת להב מס '11, עושים חתך לאורך קו האמצע של הראש מתוך כ 0.5 ס"מ מול העיניים עד 1 ס"מ מאחורי העיניים. לחזור את קפל העור מעל העין באמצעות מלקחיים בעדינות להקניט משם את רקמת החיבור הבסיסי בגב את האזמל. ואז, לחזור בו את קפל העור רוחבית וכלפי מטה ולהחזיק במקום עם מפשק כירורגי שניתן מודבקת לבסיס של המכשיר stereotaxic.
- עושים חתך לאורך שפת מעולה של העצם מסלולית תוך משיכת fascia שמעל עם מלקחיים חדה. זה יהיה למשוך את fascia שמעל ארובת העין. שולי העצם מסלולית ניתן באופן ברור ומפורט באמצעות מלקחיים לדחוף כלפי מטה על fascia שמעל במסלול. השימוש במכשיר כויה או אזמל, להמשיך את החתך אחורה לכיוון הגבול האחורי של מסלולו של העין. השתמש העצם של מסלול מעולה כמדריך החתך. הבא להמשיך קדימה חתך לכיוון הגבול הקדמי של מסלולו. החתך של מסלול מעולה הוא עשה כמיטב באמצעות מכשיר כויה קטנה על מנת למנוע דימום מכלי הדם הבסיסי לתקשר עם הסינוסים ורידי.
- אם הדימום מתרחש מספר צעדים שניתן לנקוט. ראשית, להפעיל לחץ באמצעות ספוגיות ניתוח סטרילי או צמר גפן. אם הדימום ממשיך, חל קר, פוספט סטרילי חיץ מלוחים (PBS) לאזור בעזרת טפטפת, ולשמור על לחץ. דימום מינור יפסיק לאחר כמה שניות באמצעות הליך זה. אם הדימום נמשך, חלים המתיחה לרקמה ספוגית עם הניתוח או צמר גפן על מנת לזהות את מקור הדימום במהירות לצרוב את כלי השיט נפגע. לאחר דימום הכלול, השתמש קר סטרילי PBS לנקות את אזור הניתוח של דם. האזור כירורגית יש לנקות מעת לעת על מנת להמחיש טוב יותר מבנים במסלול של העין בצורה זו.
- לאחר החתך נוקתה, להשתמש במלקחיים ו האחורי של אזמל כדי לנקות את רקמת החיבור בחלק האחורי של העין כי overlies את התוכן מסלולית. חזרה של 11 מס 'אזמל עובד גם קצה בסדר. פעולה זו תפתח חלקים עמוקים יותר של חלל מסלולית מתן חלון כירורגי גדול לעבוד בו השתמש דומון # 7b חד מעוקל-משוננת מלקחיים כשעובדים בעיניים כמו עקמומיות שלהם טיפים בסדר הם אידיאליים עבור מניפולציה מבנים במסלול. יתר על כן, serrations העזרה עם מבנים מרתק.
- בשלב הבא, להסיר את הרקמה החיבורית שמקיפה את חלוקת עיניים של עצב trigeminal אשר יושב ליד קו האמצע, ולהסיר את העצב באמצעות מלקחיים. צעד זה אינו הכרחי, אולם הסרת עצב תספק חלון גדול יותר של access לעצב הראייה בהמשך.
- בעקבות הסרת העצב, להשתמש במלקחיים לחזור בו כלי דם מתחת לחלוטין לצרוב את כלי. צעד זה גם לא הכרחי, אולם כויה של כלי זה מאפשר להעביר anteriorly, ובכך ליצור חלון גדול פעם את עצב הראייה הוא הגיע.
- השתמש זוג חד של מלקחיים, מלקחיים או כי יש לו עצות רכונים פנימה בזהירות להרים ולהסיר את שכבה דקה של רקמת חיבור על השרירים extraocular ואת בלוטת הדמעות. לסגת שרירי העין הנוסף הקדמי אל האחורי של מסלולו. גריפ החלק הפרוקסימלי של השריר עם זוג מלקחיים ולהשתמש זוג נוסף של מלקחיים מעוקל ההלבשה משוננת העין להפעיל כוח משיכה כלפי חוץ על השריר. ודא ההלבשה מלקחיים עין מכוונת באותו כיוון כמו שריר כאשר משיכת כדי למנוע קריעה. הסר את השריר הקדמי ביותר של מסלול (Superior Oblique) בצורה זו. השריר תשוחרר ממעמקי מסלול ואורך הנותרים ניתן חזר בו כדי לסובב את העין כלפי חוץ.
- חזור על שלב 3.8 עם שרירים הבא (Rectus המדיאלי), אשר ממוקם בין האונות של בלוטת הדמעות ואת בלוטת Harderian ליד קו האמצע של פני השטח הגבי של העין. קלטת את מפשק לשמור על המתיחה בשרירים.
- בעדינות להסיר את כל רקמת החיבור שנותרו על פני השטח של בלוטת הדמעות ולהרים את בלוטת כלפי מעלה באמצעות מלקחיים. לא לדחוס או לסחוט את בלוטת. כדי לחזור בלוטת, רק כלי אחד בקוטב האחורי צריך להיות צרוב. הרם את הקצה האחורי של בלוטת כלפי מעלה, ולאחר מכן לצרוב את כלי השיט.
- בשלב הבא, דש את בלוטת הדמעות קדימה כדי לפתוח את החלק האחורי של מסלול ולאפשר גישה ללא הפרעה אל השרירים כי לשכב על עצב הראייה. שמור את האזור לח כל הזמן באמצעות PBS סטרילי, וייבוש עם מטליות כירורגית או צמר גפן.
- בעזרת מלקחיים חדה שוב להסיר את רקמת חיבור דקה שמקיפה את השרירים האחוריים של מסלול (Levator Palpebrae Superioris ו Rectus מעולה) ו להפריד את חבילות הבסיס של השריר. לסגת השרירים באופן עצמאי או ביחד, באמצעות ההלבשה מעוקל משוננת מלקחיים עין, שוב, מושך בקנה אחד עם סיבי שריר. צרף את אורכי שריר הנותרים מפשק יחד עם השרירים שהיו מכווצים ב צעדים 3.8 ו 3.9 קלטת מטה מפשק כדי להחיל המתיחה. סך של 4 שרירים עכשיו יהיה מחובר מפשק. זה יהיה לסובב את העין קדימה החוצה כדי לחשוף את נדן המכיל שומן שמקיפה את עצב הראייה.
4. גישה עצב הראייה
- שימוש במלקחיים חדה (Fine קצה דומון) למשוך כלפי מעלה על הרקמה החיבורית שמקיפה את מעטפת השומן של עצב הראייה. ביצוע חתך אורכי קטן בעזרת מספריים Vannas האביב. הרחב את החתך לפי הצורך. השומן שנמצא בתוך נדן יתחיל לבלוט החוצה פעם אחת את החתך. הבא להסיר את יריעות של רקמת חיבור על ידי משיכה זהירה כלפי מעלה מקצה וניתוק דשי בצורת חצי סהר של רקמת גוף.
- הסר את המכסה השומן עצב הראייה באמצעות מלקחיים למשוך שומן, בעוד גזירה במספריים באביב Vannas. שמרו על ניקיון באמצעות סטרילי PBS ו ספוגיות ניתוח כדי לנקות את כמויות קטנות של דם שעולים להסרת הרקמה.
- עצב הראיה הוא עכשיו גלוי. כדי לגשת העצב, נדן קרום המוח המקיף את העצב יש להסיר מבלי לפגוע בעורק עיניים אשר מזין את הרשתית הפנימית. בדוק את התבנית של כלי הדם המעטה קרום המוח באמצעות מלקחיים כדי לסובב בעדינות את נדן. חפש באזור ללא כלי דם, המתיר חתך אורכי להתבצע המעטה דלקת קרום המוח.
- שימוש עדין קצה דומון מלקחיים, לצבוט את הדורה ולמשוך כלפי מעלה. ליד בסיס של טריז בצורת משולש דורא שנוצר, השתמש במספריים באביב Vannas לעשות חתך קטן המעטה. הכנס את הלהב התחתון של המספריים לתוך החתך וחתך את נדן במקביל לכיוון של עצב הראייה, נזהר שלא לפגוע בכלי הדם עם חתכים לרוחב. השתמש מלקחיים ומספריים לעטוף את הדורה צד של עצב הראייה.
- הכיסוי היחיד שנותר של עצב הוא קרום אךכנואיךי. הוא דק מאוד ושקוף. על מנת לקבוע אם הקרום עדיין קיים, להשתמש במלקחיים חדה לצבוט את פני השטח של העצב. זה אךכנואיךי קיים, לצבוט את הממברנה ולמשוך כלפי מעלה כדי ליצור טריז משולש של רקמה. לעשות חתך קטן עם קצה המספריים דומה שלב 4.4. לאחר מכן, הכנס את הלהב התחתון של המספריים ולעשות חתך אורכי ב אךכנואיךי. בשלב הבא, להשתמש במספריים שלך מלקחיים לעטוף אךכנואיךי צד של עצב הראייה.
- באמצעות מיקרו-surוו gical, להעלות את עצב הראייה מתוך מעטפת קרום המוח. לעבור את קצה הקרס סביב הקצה החיצוני של העצב ולוודא כי וו נשאר במגע עם העצב, כך אתה לא תופס את ממברנות קרום המוח עם הקרס בטעות transect אותם. הרם בעדינות את עצב הראייה מתוך מעטפת קרום המוח לחלוטין transect העצב מאחורי הנקודה נתמך על ידי הקרס. גדם transected עצב הראייה כעת יש סוף חופשי, המאפשר הסרה של וו.
- אם RGCs הולכים להיות מתויג retrogradely על מנת לכמת הישרדות, מקום פיסה קטנה של gelfoam ספוגה Fluorogold 3% (או אחרת נותב מדרדר) על גדם העצב transected הראייה (ראה פרוטוקול יופיטר 2261 ).
5. סגירת ושחזור
- להקל על המתיחה על שרירי העין נוסף ולהחזיר את העין למצב נייטרלי. תוך כדי כך, ודא לדחוף את gelfoam למטה למסלול של העין על מנת להבטיח את העין הוא הסתובב בחזרה למקומו, gelfoam נשאר סביב הגדם עצב הראייה. החזר את בלוטת הדמעות ואת שרירי העין נוסף לעמדות הטבעיות שלהם.
- החזר את קפל העור עד קו האמצע ו תפר את הפצע. החל בעין משחה עיניים לשני בעיניים. לאחר מכן, כבה את מקור isoflurane ולאפשר את בעל החיים חמצן נשימה למשך מספר דקות. מניחים את חיה בכלוב מחומם או בכלוב מתחת לפנס חום להתאושש. אין מקום מצעים בכלוב התאוששות כדי לחסל את הסיכוי aspirating מצעים במהלך ההתאוששות.
- בעלי חיים צריכים להיות מאוחסנים באופן עצמאי לאחר הניתוח. משככי כאבים כירורגית ההודעה צריכה להינתן על פי הנחיות של רשויות החיים שלכם לטיפול, ובעלי חיים צריכים להיות במעקב צמוד לאחר הניתוח.
6. נציג תוצאות:
חיתוך רוחב של תוצאות עצב הראייה לאובדן של 90% RGCs פצוע בתוך 14 ימים postaxotomy 9-11. המנגנון העיקרי למוות RGC היא אפופטוזיס 9, 12. צפיפות נורמלית של RGCs הוא כ 2500 תאים / מ"מ 2. הדמיה Epifluorescence או confocal ניתן להשתמש כדי להמחיש RGCs שכותרתו retrogradely לאחר axotomy. אפופטוזיס RGC מתפרסמים בהשהייה של כ 4 ימים לאחר axotomy, להשאיר חלון זמן המניפולציות ניסיוני. באותו יום 1 לאחר axotomy וסימון מדרדר עם Fluorogold, גופי התא RGC בשכבת תא הגנגליון של הרשתית fascicles האקסון בשכבת סיבי העצב של הרשתית נראים בבירור כאשר הדמיה הכנה flatmounted (איור 1 א). עד 14 ימים לאחר axotomy, רוב RGCs מתו, וכן RGCs שנותרו משובצים בין microglia הרשתית (איור 1b). כאשר RGCs עוברים אפופטוזיס, microglia phagocytose התאים המתים כתוצאה להפוך שכותרתו transcellularly עם נותב ניאון ששימש התווית RGCs 13, 14. הופעתו של נותב ב phagosomes של microglia שונה כי RGCs לשרוד. Microglia להכיל את נותב ב phagosomes מרוכז מאוד ובהיר מאוד כי הם גדולים יחסית הפזורים ברחבי הציטופלסמה שלהם (איור 1 ג'). RGCs יש דפוס מפוזר יותר של כתמים (איור 1 ג') עם שלפוחית punctate קטן הועברו retrogradely את האקסונים שלהם הגשת הציטופלסמה התא. בועיות אלו הם הרבה יותר קטנים ויש להם פחות אינטנסיבי הקרינה המאפשר אחד כדי להבחין RGCs ששרדו מן microglia. יתר על כן, יש microglia גופי התא הרבה יותר קטן נוטים להיות בעלי מורפולוגיה stellate או amoeboid בניגוד RGCs כי יש גופי התא גדול יחסית ומעוגל. העצים הדנדריטים של RGCs גם יכול לעזור להבדיל מהם התהליכים בהיר קצר microglia, כאשר לכימות הישרדות התא. הישרדות התא ניתן לכמת באזורים שונים של הרשתית ואת צפיפות (תאים / מ"מ 2) ניתן להסיק מן האזור של micrographs המקביל, מאז RGCs נמצאים בשכבה בתוך שכבת תא גנגליון.
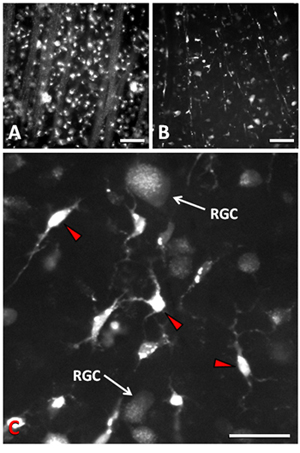
באיור 1. Micrographs Epifluorescence של RGCs שכותרתו Fluorogold לאחר axotomy ויישום של נותב אל גדם עצב הראייה. (א) 1 יום אחרי RGCs axotomy ו fascicles האקסון שלהם מסומנים עם נותב באופן punctate בסדר. (ב) עד 14 ימים לאחר axotomy, 90% RGCs מתו שכותרתו במאור microglia כי יש phagocytosed התאים המתים מסומנים גם עם נותב. (ג) הגדלה גבוהה הממחישות את ההבדל בין RGCs ו microglia (חצים אדומים) בשעה postaxotomy 14 ימים. בר סולם ב A ו-B הוא 50 מיקרומטר. בר סולם ב-C הוא 25 מיקרומטר.
Access restricted. Please log in or start a trial to view this content.
Discussion
ישנן וריאציות רבות של הליך זה כירורגית כמה צעדים בפרוטוקול זה לא הכרחי. הוא רק צריך לחזור בו השרירים לשכב על עצב הראייה על מנת לקבל גישה העצב. עם זאת, התוצאות במרחב עבודה מוגבל מאוד סביב העצב שהופך בשלבים הסופיים קריטית של חיתוך רוחב קשה יותר. במצבים מסוימים רצוי transfect ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
PDK נתמך על ידי מענק ההפעלה CIHR (MOP 86523)
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Fluorogold -(Hydroxystilbamidine bis(methanesulfonate) | Sigma-Aldrich | 39286 | |
| Gelfoam | Pharmacia Corporation (Pfizer) | ||
| Tears Naturale P.M. | Alcon | ||
| Proviodine | Medline Industries | MDS093945H | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| Micro surgical hook | Fine Science Tools | 10062-12 | |
| Eye dressing serrated forceps | Fine Science Tools | 11152-10 | |
| Dumont #7b sharp curved serrated forceps | Fine Science Tools | 11270-20 | |
| Cauterizer | Fine Science Tools | 18010-00 |
References
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. arcia, E, S. C. S. harma Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved