このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
視神経切断:中枢神経系における成人ニューロンのアポトーシスのモデル
要約
視神経切断は、成体中枢神経系の損傷の広く使用されているモデルです。軸索は完全に軸索切断後14日以内に死亡する(軸索切断)transectedされる網膜神経節細胞(RGCs)の90%。このモデルは、実験操作に簡単に従順し、再現性の高いです。
要約
網膜神経節細胞は(RGCs)視神経を経由して、網膜から脳にその出力を視覚情報CNSニューロンです。視神経は、全体RGC人口の軸索を切断、目と完全にtransected(axotomized)の軌道内でアクセスすることができます。視神経切断は、成体中枢神経系1-4のアポトーシス神経細胞死の再現可能なモデルです。眼の硝子体腔は眼内注射を介して実験操作を可能にして、網膜への薬物送達のためのカプセルとして機能するので、このモデルは特に魅力的です。硝子体液を介して化学物質の拡散は、彼らが全体のRGCの人口に基づいて行動することを保証します。また、RGCsが選択的に標的、上丘8に視神経5月7日または注入ベクトルのカットの最後に短い干渉RNA(siRNA)、プラスミド、またはウイルスベクターを適用することにより、トランスフェクションすることができる。これは、研究者は他のバイスタンダーの神経細胞または周囲のグリア細胞上で交絡の影響なく、所望の神経細胞集団のアポトーシスのメカニズムを研究することができます。追加の利点は、細胞の生存が傷害後定量することができる容易さと精度です。網膜は、平らな、層状組織であり、RGCsは最も内側の層、神経節細胞層に局在している。 RGCsの生存は、軸索切断の時に視神経の切断端に蛍光トレーサー(3%Fluorogold)を適用することによって、または上丘(RGCのターゲット)の1週間前にトレーサを注入することにより、時間の経過とともに追跡することができます。軸索切断。トレーサーは逆行全体RGC人口のラベル付け、搬送され。神経節細胞層が単分子層(細胞1個分の厚さ)であるため、RGC密度は立体学を必要とせずに、フラットマウント組織で定量することができる。視神経切断は14日postaxotomy 9月11日中に負傷したRGCsの90%のアポトーシス死につながる。 RGCのアポトーシスは、細胞死、細胞が急速に退化した後、3〜4日のpostaxotomyを遅延さにより時間経過特性を持っています。これは、アポトーシスに関与する経路に対して誘導実験操作のための時間ウィンドウを提供します。
プロトコル
1。手術手技
- 実験は無菌操作を使用して、特定の機関の動物使用のプロトコールに従って実施されるべきである。生体組織と接触する楽器と材料(ソリューション、テスト物質、トレーサー、針、など)動物福祉と研究上の潜在的な負の影響に感染して悪影響を防ぐために無菌でなければならない。
2。麻酔
- ラットは、獣医イソフルラン気化器のシステムを使用して麻酔になります。イソフルランガスを気化させるために0.8 L / minの速度で、医療グレードの酸素を使用してください。呼吸が鈍化していると動物が落ち着いたようになるまで4%のイソフルラン濃度で接続されている麻酔ボックスとダイヤルで動物を置きます。
- 次に、定位フレーム用ガスマスクの添付ファイルへのガスの流れを切り替え、定位固定装置に動物を配置。 2%、モニターの麻酔にイソフルラン濃度を下げてください。大型動物(> 300グラム)はイソフルランの濃度が高いが必要な場合があります。麻酔は手術中に監視し、イソフルラン投与量は適宜調整する必要があります。呼吸の深さと速度は、常に評価されなければならない、と深い苦痛の欠如のためのつま先のピンチの評価は(5分ごとに)実行する必要があります。
- 手術が完了したら、イソフルランをオフにすると定位装置から取り外す前に数分間、息の酸素に動物を可能にする。体温は、手術の毛布及び/または手術中に規制加熱毛布を使用してある動物をカバーすることによって維持されるべきである。
3。外科的アプローチ
- カットする毛を簡単にするために70%エタノールで頭の上に毛皮を濡らし。クリッパーやはさみを使って目の間から毛を取り除く。 70%エタノール、続いヨウ素の洗剤溶液(Proviodine、Betadine、等)のアプリケーションを交互に切開面積を3回清掃してください。角膜に点眼眼軟膏(涙ナトゥPM)を適用することにより、手術全体に角膜の潤いを維持する。手動でまぶたを開閉して角膜の表面上に軟膏を広げる。
- 11番ブレードを使用して、目の後に1 cmまでの目の前に約0.5 cmから頭の正中線に沿って切開を行います。鉗子を使用して眼を介して皮膚のフラップを収納し、静かにメスの背面と下層の結合組織を離れていじめる。次に、横方向と下方向に皮膚のフラップを収納して定位固定装置のベースに貼り付け可能な外科的リトラクターとの場所に保持する。
- 鋭いピンセットで上を覆う筋膜を引っ張っている間軌道骨の優れたリムに沿って切開を加えます。これは目の軌道を覆う筋膜を撤退する。眼窩骨の縁がはっきりと軌道を覆う筋膜を押し下げに鉗子を使用することによって画定することができます。焼灼装置やメスを使用して、目の軌道の後方限界へ向かって逆方向に切開を続ける。切開のためのガイドとして優れた軌道の骨を使用してください。次の軌道の前方限界に向かって切開の転送を継続する。優れた軌道の切開は、最高の静脈洞と通信する基本的な血管からの出血を防ぐために小さな焼灼装置を使用して行われます。
- 出血が発生した場合はいくつかのステップを行うことができます。まず、滅菌外科用スワブまたは綿棒を使用して圧力を適用する。出血が続く場合は、スポイトを使ってエリアに冷たい、滅菌リン酸緩衝生理食塩水(PBS)を適用し、圧力を維持する。小出血は、この手順を使用して数秒後に停止します。出血が続く場合は、出血源を特定し、迅速に漏洩血管を焼灼するために外科的綿棒または綿棒で組織するトラクションを適用する。出血が含まれている後に、血の外科領域をきれいにする冷滅菌PBSを使用してください。外科領域は、定期的に良く目の軌道の構造を視覚化するためにこのような方法で清掃する必要があります。
- 切開が洗浄されると、軌道の内容の上に重ね、目の後ろで結合組織をきれいに鉗子やメスの背面を使用してください。先端が微細であるため第11号メスの背面には適しています。彼らの曲率と微細なヒントとして、目で作業する場合に使用デュモン#7Bシャープ湾曲-鋸歯状の鉗子を作業に大きな手術ウィンドウを提供して眼窩の深い部分を開きます。軌道の構造を操作するのに最適です。また、セレーションがグリップ構造に役立ちます。
- 次に、正中線近くに位置する三叉神経の眼科部門を囲む結合組織を除去し、鉗子を用いて神経を取り除く。この手順は不要ですが、神経を削除するとアクセスもの大きなウィンドウを提供します後で視神経への。
- 神経の除去に続いて、下の血管を撤回するために鉗子を使用しており、完全な血管を焼灼する。このステップも必要ではない、しかし血管の焼灼は、視神経に達すると、それによってより大きいウィンドウを作成し、それを前方に移動することができます。
- そのヒントは、慎重に外眼筋と涙腺を介して結合組織の薄い層を選択し、削除するために内側に曲がってあった鋭いピンセット、または鉗子を使用してください。軌道の後方に前から余分な眼の筋肉を引っ込めます。ピンセットで筋の近位部をつまんで、筋肉を外側にトラクションを適用するには、湾曲した鋸歯状の眼帯の鉗子の2番目のペアを使用してください。テアリングを防ぐために引っ張るときに目麦粒鉗子は筋肉と同じ方向に向いていることを確認してください。このように軌道(上斜)の最も前脛骨筋を取り除く。筋肉は、軌道の奥深くから解放されると、残りの長さは、外側に目を回転させるために撤回することができます。
- 眼の背側表面の正中線近くに涙腺及びハーダー腺の葉の間に配置されて次の筋肉(内側腹直)で、ステップ3.8を繰り返します。筋肉にトラクションを維持するためにトラクターダウンテープ。
- 優しく涙腺の表面上の残りの結合組織を除去し、ピンセットを使って上向きに腺を持ち上げます。腺を圧縮またはスクイズしないでください。腺を撤回するためには、後極での唯一の単一の容器は、焼灼する必要があります。上向き腺の後端を持ち上げ、容器を焼灼する。
- 次に、軌道の後部を開き、視神経を覆う筋肉に妨げられることなくアクセスを許可するように前方に涙腺をフラップする。常に湿った領域は滅菌PBSを使用して、そして外科綿棒や綿棒で乾燥してください。
- 鋭いピンセットを使用すると、再度後方軌道(上眼瞼挙筋と上直筋)の筋肉を取り囲む薄い結合組織を除去し、筋肉の基礎となる束を分離。筋線維に沿って引っ張って、もう一度、湾曲した鋸歯状の眼帯の鉗子を使用して、個別にまたは一斉に筋肉を引っ込めます。トラクションを適用するためにトラクターをステップダウン3.8および3.9とテープに収納された筋肉と一緒にトラクターに残っている筋肉の長さを取り付けます。 4筋肉の合計は現在、リトラクターに添付されます。これは、視神経を取り囲む脂肪を含むシースを明らかにするために前進し、外側に目を回転します。
4。視神経へのアクセス
- 視神経の脂肪酸鞘を囲む結合組織に上向きに引っ張るために鋭い鉗子(ファインティップデュモン)を使用してください。小さなVannasの春のはさみを使って縦カットを行います。必要に応じてカットを展開します。カットが行われた後鞘に含まれる脂肪は膨れるが開始されます。次に慎重に端から上方に引っ張ると組織の三日月形のフラップをカットすることで結合組織のフラップを削除します。
- Vannasの春のはさみでカットしながら、脂肪を引っ張らないように鉗子を使用することによって脂肪を覆う視神経を削除します。面積は組織の除去から生じる血液の少量をきれいに滅菌PBSおよび外科綿棒を使用して常に清潔に保ってください。
- 視神経は、現在表示されています。神経にアクセスするためには、神経を囲む髄鞘は、内側の網膜を供給する眼動脈を損傷することなく削除する必要があります。そっと鞘を回転させる鉗子を使用して髄膜鞘の血管パターンを調べます。血管を欠いている領域を探し、そして髄膜鞘で行われる長手方向の切断を可能にする。
- ファインチップデュモン鉗子を使用して、硬膜をつまんで上向きに引っ張る。作成された硬膜の三角形のくさびの基盤の近くに、鞘に小さな切開を行うことVannasの春のはさみを使用してください。切開にはさみの下刃を挿入し、横方向のカットと血管を傷つけないように注意して視神経の方向、にシースを平行にカット。視神経の両側に硬膜をドレープする鉗子とはさみを使用してください。
- 神経の唯一の残っているカバーは、クモ膜です。それは非常に薄く、透明です。膜がまだ存在するかどうかを判断するためには、神経の表面を挟まないように鋭いピンセットを使用してください。それくも膜が存在する場合、メンブレンをつまみ、組織の三角形のくさびを作成するために上向きに引っ張る。 4.4ステップに似てはさみの先端で小さな切開を加えます。その後、はさみの下刃を挿入し、くも膜の長手方向のカットを行います。次に、視神経のいずれかの側にくも膜をドレープするあなたのはさみやピンセットを使用してください。
- マイクロシュルの使い方gicalフックは、髄膜鞘のうち視神経を高める。神経の外側の縁の周りにフックの先端を渡すと、フックと髄膜の膜をキャッチし、誤ってそれらをトランセクトしないようにフックが神経と接触して留まることを確認してください。ゆっくりと髄膜鞘のうち視神経を持ち上げ、完全にフックでサポートされているポイントの背後にある神経を横に切断する。 transected視神経の断端はフックの除去を可能にする、自由端を持つことになります。
- RGCsが逆行生存率を定量化するためにラベル付けすることを予定している場合、transected視神経の切り株上に3%Fluorogold(または別の逆行性トレーサー)(参照に浸したgelfoamの小片を配置Joveのプロトコル2261年に )。
5。閉鎖およびリカバリ
- 余分な眼筋でトラクションを軽減し、中立位置に目を戻す。そんな中、目が元の位置に回転させると、gelfoamは視神経の切り株の周りに残っていることを保証するために目の軌道にgelfoamを押し下げるようにしてください。彼らの自然な位置に涙腺と余分な眼の筋肉を返します。
- 正中線に皮膚のフラップを戻し、傷を縫合。両眼に点眼眼軟膏を適用します。その後、イソフルランソースをオフにして数分間息の酸素に動物を可能にする。加熱されたケージまたは回復するために熱ランプの下にケージに動物を置きます。リカバリ時に寝具を吸引する可能性を排除するために回復ケージ内の任意のベッドを配置しないでください。
- 動物は、手術後に独立して内蔵する必要があります。術後鎮痛薬は、動物医療当局のガイドラインにしたがって投与されるべきである、と動物は、慎重に手術後に監視する必要があります。
6。代表的な結果:
14日以内に怪我をRGCsの90%の損失postaxotomy 9-11の視神経結果の切除。 RGC死の主なメカニズムはアポトーシス9、12です。 RGCsの通常の密度は、約2500細胞/ mm 2である。落射蛍光または共焦点イメージングは、軸索切断後の逆行性標識されたRGCsを視覚化するために使用することができます。 RGCのアポトーシスは、実験操作のための時間ウィンドウを残し、軸索切断後約4日間だけ遅延される。軸索切断とFluorogoldと逆行性標識法1日後では、網膜の神経線維層における網膜と軸索の束の神経節細胞層におけるRGC細胞体がはっきりとわかりますするときには、イメージングflatmounted準備(図1a)。軸索切断後14日間、RGCsの大半が死亡している、といくつか残っているRGCsは網膜ミクログリア(図1b)の間に点在している。 RGCsはアポトーシス、ミクログリア貪食死細胞とtranscellularly RGCs 13,14のラベル付けに使用された蛍光トレーサーで標識となる結果としてを受けるときに。ミクログリアのファゴソームのトレーサーの外観は存続RGCsでは異なっている。ミクログリアは、比較的大規模とそれらの細胞質(図1C)に散在している高濃度と非常に明るいファゴソームにトレーサーが含まれています。 RGCsは逆行細胞の細胞質を提出、その軸索を輸送されている小さな点状の小胞での染色のより多くの拡散パターン(図1c)を持っている。これらの小胞は、はるかに小さいですし、一ミクログリアから存続RGCsを区別できるように少なく強い蛍光を持っている。さらに、ミクログリアは、はるかに小さい細胞体を持ち、などの比較的大きく、丸い細胞体を持つRGCsするのではなく星状またはアメーバの形態を持つ傾向にあります。 RGCsの樹木はまた、細胞生存率を定量化する際に、ミクログリアの短い明るいプロセスからそれらを区別することができます。細胞の生存は、網膜の異なる領域で定量することができるとRGCsが神経節細胞層内の単層で発見されているので、密度(細胞/ mm 2)は 、対応する顕微鏡写真の領域から外挿することができます。
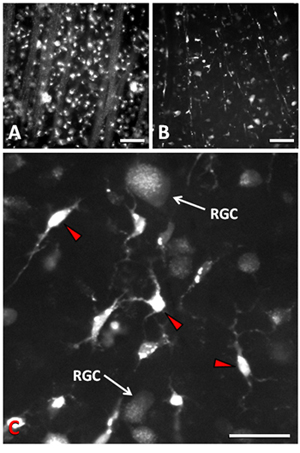
図1。視神経断端へのトレーサーの軸索切断と適用後のFluorogoldラベル付けRGCsの落射蛍光顕微鏡写真。 ()軸索切断のRGCsとその軸索の束1日後は、細かい点状の形でトレーサーで標識されています。 (B)軸索切断後の14日間で、RGCsの90%は、死んだ細胞はまた、トレーサーで標識されている貪食したミクログリアを死亡し、明るくラベルが付いています。 (C)高倍率はpostaxotomy 14日でRGCsとミクログリア(赤矢印)との間の差を示す。 AとBのスケールバーは50μmである。 Cのスケールバーは25μmである。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
そこにこの外科手術の多くのバリエーションがあり、このプロトコールのステップのいくつかは必要ありません。それは唯一の神経へのアクセスを得るために、視神経を覆う筋肉を撤回することが必要である。しかし、神経の周りは非常に限られた作業スペースにこの結果は、切除の重要な最終段階は、より困難になります。特定の状況では、外眼筋や涙腺のすべてが、このインスタンスで?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
PDKは、CIHRオペレーティング助成金(MOP 86523)によってサポートされています
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Fluorogold -(Hydroxystilbamidine bis(methanesulfonate) | Sigma-Aldrich | 39286 | |
| Gelfoam | Pharmacia Corporation (Pfizer) | ||
| Tears Naturale P.M. | Alcon | ||
| Proviodine | Medline Industries | MDS093945H | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| Micro surgical hook | Fine Science Tools | 10062-12 | |
| Eye dressing serrated forceps | Fine Science Tools | 11152-10 | |
| Dumont #7b sharp curved serrated forceps | Fine Science Tools | 11270-20 | |
| Cauterizer | Fine Science Tools | 18010-00 |
参考文献
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Valenzuela, G. arcia, E, S. C. S. harma Rescue of retinal ganglion cells from axotomy-induced apoptosis through TRK oncogene transfer. Neuroreport. 9, 3165-3170 (1998).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Berkelaar, M. Axotomy results in delayed death and apoptosis of retinal ganglion cells in adult rats. J Neurosci. 14, 4368-4374 (1994).
- Villegas-Perez, M. P. Influences of peripheral nerve grafts on the survival and regrowth of axotomized retinal ganglion cells in adult rats. J Neurosci. 8, 265-280 (1988).
- Villegas-Perez, M. P. Rapid and protracted phases of retinal ganglion cell loss follow axotomy in the optic nerve of adult rats. J Neurobiol. 24, 23-36 (1993).
- Quigley, H. A. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci. 36, 774-786 (1995).
- Thanos, S. Specific transcellular carbocyanine-labelling of rat retinal microglia during injury-induced neuronal degeneration. Neurosci Lett. 127, 108-1012 (1991).
- Thanos, S. Specific transcellular staining of microglia in the adult rat after traumatic degeneration of carbocyanine-filled retinal ganglion cells. Exp Eye Res. 55, 101-117 (1992).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved