A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الثدي زرع الخلايا اللحمية وسرطان الخلايا في الفئران C57BL/6J
In This Article
Summary
في هذا التقرير ، إلا أننا يبرهن على وجود نظام لعزل الخلايا المانحة والثقافة من الغدة الثديية الماوس ، وزرع هذه الخلايا في orthotopically الفئران المتلقي لتحليل انسجة : التفاعلات الظهارية أثناء تطوير ورم الثدي.
Abstract
وقد كان تأثير الخلايا اللحمية ، بما في ذلك الخلايا الليفية على تطور ورم الثدي موثقة بشكل جيد من خلال استخدام نماذج الماوس ، لا سيما من خلال زرع خلايا انسجة والخلايا الظهارية في الغدة الثديية من الفئران. زرع النماذج الحالية غالبا ما تنطوي على استخدام الفئران المناعة بسبب خلفيات وراثية مختلفة من خلايا انسجة والخلايا الظهارية. وغالبا ما تستخدم مصفوفات خارج الخلية لتضمين نوعين خلية مختلفة عن التفاعلات خلية خلية ثابتة ، ولكنها تنطوي على استخدام Matrigel أو ذيل فأر الكولاجين ، والتي هي ركائز المناعية. عدم وجود خلايا تي من الفئران وظيفية المناعة يمنع تقييم دقيق للانسجة الخلايا الثديية على تطور الورم في الجسم الحي ، مع انعكاسات هامة على تطوير الأدوية ونجاعتها. وعلاوة على ذلك ، والفئران المناعة مكلفة ، من الصعب ان تولد وتتطلب شروط رعاية خاصة. للتغلب على هذه العقبات ، وقد طورنا نهجا لزرع خلايا انسجة orthotopically والخلايا الظهارية في الفئران من الخلفية الجينية نفسها للحث على تشكيل ثابت الورم. هذا النظام ينطوي على حصاد طبيعي ، وسرطان الخلايا الليفية المرتبطة بها ، خلايا سرطان الثدي PyVmT والكولاجين من الفئران C57BL/6J المانحة. ثم يتم تضمين الخلايا في الكولاجين وزرع في غدد الثدي الأربية من الفئران C57BL/6J الإناث. زرع خلايا أورام PyVmT وحده شكل واضح آخر أيام 30-40 الزرع. تحليل نقطة النهاية في 60 يوما يشير إلى أن التعاون مع زرع الخلايا الليفية الثدي يعزز نمو الورم مقارنة مع الخلايا المزروعة PyVmT وحدها. بينما تم استخدام خلايا من الفئران ومصفوفة C57BL/6J في هذه الدراسات ، يمكن تطبيق عزل الخلايا ونهج المصفوفة وزرع نحو الفئران من خلفيات وراثية مختلفة يتظاهرون براعة. باختصار ، يمكن استخدام هذا النظام لتحقيق التفاعلات الجزيئية بين خلايا انسجة والخلايا الظهارية ، ويتغلب على القيود الحرجة في نماذج الماوس المناعة.
Protocol
1. العزلة واستخراج الكولاجين المانحة من الفئران C57BL/6J
- التضحية العادية الإناث الناضجة C57BL/6J الفئران باستخدام طرق IACUC المعتمدة.
- حصاد ذيول ونقع في الإيثانول 70 ٪ لمدة 45 دقائق لتعقيم الأنسجة. ذيول الجافة مع المناديل الورقية ، والتفاف في رقائق الألومنيوم. تخزين ذيول -20 درجة مئوية في حين الحاجة.
- مكان ذيول في بيئة معقمة مثل غطاء تدفق الصفحي. باستخدام مقص ، وتقسيم الجلد في جذر الذيل وقشر بعيدا عن الذيل. إزالة 0،5-1 سم من طرفي الانقسام الذيل والذيل المتبقية إلى ثلاث أو أربع قطع. تشريح الأوتار من ذيول وفصل الأوتار إلى ألياف الفردية باستخدام مشرط أو شفرة الحلاقة.
- نقل ألياف وتر إلى حاوية معقمة ويغسل بالماء المقطر العقيمة. نقل الأوتار من ذيل الفئران 5-7 لأنبوب مخروطي 50 مل تحتوي على 35 مل العقيمة غير المتأينة المياه التي تحتوي على 50 وحدة / مل البنسلين البنسلين ، 50 ميكروغرام / مل و 250 الستربتوميسين نانوغرام / مل الأمفوتريسين و0.034 N حامض الخليك المخفف من حل المخزون من حامض الخليك الجليدي (17 N). مكان على مغني الروك في 4 درجات مئوية لمدة اسبوع لاستخراج الكولاجين.
- تدور أسفل الحطام في جهاز للطرد المركزي في أعلى الجدول ز 3000 لمدة 15 دقيقة. نقل طاف ، حوالي 30 ملل لأنابيب البولي two تكييفها لالدوار بيكمان تي 50.2 وتدور 35000 ز (حوالي 17000 دورة في الدقيقة) لمدة 1 ساعة.
- فإن حجم طاف حاجة لتقليله لتحقيق تركيز 1-2 ملغ / مل. طاف نقل إلى وحدة الترشيح ultracel ك 50 Amicon وتدور أجهزة الطرد المركزي في أعلى الجدول في 3000 دورة في الدقيقة لمدة 15 على 4 درجات مئوية. نقل إلى أنبوب راشح المخروطية معقمة وحفظه. كرر الطرد المركزي حتى يتم تقليل حجم ل5-6 مل.
- قراءة تركيز البروتين. نستخدم معيار برادفورد مقايسة (Biorad) ، وذلك باستخدام معايير BSA (Biorad) والعينات غير مخفف. قياس عينة من الرشاحة الخاص ، باعتباره الشاهد السلبي.
- الاختيار لمزيد من النقاء عن طريق حل لاستخراج عينة من تنقية الكولاجين على 6 ٪ هلام بولي أكريلاميد SDS ، 10 مسارب ، و 1.5 ملم سمك هلام. إعداد 20 ميكروغرام من العينة في 30 العازلة 1X ميكرولتر تحميل SDS - PAGE تحتوي على 63 ملي الجلسرين تريس حمض الهيدروكلوريك 10 ٪ و 2 ٪ SDS الزرقاء bromophenol 0.0025 ٪ في 1.5 مل من أنابيب إيبندورف. يعد مبلغا يعادل البروتين من نوع الكولاجين ذيل فأر أنا كعنصر تحكم إيجابية. بالإضافة إلى ذلك ، إعداد مجموعة من المعايير في جيش صرب البوسنة 2،5 ، 10 ، 5 ، 20 ميكروغرام مخففة في برنامج تلفزيوني و1X العازلة التحميل. تغلي العينات في درجة حرارة 95 درجة مئوية لمدة 5 دقائق.
- السماح للعينات بارد وmicrofuge لفترة وجيزة (السرعة القصوى لمدة 10 ثانية) لتدور باستمرار التكثيف.
- تحميل عينات من العينات مع علامة الوزن الجزيئي. على سبيل المثال ، تحميل 5 ميكرولتر من Biorad المشكال القياسية البروتين. Electrophorese عند 150 فولت لحوالي 1 ساعة أو حتى الجبهة صبغ يصل إلى القاع.
- إزالة وصمة عار في الجل الأزرق coomassie العازلة. يعد هذا المخزن المؤقت عن طريق خلط 2 غرام من coomassie الزرقاء ، و 75 مل من حامض الخليك الجليدي ، 500 مل ايثانول في إجمالي حجم 1000 مل تحتوي على غير المتأينة المياه. أيضا بإعداد نفس الكمية من المخزن يزيل اللون باستخدام وصفة باستثناء دون كاشف coomassie الزرقاء. تغطية الجل مع حجم كاف للأزرق coomassie والمكان على الكرسي الهزاز.
- صخرة بلطف لمدة 1 ساعة على RT وصب وصمة عار. استبدال حل يزيل اللون الأزرق عندما يتحول الظلام. اعتقال الجل بين عشية وضحاها أو حتى يتم حل العصابات الفردية على هلام. تحديد نطاقات الكولاجين اثنين (الأوزان الجزيئية = 90 كيلو دالتون وكيلو دالتون 130) ثم لاحظ قوة عصابات ضد المعايير والضوابط. صورة هلام باستخدام نظام ثيقة هلام ، إذا لزم الأمر.
2. العزلة وثقافة خلايا سرطان الثدي المانحة والليفية من الفئران العادية وC57BL/6J PyVmT
- سن التضحية أنثى الفئران المعدلة وراثيا المتطابقة العادي أو PyVmT بعد 10 أسبوعا من العمر عندما الأورام واضحة وملموسة في الفئران المعدلة وراثيا باستخدام أساليب PyVmT IACUC المعتمدة.
- كشف الماوس على ظهرها على سطح مستو وشل أطرافه باستخدام شريط لاصق.
- جعل رأسا على عقب شق تي بين الحلمتين من الغدة الثديية الصدر والاربية وسحب الغطاء الخلفي لفضح الجلد والغدد الثديية. إزالة أنسجة الثدي واللحم المفروم الى قطع صغيرة باستخدام مقص جراحي.
- تحضير 100 مل من الكوكتيل الهضم الأنزيمية التي تحتوي على : 200 ملغ التربسين ، 500 ملغ كولاجيناز ، 4 ملغ الدناز ، 100،000 وحدة في برنامج تلفزيوني العقيمة هيالورونيداز والمضادات الحيوية بين عشية وضحاها على الجليد ومن ثم لمدة 3 ساعات في 37 درجة مئوية.
- إضافة 10 مل من برنامج تلفزيوني يحتوي على 10 ٪ مصل بقري جنيني (FBS) لكل عينة وأجهزة الطرد المركزي بيليه خلية في جهاز للطرد المركزي طاولة عند 1500 دورة في الدقيقة لمدة 5 دقائق في 4 درجات مئوية.
- نضح بلطف وطاف بيليه resuspend في خلية في مل 5-7 من FBS PBS/10 ٪. تكرار القصص ويغسل مرتين أخريين.
- Resuspend الكرية خلية في 10 مل من DMEM FB تحتوي على 10 ٪S يحتوي على 50 وحدة / مل البنسلين ، 50 ميكروغرام / مل الستربتوميسين و 250 نانوغرام / مل الأمفوتريسين على أطباق 10 سم مغلفة أولا نوع الكولاجين لوحات معطف مع الكولاجين ، وإضعاف الكولاجين 1 مل (باستخدام المخزون 1.5 ملغ / مل) في 39 0.02 مل من حمض الخليك المخفف N في ماء مقطر معقم أو برنامج تلفزيوني. الماصة 5 مليليتر من الكولاجين تعمل على حل لوحات 10 سم. يحضن في درجة حرارة الغرفة لمدة لا تقل عن 10 دقائق. نضح الكولاجين الزائد. لوحات Parafilm غير المستخدمة وتخزينها في 4 درجات مئوية لمدة أسبوع.
- تغيير وسائل الإعلام 2 -- 3 مرات في الأسبوع. سيتميز الهضم ناجحة للأنسجة وجود بؤر الظهارية محاطة خلايا مغزلية الشكل ليفية.
- فصل الخلايا الليفية والخلايا الظهارية التي tryspinization انتقائية. نضح في وسائل الاعلام وغسل الخلايا مع برنامج تلفزيوني واحد. الماصة 1 مل من 0.25 ٪ trypsin/0.54 ملي EDTA على الخلايا ويحضن في درجة حرارة الغرفة. الخلايا الليفية هي أكثر تمسكا فضفاضة من الخلايا الظهارية. تحقق من وجود مفرزة الليفية تحت المجهر بعد 2 دقيقة ، وينبغي أن الخلايا تطفو في تعليق أو جمعوا في حين لا يزال ينبغي التقيد بؤر الظهاري إلى السطح.
- بخفة الطبق لتخفيف الليفية وبلطف الماصة 10 مليليتر من الدم يحتوي على المتوسط في الطبق لإزالة الخلايا الليفية.
- الماصة الليفية التي تحتوي على وسائل الإعلام في أنبوب مخروطي 15 مل وأجهزة الطرد المركزي كما هو موضح في الخطوة 5). Replate هذه الخلايا المغلفة على الكولاجين أطباق 10 سم وتكرار هذه العملية الانتقائية trypsinization حتى يتم فصلها تماما الخلايا الليفية والخلايا الظهارية.
- التحقق من نقاء خلية تلوين المناعي للعلامات الظهارية مثل CK14 CK18 وعلامات والليفية مثل العضلات ألفا أكتين السلس (α - SMA).
3. المناعي تلون الخلايا المستزرعة
- coverslips مكان الزجاج في أطباق 6 سم. تعقيم بواسطة أشعة الشمس فوق البنفسجية لمدة 5 إلى 10 دقائق في تدفق الصفحي هود.
- معطف ساترة مع مل 1-2 العمل الأسهم حل الكولاجين لمدة 10 دقائق في درجة حرارة الغرفة (RT). نضح الزائد.
- ويعرض للتريبسين وحة 200000 الليفية أو الخلايا الظهارية في العينة. إضافة 3-5 مل من وسائل الإعلام الكامل واحتضان لمدة 24 ساعة.
- نضح في وسائل الإعلام ، وغسل الخلايا مع برنامج تلفزيوني والإصلاح في الميثانول في الجليد الباردة -20 درجة مئوية لمدة 7 دقائق.
- غسل الخلايا مع برنامج تلفزيوني مرتين لإزالة الإيثانول ، وكتلة مع 1-2 مل من برنامج تلفزيوني يحتوي على 1 ٪ FBS لمدة 1 ساعة على RT.
- باستخدام ملقط ، إزالة coverslips ووضعه في وعاء كبير ضحلة مغطاة parafilm أو غيرها من سطح مسعور.
- يخفف من الأجسام المضادة الأولية التالية 1:100 في عرقلة الحل : مكافحة السلس أكتين العضلات (α - SMA ، ومكافحة CK14 (علامة الظهارية القاعدية) ، ومكافحة CK18 (علامة الظهارية اللمعية).
- الماصة 100 ميكرولتر من الأضداد مباشرة على coverslips لمدة 1 ساعة على RT. احتضان ساترة منفصلة من الخلايا في عرقلة الحل ، وهذا سيكون بمثابة نموذج لسيطرة الجسم المضاد الثانوي.
- نضح الأضداد والماصة 1 مل من برنامج تلفزيوني مباشر على ساترة لغسل. نضح وكرر 3-5 مرات.
- تمييع الأضداد التالية الثانوية في عرقلة الحل : مكافحة الفأر اليكسا 488 في 1:100 ، ومكافحة فأر biotinylated في 1 : 500 ، ومكافحة الفأر اليكسا - 568.
- التفاف الحاوية مع coverslips في رقائق الألومنيوم. الماصة 100 ميكرولتر من الأجسام المضادة الثانوية المناسبة مباشرة على coverslips : α - SMA مع مكافحة الفأر اليكسا 568 ، CK 14 تلطيخ مع الماوس مكافحة biotinylated وCK18 مع مكافحة الفأر اليكسا 488. تغطية الحاويات لحماية عينات من الضوء المرئي.
- نضح الأضداد وتغسل مع برنامج تلفزيوني كما في الخطوة 9). ترك العينات في برنامج تلفزيوني ، باستثناء CK14 تلطيخ.
- تمييع streptavidin مترافق إلى 1:500 568 الكسا في برنامج تلفزيوني. احتضان العينات CK14 ملطخة strepatividin اليكسا - 568 لمدة 30 دقيقة في RT في الظلام. يغسل في برنامج تلفزيوني كما في الخطوة 9)
- تمييع دابي 1 : 500 في برنامج تلفزيوني. نضح في برنامج تلفزيوني من العينات واحتضان مع دابي لمدة 10 دقائق RT في الظلام.
- شطف عينات مع برنامج تلفزيوني. الماصة 100 ميكرولتر من إطالة مكافحة تتلاشى كاشف على الشرائح الزجاجية ، وتحويل ساترة أكثر من ذلك أن الخلايا هي التي تواجه شريحة زجاجية. إمالة ساترة لإحدى الزوايا لجعل بلطف الاتصال مع وسائل الإعلام في تصاعد مستمر.
- صورة العينات باستخدام مجهر المناعي. الحفاظ على عينات في الظلام لحماية إشارة المناعي ، والتي سوف تستمر حوالي 2 أسابيع.
4. إعداد خلايا الكولاجين جزءا لا يتجزأ من لتطعيمها
- لتضمين الخلايا في الكولاجين ، فمن الضروري لخفض درجة الحموضة من الكولاجين لتحقيق البلمرة عن طريق خلط الكولاجين مع حل الإعداد. إعداد وضع حل عن طريق خلط 100 مل من محلول الملح وايرل 10X المتوازن (EBSS) مع 2،45 غرام من NaHCO3 و 7.5 مل من هيدروكسيد الصوديوم 1 م و 42.5 مل من الماء المقطر العقيمة. كذلك تعقيم باستخدام زجاجة وحدة كبار 0،22 ميكرون تصفية يعلق على زجاجة معقمة. <لى> مزيج من الكولاجين (تركيز المخزون 1 ملغ / مل) مع وضع الحل في البداية 4 : 1 النسبة. الكسب غير المشروع لأحد ، ومزيج من الكولاجين 100 ميكرولتر مع 25 ميكرولتر من الحل في وضع أنبوب إيبندورف. دوامة لفترة وجيزة أو الماصة العينة صعودا وهبوطا لخلط العينة بدقة.
- إضافة الكولاجين أو حل الإعداد في زيادات ميكرولتر 50-10 ومزيج دقيق حتى صبغ أحمر الفينول في التغييرات الخليط إلى الضوء الوردي الى اللون البرتقالي ، والتي تعكس درجة الحموضة محايد. واللون الأصفر يدل على درجة الحموضة الحمضية بينما الوردي الداكن يعكس الرقم الهيدروجيني الأساسية. الحفاظ على الخليط على الجليد لمنع البلمرة.
- إزالة الخلايا الليفية والخلايا الظهارية من قبل لوحة trypsinization. أولا ، نضح في وسائل الإعلام ، ويغسل مع 5 مل من برنامج تلفزيوني. الماصة 1 مل من 0.25 ٪ في trypsin/0.54 ملي HBSS EDTA لكل لوحة. احتضان الليفية في لRT 2-5 دقائق. احتضان الخلايا الظهارية في 37oC ل2-6 دقائق. اضغط على لوحات بلطف لتخفيف الخلايا. تحقق من وجود مفرزة باستخدام microscope.Quench والتربسين التي pipetting 9 مل من المتوسط على لوحة كاملة ونقل الخلايا إلى أنبوب 15 مل العقيمة المخروطية.
- إزالة 50 المجاهدين وعدد الخلايا التي عدادة الكريات. علما أن إجمالي حجم الخلايا في كل أنبوب (حوالي 10 مل).
- بيليه الخلايا في 1500 دورة في الدقيقة لمدة 5 دقائق على RT. نضح في الخلية وبيليه resuspend الخلايا إلى تركيز ميكرولتر cells/100 100000. على سبيل المثال ، resuspend 500000 الخلايا في الحجم الإجمالي من 500 ميكرولتر من وسائل الإعلام كاملة.
- 250000 خليط الخلايا اللحمية (250 ميكرولتر) و 100،000 الخلايا السرطانية (100 ميكرولتر) في أنبوب منفصل. 1000 دورة في الدقيقة Microfuge 10 ثانية ، عن طريق إزالة طاف pipetting. إضافة 50 ميكروليتر من الحل الكولاجين تعديلها إلى الخلايا. الماصة صعودا وهبوطا لتفريق الخلايا بالتساوي. الماصة للميكرولتر 50 في 6 سم العقيمة لوحة زراعة الأنسجة لتشكيل قطرة دائرية. احتضان الكسب غير المشروع بلغت 37 درجة مئوية لمدة 10 دقيقة لتبلمر.
- إضافة بلطف 5 مليليتر من وسائل الإعلام في لوحة كاملة عن طريق لوحة إمالة بزاوية وpipetting ببطء وسائل الإعلام من جانب واحد من لوحة. إمالة لوحة حولها حتى وسائل الإعلام تغطي الكسب غير المشروع.
- احتضان لمدة 24 ساعة عند 37 درجة مئوية. زرع فورا.
5. طب العيون زرع خلايا الكولاجين جزءا لا يتجزأ من الفئران C57BL/6J
- افتعال قضيب زجاج رقيقة لجراحة زرع الأعضاء. تسخين الزجاج باستخدام الماصة باستور ناسخ بنسن. باستخدام الملقط ، وتمتد من نهاية الماصة إلى 2-3 مم في السماكة. السماح لتبرد ، وتعقيم بواسطة الايثانول 70 ٪.
- تعقيم الأدوات الجراحية التالية قبل التعقيم والايثانول 70 ٪ : الجرح مقص الجراحية الدقيقة ، مقص جراحي حادة ، ملقط حادة ، ملقط رقيقة ، ومقاطع الجرح ، التيلة
- تخدير باستخدام الماوس مع 2-3 ٪ isoflurane باستخدام آلة isoflurane نظافتها. متوسط معدل التدفق 2 O المستخدمة هي 1 لتر / دقيقة عن طريق مخروط الأنف.
- وضع الفأرة على ظهرها وشل أطرافه بشريط لاصق أو أخرى قابلة للإزالة. إزالة الشعر مع مزيل الشعر الكيميائية مثل ناير. تعقيم البطن مع القطن ينظف الايثانول كبديل بين 70 ٪ و betadine بطريقة تشبه الهدف.
- تصمد جزء من الجلد من الغدة الثديية باستخدام الملقط صريحة مع يد واحدة. مع من ناحية أخرى ، وذلك باستخدام مقص جراحي صريحة لجعل رأسا على عقب شق - T الحلمات بين 9 و # # 10 أو # # 4 و 5 من حلمات الثدي والغدد الأربية لفضح الغدد الثديية.
- جعل شق الجيب تحت العقدة الليمفاوية أو الشريان الثديي مع مقص صغير الربيع الجراحي.
- إزالة الفساد الكولاجين من الأنسجة صحن الثقافة باستخدام ملقط. إزالة السوائل الزائدة من الكسب غير المشروع عن طريق اللمس الكولاجين بلطف على معقمة يمسح الشريحة والكسب غير المشروع الكولاجين تماما في جيب باستخدام قضيب زجاج رقيق.
- خياطة رفرف الجلد باستخدام خيوط # 2 الأمعاء امتصاص المواد الغذائية أو الجرح.
- السماح لاسترداد الماوس في القفص.
- رصد الفئران مرتين أسبوعيا كحد أدنى ، لتحسس الأورام. التضحية عند الفئران بأورام يصل إلى 1 سم في القطر. حصاد الأنسجة لتحليلها.
6. ممثل النتائج :
عزل واستخلاص مادة الكولاجين من الفئران C57BL/6J
تم تكييف هذه الإجراءات من 1. استخراج البروتين الكولاجين من ذيول الماوس 5-7 غلة حوالي 1-1،5 ملغ / مل في الحجم النهائي 6 لتر ، أو 6-9 ملغ من البروتين. coommassie التي يتم الكشف عنها وصمة عار ، والعصابات الموافق 90 كيلو دالتون و130 كيلو دالتون في الممرات محملة العينات المستخرجة من ذيول الفأرة ، مما يشير إلى وجود نوع من الكولاجين الكولاجين وأنا مؤيدة للالتوالي (الشكل 1).
العزلة وثقافة خلايا سرطان الثدي والخلايا الليفية من الفئران العادية وC57BL/6J PyVmT.
تم تكييف الإجراءات من 2. ويمكن التمييز بين الخلايا السرطانية والخلايا الليفية PyVmT الاختلافات في خلية التشكل والتعبير محددة مارس الظهارية والوسيطةاستعادة الطاقة الحركية. ويتم تحديد خلايا سرطان PyVmT بواسطة شكل وشارك في التعبير عن الحصوه ، CK18 ، علامة اللمعية الظهارية وCK14 ، علامة الظهارية القاعدية ، ولكن ليس عن α - SMA (الشكل 2). الخلايا الليفية هي أكبر الخلايا الثديية مع النمط الظاهري مغزل الشكل والتعبير عن مستويات عالية من SMA - α لكن لا تعبر عن CK14 أو CK 18 (الشكل 2). هذه البيانات تشير إلى أكثر من 95 ٪ النقاء الخلية الليفية والخلايا الطلائية باستخدام الإجراءات المذكورة.
طب العيون زرع خلايا الكولاجين جزءا لا يتجزأ من الفئران C57BL/6J
تم تكييف هذه الإجراءات في الفترة من 3 ، 4. وضحى زرع عند الفئران بأورام المتلقي في أي من المجموعتين التجريبية تصل 1.0 سم في القطر ، أو ما يقرب من 60 يوما. في حين زرع خلايا PyVmT وحدها نتائج ملموسة في الأورام بعد 3-40 أيام ، وبلغ متوسط الكتلة ورم من 0.335 غرام في 60 يوما ، وشارك في زرع خلايا سرطان الخلايا الليفية PyVmT مع نتائج الثديية في كتلة الورم يعني من 0.630 غرام ، مشيرا إلى تعزيز نمو الورم عن طريق الخلايا الليفية (الشكل 3).
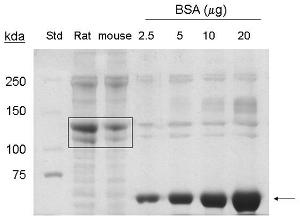
الشكل 1. يشار Coomassie تحليل وصمة عار من نوع الكولاجين أنا الاستخراج من ذيول الماوس. BSA (~ 66 كيلو دالتون) من الأسهم. يشار التجارية الكولاجين ذيل فأر (20 ميكروغرام البروتين) ، وتنقية الكولاجين ذيل الفأر (20 ميكروغرام البروتين) بواسطة مربع (~ 130 كيلو دالتون ، ~ 90 كيلو دالتون البروتينات). STD = معيار الوزن الجزيئي.
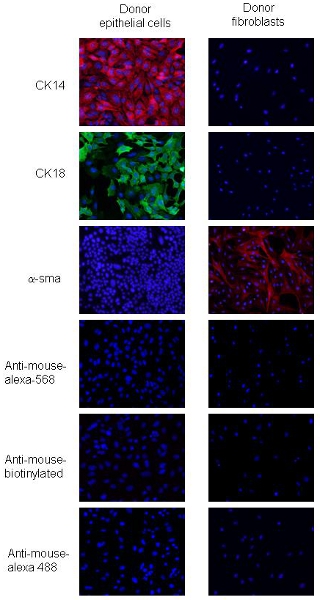
الشكل 2. تلوين المناعي للخلايا سرطان الثدي PyVmT المانحة والليفية. immunostained أ و ب لوحات تمثل خلايا سرطان الثدي PyVmT عن الأجسام المضادة لCK14 CK18 و. ج لوحة تمثل الليفية ملطخة الأجسام المضادة لSMA - α. الصور المبينة مع تراكب في دابي 20X التكبير.
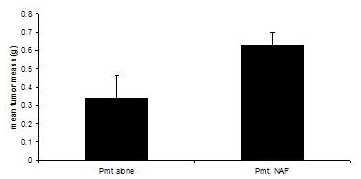
الشكل 3. وكان حصاد التنمية ورم الثدي في الفئران C57BL/6J في وجود أو عدم وجود الخلايا الليفية. الأورام الثديية من الفئران بخلايا سرطان زرع PyVmT في وجود أو عدم وجود الخلايا الليفية الثديية وزنه. + يعني الخطأ المعياري للمتوسط. N = 6 لكل مجموعة.
Discussion
وقد تجلى مساهمة الفنية الليفية في تطور الورم من خلال نماذج لزراعة الأعضاء ، والذي يرتبط سرطان الخلايا الليفية شارك في زرع الثدي حميدة مع النتائج الخلايا الظهارية في زيادة نمو الورم والغازية 5. وقد شملت زرع النهج التقليدي استخدام الفئران SCID عارية أو أن تشارك في ?...
Disclosures
حيوانات التجارب :
وقد أجريت تجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها لجنة IACUC في جامعة كنساس المركز الطبي.
Acknowledgements
وقد تم تمويل هذا المشروع من خلال منحة من قبل عدد المعاهد الوطنية للصحة / NCI R00 CA127357 ومركز جامعة كانساس الهبات السرطان.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| الفئران C57BL/6N | هارلان | N / A | |
| MMTV - PyVmT الفئران المعدلة وراثيا | جاكسون المختبرات | 002374 | |
| المصل البقري الجنين | الصياد | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| البنسلين / الستربتوميسين | الصياد | MT - 30-001 | |
| أمفوتيريسين | الصياد | BP2645 - 20 | |
| Amicon الترشيح الأعمدة ultracel 50K | ميليبور | UFC905008 | |
| أنابيب لبيكمان TI الدوار | بيكمان | 355618 | |
| ذيل فأر الكولاجين | الصياد | CB 40236 | |
| 10X EBSS | سيغما الدريتش | E7510 - 100ML | |
| التربسين 1X ، 0.25 ٪ في الكالسيوم ث / س HBSS والمغنيسيوم | الصياد | MT - 25 - 050 - CI | |
| الجليدية حمض الخليك | الصياد | A491 - 212 | |
| Coomasie الزرقاء | الصياد | BP101 25 | |
| التربسين | سيغما الدريتش | T3924 - 100ML | |
| كولاجيناز A | سيغما AldrichC0130 - 50 | ||
| hyalronidase | سيغما الدريتش | H3884 | |
| الدناز | سيغما الدريتش | D5025 | |
| مشكال البروتين القياسية | Biorad | 1610375 | |
| الشرائح الزجاجية | الصياد | 12545-78 | |
| الزجاج coverslips | VWR | 101400-042 | |
| Vimentin الضد S - 20 | سانتا كروز التكنولوجيا الحيوية | SC - 7558 | |
| α - السلس الضد عضلة أكتين | Abcam | ab5694 | |
| CK14 الأضداد | سانتا كروز التكنولوجيا الحيوية | SC - 53253 | |
| CK18 الأضداد | Abcam | ab668 | |
| دابي | سيغما الدريتش | D9542 | |
| مكافحة فأر biotinylated | ناقلات المختبرات | BA9200 | توزع من خلال فيشر |
| مكافحة الفأر اليكسا - 568 | Invitrogen | A10037 | |
| مكافحة الفأر اليكسا - 488 | Invitrogen | A11001 | |
| Streptavidin اليكسا - 488 - | Invitrogen | S11226 | |
| دابي | Invitrogen | D21490 | |
| إطالة antifade | Invitrogen | P - 36930 | |
| مقص جراحي | أدوات العلوم غرامة | 91400-12 | |
| مقص الربيع الجميلة | أدوات العلوم غرامة | 15000-02 | |
| كليلة ملقط | أدوات العلوم غرامة | 11002-12 | |
| # 5 ملقط غرامة | أدوات العلوم غرامة | 11251-10 | |
| خياطة الوتر الكروميك | الصياد | NC9326254 | |
| الزجاج باستور الماصة | الصياد | 22-042-815 | |
| الإيثانول | الصياد | A406P 4 | |
| betadine | الصياد | NC9386574 | |
| مقاطع الجرح | الصياد | 12032-07 | |
| الجرح التيلة | الصياد | 12031-07 |
References
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved