Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Молочные трансплантации стромальных клеток и клетки карциномы у мышей C57BL/6J
В этой статье
Резюме
В этом докладе, мы демонстрируем системы, чтобы изолировать и культуры донорских клеток от мышей молочной железы, и orthotopically трансплантации этих клеток мышам-получателей, чтобы проанализировать стромальных: эпителиальных взаимодействий в молочных развития опухоли.
Аннотация
Влиянием стромальных клеток, включая фибробласты на молочные прогрессии опухоли были хорошо документированы с помощью мыши моделей, в частности, путем трансплантации стромальных клеток и клеток эпителия молочной железы мышей. Современные модели трансплантации часто связаны с использованием иммунитетом мышей из-за различных генетических особенностей, характерных для клетки стромы и эпителиальных клеток. Внеклеточной матрицы часто используется для внедрения двух различных типов клеток для последовательного межклеточных взаимодействий, но связаны с использованием Матригель или крысы хвост коллагена, которые иммуногенных субстратов. Отсутствие функциональной Т-клеток от мышей иммунитетом предотвращает точную оценку стромальных клеток опухоли молочной железы на прогрессию в живом организме, что имеет важные последствия на развитие и эффективность лекарств. Более того, ослабленным иммунитетом мышей являются дорогостоящими, трудно породы и требуют особых условий ухода. Чтобы преодолеть эти препятствия, мы разработали подход к orthotopically трансплантации стромальных клеток и эпителиальных клеток мышам с того же генетического фона, чтобы вызвать последовательное формирование опухоли. Эта система включает в себя уборка нормальная, рак связаны фибробластов, PyVmT клетки молочной железы рак и коллаген-доноров мышам C57BL/6J. Затем клетки встроенных в коллагене и пересадить в паховых молочных желез самок мышей C57BL/6J. Трансплантация PyVmT клетки только форма ощутимой опухоли 30-40 дней после пересадки. Endpoint анализ на 60 дней показывает, что совместное трансплантации фибробластов усиливает рост опухоли молочной сравнению с PyVmT клетки трансплантировали в одиночку. Хотя клетки и матрицы от мышей C57BL/6J были использованы в этих исследованиях, изоляции клеток и матричных и трансплантации подход может быть применен к мышей от различных генетических фоны демонстрируя универсальность. Таким образом, эта система может быть использована для исследования молекулярных взаимодействий между клетками стромы и эпителиальных клеток, и преодолевает ограничения критических с ослабленным иммунитетом модели мыши.
протокол
1. Выделение и извлечение доноров коллагена от мышей C57BL/6J
- Жертва зрелых нормальных самок мышей C57BL/6J с использованием утвержденных IACUC методами.
- Урожай хвосты и замочить в 70% этаноле в течение 45 минут для стерилизации тканей. Сухие хвосты с папиросную бумагу, завернуть в алюминиевую фольгу. Магазин хвосты от -20 ° C до необходимости.
- Место хвосты в стерильной среде, таких как капот ламинарного потока. Использование ножницы, сплит кожу корня хвоста и очистить от хвоста. Удалить 0,5 до 1 см с обоих концов хвост и разделить оставшиеся хвост на три или четыре части. Рассекают сухожилия с хвостами и отдельные сухожилия на отдельные волокна с помощью скальпеля или лезвия бритвы.
- Передача сухожилия волокон стерильный контейнер и промыть стерильной дистиллированной водой. Трансфер из сухожилий хвоста 5-7 мышей 50 мл коническую трубку с 35 мл стерильной деионизированной воды, содержащей 50 ед / мл пенициллина пенициллина, 50 мкг / мл стрептомицина и 250 нг / мл амфотерицина, и 0,034 N разбавленной уксусной кислотой из маточный раствор ледяной уксусной кислоты (17 N). Место на рокера при 4 ° С в течение недели, чтобы извлечь коллаген.
- Спином вниз мусора в столешнице центрифуге при 3000 г в течение 15 минут. Передача супернатант, примерно 30 мл до двух поликарбонатные трубы адаптированы для Бекман 50,2 Ti ротора и спина в 35000 г (примерно 17000 оборотов в минуту) в течение 1 часа.
- Объем супернатанта должна быть уменьшена до достижения концентрации 1-2 мг / мл. Передача супернатант к ultracel 50 к Amicon блок фильтрации и спина в столешнице центрифуге при 3000 оборотов в минуту в течение 15 при 4 ° C. Передача фильтрата стерильные конические трубки и сохранить. Повторите центрифугирования пока объем уменьшается до 5-6 мл.
- Прочитано концентрации белка. Мы используем стандартные Бредфорда (Biorad), используя стандарты BSA (Biorad) и неразбавленный образцов. Мера выборки из вашего фильтрата, в качестве отрицательного контроля.
- Дальнейшая проверка чистоты добычи путем разрешения образца очищенного коллагена на 6% SDS полиакриламидном геле, 10 переулков, 1,5 мм толщины геля. Подготовка 20 мкг образца в 30 мкл 1x SDS-PAGE загрузки буфера, содержащего 63 мМ Трис-HCl 10% глицерина, 2% SDS 0,0025% бромфенолового синего в 1,5 мл пробирок Эппендорф. Подготовка эквивалентное количество белка из крысиного хвоста коллагена типа I в качестве положительного контроля. Кроме того, подготовить набор стандартов BSA в 2,5, 5, 10, 20 мкг разводят в PBS и 1X загрузки буфера. Отварите образцов при 95 ° С в течение 5 минут.
- Пусть образцы прохладно и кратко микроцентрифужную (максимальная скорость в течение 10 секунд) для замедления вращения конденсации.
- Загрузите образцы образцы наряду с маркер молекулярного веса. Например, нагрузка 5 мкл Калейдоскоп стандартных белков Biorad. Electrophorese при 150 вольт в течение приблизительно 1 часа или пока краска фронт достигнет дна.
- Удаление геля и пятна в буфере Кумасси синий. Подготовка этого буфера путем смешивания 2 г Кумасси синий, 75 мл ледяной уксусной кислоты, 500 мл этанола в общем объеме 1000 мл, содержащих де-ионизированной воды. Также приготовьте такое же количество destain буфера, используя рецепт только без реагента Кумасси синий. Обложка гель с достаточным объемом для Кумасси синий и место на рокера.
- Рок мягко в течение 1 часа при комнатной температуре и переливать пятно. Замените destain решение, когда оно становится темно-синим. Задержать гель на ночь или до отдельных полос решаются на геле. Найдите два коллагена полос (молекулярный вес = 90 кДа и 130 кДа) и обратите внимание на прочность полос от стандартов и контроля. Изображение геля с помощью системы гель документ, в случае необходимости.
2. Выделение и культуры донорских клеток молочной железы рак и фибробласты из нормальной и PyVmT мышей C57BL/6J
- Жертва соответствующей возрастной женщины нормальным или PyVmT трансгенных мышей после 10-недельного возраста, когда опухоли являются очевидными и ощутимыми в PyVmT трансгенных мышей с использованием утвержденных IACUC методами.
- Expose мыши на спине на плоской поверхности и иммобилизации конечностей использования клейкой ленты.
- Сделать с ног на голову T разрез между соски грудной и паховых молочных желез и тянуть обратно кожный лоскут, чтобы разоблачить молочных желез. Удаление молочных тканей и фарш на небольшие части, используя хирургические ножницы.
- Подготовка 100 мл ферментативного переваривания коктейль, содержащий: 200 мг трипсин, коллагеназа 500 мг, 4 мг ДНКазы, 100000 единиц гиалуронидазы в стерильном PBS и антибиотиками всю ночь на льду, а затем в течение 3 часов при температуре 37 ° C.
- Добавьте 10 мл PBS, содержащего 10% эмбриональной телячьей сыворотки (FBS) для каждого образца и центрифуги осадок клеток в столешнице центрифуге при 1500 оборотов в минуту в течение 5 минут при 4 ° C.
- Аккуратно аспирата супернатант и ресуспендируют осадок клеток в 5-7 мл PBS/10% FBS. Повторите спина и мыть два раза.
- Ресуспендируют осадок клеток в 10 мл DMEM, содержащей 10% FBS, содержащий 50 ед / мл пенициллина, 50 мкг / мл стрептомицина и 250 нг / мл амфотерицина на 10 см блюда покрыта коллагена типа I. Для пальто пластин с коллагеном, развести коллагена 1 мл (с использованием фондовых 1,5 мг / мл) на 39 мл 0,02 N уксусной кислоты растворяют в стерильной дистиллированной воде или PBS. Внесите 5 мл коллагена рабочего раствора на 10 см пластин. Инкубируйте при комнатной температуре в течение минимум 10 минут. Аспирируйте избыточного коллагена. Парафильмом неиспользованных плит и хранить при 4 ° С в течение недели.
- Изменение СМИ 2 - 3 раза в неделю. Успешное усвоение тканями будет характеризоваться наличием эпителиальных очагов окружении веретенообразную форму фибробластов клеток.
- Отдельные фибробласты и эпителиальные клетки селективным tryspinization. Аспирируйте СМИ и промыть клетки с PBS один раз. Внесите 1 мл 0,25% trypsin/0.54 мМ ЭДТА на клетки и инкубировать при комнатной температуре. Фибробласты более свободно, чем приверженец эпителиальных клеток. Проверьте фибробластов отряд под микроскопом в течение 2 минут, клетки должны быть плавающие в суспензии или окружены в то время как эпителиальные очагов все равно должны быть привязаны к поверхности.
- Слегка нажмите на блюдо, чтобы ослабить фибробластов и осторожно пипеткой 10 мл сыворотки, содержащей среды в блюдо, чтобы удалить фибробластов.
- Внесите средах, содержащих фибробласты в 15 мл коническую трубку и центрифуги, как описано в шаге 5). Replate этих клеток на коллаген покрытием 10 блюд см и повторить процесс отбора трипсинизации до фибробласты и эпителиальные клетки полностью разделены.
- Проверьте чистоту ячейки с помощью иммунофлуоресценции окрашивание на эпителиальные маркеры, такие как CK14 и CK18 и фибробластов маркеров, таких как альфа-актин гладких мышц (α-SMA).
3. Иммунофлуоресценции окрашивания культивируемых клеток
- Место стекла покровные в 6 см блюд. Стерилизовать ультрафиолетового облучения от 5 до 10 минут в ламинарном боксе.
- Пальто покровное с 1-2 мл рабочего раствора фондовом коллагена в течение 10 минут при комнатной температуре (RT). Аспирируйте избытке.
- Trypsinize и пластины 200000 эпителиальных клеток или фибробластов на образец. Добавить 3-5 мл полной среды и инкубировать в течение 24 часов.
- Аспирируйте СМИ, мыть клетки с PBS и исправить в ледяной метанола при температуре -20 ° С в течение 7 минут.
- Вымойте клеток с PBS в два раза, чтобы удалить этанол, и блок с 1-2 мл PBS, содержащего 1% FBS в течение 1 часа при комнатной температуре.
- Использование щипцов, удалите покровные и место в большой мелкий контейнер покрытый парафильмом или другой поверхности гидрофобной.
- Развести следующих первичных антител 1:100 в блокировании решения: анти-актин гладких мышц (α-SMA, анти-CK14 (базальной эпителиальной маркер), анти-CK18 (просвета эпителиальных маркеров).
- Внесите 100 мкл антител непосредственно на покровных в течение 1 часа при комнатной температуре. Инкубируйте отдельных покровное клеток в блокировании решения; этот пример будет служить в качестве вторичного контроля антител.
- Аспирируйте антител и пипетки 1 мл PBS прямо на покровное мыть. Аспирацию и повторите 3-5 раз.
- Развести следующие вторичные антитела в блокировании решения: анти-мышь-Alexa 488 в 1:100, антимышиным биотинилированного на 1: 500, анти-мышь-Alexa-568.
- Заверните контейнер с покровных в алюминиевую фольгу. Внесите 100 мкл соответствующего вторичного антитела непосредственно на покровные: α-SMA с анти-мышь-Alexa 568, CK 14 окрашивания антимышиным биотинилированного и CK18 с анти-мышь-Alexa 488. Крышка контейнера для защиты образца от видимого света.
- Аспирируйте антител и промыть PBS, как в пункте 9). Оставьте образцов в PBS, за исключением CK14 окрашивания.
- Развести стрептавидин конъюгированные с Alexa 568 1:500 в PBS. Инкубируйте CK14 окрашенных образцов с strepatividin-Alexa 568 в течение 30 минут при комнатной температуре в темноте. Стирать в PBS, как в пункте 9)
- Развести DAPI 1: 500 в PBS. Аспирируйте PBS из образцов и инкубировать с DAPI в течение 10 минут РТ в темноте.
- Промыть образцов с PBS. Внесите 100 мкл Продли анти-Fade реагента на стеклах, повернуть покровное над тем, что клетки, стоящие перед стекло. Tilt покровное к одним углом, чтобы аккуратно установить контакт с монтажа средств массовой информации.
- Изображение образцов с использованием иммунофлюоресценции микроскопом. Храните образцы в темноте, чтобы защитить иммунофлюоресценции сигнал, который продлится около 2 недель.
4. Подготовка коллагена встроенных клетки для пересадки
- Чтобы внедрить в клетки коллагена, необходимо снизить рН коллагена для достижения полимеризации путем смешивания коллагена с настройки решения. Подготовка настройка решения путем смешивания 100 мл сбалансированного солевого раствора 10X Графа (EBSS) с 2,45 г NaHCO3, 7,5 мл 1 М NaOH и 42,5 мл стерильной дистиллированной воды. Далее стерилизовать используя бутылку верхней 0,22 микрон фильтр прилагается к стерильной бутылке.
- Mix коллагена (фондовый концентрации 1 мг / мл) с установкой решение по стартовой 4: 1 отношение. С одной стороны трансплантата, смешать 100 мкл коллагена с 25 мкл установка решения в трубке Эппендорф. Кратко Vortex или пипеткой образец вверх и вниз, перемешать образец тщательно.
- Добавить коллагена или установки решения на 5-10 мкл шагом и тщательно перемешать до фенола красного красителя в смеси изменений в светло-розового до оранжевого цвета, отражающие нейтральным рН. Желтый цвет указывает на кислую рН в то время как темно-розовый, отражает основные рН. Держите смесь на лед, чтобы предотвратить полимеризацию.
- Удалить фибробласты и эпителиальные клетки пластины трипсинизации. Во-первых, аспирация СМИ и промыть 5 мл PBS. Внесите 1 мл 0,25% trypsin/0.54 мМ ЭДТА в HBSS на чашку. Инкубируйте фибробластов при комнатной температуре в течение 2-5 минут. Инкубируйте эпителиальных клеток при 37 ° С в течение 2-6 минут. Нажмите пластин осторожно, чтобы ослабить клеток. Проверьте отряд использованием microscope.Quench трипсина с помощью пипетки 9 мл полной среды на тарелку и передачи клеткам стерильные 15 мл коническую трубку.
- Удалить 50 мкл и считать клеток гемоцитометра. Обратите внимание, общий объем клеток в каждую пробирку (примерно 10 мл).
- Гранул клеток при 1500 оборотов в минуту в течение 5 мин при комнатной температуре. Аспирируйте осадок клеток и ресуспендируйте клетки концентрация 100000 cells/100 мкл. Например, ресуспендируют 500000 клеток в общем объеме 500 мкл полной информации.
- Смешать 250 000 стромальных клеток (250 мкл) и 100000 опухолевых клеток (100 мкл) в отдельном трубки. Микроцентрифужную 10 с 1000 оборотов в минуту, удалить супернатант с помощью пипетки. Добавить 50 мкл регулируется решением коллагена в клетках. Внесите вверх и вниз, чтобы разогнать клетки равномерно. Внесите 50 мкл в стерильные 6 см планшета для культуры ткани образуют круговой капли. Инкубируйте трансплантата при 37 ° С в течение 10 минут к полимеризации.
- Аккуратно добавить 5 мл полной среды в пластине за счет наклона пластины под углом и медленно пипетирования СМИ одной стороне пластины. Наклон пластины вокруг, пока СМИ освещают трансплантата.
- Инкубируйте в течение 24 часов при температуре 37 ° C. Пересадка сразу.
5. Ортоптическое трансплантации коллагена встроенных клеток у мышей C57BL/6J
- Изготовление тонкой стеклянной палочки для трансплантационной хирургии. Тепло пипетки Пастера стекла использованием горелки Бунзена. Использование щипцов, стрейч конца пипетки из до 2-3 мм в толщину. Дайте остыть, и стерилизовать на 70% этанола.
- Стерилизовать следующие хирургические инструменты в автоклаве и 70% этилового спирта: изобразительное хирургических ножниц, тупая хирургические ножницы, пинцеты тупой, тонкие щипцы, раны клипы, раны основных
- Анестезию мыши, используя с 2-3% изофлуран использованием изофлуран очистки машины. Средний O 2 скорость потока используется 1 л / мин через носовой обтекатель.
- Положите мыши на его спине и иммобилизации конечностей с лентой или другой съемный клей. Удалить волосы с химической удаления волос, таких как Наир. Стерилизовать живота с хлопком моечные альтернативно от 70% этанола и бетадин в целевой подобным же образом.
- Держитесь части кожи молочной железы использованием тупых щипцы с одной стороны. С другой стороны, используя тупые ножницы хирургические, чтобы с ног на голову Т-разрез между # 9 и # 10 сосков или # 4 и # 5 соски паховых молочных желез подвергать молочных желез.
- Сделать карманные разрез под лимфатических узлов или молочных артерии с небольшими хирургическими ножницами весной.
- Удалить из коллагена трансплантата блюдо культуры тканей использованием щипцов. Удалите излишки жидкости из коллагена трансплантата, аккуратно вытирая на стерильной вытереть и слайд коллагена трансплантат полностью в карман с помощью тонкой стеклянной палочки.
- Шовный кожный лоскут с помощью # 2 кишки рассасывающиеся нити или рана скоб.
- Пусть мыши восстанавливаться в клетке.
- Монитор мыши два раза в неделю, как минимум, для пальпации опухолей. Жертва мышей, когда опухоль достигает 1 см в диаметре. Урожай тканей для анализа.
6. Представитель Результаты:
Выделение и извлечение коллагена от мышей C57BL/6J
Эти процедуры были адаптированы из 1. Добыча белка коллагена от 5-7 хвостов мышей дает примерно 1-1,5 мг / мл в 6 мл конечного объема, или 6 - 9 мг белка. По coommassie пятна, полосы, соответствующие 90 кДа и 130 кДа обнаружены в переулках загружены образцы, извлеченные из хвостов мышей, что указывает на наличие коллагена типа I и про-коллагеновые соответственно (рис. 1).
Выделение и культуры клеток молочной железы рак и фибробласты из нормальной и PyVmT мышей C57BL/6J.
Процедуры были адаптированы из 2. PyVmT карциномы клеток и фибробластов можно выделить различия в морфологии клеток и экспрессии специфических эпителиальных и мезенхимальных рынковKERS. Клетки карциномы PyVmT идентифицируются по форме булыжника и со-экспресс CK18, просвета эпителиальных маркеров и CK14, базальной эпителиальной маркер, но не выразить α-SMA (рис. 2). Молочные фибробласты больше клеток с фенотипом веретенообразную форму и выразить высокие уровни α-SMA, но не выражают CK14 или CK 18 (рис. 2). Эти данные свидетельствуют о более чем 95% чистоты ячейки для фибробластов и эпителиальных клеток с использованием изложенных процедур.
Ортоптическое трансплантации коллагена встроенных клеток у мышей C57BL/6J
Эти процедуры были адаптированы из 3, 4. Трансплантация получателя мышей приносятся в жертву, когда опухоли в любой экспериментальной группы достигают 1,0 см в диаметре, или примерно 60 дней. Хотя трансплантация PyVmT клетки только приводит к ощутимой опухоли после 30 - 40 дней, достигая средней опухоли массой 0,335 грамма на 60 дней, со-трансплантация PyVmT клетки карциномы молочной с результатами фибробластов в средней опухоли массой 0,630 грамма, что указывает на повышение опухолевого роста фибробластов (рис. 3).
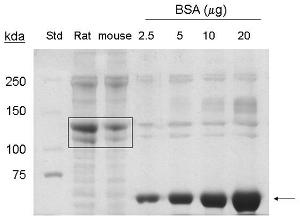
Рисунок 1. Кумасси пятно анализ коллагена типа I извлечения из мышь хвосты. BSA (~ 66 кДа) отмечен стрелкой. Коммерческая коллагена хвоста крысы (20 мкг белка), и очищенный коллаген мышь хвоста (20 мкг белка) обозначены поле (~ 130 кДа, ~ 90 кДа белков). Std = молекулярная стандартного веса.
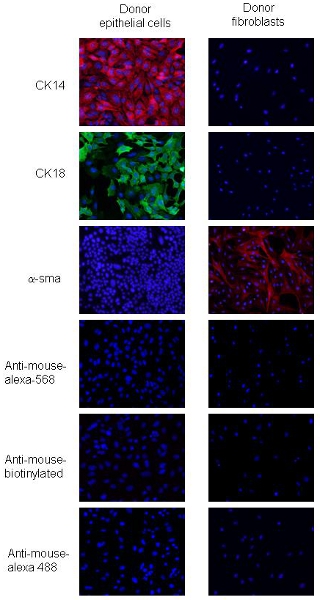
Рисунок 2. Иммунофлуоресценции окрашивание доноров PyVmT клетки молочной железы рак и фибробластов. Панели и б представляют PyVmT клетки молочной железы рак immunostained на наличие антител к CK14 и CK18. Группа с представляет фибробластов окрашивали антителами к α-SMA. Изображения отображаются с DAPI наложения на 20-кратным увеличением.
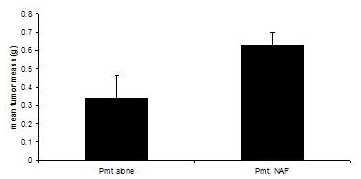
Рисунок 3. Молочные развития опухоли у мышей C57BL/6J в наличии или отсутствии фибробластов. Опухолей молочной железы были собраны от мышей, пересаженных с клетками карциномы PyVmT в наличии или отсутствии молочных фибробластов и взвешивали. Средний + стандартная ошибка среднего. N = 6 в группе.
Обсуждение
Функциональный вклад фибробластов в опухолевой прогрессии была продемонстрирована на основе моделей трансплантации, в которых рак связаны фибробластов совместно с пересаженной доброкачественные эпителиальные клетки результатов в увеличении роста опухоли и инвазивности 5. Тр...
Раскрытие информации
Эксперименты на животных:
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами, установленными IACUC комитета при Университете Канзаса медицинский центр.
Благодарности
Этот проект был профинансирован через НИЗ / NCI номер гранта R00 CA127357 и Канзасского университета онкологический центр фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| C57BL/6N мышей | Харлан | N / A | |
| MMTV-PyVmT трансгенных мышей | Джексон лабораторий | 002374 | |
| Эмбриональной телячьей сыворотки | Рыболов | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| Пенициллин / стрептомицин | Рыболов | MT-30-001 | |
| амфотерицин | рыболов | BP2645-20 | |
| Amicon фильтрации столбцов ultracel 50k | Millipore | UFC905008 | |
| Трубы для Бекман TI ротора | Бекман | 355618 | |
| Коллаген крысиного хвоста | Рыболов | CB 40236 | |
| 10x EBSS | Sigma Aldrich | E7510-100мл | |
| Трипсин 1X, 0,25% в HBSS без кальция и магния | Рыболов | МТ-25-050-CI | |
| Ледяная уксусная кислота | Рыболов | A491-212 | |
| Coomasie синий | Рыболов | BP101 25 | |
| Трипсин | Sigma Aldrich | T3924-100мл | |
| Коллагеназа | Sigma AldrichC0130-50 | ||
| hyalronidase | Sigma Aldrich | H3884 | |
| ДНКазы | Sigma Aldrich | D5025 | |
| Стандартный калейдоскоп белка | Biorad | 1610375 | |
| Стекло слайдов | Рыболов | 12545-78 | |
| Стекла покровные | VWR | 101400-042 | |
| Виментин антител S-20 | Санта-Крус биотехнологии | SC-7558 | |
| α-актин гладких мышц антител | Abcam | ab5694 | |
| CK14 антител | Санта-Крус биотехнологии | SC-53253 | |
| CK18 антител | Abcam | ab668 | |
| DAPI | Sigma Aldrich | D9542 | |
| Анти-мышь биотинилированного | Векторные лабораторий | BA9200 | Распределенные по Фишеру |
| Анти-мышь-Alexa-568 | Invitrogen | A10037 | |
| Анти-мышь-Alexa-488 | Invitrogen | A11001 | |
| Стрептавидин-Alexa-488 | Invitrogen | S11226 | |
| DAPI | Invitrogen | D21490 | |
| Продлите antifade | Invitrogen | P-36930 | |
| Хирургические ножницы | Инструменты изобразительных наук | 91400-12 | |
| Изобразительное ножницы весны | Инструменты изобразительных наук | 15000-02 | |
| Блант щипцы | Инструменты изобразительных наук | 11002-12 | |
| # 5 тонких щипцов | Инструменты изобразительных наук | 11251-10 | |
| Шовный Gut хромовой | Рыболов | NC9326254 | |
| Стекло Пастера пипетки | Рыболов | 22-042-815 | |
| Этанол | Рыболов | A406P 4 | |
| бетадин | рыболов | NC9386574 | |
| Рана клипы | Рыболов | 12032-07 | |
| Рана основных | Рыболов | 12031-07 |
Ссылки
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены