需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
C57BL/6J小鼠乳腺间质细胞和癌细胞的移植
摘要
在这份报告中,我们展示了一个系统,以隔离和文化的供体细胞,从小鼠乳腺和原位移植受体小鼠,这些细胞分析基质上皮细胞的相互作用:在乳腺肿瘤的发展。
摘要
基质细胞的影响,包括对乳腺肿瘤的进展的成纤维细胞已通过使用小鼠模型,特别是通过在小鼠乳腺间质细胞和上皮细胞移植。目前的移植模型往往涉及由于不同遗传背景的基质细胞和上皮细胞的免疫功能低下小鼠的使用。细胞外基质经常被用来嵌入一致的细胞 - 细胞相互作用的两种不同类型的细胞,但涉及的基质胶或鼠尾胶原蛋白,它具有免疫原性的基板使用。缺乏功能的T细胞免疫功能低下小鼠防止基质细胞在体内对乳腺肿瘤的进展进行准确的评估,对药物研发和疗效有重要的影响。此外,免疫功能低下小鼠,成本高昂,难以滋生和需要特殊照顾的条件。为了克服这些障碍,我们已经开发出一种方法原位基质细胞和上皮细胞相同的遗传背景移植到小鼠体内诱发肿瘤形成一致。该系统涉及捐助C57BL/6J小鼠收获正常,癌相关成纤维细胞,PyVmT乳腺癌细胞和胶原蛋白。胶原蛋白细胞,然后嵌入和雌性C57BL/6J小鼠腹股沟乳腺移植。单靠PyVmT细胞移植的形式30-40天可扪及肿瘤移植后。端点在60天的分析表明,与成纤维细胞联合移植相比提高了乳腺肿瘤的生长PyVmT细胞移植单独。虽然在这些研究中,C57BL/6J小鼠的细胞和基质细胞和基质隔离和移植的方法可应用于对来自不同遗传背景的小鼠表现出多功能性。综上所述,本系统可用于研究基质细胞和上皮细胞之间的分子间的相互作用,并克服在免疫功能低下小鼠模型中的关键限制。
研究方案
1。 C57BL/6J小鼠捐助胶原蛋白的分离和提取
- 牺牲成熟的正常使用批准IACUC方法雌性C57BL/6J小鼠。
- 收获的尾巴,和70%的乙醇浸泡45分钟消毒组织。干用纸巾的尾巴,在铝箔包装。存放在-20℃的尾巴,直到需要。
- 放置在无菌的环境,如层流罩尾巴。用剪刀,分裂尾根皮肤和剥离从尾部。删除从尾部两端的0.5〜1厘米,并分为三,四件,剩下的尾巴。剖析尾巴筋和分离成单纤维筋,用手术刀或刀片。
- 肌腱纤维转移到无菌的容器中,并用无菌蒸馏水冲洗。转移肌腱5-7老鼠尾巴到50毫升锥形管中含有35毫升无菌去离子水含有50单位/ ml青霉素青霉素,50微克/ ml链霉素和250纳克/毫升霉素和0.034 ñ醋酸摊薄一冰醋酸(17 N)的储备液。摇杆放置在4 ° C,一个星期中提取的胶原蛋白。
- 离心15分钟表中的3000克离心机的碎片。转移上清,约30毫升两个聚碳酸酯管在35000克(约17000 RPM)贝克曼50.2 TI转子和自旋为1小时适应。
- 上清量将达到1-2毫克/毫升的浓度需要降低。 15的上清转移到一个ultracel 50 K Amicon过滤装置和旋转表在3000转的离心机,在4 ° C。滤液传输到无菌锥形管和保存。重复离心,直到体积缩小到5-6毫升。
- 阅读的蛋白浓度。我们使用标准的Bradford法(BioRad公司),使用BSA标准(BioRad公司)和未经稀释的样品。测量样品从您的滤液,作为阴性对照。
- 进一步检查,解决了6%的SDS聚丙烯酰胺凝胶,10车道,凝胶厚度为1.5毫米的纯化胶原样本提取的纯度。准备在30μl的1X SDS - PAGE上样缓冲液含有63毫米的Tris盐酸10%甘油,2%SDS的1.5 ml Eppendorf管中的0.0025%溴酚蓝样品20微克。从鼠尾型胶原阳性对照我准备同等数额的蛋白质。此外,准备在2.5,5,10 BSA标准,在PBS和1X样缓冲液稀释20微克。煮沸的样品在95℃5分钟。
- 让凉爽的样品,并简要离心(最高速度为10秒)降速凝结。
- 随着分子量标记装入样品。例如,负载5μL万花筒BIORAD蛋白质标准。在150伏或约1小时,直到染料前端Electrophorese达到底部。
- 取出凝胶染色考马斯亮蓝缓冲区。准备2克,500毫升含有去离子水的总体积在1000毫升乙醇,75毫升的冰醋酸,考马斯蓝混合这个缓冲区。同时准备destain缓冲区的相同数额,使用除无考马斯亮蓝试剂配方。与考马斯亮蓝和地方上的摇杆盖足量的凝胶。
- 岩轻轻为1小时RT和倒出污渍。更换destain解决方案时变为深蓝色。通宵扣留的凝胶或个人的乐队,直到凝胶上解决。找到两个胶原蛋白带(分子量= 90 kDa和130 kDa的),并注意对标准和控制乐队的实力。如有必要,使用凝胶DOC系统,凝胶图像。
2。捐助乳腺癌细胞和正常和PyVmT C57BL/6J小鼠成纤维细胞的分离和培养
- 10周龄后牺牲的年龄相匹配女性正常或PyVmT转基因小鼠的肿瘤是显而易见的,在使用批准IACUC方法PyVmT的转基因小鼠的情溢于言表。
- 暴露在它的后面鼠标在一个平面上,并用胶带粘接固定四肢。
- 向下一个倒置T之间的胸部和腹股沟乳腺乳头的切口和皮瓣拉回到暴露乳腺。取出乳腺组织和剁碎成小块,用手术剪。
- 准备100毫升酶消化含鸡尾酒:4毫克DNA酶,胶原酶500毫克,200毫克胰蛋白酶,10万台,在无菌PBS透明质酸酶和抗生素一夜之间冰和3小时,然后在37 ° C。
- 添加10毫升,用含10%胎牛血清(FBS),每个样品离心细胞沉淀在5分钟1500转速表离心机4 ° C。
- 轻轻吸出上清液,重悬细胞沉淀5-7毫升PBS/10%胎牛血清。重复的自旋和洗两次。
- 在10毫升含10%的FB的DMEM重悬细胞沉淀含50个单位/ ml青霉素,50微克/ ml链霉素和250毫微克/毫升霉素涂有I型胶原蛋白与胶原蛋白外衣板10厘米菜,胶原蛋白1毫升稀释成39(使用股票1.5毫克/毫升) 0.02 N醋酸毫升在无菌蒸馏水或PBS稀释。胶原吸取5毫升到10厘米的板的解决方案。在室温下孵育至少10分钟。吸干多余的胶原蛋白。封口膜未使用的板材和储存在4 ° C为一个星期。
- 更改媒体每周2 - 3次。成功消化组织的特点将是由主轴形成纤维细胞细胞上皮灶周围存在。
- 选择性tryspinization分离成纤维细胞和上皮细胞。吸媒体,用PBS洗细胞一次。吸取1毫升的0.25%trypsin/0.54毫米EDTA将细胞和室温孵育。成纤维细胞是较为松散上皮细胞粘附。检查支队2分钟后显微镜下成纤维细胞,细胞应漂浮在暂停或四舍五入而上皮灶仍然应该坚持到表面。
- 轻轻敲击的菜,放松的成纤维细胞和轻轻吸管10毫升含药血清培养基,在菜中删除成纤维细胞。
- 吸取的媒体中含有15毫升的锥形管和第5步中描述的离心机的成纤维细胞)。到胶原蛋白涂10厘米菜Replate这些细胞,并重复直到完全分离成纤维细胞和上皮细胞的选择性胰蛋白酶消化过程。
- CK14和CK18和α-平滑肌肌动蛋白(α- SMA),如成纤维细胞的标志物,如上皮标记免疫荧光染色细胞纯度检查。
3。培养细胞的免疫荧光染色
- 将在6厘米的菜盖玻片。通过5至10分钟,在层流罩的紫外线照射消毒。
- 大衣的工作10分钟,在室温(RT)的股票胶原溶液1-2毫升的盖玻片。吸干多余的。
- Trypsinize和板材20万的上皮细胞,每个样品或成纤维细胞。添加3-5毫升的完整的媒体和孵育24小时。
- 吸媒体,用PBS洗细胞和固定冰在-20 ° C的冷甲醇为7分钟。
- 用PBS洗涤细胞两次,以1-2毫升,在室温下1小时用含1%FBS的删除,乙醇和块。
- 使用镊子,取出一个大浅盖容器内,用封口膜或其他疏水表面的盖玻片和地点。
- 淡化以下主要抗体1:100封闭液:抗平滑肌肌动蛋白(α- SMA,抗CK14(基底上皮标记),抗- CK18(管腔上皮标记)。
- 吸取100μL抗体直接到在室温下1小时盖玻片。在封闭液中孵育一个单独的细胞盖玻片,此样品将作为第二抗体控制。
- 抗体和吸管1毫升的PBS洗盖玻片直接吸。吸和重复3-5次。
- 淡化在以下封闭液的二抗:抗鼠ALEXA 488 1:100,抗鼠生物素为1:500,抗鼠的ALEXA - 568。
- 包装容器的铝箔盖玻片。吸取100μL直接的盖玻片上适当的二级抗体:抗鼠ALEXA 568,CK 14染色抗鼠生物素和抗鼠ALEXA 488 CK18的α- SMA。盖的容器,以保护样品的可见光。
- 吸抗体,并在第9步,用PBS洗)。保留的样本,在PBS CK14染色的除外。
- 共轭ALEXA 568 1:500 PBS稀释链霉。孵育strepatividin ALEXA 568 CK14染色样品在室温为30分钟,在黑暗中。 PBS冲洗,如步骤9)
- 在PBS稀释的DAPI 1:500。吸的PBS样品,并用DAPI孵育10分钟,在黑暗中的RT。
- 用PBS冲洗样品。吸取100μL延长到玻片上的防褪色试剂,转过来,让细胞所面临的载玻片盖玻片。盖玻片倾斜一个角度,轻轻地接触与安装媒体。
- 使用免疫荧光显微镜图像样本。保持在黑暗中的样本,以保护免疫荧光信号,这将持续约2周。
4。胶原蛋白的嵌入式嫁接细胞的制备
- 要嵌入的胶原蛋白细胞,它是要降低胶原蛋白的pH值,以达到混合的设置解决方案的胶原蛋白的聚合。准备混合10X伯爵的平衡盐溶液与2.45克碳酸氢钠,7.5毫升的1 M NaOH和42.5毫升无菌蒸馏水100毫升(EBSS)设置的解决方案。进一步消毒,用一个瓶子的顶部0.22微米的过滤器单元连接到一个无菌瓶。 <李>混合设置解决方案在一个起点4胶原蛋白(股票浓度为1毫克/毫升):1的比例。对于一个移植,混合设置在Eppendorf管中的解决方案与25μL100μL的胶原蛋白。涡简要或吸管样品多达上下彻底混合样品。
- 补充胶原蛋白或设置在5-10μL增量的解决方案和调匀,直到苯酚混合物中的变化到浅粉色橙色红色染料,中性PH值的反映。黄色表示酸性,而暗粉色反映了基本的pH值。保持冰的混合物,以防止聚合。
- 胰蛋白酶板卸下的成纤维细胞和上皮细胞。首先,吸媒体,并用5毫升的PBS。吸取1毫升0.25%trypsin/0.54 mM的EDTA在每盘的HBSS。在室温下孵育2-5分钟的成纤维细胞。上皮细胞在37℃孵育2-6分钟。点触板,轻轻地松开细胞。检查吹打9毫升完全培养基上盘使用microscope.Quench支队胰蛋白酶和细胞转移到无菌的15毫升锥形管。
- 删除50 UL和血球计数细胞。请注意在每管细胞的总量(约10毫升)。
- 颗粒细胞在室温下5分钟1500转。吸细胞沉淀和悬浮细胞浓度100,000 cells/100μL。例如,在一个完整的媒体的500μL总体积50万细胞重悬。
- 混合在一个单独的管25万间质细胞(250μL),100,000(100微升)肿瘤细胞。离心10秒1000转,除去上清液吹打。添加50μL调整后的胶原蛋白溶液对细胞。吸取最多和均匀分散的细胞。吸取50μL在6厘米的无菌组织培养板,形成一个圆形的下降。移植物在37℃10分钟,聚合。
- 轻轻地添加在板5 MLS完整的媒体通过倾斜板的角度,慢慢地移液板一侧的媒体。倾斜板,直到媒体覆盖嫁接。
- 24小时在37 ° C。移植立即。
5。直视C57BL/6J小鼠移植嵌入式的胶原蛋白细胞
- 编造移植手术的细玻璃棒。热巴斯德玻璃吸管,用本生灯。使用镊子,舒展吸管年底,厚度在2-3毫米。晾凉,70%的乙醇消毒。
- 以下的手术器械消毒高压灭菌和70%乙醇:精细的手术剪,手术剪刀钝,钝钳,镊子较薄,伤口剪辑,伤口主食
- 麻醉与异氟醚使用2-3%异氟醚清除机的鼠标使用。 O 2的平均流量为1升/分钟通过鼻锥。
- 莱鼠标在它的后面,并用胶带或其他可移动的胶粘剂的固定四肢。删除与化学奈尔,如头发卸妆的头发。消毒棉擦拭之间70%的乙醇和优碘的另外一个目标,喜欢时尚的腹部。
- 乳腺腺体一方面使用钝钳托起皮肤的一部分。用另一只手,用生硬的手术剪,使一个倒置下来的#9,#10乳头或#4和#5腹股沟乳腺乳头之间的T型切口暴露乳腺。
- 做一个小型手术弹簧剪刀下淋巴结或乳内动脉的口袋切口。
- 从组织文化菜用钳取出胶原移植。删除多余的液体轻轻涂抹抹,并完全采用薄玻璃棒滑入口袋里的胶原蛋白移植到无菌的胶原移植。
- 使用#2肠道吸收缝合线或伤口订书钉缝合皮瓣。
- 让鼠标在笼中恢复。
- 监测小鼠每周至少两次,对肿瘤的触诊。牺牲小鼠的肿瘤直径达到1厘米时,。丰收组织进行分析。
6。代表性的成果:
从C57BL/6J小鼠的分离和提取的胶原蛋白
这些程序进行了调整,从1。从5-7鼠标尾巴的胶原蛋白的提取产量约6毫升的最终体积的1-1.5毫克/毫升,或6 - 9毫克的蛋白质。 coommassie染色,乐队90 kDa和130 kDa的相应检测从小鼠尾巴中提取的样品装入车道,表明I型胶原和骨胶原的存在(图1)。
从正常和PyVmT C57BL/6J小鼠乳腺癌细胞和成纤维细胞的分离和培养。
2的程序进行了调整。 PyVmT肿瘤细胞和成纤维细胞,细胞形态差异和特定的上皮细胞和间质MAR的表达可以区分KERS。 PyVmT癌细胞确定由鹅卵石形状和共表达CK18,管腔上皮细胞标记和CK14,基底上皮标记,但不表达α- SMA(图2)。乳腺纤维母细胞与主轴形表型大细胞和α- SMA的表达水平高,但不表达CK14或CK 18(图2)。这些数据表明,使用概述的程序为成纤维细胞和上皮细胞的细胞纯度达95%以上。
直视C57BL/6J小鼠移植嵌入式的胶原蛋白细胞
这些程序进行了调整,从3,4。移植受体小鼠被处死时,无论是实验组的肿瘤直径达到1.0厘米,约60天。虽然移植PyVmT扪及肿瘤细胞的结果后30 - 40天,60天达到平均0.335克的肿块,结果平均0.630克的肿块乳腺成纤维细胞中的PyVmT癌细胞联合移植,表明增强肿瘤生长的成纤维细胞(图3)。
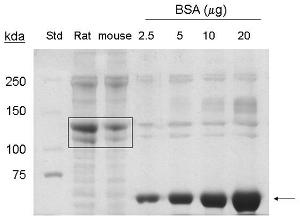
图1。考马斯染色分析,从小鼠尾巴提取I型胶原蛋白。BSA(〜66 kDa)的指示箭头。商业鼠尾胶原蛋白(20μg蛋白),以及纯化的鼠尾胶原蛋白(20μg蛋白)表示框(〜130 kDa的,〜90 kDa的蛋白)。 STD =分子量标准。
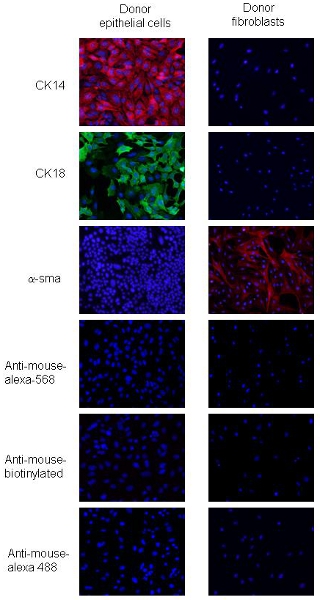
图2。捐助PyVmT乳腺癌细胞和成纤维细胞的免疫荧光染色。面板A和B代表PyVmT乳腺肿瘤细胞的免疫染色的抗体, CK14和CK18。 C组代表与α- SMA抗体染色的成纤维细胞。用DAPI覆盖在20倍放大倍率的图像显示。
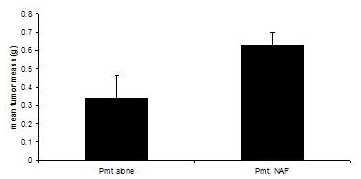
图3。 C57BL/6J小鼠成纤维细胞的存在或缺乏的乳腺肿瘤的发展 。乳腺肿瘤收获PyVmT肿瘤细胞移植在小鼠乳腺成纤维细胞的存在或缺乏和体重。平均+平均值的标准误差。 N =每组6。
讨论
功能的成纤维细胞在肿瘤进展的贡献已经证明,通过移植模型,癌相关成纤维细胞联合移植良性乳腺上皮细胞,在肿瘤的生长和增加侵袭5结果。涉及传统的移植方法有免疫缺陷或裸鼠移植合作,从不同的遗传鼠标背景或不同物种的基质和上皮细胞的使用。免疫功能低下小鼠缺乏功能性T细胞,从而起到关键作用,通过识别肿瘤特异性抗原和随后的定位,抑制肿瘤细胞转移扩散 6,?...
披露声明
动物实验:
在堪萨斯大学医学中心的IACUC委员会规定的准则和法规的规定进行了动物实验。
致谢
资助这个项目是通过NIH / NCI的授予R00 CA127357和堪萨斯大学癌症研究中心捐赠。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| C57BL/6N小鼠 | 哈伦 | N / A | |
| MMTV - PyVmT转基因小鼠 | 杰克逊实验室 | 002374 | |
| 胎牛血清 | 费舍尔 | SH3039603PR | |
| DMEM培养液 | VWR | 10000113873 | |
| 青霉素/链霉素 | 费舍尔 | MT - 30 - 001 | |
| 两性霉素 | 费舍尔 | BP2645 - 20 | |
| Amicon过滤列ultracel 50K | Millipore公司 | UFC905008 | |
| 贝克曼德州仪器转子管 | 贝克曼 | 355618 | |
| 鼠尾胶原 | 费舍尔 | CB 40236 | |
| 10X EBSS | 西格玛爱秩序 | E7510 - 100ML | |
| 胰蛋白酶1X的HBSS W / O钙和镁的0.25% | 费舍尔 | MT - 25 - 050 - CI | |
| 冰醋酸 | 费舍尔 | A491 - 212 | |
| Coomasie蓝色 | 费舍尔 | BP101 25 | |
| 胰蛋白酶 | 西格玛爱秩序 | T3924 - 100ML | |
| 胶原酶一个 | 适马AldrichC0130 - 50 | ||
| hyalronidase | 西格玛爱秩序 | H3884 | |
| DNA酶 | 西格玛爱秩序 | D5025 | |
| 万花筒蛋白标准 | BIORAD | 1610375 | |
| 载玻片 | 费舍尔 | 12545-78 | |
| 盖玻片 | VWR | 101400-042 | |
| 波形蛋白抗体的S - 20 | 圣克鲁斯生物技术 | SC - 7558 | |
| α-平滑肌肌动蛋白抗体 | Abcam公司 | ab5694 | |
| CK14抗体 | 圣克鲁斯生物技术 | SC - 53253 | |
| CK18的抗体 | Abcam公司 | ab668 | |
| DAPI | 西格玛爱秩序 | D9542 | |
| 反鼠标生物素 | 媒介实验室 | BA9200 | 分布通过费舍尔 |
| 抗鼠ALEXA - 568 | Invitrogen公司 | A10037 | |
| 抗鼠ALEXA - 488 | Invitrogen公司 | A11001 | |
| 链霉亲和ALEXA - 488 | Invitrogen公司 | S11226 | |
| DAPI | Invitrogen公司 | D21490 | |
| 延长抗淬灭 | Invitrogen公司 | P - 36930 | |
| 手术剪 | 精细科学的工具 | 91400-12 | |
| 鸟语花香,剪刀 | 精细科学的工具 | 15000-02 | |
| 钝钳 | 精细科学的工具 | 11002-12 | |
| #5细钳 | 精细科学的工具 | 11251-10 | |
| 肠道铬缝合 | 费舍尔 | NC9326254 | |
| 玻璃巴斯德吸管 | 费舍尔 | 22-042-815 | |
| 乙醇 | 费舍尔 | A406P 4 | |
| 优碘 | 费舍尔 | NC9386574 | |
| 伤口剪辑 | 费舍尔 | 12032-07 | |
| 伤口主食 | 费舍尔 | 12031-07 |
参考文献
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。