Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
C57BL/6J Fare Stromal Cells ve Karsinomu Hücreler Meme Nakli
Bu Makalede
Özet
Bu raporda, izole etmek için bir sistem ve fare meme bezi kültür donör hücreleri göstermek ve bu hücrelerin orthotopically nakli stromal analiz etmek için alıcı farelerde meme tümör gelişimi sırasında epitelyal etkileşimler.
Özet
Stromal hücreler, fibroblastlar meme tümör progresyonu dahil olmak üzere etkisi özellikle farelerde meme bezi stromal hücreleri ve epitel hücrelerinin nakli yoluyla, fare modellerinin kullanımı ile belgelenmiştir. Şu nakli modelleri genellikle stromal hücreler ve epitel hücrelerinin farklı genetik geçmişleri nedeniyle immün sistemi baskılanmış farelerde içerir. Ekstrasellüler matrisler genelde tutarlı hücre-hücre etkileşimleri için iki farklı hücre tipleri gömmek, ancak Matrigel veya sıçan kuyruğu kollajen, immunojenik substratlar kullanımı dahil etmek için kullanılır. Immünkompromize farelerden elde edilen fonksiyonel T hücre eksikliği, ilaç geliştirme ve etkinliği üzerinde önemli etkileri, in vivo tümör progresyonu meme stromal hücreler doğru bir değerlendirme önler . Ayrıca, immün sistemi baskılanmış farelere, yüksek maliyetli sabit, özel bakım koşullarında ırk ve gerektirir. Bu engelleri aşmak için, biz orthotopically tutarlı tümör oluşumuna neden aynı genetik arka plan, stromal hücre ve epitel hücreleri farelere nakli için bir yaklaşım geliştirdik. Bu sistem, donör C57BL/6J fareler, normal karsinom ilişkili fibroblastlar, PyVmT meme kanseri hücreleri ve kollajen hasat içerir. Hücreler daha sonra kolajen gömülü ve kasık, dişi C57BL/6J farelerin meme bezleri nakledilen. PyVmT hücreleri tek başına Transplantasyon palpe edilebilir tümörler 30-40 gün transplantasyon sonrası oluşturur. 60 gün Son Nokta analizi fibroblastlar ile birlikte transplantasyon yalnız nakledilen PyVmT hücreleri ile karşılaştırıldığında meme tümör büyümesini artırır gösterir. C57BL/6J farelerin hücreleri ve matriks bu çalışmalarda kullanılan iken, hücre ve matriks izolasyonu ve transplantasyonu yaklaşım çok yönlülük gösteren farklı genetik kökenden farelere karşı uygulanabilir. Özetle, bu sistem stromal hücreleri ve epitel hücreleri arasındaki moleküler etkileşimler araştırmak için kullanılan olabilir ve immün sistemi baskılanmış fare modellerinde kritik kısıtlamaların üstesinden gelmektedir.
Protokol
1. C57BL/6J fareler İzolasyon ve donör kollajen çıkarma
- Onaylanmış IACUC yöntemler kullanılarak, normal olgun kadın C57BL/6J fareler Kurban.
- Kuyrukları Hasat ve dokuları sterilize etmek için 45 dakika boyunca% 70 etanol içinde bekletin. Kuru kağıt mendil ile kuyrukları, alüminyum folyo ile sarın. -20 ° C kadar gerekli kuyrukları saklayın.
- Steril bir ortamda böyle bir laminer akış kaputu gibi kuyrukları yerleştirin. Makas kullanarak, kuyruk kökünde çatlatmaya ve soyma kuyruk uzakta. Kuyruk her iki ucunda 0,5-1 cm çıkarın ve üç ya da dört parçalar halinde kalan kuyruk bölmek. Kuyrukları tendonları inceleyin ve bir neşter veya traş bıçağı kullanarak bireysel liflerin tendonların ayrı.
- Tendon lifleri steril bir kaba aktarın ve steril distile su ile yıkayın. 5-7 farelerin kuyruk 35 ml steril de-iyonize su içeren 50 ünite / ml penisilin penisilin, 50 mikrogram / ml streptomisin ve 250 ng / ml amfoterisin ve 0,034 K ile seyreltilmiş asetik asit içeren 50 ml konik tüp Transfer tendonları buzul asetik asit (17 K) bir stok solüsyonu. Rocker yerleştirin 4 ° C 'de bir hafta boyunca kollajen ayıklayın.
- 3000 g de 15 dakika boyunca bir masa üstü santrifüj enkaz aşağı spin. Süpernatant, yaklaşık 30 ml, 1 saat süreyle 35.000 gr (yaklaşık 17.000 rpm) Beckman 50.2 Ti rotor ve spin için uyarlanmış iki polikarbonat borular aktarın.
- Süpernatantı hacmi azalır, 1-2 mg / ml 'lik bir konsantrasyon elde etmek gerekecektir. 4 ultracel 50 k Amicon filtrasyon ünitesi ve 3000 rpm'de bir masa üstü santrifüj spin süpernatantı transfer için 15 ° C Süzüntü, steril bir konik tüpe aktarın ve kaydedin. Santrifüj hacmi 5-6 ml kadar tekrarlayın.
- Protein konsantrasyonu okuyun. Biz BSA standartları (Biorad) ve sulandırılmamış örnekleri kullanarak, standart bir Bradford assay (Biorad) kullanın. Negatif kontrol olarak sizin süzüntü bir örnek ölçün.
- Ayrıca% 6 SDS-poliakrilamid jel, 10 şeritli, 1,5 mm jel kalınlığında kollajen saflaştırılmış bir örnek çözme ekstraksiyon saflık için kontrol edin. 63 mM Tris HCl% 10 gliserol,% 2 1,5 ml Eppendorf tüpleri SDS 0,0025% Bromophenol Mavi içeren 30 ul 1x SDS-PAGE yükleme tamponu 20 mg örnek hazırlayın. Sıçan kuyruğu kollajen tip bir pozitif kontrol olarak eşdeğer bir miktarda protein hazırlayın. Buna ek olarak, 2.5, 5, 10, PBS ve 1X yükleme tamponu sulandırılmış 20 mg BSA standartlarının bir dizi hazırlamak. Numuneleri 95 ° C 5 dakika kaynatın.
- Yoğuşma aşağı spin (10 saniye süreyle maksimum hızda) örnekleri serin ve kısaca mikrofuge'de edelim.
- Moleküler ağırlık belirteci ile birlikte örnekleri örnekleri yükleyin. Örneğin, 5 Kaleidoscope Biorad protein standart ul yükleyin. , Yaklaşık 1 saat için 150 volt veya boya ön kadar Electrophorese alt ulaşır.
- Jel çıkarın ve Coomassie mavi tampon leke. 2 g Coomassie mavi, 75 ml buzul asetik asit, de-iyonize su içeren toplam hacmi 1000 ml, 500 ml etanol karıştırma bu tampon hazırlayın. Ayrıca, Coomassie mavi reaktif olmadan dışında tarifi kullanarak destain tampon aynı miktarda hazırlar. Jel Coomassie mavi ve bir rocker yer için yeterli bir hacmi ile kaplayın.
- Leke RT ve süzün az 1 saat için hafifçe sallayın. Koyu maviye dönüşürken destain çözüm değiştirin. Gecede jel gözaltına aldı ya da bireysel bantları, jel giderilinceye kadar. Iki kollajen bantları (molekül ağırlığı = 90 kDa ve 130 kDa) standartları ve kontrollere karşı bantları gücü bulun ve not edin. Resim jel, jel doc sistemini kullanarak gerekirse.
2. İzolasyon ve kültür normal ve PyVmT C57BL/6J farelerden alınan donör meme kanseri hücreleri ve fibroblastlar
- Tümörler belirgin ve onaylanmış IACUC yöntemler kullanılarak PyVmT transgenik farelerin hissediliyor Kurban yaş yaşı 10 hafta sonra kadın normal veya PyVmT transgenik fareler eşleştirilir.
- Düz bir yüzey üzerinde fare Açığa sırtında ve bacaklarda yapıştırıcı bant kullanarak hareketsiz.
- Bir baş, göğüs ve kasık meme bezi meme arasında T insizyon aşağı yapın ve meme bezlerinin maruz flep geri çekin. Meme dokuları çıkarın ve cerrahi makas kullanarak küçük parçalar halinde kıyma.
- 37 ° 200 mg tripsin, 500 mg kollajenaz, 4 mg DNAz, 3 saat sonra buz üzerinde gece ve 100.000 steril PBS hiyalüronidaz birimleri ve antibiyotikler ° C: 100 ml içeren bir enzimatik sindirim kokteyl hazırlayın
- PBS, 4, 5 dakika için 1500 rpm bir masa üstü santrifüj her bir örnek ve santrifüj hücre pelletini% 10 fetal sığır serumu (FBS) içeren 10 ml ° C
- Süpernatantı yavaşça aspire PBS/10% FBS 5-7 ml hücre pelletini tekrar süspansiyon haline getirin. Spin iki kez daha tekrarlayın ve yıkayın.
- % 10 FB içeren DMEM, 10 ml hücre pelletini tekrarS 50 ünite içeren / ml penisilin, 50 mikrogram / ml streptomisin ve 250 ng / ml amfoterisin kollajen tip I kollajen ile kat plakalar ile kaplı 10 cm yemekler (stok 1.5 mg / ml), 39 içine kollajen 1 ml seyreltilmiş 0,02 N asetik asit ml steril distile su veya PBS içinde seyreltilmesi. Kollajen pipetleyin 5 ml 10 cm 'lik plakaların üzerine çözüm. Için en az 10 dakika oda sıcaklığında inkübe edin. Aşırı kollajen aspire. Parafilm kullanılmayan tabak, 4 ve mağaza ° C de bir hafta boyunca.
- Haftada 3 kez bir medya 2 değiştirin. Dokuların Başarılı sindirim iğsi fibroblastik hücreleri tarafından çevrili epitel odaklarının varlığı ile karakterize edilecektir.
- Seçici tryspinization fibroblastlar ve epitel hücreleri ayırın. Aspire medya ve PBS ile hücreler bir kez yıkayın. Pipetleyin 1 ml% 0.25 'hücreleri ve oda sıcaklığında inkübe üzerine trypsin/0.54 mM EDTA. Fibroblastlar, epitel hücreleri daha gevşek yapışık. 2 dakika sonra mikroskop altında fibroblast ayrılması için kontrol edin; hücreleri süspansiyon içinde yüzen ya da epitel odakları hala yüzeye yapışık olmalıdır yuvarlak olmalıdır.
- Fibroblastlar kaldırmak için çanak çanak serum içeren orta fibroblastlar ve hafifçe pipetlemeyin 10 ml gevşetmek için hafifçe dokunun.
- Pipetleyin 5. adımda açıklandığı gibi 15 ml konik tüp ve santrifüj fibroblastlar içeren medya). Replate kollajen kaplı 10 cm yemekleri üzerine bu hücreler ve fibroblastlar ve epitel hücreleri tamamen ayrılır kadar seçici trypsinization işlemi tekrarlayın.
- CK14, CK18 ve alfa düz kas aktin (α-SMA) olarak fibroblast işaretleri gibi epitelyal belirteçler için immünofloresan boyama hücre saflık için kontrol edin.
3. Kültür hücreleri immünofloresan boyaması
- 6 cm yemekleri cam lamelleri yerleştirin. Laminer akış kaputu, 5 ila 10 dakika süreyle UV ışınlarına maruz kalma ile sterilize edin.
- Kat 1-2 ml az 10 dakika oda sıcaklığında (RT) için stok kollajen çözüm çalışma lamel. Fazla aspire.
- Örnek başına 200.000 epitel hücreleri ve fibroblastlar Trypsinize ve plaka. 3-5 ml tam medya ekleyin ve 24 saat boyunca inkübe edin.
- Medya aspire, hücreleri PBS ile yıkama ve -20 ° C'de 7 dakika boyunca buz gibi metanol düzeltmesi.
- PBS ile iki kez 1-2 ml PBS oda sıcaklığında 1 saat süreyle% 1 FBS içeren etanol, ve blok kaldırmak için hücreleri yıkayın.
- Forseps kullanarak, parafilm veya diğer hidrofobik yüzey ile kaplı geniş bir sığ bir kapta lamelleri ve yer çıkarın.
- Anti-düz kas aktin (α-SMA, anti-CK14 (bazal epitel işaretleyici), anti-CK18 (luminal epitel işaretleyici): 1:100 engelleme çözümü aşağıdaki birincil antikorlar sulandırınız.
- Oda sıcaklığında 1 saat süreyle doğrudan lamelleri üzerine antikor pipetleyin 100 ul. Inkübe engelleme çözüm hücre ayrı bir lamel; bu örnek, sekonder antikor kontrol olarak görev yapacak.
- Yıkamak için doğrudan lamel antikor ve pipetlemeyin 1 ml PBS aspire edin. Aspire edin ve 3-5 kez tekrarlayın.
- 1:100 az anti-fare-alexa 488, 1 biotinlenmiş anti-fare:: 500, anti-fare-alexa-568 çözümü engelleme aşağıdaki sekonder antikor sulandırınız.
- Kap, alüminyum folyo lamelleri ile sarın. Pipetleyin doğrudan lamelleri uygun ikincil antikor ul: 100 anti-fare-alexa 568, anti-fare-alexa 488 ile CK 14 biotinlenmiş anti-fare boyama ve CK18 ile α-SMA. Görünür ışık örnekleri korumak için konteyner örtün.
- Aspire antikor) 9. adımı olarak PBS ile yıkayın. CK14 boyanması dışında örnekleri PBS içinde bırakın.
- PBS içinde alexa 568 1:500 konjuge streptavidin sulandırınız. CK14 strepatividin-alexa 568 ile vitray örnekleri, karanlıkta, oda sıcaklığında 30 dakika inkübe edin. Adım 9) PBS içinde yıkayın
- PBS içinde 500: DAPI 1 sulandırınız. Örnekleri PBS aspire ve karanlıkta 10 dakika RT DAPI ile inkübe edin.
- Örnekleri PBS ile durulayın. , Pipetleyin 100 ul, cam Slaytlarınıza anti-solmaya reaktif Prolong böylece hücreler cam slayt bakacak şekilde üzerine lamel açmak. Nazikçe monte medya ile iletişim kurmak için başka bir açıdan lamel yatırın.
- Immünofloresan bir mikroskop kullanılarak örnekleri Resim. Yaklaşık 2 hafta sürecek immünofloresan sinyal korumak için karanlık örnekleri tutun.
4. Aşılama için kolajen gömülü hücrelerinin hazırlanması
- Kollajen hücrelerin gömmek için, kollajen bir ayar çözümü ile karıştırılarak polimerizasyon elde etmek için kollajen pH değerini düşürmek için gerekli. 10X Earl Dengeli Tuz Çözeltisi 100 ml (EBSS), NaHCO3, 2.45 g, 7.5 ml 1 M NaOH ve 42.5 ml steril distile su ile karıştırılarak ayar çözüm hazırlayın. Daha steril bir şişe bağlı bir şişe üst 0.22 mikron filtre ünitesi kullanılarak sterilize edin. <1 oranı: li> bir başlangıç 4 çözüm ayarı ile kolajen (stok konsantrasyonu 1 mg / ml) karıştırın. Bir greft için, bir Eppendorf tüp çözüm ayarı 25 ul 100 ul kollajen karıştırın. Vorteks kısaca veya pipetlemeyin örnek yukarı ve aşağı örnek iyice karıştırmak için.
- 5-10 ul artışlarla kolajen ya da ayar çözüm ekleyin ve bir nötr pH yansıtan turuncu renk pembe bir ışık karışımı değişiklikler fenol kırmızısı boya kadar iyice karıştırın. , Koyu pembe, bazik pH yansıtır sarı renkli asidik pH gösterir. Polimerizasyonu önlemek için buz karışımı tutun.
- Trypsinization tarafından plaka fibroblastlar ve epitel hücreleri çıkarın. İlk olarak, medya aspirat ve 5 ml PBS ile yıkayın. Pipetleyin 0.25%, yüzey başına HBSS trypsin/0.54 mM EDTA, 1 ml. RT fibroblastlar 2-5 dakika inkübe edin. Epitel hücreleri 2-6 dakika süreyle 37 ° C'de inkübe edin. Plakalar hücreleri gevşetmek için hafifçe dokunun. Plaka üzerine 9 ml tam orta pipetleme dekolmanı microscope.Quench tripsin kullanarak kontrol edin ve 15 ml steril konik tüp hücreleri aktarmak.
- 50 ul çıkarın ve hemasitometre hücreleri saymak. Her bir tüp içinde hücrelerin toplam hacmi (yaklaşık 10 ml) dikkat edin.
- RT az 5 dakika 1500 rpm'de Pelet hücreleri. Hücre pelletini aspire ve 100.000 cells/100 ul bir konsantrasyon hücreleri tekrar süspansiyon haline getirin. Örneğin, toplam hacmi 500 ul eksiksiz bir medya 500.000 hücreleri tekrar süspansiyon haline getirin.
- Ayrı bir tüp içinde 250.000 stromal hücreler (250 ul) ve 100.000 tümör hücrelerinin (100 ul) karıştırın. Mikrofuge'de 10 sn 1000 rpm, pipetleme tarafından supernatant çıkarın. Düzeltilmiş kollajen çözüm hücrelere 50 ul ekleyin. Hücreler eşit olarak dağıtmak için pipetleyin yukarı ve aşağı. Pipetleyin steril 6 cm doku kültürü plakası 50 ul dairesel bir damla şeklinde. 37 ° C de 10 dakika süreyle polimerize greft inkübe edin.
- Yavaşça bir açıyla eğerek plaka plaka eksiksiz bir medya 5 ml ekleyin ve yavaş yavaş yan plakanın bir medya pipetleme. Medya greft kapsar kadar etrafında plaka yatırın.
- 37 az 24 saat inkübe ° C. Hemen nakli.
5. Ortoptik C57BL/6J fareler kollajen gömülü hücrelerinin nakli
- Nakli ameliyatı için ince bir cam çubuk üretmektedirler. Bunsen beki kullanarak bir bardak yeniden süspanse ısıtın. Forseps kullanarak, 2-3 mm kalınlığında pipetlemeyin sonuna streç. Soğumasını bekleyin ve% 70 etanol ile sterilize edin.
- Otoklav ve% 70 etanol ile aşağıdaki cerrahi aletler sterilize ince cerrahi makas, künt cerrahi makas, künt forseps, ince forseps, yara klipleri, zımba yara
- % Izofluran 2-3 izofluran bir süpürücü makine ile fare kullanarak anestezisi. Kullanılan ortalama O 2 debisi burun konisi ile 1 L / dakika.
- Sırtında fare Lay ve teyp ya da diğer çıkarılabilir yapıştırıcı ile uzuvların hareketsiz. Nair gibi kimyasal saç çıkarıcı ile saç çıkarın. Pamuk,% 70 etanol ve betadin arasında bir hedef gibi moda alternatif sürüntü ile karın sterilize edin.
- Cildin bir parçası, bir yandan künt forseps kullanarak meme bezi tarafından tutun. Diğer elinizle, künt cerrahi makas kullanılarak meme bezlerinin maruz # 9 ve # 10 meme veya # 4 ve # 5 inguinal meme bezlerinin meme arasında T-insizyon aşağı bir ters yapmak.
- , Küçük cerrahi yaylı makas ile lenf nodu ya da meme arter altında bir cep kesi olun.
- Forseps kullanılarak doku kültürü çanak kollajen greft çıkarın. Hafifçe silin ve ince bir cam çubuk kullanarak kollajen greft slayt cebine tamamen steril üzerine dabbing kollajen greft fazla sıvı çıkarın.
- # 2 gut emilebilir dikişlerle veya yara zımba kullanarak flep dikin.
- Fare kafes kurtarmanızı sağlar.
- Tümörler için palpe, en az haftada iki kez fareler izleyin. Tümörlerin çapı 1 cm ulaştığınızda fareler Kurban. Hasat analiz için dokular.
6. Temsilcisi Sonuçlar:
C57BL/6J fareler İzolasyon ve kollajen çıkarma
Bu prosedürler 1 den adapte edilmiştir. - 5-7 fare kuyrukları kollajen protein çıkarımı 6 ml son hacmi yaklaşık 1-1.5 mg / ml, veya 6, 9 mg protein verir. Coommassie olarak 90 kDa ve 130 kDa karşılık gelen leke, bant sırasıyla kollajen tip I ve pro-kolajen varlığını gösteren (Şekil 1), fare kuyrukları çıkarılan örnekleri ile yüklenen şerit tespit edilir.
Normal ve PyVmT C57BL/6J farelerde meme kanseri hücreleri ve fibroblastlar izolasyonu ve kültürü.
Işlemleri 2 ila adapte edilmiştir. PyVmT karsinom hücreleri ve fibroblastlar, epitelyal ve mezenkimal mar hücre morfolojisi ve ifade farklılıkları ayırt edilebilirKERS. PyVmT karsinom hücreleri arnavut kaldırımlı şekil ve co-express CK18, luminal epitelyal bir işaretleyici ve CK14, bazal epitel işaretleyici, ama ifade α-SMA (Şekil 2) ile tanımlanır. Meme fibroblastlar, iğsi fenotip ile büyük hücreler ve α-SMA, yüksek düzeyde ifade ama CK14 veya CK 18 (Şekil 2) ifade yoktur. Bu veriler özetlenen prosedürlerini kullanarak fibroblastlar ve epitel hücreleri için% 95 hücre saflık üzerinde gösterir.
Ortoptik C57BL/6J fareler kollajen gömülü hücrelerinin nakli
Bu prosedürler, 3, 4 adapte edilmiştir . Nakli alıcı fareler her iki deney grubunda tümör çapı 1.0 cm, ya da yaklaşık 60 gün ulaştığınızda kurban. Sonra palpabl tümörlerde tek başına PyVmT hücrelerinin nakli 30 - 40 gün iken, 60 gün ortalama 0,335 gram tümör kitlesi ulaşan, meme fibroblastlar sonuçları ile 0,630 gram ortalama tümör kitlesi PyVmT kanseri hücreleri co-nakli, geliştirme belirten fibroblastlar (Şekil 3) tümör büyümesi.
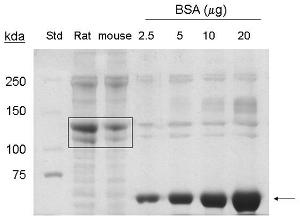
Şekil 1. Kollajen tip fare kuyrukları Ben çıkarma Coomassie leke analizi. BSA (~ 66 kDa), ok işareti ile belirtilir . Ticari sıçan kuyruğu kolajen (20 mg protein) ve saflaştırılmış fare kuyruğu kolajen (20 mg protein), kutu (~ 130 kDa, ~ 90 kDa proteinler) ile gösterilir. Std = moleküler ağırlık standardı.
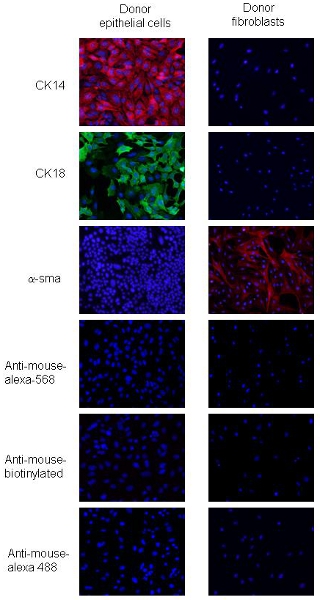
Şekil 2. Donör PyVmT meme kanseri hücreleri ve fibroblastlar immünofloresan boyaması a ve b PyVmT meme kanseri hücreleri temsil Panelleri CK14, CK18 karşı antikorlar için immunohistokimyasal. Paneli c, α-SMA için antikor ile boyandı fibroblastlar temsil eder. Görüntüler 20x büyütme DAPI kaplaması ile gösterilir.
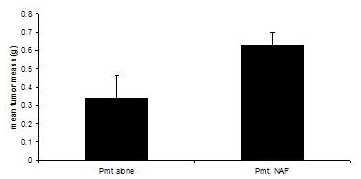
Şekil 3. Meme tümör gelişimini fibroblastların varlığı ya da yokluğu C57BL/6J farelerde meme tümörleri, meme fibroblastların varlığı ya da yokluğu PyVmT kanseri hücreleri nakledilen farelerde hasat ve tartıldı . Ortalama ± ortalamanın standart hatası. N = grup başına 6.
Tartışmalar
Tümör progresyonu fibroblastların fonksiyonel katkı karsinom ilişkili fibroblastlar, artan tümör büyümesi ve invazivlik 5 iyi huylu meme epitel hücreleri ile birlikte nakledilen hangi transplantasyon modelleri ile kanıtlanmıştır . Konvansiyonel nakli yaklaşımlar, farklı genetik fare geçmişleri ya da farklı türlerin ortak nakli stromal ve epitelyal hücreleri SCID veya çıplak farelerin kullanılması yer var. Immün sistemi baskılanmış farelerde tümör spesifik antijen ve tümör hü...
Açıklamalar
Hayvan deneyleri:
Kansas Tıp Merkezi Üniversitesi IACUC komite tarafından belirlenen kurallara ve yönetmeliklere uygun olarak hayvanlar üzerinde deneyler yapıldı.
Teşekkürler
Bu proje üzerine NIH / NCI hibe sayısı R00 CA127357 ve Kansas Üniversitesi Kanser Merkezi Endowment tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| C57BL/6N fareler | Harlan | N / A | |
| MMTV-PyVmT transgenik farelerde | Jackson laboratuvarlar | 002374 | |
| Fetal sığır serumu | Balıkçı | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| Penisilin / streptomisin | Balıkçı | MT-30-001 | |
| amfoterisin | balıkçı | BP2645-20 | |
| Amicon filtrasyon sütun ultracel 50k | Millipore | UFC905008 | |
| Beckman TI rotor için tüpleri | Beckman | 355618 | |
| Rat kuyruk kollajen | Balıkçı | CB 40.236 | |
| 10x EBSS | Sigma Aldrich | E7510-100ML | |
| Tripsin 1X, HBSS w / o Kalsiyum ve Magnezyum% 0.25 | Balıkçı | MT-25-050-CI | |
| Asetik sirke asidi | Balıkçı | A491-212 | |
| Coomasie mavi | Balıkçı | BP101 25 | |
| Tripsin | Sigma Aldrich | T3924-100ml | |
| Kollajenaz A | Sigma AldrichC0130-50 | ||
| hyalronidase | Sigma Aldrich | H3884 | |
| DNaz | Sigma Aldrich | D5025 | |
| Kaleidoscope Protein standardı | Biorad | 1610375 | |
| Cam slaytlar | Balıkçı | 12545-78 | |
| Cam lamelleri | VWR | 101400-042 | |
| Vimentin antikor S-20 | Santa Cruz Biyoteknoloji | SC-7558 | |
| α-düz kas aktin antikor | Abcam | ab5694 | |
| CK14 antikor | Santa Cruz Biyoteknoloji | sc-53.253 | |
| CK18 antikor | Abcam | ab668 | |
| DAPI | Sigma Aldrich | D9542 | |
| Anti-fare biotinlenmiş | Vektör laboratuvarlar | BA9200 | Fisher aracılığıyla dağıtılmaktadır |
| Anti-fare-alexa-568 | Invitrogen | A10037 | |
| Anti-fare-alexa-488 | Invitrogen | A11001 | |
| Streptavidin-alexa-488 | Invitrogen | S11226 | |
| DAPI | Invitrogen | D21490 | |
| Antifade Prolong | Invitrogen | P-36.930 | |
| Cerrahi makas | Güzel Bilim Araçları | 91400-12 | |
| Güzel bahar makas | Güzel Bilim Araçları | 15000-02 | |
| Blunt forseps | Güzel Bilim Araçları | 11002-12 | |
| # 5 ince forseps | Güzel Bilim Araçları | 11251-10 | |
| Gut kromik sütür | Balıkçı | NC9326254 | |
| Cam tamamen yeniden süspanse | Balıkçı | 22-042-815 | |
| Etanol | Balıkçı | A406P 4 | |
| betadin | balıkçı | NC9386574 | |
| Yara klipleri | Balıkçı | 12032-07 | |
| Yara elyaf | Balıkçı | 12031-07 |
Referanslar
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır