A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وحيد ذبابة الفاكهة Ommatidium تشريح والتصوير
In This Article
Summary
عامل يحد من استخدام الكبار ذبابة الفاكهة العين لدراسة تنكس عصبي وبيولوجيا الخلية هو صعوبة التصوير من العمليات داخل الخلايا. وصفنا تشريح ommatidia واحدة لإنشاء النية الحسنة ، زراعة الخلايا العصبية الأولية ، والتي يمكن أن تخضع للعلاج بالعقاقير والتصوير المتقدمة.
Abstract
جعلت ذبابة الفاكهة ذبابة الفاكهة السوداء البطن مساهمات لا تقدر بثمن للبحث علم الأعصاب ، واستخدمت على نطاق واسع كنموذج للأمراض العصبية بسبب الوراثة القوية 1. وقد عين الذبابة لا سيما الجهاز المفضل للبحوث تنكس عصبي ، ويجري الجزء الأكثر الوصول إليها والاستغناء عنها ، من حياة النظام العصبي ذبابة الفاكهة. لكن التحذير من العيون كبرى سليمة هو صعوبة ، وذلك بسبب تألق ذاتي مكثفة من الصباغ ، والأحداث في التصوير داخل الخلايا ، مثل ديناميات 2 الالتهام الذاتي ، والتي لها أهمية قصوى لفهم تنكس عصبي.
لقد اعتدنا في الآونة الأخيرة تشريح وثقافة واحدة ommatidia 3 التي كانت ضرورية لفهمنا للاختلالات autophagic في نموذج يطير من Dentatorubro - Pallidoluysian الضمور (DRPLA) 3 ، 4.
نحن الآن التقرير وصفا شاملا لهذه التقنية (الشكل 1) ، وتكييفها من الدراسات الكهربية 5 ، التي من المرجح أن يتوسع بشكل كبير في إمكانية نماذج الطيران لتنكس عصبي. ويمكن تكييف هذه الطريقة لصورة حية الأحداث التحت خلوية ، ورصد فعالية الدواء على خلايا مستقبلة للضوء (الشكل 2). إذا استعملت في تآلف مع تقنيات الفسيفساء 6-8 ، يمكن أن يعاير ردود الخلايا المختلفة وراثيا بشكل متواز (الشكل 2).
Protocol
1. تشريح الشبكية ذبابة الفاكهة
- سد بئر واحدة من الشرائح الزجاجية 3 - حسنا مع الفوسفات مخزنة المالحة (PBS 1X) ، وتخدير ثم عن طريق الذباب CO 2. ويمكن استخدام كل من الذكور والإناث لهذه التجربة.
- بمجرد أن يتم تخدير الذباب ، والتقاط ذبابة واحدة باستخدام ملقط وأسقطه في صحن صغير من برنامج تلفزيوني.
- تحت نطاق تشريح ، قرصة خرطوم بالملقط ، ثم فصل الرأس عن الجسم عن طريق قطع الرقبة باستخدام مجموعة الثانية من الملقط.
- عقد رئيس يطير من خرطوم ، وقطع في نصف طول خط الوسط يسار / يمين رأسه يطير مع microscissors للكشف عن الدماغ.
- استخدام غيض ماصة لالتقاط قطع شبكية العين ، ونقل إلى البئر الثانية من الشرائح الزجاجية 3 - حسنا مليئة المتوسطة شنايدر.
- أولا ، بعيدا قشر معظم بشرة الرأس والدماغ ثم إزالة بالملقط. الحفاظ على شبكية العين الواقعة بين الصفيحة والقرنية.
- المقبل ، ونقل على شبكية العين قطرة (50 ميكرولتر) من المتوسط Schnieder الطازجة وضعها مباشرة على شريحة زجاجية.
2. تشريح ommatidia
- تبعا للغرض النهائي للتشريح (سواء المباشرة أو التصوير الثقافة) وعلى البصريات من المجهر الفلورسنت (المباشر أو مقلوب) ، يمكن أن هذه الخطوة تتم إما على شريحة المجهر أو في صفيحة ال 24 أيضا. لغرض التشريح النهائي لهذا ، سيتم تشريح ommatidia مباشرة على شريحة زجاجية.
- فهم إما في نهاية معظم الظهرية أو البطنية من شبكية العين مع ملقط. microscissors به ، وقطع في الشبكية في نصف طول خط الوسط الظهرية / بطني لفضح ommatidia في منتصف العين.
- يواصل فهم الشبكية بحيث القرنية أسفل الصفيحة ويكون مواجها لها. باستخدام إبرة التنغستن غرامة ، وفصل ommatidia من الصفيحة والقرنية.
- سوف ommatidia واحد وجمع مجموعات من ommatidia في قاع البئر أو الشريحة. إزالة أي أكبر الحطام الذي قد جمعت قبل المتابعة.
3. العلاج ، وتلطيخ والتصوير
- لتحليل الالتهام الذاتي ، تمييع 1:1000 Lysotracker في انخفاض شنايدر (الأولى في تمييع 01:10 شنايدر ثم إضافة 0.5 ميكرولتر إلى الانخفاض على الشريحة) ، ومزيج الانتظار 10 ثانية.
- إزالة السائل الزائد من الشريحة ، والحرص على ترك وراء ommatidia. يتم ذلك بشكل أفضل مع تلميح هلام تحميل الغرامة.
- إضافة قطرة من Vectashield لتغطية ommatidia ، وتطبيق ساترة وختم مع nailpolish.
4. ممثل النتائج :
ينبغي على حسن تنفيذ البروتوكول ترك عددا من ommatidia وحيدة ومجموعات صغيرة من ommatidia ظل متماسكا بفعل شظايا الصفيحة فصل لطيف ولكن على الجانب القرنية. ولا يمكن تصوير هذه كما في هذا المثال لتصور Atg8 : GFP وLysotracker ، والتي تبين autophagosomes ، وlysosomes autophagolysosomes (الشكل 3). ويمكن استخدام أسلوب التصوير الحية ، ولكن في هذه الحالة فإنه تجدر الإشارة إلى أن تألق ذاتي المتوسطة وشنايدر وسوف تجعل من الصعب التمييز بين الاشارات كثافة منخفضة الفلورسنت. قضية أخرى هي أن حبيبات الصباغ التي لا تزال تعلق على خلايا مستقبلة للضوء الفلورسنت وبشكل مكثف ، وخاصة في القناة الحمراء. قد تكون هناك حاجة لصورة brightfield لتمييزها عن العضيات حقيقية.
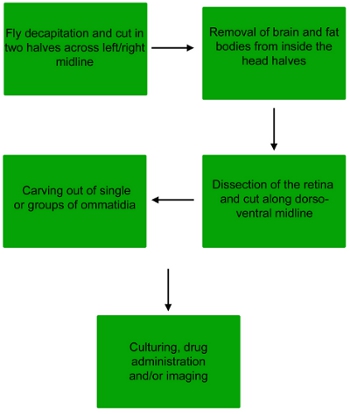
الشكل 1. مخطط تدفق إجراء تشريح للحصول على ommatidia واحدة أو مجموعات صغيرة من ommatidia من الشبكية الطيران.
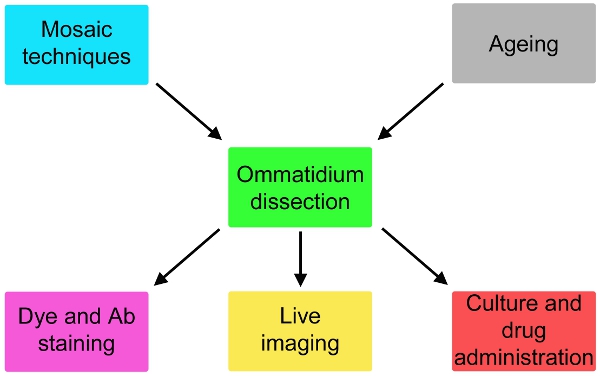
الشكل 2. التغيرات المحتملة للبروتوكول بسيطة هنا تصف التي تنطوي على علم الوراثة والشيخوخة يطير المنبع للتشريح وتلطيخ أو زراعة لمدة تصل إلى 24 ساعة والمصب إدارة مكافحة المخدرات التابع لتشريح.
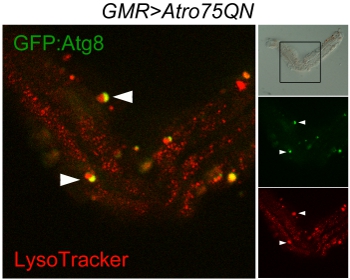
الشكل 3 متحد البؤر المسح الضوئي للautophagosomes وlysosomes في تشريح واحدة من ommatidium AW ؛ GMR - Gal4 ، UAS - Atro75QN ؛ UAS GFP - : : Atg8 / + الطيران ، وتعبر عن polyglutamine Atrophin متحولة والذين تتراوح أعمارهم بين 12 يوما حتى 29 درجة مئوية. لوحة brightfield (أعلى اليمين) يعرض بنية سليمة تقريبا ommatidium والإطار يشير المنطقة الممسوحة ضوئيا. علامات حمراء Lysosomes ، الأخضر autophagosomes ، lysosomes السيارات ، مما أسفر عن الانصهار من العضيات اثنين ، تظهر الصفراء. ورؤوس سهام تشير حدثين الانصهار الجارية بين autophagosomes وlysosomes.
Discussion
تشريح ommatidium احدة المعروضة هنا يمكن جمع معلومات أكثر عمقا حول الخلية البيولوجية مثل العمليات تنكس عصبي ، عندما غرار ذبابة الفاكهة في العين. الخلايا العصبية مستقبلة للضوء أكثر يمكن الوصول إليها بسهولة من الخلايا العصبية الأخرى ، وأنهم السيتوبلازم كبيرة على ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر برنار Charroux للمناقشات. وقد تم تمويل هذا العمل من قبل المدرسة الطبية بوكل.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| مصدر CO2 المحمولة | Flystuff | 59-150 | تتوفر عبوات |
| دومون النتاف او أداة النتف رقم 5 | العلم AGAR | T5034 | |
| 3 حسنا الشرائح الزجاجية | EMS | 71561-01 | |
| المقص الصغير | VWR | HAMMHSB516 - 09 | |
| شنايدر متوسطة | VWR | 733-1663 | |
| LysoTracker الأحمر DND - 99 | Invitrogen | L7528 | |
| الشرائح Superfrost | VWR | 631-0108 | |
| Vectashield مع دابي | ناقلات مختبرات | H - 1200 | |
| Coverslips | VWR | 631-1336 |
References
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Nisoli, I. Neurodegeneration by polyglutamine Atrophin is not rescued by induction of autophagy. Cell Death Differ. 17, 1577-1587 (2010).
- Charroux, B., Fanto, M. The fine line between waste disposal and recycling: DRPLA fly models illustrate the importance of completing the autophagy cycle for rescuing neurodegeneration. Autophagy. 6, 667-669 (2010).
- Hardie, R. C. Voltage-sensitive potassium channels in Drosophila photoreceptors. J Neurosci. 11, 3079-3095 (1991).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends in neurosciences. 24, 251-254 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-1234 (2011).
- Napoletano, F. Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat. The EMBO journal. 30, 945-958 (2011).
- Ravikumar, B. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease. Nature. 36, 585-595 (2004).
- Zou, S., Meadows, S., Sharp, L., Jan, L. Y., Jan, Y. N. Genome-wide study of aging and oxidative stress response in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 97, 13726-13731 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved