Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Drosophila Ommatidium Diseksiyon ve Görüntüleme
Bu Makalede
Özet
Yetişkin kullanımı sınırlayıcı faktör Drosophila Göz nörodejenerasyon ve hücre biyolojisi çalışmada, hücre içi süreçlerin zor görüntüleme. Biz, ilaç tedavisi ve ileri görüntüleme konusu olabilir iyi niyetli bir primer nöronal hücre kültürü, oluşturmak için tek ommatidia diseksiyonu açıklar.
Özet
Meyve sineği Drosophila melanogaster sinirbilim araştırması için çok değerli katkılarda bulunmuştur ve nörodejeneratif hastalıklar için çünkü güçlü genetik 1 bir model olarak yaygın olarak kullanılmaya başlanmıştır. Özellikle sinek göz Drosophila sinir sisteminin en erişilebilir ve yaşam vazgeçilebilir bir parçası olmak, nörodejenerasyon araştırma için tercih organı olmuştur . Ancak sağlam gözleri en önemli uyarı nörodejenerasyon anlamak için her şeyden otofaji dinamikleri 2 hücre içi olaylar gibi görüntüleme, çünkü pigment yoğun otofloresans zorluk.
Biz son zamanlarda Dentatorubro-Pallidoluysian Atrofi bir sinek modeli (DRPLA) 3, 4 otofajik işlev bozukluklarının anlaşılması için gerekli olan tek ommatidia 3 diseksiyon ve kültür kullandık .
Şimdi nörodejenerasyon için sinek modelleri olasılığını önemli ölçüde genişletmek için muhtemel elektrofizyolojik çalışmalar 5, uyarlanmış bu tekniği (Şekil 1), kapsamlı bir açıklama raporu . Bu yöntem, görüntü, canlı hücre içi olaylar ve fotoreseptör hücrelerinin (Şekil 2) üzerine etkili ilaç yönetimini izlemek için adapte edilebilir. , Mozaik teknikleri 6-8 ile birlikte kullanılması durumunda, hücrelerin genetik olarak farklı tepkiler (Şekil 2) paralel olarak test edilebilir .
Protokol
1. Drosophila retina diseksiyonu
- Bir iyi bir 3-Well Cam Slayt doldurun fosfat tamponlu salin (PBS 1X) ve sonra CO 2 sinekler uyutmak. Hem erkekler hem de bu deney için kullanılabilir.
- Sinekler anestezi sonra, forseps kullanarak tek bir sinek pick up ve PBS küçük bir çanak içine bırakın.
- Diseksiyon kapsamında, forseps ile burnumun çimdik, ve daha sonra ikinci bir forseps kullanarak boyun kesilmesinin vücut baş ayırmak.
- Sol / sağ orta hat beyin ortaya çıkarmak için microscissors sinek kafası boyunca yarıya, burnumun Holding sinek kafası.
- Retina pick up ve iyi bir Schneider orta dolu 3-Well Cam Slide ikinci transfer için bir kesme pipet kullanın.
- Birincisi, daha sonra uzakta kabuğu kafa manikür ve forseps ile beyin kaldırmak. Lamina ve kornea arasında sıkışmış retina tutun.
- Sonra, retina taze Schnieder orta cam slayt doğrudan yerleştirilen bir damla (50 ul) üzerine aktarın.
2. Ommatidia diseksiyonu
- Diseksiyon (anında görüntü veya kültür olsun) nihai amacı ve floresan mikroskop (doğrudan ya da ters) optik olarak, bu adımı bir mikroskop lamı üzerine veya 24 plaka ya alabilir. Bu diseksiyon nihai amacı için, ommatidia cam slayt üzerine doğrudan disseke olacaktır.
- Ya forseps ile retinanın en dorsal veya ventral sonuna kavrayın. Microscissors kullanarak, gözün ortasında ommatidia / dorsal ventral orta hat boyunca ortaya çıkarmak için yarım retina kesti.
- Gibi retina, kornea aşağı bakacak ve lamina ile karşı karşıya olduğunu kavramak için devam edin. Ince bir tungsten iğne kullanılması, lamina ve kornea ommatidia ayırın.
- Tek ommatidia ve ommatidia gruplar, iyi veya slayt alt toplayacaktır. Devam etmeden önce toplanan olabilecek herhangi bir büyük enkaz çıkarın.
3. Tedavi, boyama ve görüntüleme
- Otofaji analiz etmek, 1:1000 Schneider açılan Lysotracker (sonra ilk seyreltik Schneider 01:10 ve slayt açılan 0.5 ul), mix sulandırmak ve 10 saniye bekleyin.
- Ommatidia geride bırakmak için dikkatli olmak, slayt aşırı sıvı çıkarın. Bu ince bir jel yükleme ucu ile yapılır.
- Ommatidia kapağı için Vectashield bir damla, bir oje ile lamel ve mühür uygulanır.
4. Temsilcisi Sonuçlar:
Protokol iyi yürütme lamina parçaları ile birlikte tutulur ama güzel kornea tarafta ayrılmış, tek ommatidia ve ommatidia küçük gruplar bir dizi bırakmalısınız. Autophagosomes, lizozomlar ve autophagolysosomes (Şekil 3) gösteren, GFP ve Lysotracker: Bu Atg8 görselleştirmek için bu örnekte olduğu gibi görüntülü olabilir. Bu yöntem, canlı görüntüleme için kullanılabilir, ancak bu durumda Schneider orta otofloresans düşük yoğunluklu floresan sinyalleri ayırt etmek zor olacağı not edilmelidir. Ek bir sorun fotoreseptörlerin bağlı kalır pigment granülleri yoğun floresan, özellikle kırmızı kanal olmasıdır. Bir aydınlık resim gerçek organelleri onları ayırmak için gerekli olabilir.
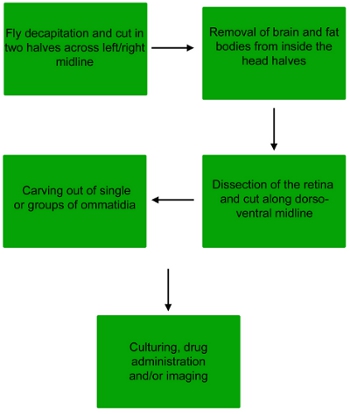
Şekil 1 sinek retina diseksiyonu işlem akış şeması, tek ommatidia veya küçük gruplar ommatidia elde etmek için .
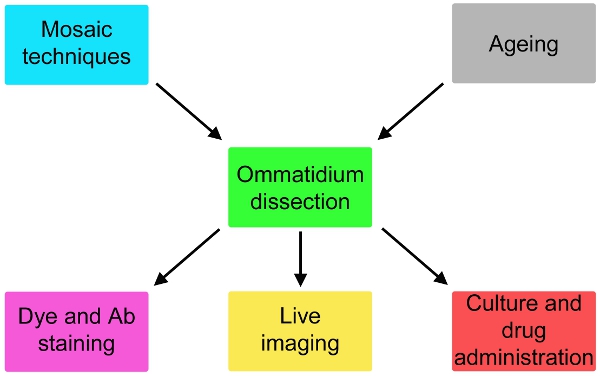
Şekil 2 Burada basit bir protokol olası varyasyonları sinek genetik içerir ve 24 saat diseksiyonu ilaç yönetimi downstream diseksiyon ve boyama veya kültür yukarı yaşlanma olduğunu açıklar.
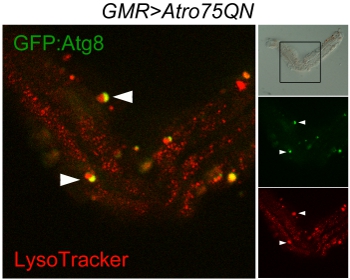
Şekil 3 Konfokal tarama aw disseke tek ommatidium autophagosomes ve lizozomlar; GMR-Gal4, UAS-Atro75QN; UAS-GFP:: Atg8 / + sinek poliglutamin Atrophin mutant ve yaşlı 12 gün ifade, 29 ° C Aydınlık paneli (sağ üstte) ommatidium neredeyse sağlam bir yapı gösterir ve çerçeve taranan bölgeyi gösterir. Iki organellerin füzyon sonucu kırmızı lekeler Lizozomlar, yeşil autophagosomes, oto-lizozomlar, sarı görünür. Ok autophagosomes ve lizozomlar arasında devam eden iki füzyon olayları göstermektedir.
Tartışmalar
Burada sunulan tek ommatidium diseksiyonu Drosophila göz modellenen nörodejenerasyon gibi süreçleri hakkında derin hücre biyolojik bilgi toplama sağlar. Fotoreseptör nöronlar diğer nöronlarla daha kolay erişilebilir ve onlar sitoplazma, in vivo olarak nörodejenerasyon ölçmek için birçok model yetkin kullanılan çok aynı hücrelerde, özellikle büyük ve böylece vezikül dinamiklerini incelemek için uygun . Diseksiyon kritik yönü ağırlıklı olarak Sabitlenmemiş doku kadar kur...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz Bernard Charroux tartışmalar için teşekkür ederiz. Bu çalışma KCL Biyomedikal Okulu tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| Taşınabilir CO2 Dispenseri | Flystuff | 59-150 | Bilgiler mevcut |
| DUMONT Cımbız No 5 | Bilimsel AGAR | T5034 | |
| 3-Well Cam Slayt | EMS | 71561-01 | |
| Mikro makas | VWR | HAMMHSB516-09 | |
| Schneider Orta | VWR | 733-1663 | |
| LysoTracker Kırmızı DND-99 | Invitrogen | L7528 | |
| SuperFrost Slaytlar | VWR | 631-0108 | |
| DAPI ile Vectashield | Vektör Labs | H-1200 | |
| Lameller | VWR | 631-1336 |
Referanslar
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Nisoli, I. Neurodegeneration by polyglutamine Atrophin is not rescued by induction of autophagy. Cell Death Differ. 17, 1577-1587 (2010).
- Charroux, B., Fanto, M. The fine line between waste disposal and recycling: DRPLA fly models illustrate the importance of completing the autophagy cycle for rescuing neurodegeneration. Autophagy. 6, 667-669 (2010).
- Hardie, R. C. Voltage-sensitive potassium channels in Drosophila photoreceptors. J Neurosci. 11, 3079-3095 (1991).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends in neurosciences. 24, 251-254 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-1234 (2011).
- Napoletano, F. Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat. The EMBO journal. 30, 945-958 (2011).
- Ravikumar, B. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease. Nature. 36, 585-595 (2004).
- Zou, S., Meadows, S., Sharp, L., Jan, L. Y., Jan, Y. N. Genome-wide study of aging and oxidative stress response in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 97, 13726-13731 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır