A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אחד תסיסנית אומטידיום Dissection והדמיה
In This Article
Summary
הגורם המגביל בשימוש של המבוגר תסיסנית עין ללמוד ניוון מוחיים, ביולוגיה של התא הוא קשה הדמיה של תהליכים תאיים. אנו מתארים את דיסקציה של האומטידיה בודד כדי ליצור בתום-בתום תא ראשוני תרבות העצבית, אשר יכול להיות נושא לטיפול תרופתי והדמיה מתקדמים.
Abstract
זבוב הפירות דרוזופילה melanogaster תרם תרומות יקר המוח במחקר כבר בשימוש נרחב כמודל מחלות ניווניות בגלל הגנטיקה שלה עוצמה 1. העין לטוס בפרט כבר האיבר של בחירה עבור מחקר ניוון מוחיים, להיות חלק נגיש ביותר החיים dispensable של מערכת העצבים תסיסנית. עם זאת, אזהרה גדולה של העיניים שלם הוא הקושי, בגלל autofluorescence האינטנסיבי של הפיגמנט, באירועים הדמיה תאיים, כגון autophagy הדינמיקה 2, אשר עליונה הבנה של ניוון מוחיים.
השתמשנו לאחרונה לנתיחה והתרבות של האומטידיה אחד 3 כי כבר חיוני להבנת תפקוד autophagic במודל זבוב של ניוון Dentatorubro-Pallidoluysian (DRPLA) 3, 4.
כעת אנו מדווחים תיאור מקיף של טכניקה זו (איור 1), המותאמים ממחקרים אלקטרו 5, אשר צפוי להרחיב באופן משמעותי את האפשרות של מודלים לטוס ניוון מוחיים. שיטה זו יכולה להתאים לדימוי חי אירועים subcellular כדי לפקח והתרופות אפקטיבי על התאים קולטי האור (איור 2). אם בשילוב עם טכניקות פסיפס 6-8, התגובות של תאים שונים גנטית יכול להיות assayed במקביל (איור 2).
Protocol
1. Dissection של הרשתית תסיסנית
- מילוי אחד טוב של שקופיות 3-ובכן זכוכית עם פוספט שנאגרו מלוחים (PBS 1X), ולאחר מכן להרדים זבובים על ידי ה-CO 2. שני זכרים ונקבות ניתן להשתמש לצורך הניסוי הזה.
- לאחר הזבובים מורדמים, להרים זבוב אחד באמצעות מלקחיים ו זרוק אותו לתוך צלחת קטנה של PBS.
- תחת בהיקף לנתח, לצבוט את חוטם עם מלקחיים, ולאחר מכן לנתק את הראש מהגוף על ידי ניתוק הצוואר באמצעות סט שני של מלקחיים.
- החזקת הראש לטוס חוטם, בחצי לאורך קו האמצע שמאלה / ימינה ראש לטוס עם microscissors לחשוף את המוח.
- השתמש קצה פיפטה לחתוך להרים את הרשתית, ולהעביר שנייה גם של 3-Slide ובכן זכוכית מלאים בינוני שניידר.
- ראשית, לקלף ביותר לציפורן ראש ולאחר מכן להסיר את המוח עם מלקחיים. שמור את הרשתית דחוקה בין lamina לבין הקרנית.
- לאחר מכן, להעביר את הרשתית על ירידה (50 μl) של המדיום Schnieder טרי ממוקם ישירות על שקופיות הזכוכית.
2. Dissection של האומטידיה
- בהתאם למטרה הסופית של הניתוח (בין אם באופן מיידי או הדמיה תרבות) ועל אופטיקה של מיקרוסקופ פלואורסצנטי (ישיר או הפוך), שלב זה יכול להתרחש גם על המיקרוסקופ שקופית או בצלחת 24 באר. למטרה הסופית של הניתוח הזה, האומטידיה יהיה גזור ישירות על גבי שקופיות הזכוכית.
- אחוז או סוף הגב או הגחון ביותר של הרשתית עם מלקחיים. שימוש microscissors, לחתוך את הרשתית במחצית לאורך קו האמצע הגב / הגחון לחשוף את האומטידיה באמצע העין.
- המשך לתפוס את הרשתית כזה הקרנית פונה למטה lamina הוא פונה כלפי מעלה. באמצעות מחט טונגסטן בסדר, לנתק את האומטידיה מ lamina לבין הקרנית.
- האומטידיה יחיד וקבוצות האומטידיה תאסוף בתחתית הבאר או שקופיות. הסר את כל פסולת גדול שייתכן שנאספו לפני שתמשיך.
3. , טיפול מכתים הדמיה
- כדי לנתח autophagy, לדלל 1:1000 Lysotracker בירידת שניידר (הראשון לדלל 1:10 ב שניידר ולאחר מכן להוסיף 0.5 μl עד טיפת בשקופית), לערבב ולהמתין 10 שניות.
- הסר את נוזל עודף בשקופית, נזהר לצאת מאחורי האומטידיה. זה נעשה בצורה הטובה ביותר עם טיפ ג'ל עדין טוען.
- הוסף ירידה של Vectashield כדי לכסות את האומטידיה, להחיל coverslip וסוגרים עם nailpolish.
4. נציג תוצאות:
ביצוע טוב של הפרוטוקול צריך להשאיר מספר האומטידיה יחיד של קבוצות קטנות של האומטידיה שמרו יחד על ידי שברי lamina אבל מופרדים יפה בצד הקרנית. אלה יכולים להיות צילמו כמו בדוגמה זו כדי להמחיש Atg8: GFP ו Lysotracker, מראה autophagosomes, lysosomes ו autophagolysosomes (איור 3). השיטה יכולה לשמש הדמיה לחיות, אולם במקרה זה יש לציין כי autofluorescence של המדיום של שניידר יקשה להבחין בין אותות בעוצמה נמוכה ניאון. סוגיה נוספת היא כי גרגרי פיגמנט שנותרו המחוברים photoreceptors הם פלורסנט מאוד, במיוחד במסלול האדום. תמונה brightfield עשויים להידרש להבדילם האברונים אמיתי.
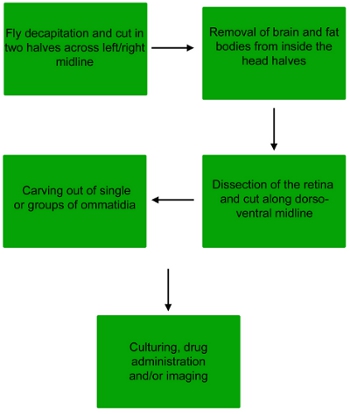
באיור 1. תרשים זרימה של הליך לנתיחה כדי להשיג האומטידיה בודד או קבוצות קטנות של האומטידיה מן הרשתית לעוף.
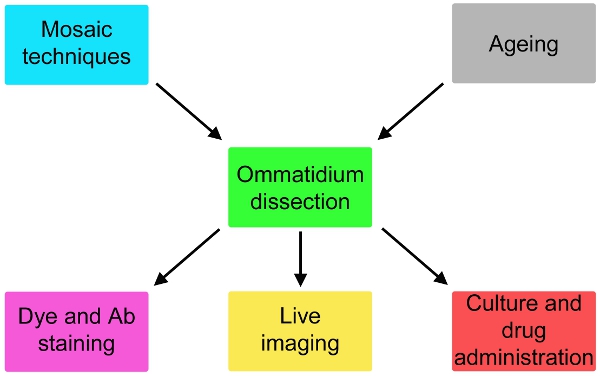
איור 2. וריאציות אפשריות של פרוטוקול פשוט לתאר כאן שכוללות גנטיקה לטוס והזדקנות במעלה הזרם של דיסקציה ו מכתים או culturing במשך עד 24 שעות והתרופות במורד הזרם של הניתוח.
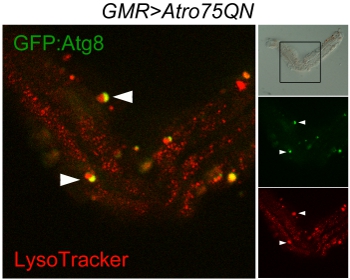
איור 3 לסרוק Confocal של autophagosomes ו lysosomes ב אומטידיום יחיד גזור מן aw;-GMR Gal4, כטב"מ-Atro75QN; כטב"מ-GFP:.: Atg8 / + לעוף, להביע polyglutamine Atrophin מוטנטי בגילאי 12 ימים ב 29 ° C. לוח brightfield (מימין למעלה) מציג את מבנה כמעט בשלמותה של אומטידיום ואת המסגרת מצביע על האזור שנסרק. האדום מסמן ליזוזומים, ירוק autophagosomes, Auto-lysosomes, וכתוצאה מכך על ידי איחוי של שני אברונים, מופיעים צהוב. ראשי חץ מציינים שני אירועים היתוך מתמשך בין autophagosomes ו lysosomes.
Discussion
דיסקציה אומטידיום יחיד המוצגת כאן מאפשרת איסוף מידע התא עמוק יותר על תהליכים ביולוגיים כמו ניוון מוחיים, כאשר הדגם בעין תסיסנית. הנוירונים הם photoreceptor נגיש יותר בקלות מאשר נוירונים אחרים והם הציטופלסמה הוא גדול במיוחד, מתאים ובכך ללמוד הדינמיקה שלפוחית, בתאי בדי...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
אנו מודים ברנרד Charroux לדיונים. עבודה זו מומנה על ידי בית הספר ביו KCl.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| Dispenser CO2 ניידת | Flystuff | 59-150 | מילוי גם זמין |
| דומונט פינצטה לא 5 | מדעי אגר | T5034 | |
| 3-ובכן זכוכית נושאת | EMS | 71561-01 | |
| מיקרו מספריים | VWR | HAMMHSB516-09 | |
| שניידר בינוני | VWR | 733-1663 | |
| LysoTracker האדום DND-99 | Invitrogen | L7528 | |
| Superfrost שקופיות | VWR | 631-0108 | |
| Vectashield עם Dapi | וקטור Labs | H-1200 | |
| Coverslips | VWR | 631-1336 |
References
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Nisoli, I. Neurodegeneration by polyglutamine Atrophin is not rescued by induction of autophagy. Cell Death Differ. 17, 1577-1587 (2010).
- Charroux, B., Fanto, M. The fine line between waste disposal and recycling: DRPLA fly models illustrate the importance of completing the autophagy cycle for rescuing neurodegeneration. Autophagy. 6, 667-669 (2010).
- Hardie, R. C. Voltage-sensitive potassium channels in Drosophila photoreceptors. J Neurosci. 11, 3079-3095 (1991).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends in neurosciences. 24, 251-254 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-1234 (2011).
- Napoletano, F. Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat. The EMBO journal. 30, 945-958 (2011).
- Ravikumar, B. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease. Nature. 36, 585-595 (2004).
- Zou, S., Meadows, S., Sharp, L., Jan, L. Y., Jan, Y. N. Genome-wide study of aging and oxidative stress response in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 97, 13726-13731 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved