É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Único Drosophila Dissection omatídeo e Imagem
Neste Artigo
Resumo
O fator limitante no uso do adulto Drosophila Olho para estudar neurodegeneração e biologia celular é a imagem difícil de processos intracelulares. Descrevemos a dissecação de omatídeos única para gerar uma boa-fé de cultura de células neuronais primários, que podem ser sujeitos a tratamento medicamentoso e avançados de imagem.
Resumo
A mosca da fruta Drosophila melanogaster fez contribuições inestimáveis para pesquisa em neurociência e tem sido amplamente utilizado como modelo para doenças neurodegenerativas por causa de sua genética poderosa 1. O olho da mosca em particular, tem sido o órgão de escolha para a pesquisa neurodegeneração, sendo a parte mais acessível e de vida dispensáveis do sistema nervoso Drosophila. No entanto, a ressalva importante de olhos intactos é a dificuldade, por causa da intensa autofluorescência do pigmento, em eventos intracelulares de imagem, como a autofagia dinâmica 2, que são fundamentais para a compreensão da neurodegeneração.
Temos utilizado recentemente a dissecção ea cultura de omatídeos única 3 que tem sido essencial para a nossa compreensão das disfunções autofágica em um modelo de voar (DRPLA) 3 de Dentatorubro-Pallidoluysian Atrofia, 4.
Temos agora um relatório de descrição abrangente dessa técnica (Fig. 1), adaptado de estudos eletrofisiológicos 5, que é provável expandir dramaticamente a possibilidade de voar por modelos neurodegeneração. Este método pode ser adaptado a imagem ao vivo de eventos subcelulares e para monitorar a administração da droga eficaz para células fotorreceptoras (Fig. 2). Se usado em combinação com técnicas de mosaico 6-8, as respostas das células geneticamente diferentes podem ser testadas em paralelo (Fig. 2).
Protocolo
1. Dissecção da retina Drosophila
- Preencher um poço de uma lâmina de vidro 3-Bem com tampão fosfato salina (PBS 1X), e depois anestesiar voa de CO 2. Os machos e as fêmeas podem ser utilizados para este experimento.
- Uma vez que as moscas são anestesiados, pegar uma única mosca usando uma pinça e solte-o no prato pequeno de PBS.
- De acordo com um escopo de dissecação, aperte a tromba com uma pinça, e depois retirar a cabeça do corpo, cortando o pescoço com um segundo conjunto de fórceps.
- Segurando a cabeça voar a partir do proboscis, cortado pela metade ao longo da linha média esquerda / direita a cabeça voar com microtesoura para revelar o cérebro.
- Use uma ponteira de corte para pegar a retina, e transferir para um segundo poço da lâmina de vidro 3-Bem cheio com meio Schneider.
- Primeiro, descascar mais da cutícula cabeça e em seguida, retire o cérebro com uma pinça. Manter a retina colada entre a lâmina ea córnea.
- Em seguida, transferir a retina em uma gota (50 ul) de médio Schnieder fresco colocado diretamente da lâmina de vidro.
2. Dissecção da omatídeos
- Dependendo do objetivo final da dissecção (se a imagem imediata ou cultura) e na óptica do microscópio de fluorescência (direto ou invertido), esta etapa pode ter lugar numa lâmina de microscópio ou uma placa de 24 poços. Para o objectivo final desta dissecção, a omatídeos serão dissecados diretamente sobre a lâmina de vidro.
- Compreender tanto o fim mais dorsal ou ventral da retina com uma pinça. Usando microtesoura, corte a retina na metade ao longo da linha média dorsal / ventral para expor os omatídeos no meio do olho.
- Continuar a se agarrar a retina de tal forma que a córnea é voltado para baixo ea lâmina é virada para cima. Usando uma agulha de tungstênio fino, retire o omatídeos da lâmina e da córnea.
- Omatídeos individuais e grupos de omatídeos irá recolher no fundo do poço ou slide. Remova todos os maiores detritos que possam ter recolhido antes de prosseguir.
3. Coloração, tratamento e imagem
- Para analisar a autofagia, diluir 1:1000 Lyso Tracker na queda Schneider (primeiro diluir 1:10 em Schneider e adicione 0,5 mL para a queda no slide), misture e aguarde 10 segundos.
- Retire o excesso de líquido a partir do slide, tendo o cuidado de deixar para trás o omatídeos. Este é o melhor feito com uma ponta fina de gel loading.
- Adicionar uma gota de Vectashield para cobrir os omatídeos, cobrir com uma lamela e selar com verniz.
4. Resultados representativos:
A boa execução do protocolo deve deixar um número de omatídeos individuais e de pequenos grupos de omatídeos mantidos juntos por fragmentos de lâmina, mas bem separada do lado da córnea. Estes podem ser visualizados como neste exemplo para visualizar Atg8: GFP e Lyso Tracker, mostrando autofagossomas, lisossomos e autophagolysosomes (Fig. 3). O método pode ser usado para geração de imagens ao vivo, no entanto, neste caso, é de notar que a autofluorescência de meio Schneider fará com que seja difícil de distinguir os sinais de baixa intensidade fluorescente. Um problema adicional é que os grânulos de pigmento que permanecer solidários com os fotorreceptores são intensamente fluorescentes, especialmente no canal vermelho. Uma imagem de campo claro pode ser necessária para distingui-las das organelas genuíno.
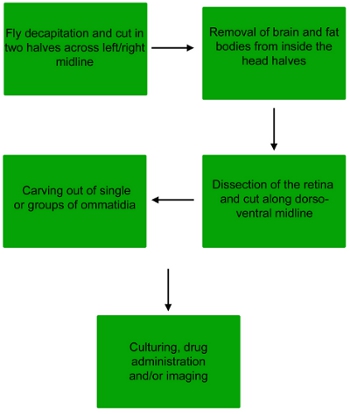
Figura 1. Fluxograma do procedimento de dissecção para obter omatídeos individuais ou pequenos grupos de omatídeos da retina voar.
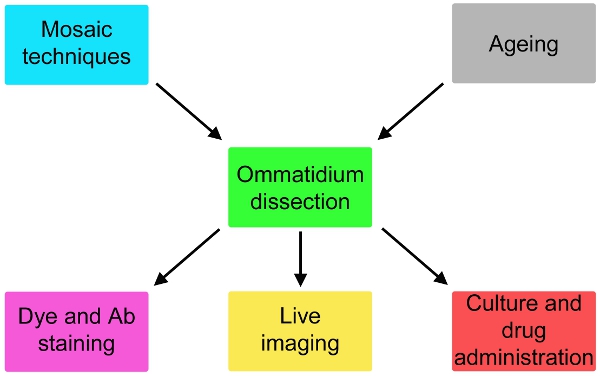
Figura 2. Variações possíveis do protocolo simples descrevem que envolvem genética da mosca e envelhecimento upstream da dissecção e coloração ou cultura para até 24 horas ea jusante de drogas de administração da dissecção.
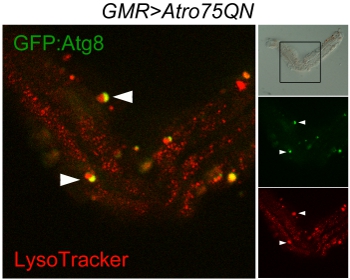
Figura 3 varredura confocal de autofagossomas e lisossomos em um único omatídeo dissecados de aw; GMR-Gal4, UAS-Atro75QN; UAS-GFP:.: Atg8 / fly +, expressando uma poliglutaminas Atrophin mutante e com idades entre 12 dias a 29 ° C. O painel de campo claro (à direita) exibe a estrutura quase intacta da omatídeo eo quadro indica a área digitalizada. Os lisossomos marcas vermelhas, verdes do autofagossomas, auto-lisossomos, resultando pela fusão das duas organelas, aparecem amarelo. Das setas indicam dois eventos de fusão em curso entre autofagossomas e lisossomos.
Discussão
A dissecção omatídeo única apresentada aqui permite a coleta de informações mais profundas sobre os processos biológicos celulares, como neurodegeneração, quando modelada no olho Drosophila. Os neurônios fotorreceptores são mais facilmente acessível do que outros neurônios e eles citoplasma é particularmente grande, e, portanto, adequado para estudar a dinâmica da vesícula, nas células mesma usada eficientemente em muitos modelos para quantificar neurodegeneração in vivo. O aspecto c...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos a Bernard Charroux para as discussões. Este trabalho foi financiado pela Escola KCL Biomédica.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Dispenser CO2 portáteis | Flystuff | 59-150 | Recargas também está disponível |
| DUMONT Tweezer n º 5 | AGAR Scientific | T5034 | |
| 3-Bem lâmina de vidro | EMS | 71561-01 | |
| Micro tesoura | VWR | HAMMHSB516-09 | |
| Médio Schneider | VWR | 733-1663 | |
| Lyso Tracker Red DND-99 | Invitrogen | L7528 | |
| Slides Superfrost | VWR | 631-0108 | |
| Vectashield com DAPI | Vector Labs | H-1200 | |
| Lamínulas | VWR | 631-1336 |
Referências
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Nisoli, I. Neurodegeneration by polyglutamine Atrophin is not rescued by induction of autophagy. Cell Death Differ. 17, 1577-1587 (2010).
- Charroux, B., Fanto, M. The fine line between waste disposal and recycling: DRPLA fly models illustrate the importance of completing the autophagy cycle for rescuing neurodegeneration. Autophagy. 6, 667-669 (2010).
- Hardie, R. C. Voltage-sensitive potassium channels in Drosophila photoreceptors. J Neurosci. 11, 3079-3095 (1991).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends in neurosciences. 24, 251-254 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-1234 (2011).
- Napoletano, F. Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat. The EMBO journal. 30, 945-958 (2011).
- Ravikumar, B. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease. Nature. 36, 585-595 (2004).
- Zou, S., Meadows, S., Sharp, L., Jan, L. Y., Jan, Y. N. Genome-wide study of aging and oxidative stress response in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 97, 13726-13731 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados