A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Ligated تطبيق ماوس الفحص باير لتصحيح حلقة لتقييم امتصاص الأمعاء البكتيرية بواسطة خلايا M
In This Article
Summary
الخلايا M في ظهارة جريب المرتبطة المتخصصة التي تغطي بقع باير لتلعب دورا هاما لالترصد المناعي المخاطي في الأمعاء المرتبطة الأنسجة اللمفاوية. نحن هنا وصف طريقة لتقييم من قبل خلايا جرثومية transcytosis M في الجسم الحي. هذا الأسلوب يوفر طريقة لفهم M - خلية وظيفة في الجهاز المناعي.
Abstract
ويسكن داخل القناة الهضمية لدينا مع عدد هائل من البكتيريا المتعايشة. ويتعرض بشكل مستمر على سطح الغشاء المخاطي في الجهاز الهضمي لهم وأحيانا لمسببات الأمراض. أنسجة الأمعاء المرتبطة اللمفاوية (GALT) تلعب دورا رئيسيا لتحريض الاستجابة المناعية المخاطية لهذه الميكروبات 1 و 2. لبدء الاستجابة المناعية المخاطية ، لا بد من نقل مستضدات المخاطية من لمعة الأمعاء عبر حاجز الظهارية في بصيلات اللمفاوية المنظمة مثل بقع باير. وتتوسط هذه transcytosis مستضد الخلايا المتخصصة التي الظهارية M 3 ، 4. الخلايا هي الخلايا الظهارية M شاذة أن يبلعم بنشاط الجزيئات والميكروبات. على عكس الخلايا الجذعية (DCS) ، والضامة ، لمولدات المضادات التي تستهدف lysosomes للتدهور ، الخلايا M transcytose أساسا المنضوية مستضدات. هذا transcytosis الجزيئات النشطة من خلال الخلايا M يسلم مستضد إلى بصيلات الكامنة اللمفاوية بتنظيمويعتقد د ضروريا لبدء المستضد محددة الاستجابات المناعية المخاطية. ومع ذلك ، فإن تعزيز هذه الآليات الجزيئية امتصاص المستضدات من قبل الخلايا M غير معروفة الى حد كبير. وأفادت ونحن في وقت سابق ان بروتين سكري 2 (GP2) ، وأعرب تحديدا على غشاء البلازما قمية من الخلايا M بين الخلايا المعوية ، بمثابة مستقبلات transcytotic لمجموعة فرعية من المتعايشة enterobacteria والممرضة ، بما في ذلك كولاي والسالمونيلا التيفية الفأرية enterica ضرب مصلي (س. التيفية الفأرية ) ، من خلال الاعتراف FimH ، وهو مكون من النوع الأول الشعرة على الغشاء الخارجي الجرثومي 5. هنا ، نقدم طريقة لتطبيق الفحص a باير الماوس ، حلقة التصحيح لتقييم امتصاص الأمعاء البكتيرية بواسطة خلايا M. هذا الأسلوب هو نسخة محسنة من الحلقة مقايسة الماوس المعوية الموصوفة سابقا 6 ، 7. تحسين نقاط هي كما يلي : 1. وقد استخدم Isoflurane كوكيل مخدر. 2. حوالي 1 سم ligated امب حلقة المعويةتم تعيين جي التصحيح باير لتصل. 3. وكانت البكتيريا fluorescently المسمى تناولها من قبل الخلايا M بواسطة كاشف العلامات مضان أو overexpressing بروتين فلوري مثل البروتين الفلوري الأخضر (GFP). 4. تم الكشف عن الخلايا M في ظهارة جريب المرتبطة تغطي رقعة من قبل باير كله يشن immunostainig مع الأضداد المضادة GP2. 5. وقد لوحظت الفلورسنت transcytosis البكتيرية بواسطة خلايا M عن طريق التحليل المجهري متحد البؤر. ويمكن للمقايسة باير الماوس ، التصحيح حلقة المعوية توريد أي نوع من الإجابة المتعايشة أو البكتيريا المسببة للأمراض transcytosed بواسطة خلايا M ، ويمكن أن يقودنا إلى فهم الآلية الجزيئية لكيفية تنشيط جهاز المناعة من خلال الخلايا المخاطية M.
Protocol
1. إعداد الخلايا البكتيرية
- الجلسرين متتالية خزنت البكتيريا الفلورية (مثل GFP التيفية الفأرية S. الإعراب) على لوحة LB آغار تحتوي على 100 ميكروغرام / مل من أمبيسيلين.
- ثقافة مستعمرة واحدة من آجار LB بين عشية وضحاها في 2 مل من المتوسط LB جديدة.
- إضافة 0.5 مل من ثقافة البكتيرية إلى 4.5 مل من المتوسط LB جديدة واحتضان حتى يتم التوصل إلى كثافة ضوئية من 1.0 إلى 600 نانومتر.
- حصاد الخلايا البكتيرية بواسطة الطرد المركزي (3000 XG ، 5 دقائق و 4 درجات مئوية).
- تجاهل طاف ويغسل مرتين مع 5.0 مل من الفوسفات العقيمة المالحة العازلة (PBS).
- Resuspend بيليه البكتيرية مع 5 مل من برنامج تلفزيوني ، واستخدام 50 ميكرولتر من تعليق يحتوي على ما يقرب من 10 7 وحدة مستعمرة تشكيل (كفو) كما قيحة.
- في حالة استخدام البكتيريا fluorescently المسمى ، وصفت الخلايا البكتيرية بواسطة كاشف مضان العلامات وفقا لبروتوكول قياسي.
2. Anesthesia
- ملء مربع صغير من البلاستيك (10 × 10 × 5 سم) مع 5 ٪ (V / V) تبخيرها isoflurane مختلطة مع الهواء (معدل التدفق : 200 مل / دقيقة).
- تخدير ثمانية إلى ستة عشر ضعف عمره الفئران الذكور أو الإناث في المربع.
- نقل الفئران إلى طاولة التشريح بعد التخدير.
- تخدير مستمر الفئران بنسبة 2 ٪ (V / V) تبخيرها isoflurane مختلطة مع الهواء (معدل التدفق : 200 مل / دقيقة) (الشكل 1). هذا هو إجراء المحطة.
3. باير لفحص التصحيح Ligated حلقة
- 1cm شق الجلد في البطن والصفاق ثم قطع البطن لتخدير الماوس وإخراج الأمعاء الدقيقة تحتوي على تصحيح باير.
- Ligate الأمعاء مع خيوط الحياكة ، مع الحرص على تجنب الأوعية الدموية. ملاحظة : ربط جانب واحد فقط من الأمعاء ، وترك الجانب الآخر فضفاضة.
- ضخ 50 ميكروليتر من البكتيريا أو تعليق برنامج تلفزيوني (مراقبة) مع حقنة في حلقة التصحيح ligated على باير ليالي فضفاضIDE للأمعاء (الشكل 2).
- ربط الجانب فضفاضة ، وإغلاق البطن الماوس مع مقطع.
- بعد 1 ساعة ، وإزالة ligated حلقة التصحيح باير ، والموت ببطء الماوس بواسطة الخلع عنق الرحم.
- باير المكوس والتصحيح من حلقة التصحيح باير لligated.
- امض الجانب قمية من التصحيح من قبل باير 1ml من PBS باستخدام محقنة موصولة إلى إبرة لإزالة السوائل المخاطية الزائدة والبكتيريا. امض تصحيح باير إضافية مرتين.
4. كله تلطيخ جبل والتحليل المجهري مبائر من التصحيح باير
- الإصلاح التصحيح باير في حل Cytofix / Cytoperm دينار بحريني على الجليد لمدة 1 ساعة.
- يغسل التصحيح باير لثلاث مرات مع 1ml دينار بحريني بيرم / اغسل العازلة لمدة 5 دقائق ، ثم كتلة مع 1 مل من عازلة تمنع تحتوي على 0.1 ٪ (W / V) سابونين ، 0.2 ٪ (W / V) BSA في برنامج تلفزيوني لمدة 30 دقيقة على الجليد.
- إضافة 200 أضعاف المخفف لمكافحة فأر GP2 ريتوكسيماب (5 ميكروغرام / مل) على عينة للكشف عنالخلايا M.
- احتضان لمدة 2 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجات مئوية.
- يغسل ثلاث مرات مع 1 مل من برنامج تلفزيوني الباردة ، ثم إضافة 200 أضعاف المخفف الأجسام المضادة مفتش الحكومة لمكافحة الجرذان مترافق مع DyLight549 (20 ميكروغرام / مل) إلى العينة.
- احتضان عينة على الجليد لمدة 2 ساعة.
- يغسل ثلاث مرات مع 1 مل من برنامج تلفزيوني الباردة ، ثم إضافة 50 أضعاف المخفف اليكسا 633 Phalloidin مترافق إلى عينة للكشف عن طراز F - الأكتين.
- احتضان على الجليد لمدة 2 ساعة.
- يغسل باستخفاف مع 1 مل من برنامج تلفزيوني الباردة. ثم ضع 3-4 قطع من الزجاج تغطي التعميم على شريحة ، وتضمين العينات في حل 30 ٪ من الجلسرين في برنامج تلفزيوني على الشريحة (الشكل 3).
- مراقبة العينات مع DM - IRE2 مبائر مجهر المسح بالليزر أو ترميم deconvolution DeltaVision المجهر.
5. ممثل النتائج :
ligated المثال عينة من الماوس مقايسة باير حلقة التصحيح مع GFP - التيفية S.ولوحظ murium مع deconvolution DeltaVision المجهر ترميم (الشكل 4). هو transcytosed GFP - التيفية الفأرية S. بواسطة GP2 الخلايا M +. ويمكن مقايسة باير الماوس ، التصحيح حلقة المعوية تحديد نوع البكتيريا المسببة للأمراض أو المتعايشة التي يمكن transcytosed بواسطة خلايا M.

الشكل 1. التخدير من الفئران تحت شرط isoflurane تبخيرها. تم تزويد تبخيرها isoflurane بواسطة جهاز تخدير ، مكرسة (الجانب الأيسر).
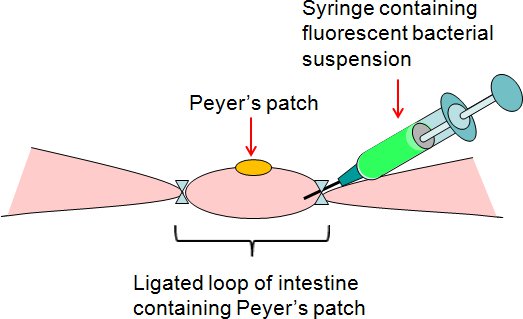
الشكل 2. موجز مقايسة باير لligated التصحيح حلقة المعوية. تم حقن تعليق الفلورسنت البكتيرية بواسطة حقنة في حلقة التصحيح باير ligated على الجانب فضفاض من الأمعاء.
الشكل رقم 3. جبل العينات. كانت جزءا لا يتجزأ من العينات في حل 30 ٪ من الجلسرين في برنامج تلفزيوني على شريحة الخاصة التي كانت متجهة لوحة بلاستيكية مثقبة (1MM سميكة) من قبل وكيل لاصقة على شريحة زجاجية.
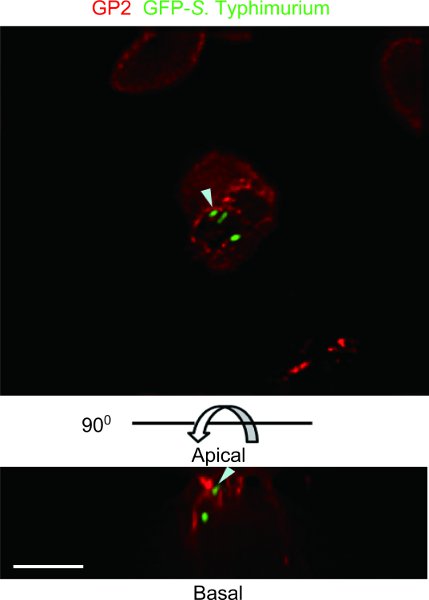
الشكل 4. مثال على الفأرة ligated مقايسة باير حلقة التصحيح مع GFP - التيفية الفأرية S.. وكان GP2 الملون ، والذي هو كما ذكرت علامة الخلية M محددة 5 ، مع GP2 الأضداد المضادة للماوس (الأحمر) ، وعينة لوحظ مع deconvolution DeltaVision المجهر ترميم. وكان التعبير عن GFP - التيفية الفأرية S. المشترك مع مترجمة GP2 على غشاء البلازما قمية من الخلايا M والحويصلات في هيولي تحت القمة (السهام). أعلى ، عرض قمي. والجانب السفلي ، وجهات النظر الجانبي. شريط الحجم : 10 ميكرومتر.
Discussion
فترة حضانة من التصحيح باير ligated مع تعليق الجرثومي هو عادة لمدة 1 ساعة لمراقبة إدراج الجرثومي في الخلايا M. في حالة الحضانة 4 ساعات ، غالبا ما يتم الكشف عن البكتيريا في منطقة الخلايا التائية من بقع باير. كما يتبخر التخدير نشوق isoflurane الفئران يمكن أن تبقي مستقرة ، وفترة ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر جميع أعضاء بنك الاستثمار الأوروبي لتطوير هذه التقنية. وأيد هذا البحث في جزء من المنح والمعونات وللبحوث العلمية في المجالات ذات الأولوية على "الاتجار الغشائية" (HO) ، و "ماتريكس من الظواهر المعدية" (KH) والعلماء الشباب (SF وKH) ، والبحث العلمي (HO ) ، والبحث العلمي في مجالات مبتكرة "الخدمات اللوجستية بين الخلايا" (HO) ، من وزارة التربية والتعليم والثقافة والرياضة والعلوم والتكنولوجيا في اليابان.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليق (اختياري) |
|---|---|---|---|
| آجار LB - أمبيسيلين 100 | SIGMA | L5667 | |
| Cy3 أحادية رد الفعل صبغ حزمة | جنرال إلكتريك للرعاية الصحية | PA23001 | |
| الكسا فلور 350 الكربوكسيلية الحمضية ، succinimidyl استر | Invitrogen | A10168 | |
| استنشاق التخدير جهاز | شينانو Seisakusho | SN - 487 | |
| والتثبيت Permeabilization حل | دينار بحريني | 554722 | |
| مكافحة فأر 2 بروتين سكري الجسم المضاد | MBL | D278 - 3 | 200 أضعاف التخفيف (5μg/ml) |
| الماعز المضادة للمفتش الجرذ ، F (أ ب ') 2 جزء محدد | جاكسون ImmunoResearch | 112-505-006 | 200 أضعاف التخفيف (20μg/ml) |
| الكسا فلور 633 Phalloidin | المسابر الجزيئية | A22284 | 50 أضعاف التخفيف |
| مبائر الليزر المسح المجهر | لايكا مايكروسيستمز | DMIRE2 | |
| DeltaVision ترميم deconvolution مجهر | تطبق الدقة | DeltaVision الأساسية |
References
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved