このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
M細胞による細菌の取り込みを評価するパイエル板腸管ループアッセイを連結したマウスのアプリケーション
要約
パイエル板を覆う特殊な濾胞関連上皮におけるM細胞は腸管関連リンパ系組織における粘膜免疫監視に重要な役割を果たす。ここでは、M細胞による細菌のトランスサイトーシスのために評価方法を説明 in vivoで。このメソッドは、免疫系におけるM細胞の機能を理解する方法を提供する。
要約
私たちの腸の内側には共生細菌の膨大な数で生息しています。消化管の粘膜表面は、継続的に、時には病原体にさらされています。腸管関連リンパ組織(GALT)は、これらの微生物1、2への粘膜免疫応答の誘導に重要な役割を果たす。粘膜免疫応答を開始するには、粘膜の抗原は、パイエル板などの組織リンパ濾胞に上皮バリアを介して腸管内腔から運ばれている必要があります。この抗原のトランスは、特殊な上皮M細胞3、4によって媒介される。 M細胞は積極的に高分子や微生物を貪食非定型上皮細胞である。樹状細胞(DC)とマクロファージ、分解のためにリソソームへの標的抗原とは異なり、M細胞は主に内部化された抗原をtranscytose。 M細胞を介してこの積極的な高分子のトランスサイトーシスは、基盤となる組織リンパ濾胞に抗原を提供dは、抗原特異的粘膜免疫応答を開始するために不可欠であると考えられている。しかし、M細胞がこの抗原取り込みを促進する分子機構はほとんど不明です。我々は以前、特に腸の中のM細胞の頂端部細胞膜上に発現する糖タンパク質2(GP2)は、 大腸菌やサルモネラ血清型ネズミチフス菌(S.ネズミチフス菌を含む共生と病原性腸内細菌のサブセットのためのtranscytotic受容体として機能することを報告している)、FimH、細菌の外膜5上のI型線毛の成分を認識すること。ここで、我々は、マウスのパイエル板腸管ループアッセイのアプリケーションM細胞による細菌の取り込みを評価するための方法を提示する。このメソッドは、以前に6,7を説明したマウス腸管ループアッセイの改良版です。改良点は以下のとおりである:1。イソフルランは、麻酔剤として使用した。 2。約1cm結紮腸管ループincludINGパイエル板が設置されました。 3。 M細胞に取り込ま細菌は、蛍光の蛍光標識試薬によってまたは緑色蛍光タンパク質(GFP)などの過剰発現蛍光タンパク質で標識した。 4。パイエル板を覆う濾胞関連上皮におけるM細胞は、抗GP2抗体でホールマウントimmunostainigにより検出した。 5。 M細胞による蛍光細菌のトランスは、共焦点顕微鏡分析により観察した。マウスパイエル板腸管ループアッセイは、どのようなM細胞によってtranscytosed共生や病原性細菌の答えを供給することができる、とM細胞を介して粘膜免疫系を刺激する方法の分子機構を理解するのにつながる可能性があります。
プロトコル
1。細菌細胞の調製
- ストリークグリセロールは、LB上の蛍光細菌(例えば、ネズミチフス菌の発現GFPなど)アンピシリン100μg/ mlを含む寒天プレートを買い物カゴに追加。
- 新しいLB培地2 mlの一晩LB寒天培地からの培養は、単一のコロニー。
- 600nmで1.0の光学密度に達するまで新たなLB培地とインキュベート4.5 mlにバクテリア培養液0.5mlを追加。
- 遠心により収穫細菌細胞(3,000 × gで、5分、4℃)。
- 上清を捨て、滅菌リン酸緩衝生理食塩水(PBS)5.0 mlで2回洗浄する。
- PBS 5mlでバクテリアペレットを再懸濁し、そして接種物として約10 7コロニー形成単位(CFU)を含む懸濁液50μlを使用してください。
- 蛍光標識された細菌を用いた場合には、細菌細胞は、標準的なプロトコルに従って蛍光標識試薬で標識した。
2。 Anesthesia
- 5%(v / v)で、小さなプラスチック製ボックス(10 × 10 × 5センチ)埋めることは、空気(:200ml /分の流量)と混合イソフルラン気化。
- ボックスの16 -弱い齢の雄または雌マウス八への麻酔。
- 麻酔の後に解剖台にマウスを移動します。
- ( 図1):連続して2%(V / V)でマウスを麻酔とイソフルランは、空気(200ml /分の流量)と混合気化。これは端末の手順です。
3。連結したパイエル板のループアッセイ
- その後、切り込みを入れる腹部の皮膚の1cmと麻酔マウスの腹部腹膜をカットし、パイエル板を含む小腸を取り出してください。
- 血管をしないように注意しながら、糸を縫製して腸をライゲーションする。注:のみバインド腸の一方の側、そして反対側は緩いまま。
- 緩みの上で連結されたパイエル板のループに注射器で細菌懸濁液またはPBS(コントロール)の50μlを注入する腸のIDE( 図2)。
- ゆるみ側をバインドし、クリップをマウスの腹部を閉じます。
- 1時間後、連結したパイエル板のループを削除し、頚椎脱臼によりマウスを安楽死させる。
- 結紮パイエル板ループから税パイエル板。
- 過剰な粘液や細菌を除去するために針に接続された注射器を使用してPBSを1mlによってパイエル板の頂端側に点滅。パイエル板はさらに2回点滅。
4。全体のマウントの染色とパイエル板の共焦点顕微鏡解析
- 1時間氷上でBD Cytofix / Cytoperm溶液中でのパイエル板を修正。
- 上で30分間0.1%(w / v)のサポニン、0.2%(w / v)のPBS中のBSAを含むブロッキングバッファー1mlをブロックしてBDパーマ/ 5分間洗浄バッファーを1mlのでパイエル板を3回洗浄し、氷。
- 検出するために試料を200倍の抗マウス希釈GP2モノクローナル抗体(5μg/ ml)を追加するM細胞。
- 4℃、室温または一晩で2時間℃でインキュベート
- 冷PBS 1mlで3回洗浄し、その後DyLight549(20μg/ ml)を持つ試料に結合した200倍希釈した抗ラットIgG抗体を加える。
- 2時間のためのサンプルを氷上でインキュベートする。
- 冷PBS 1mlで3回洗浄し、その後、F -アクチンを検出するために試料を50倍希釈のAlexa 633共役ファロイジンを追加します。
- 2時間氷上でインキュベートする。
- 冷PBS 1mlで軽く洗ってください。その後、スライド上に円形のカバーガラス3〜4枚を配置し、スライド上のPBSでグリセロールの30%溶液( 図3)の試料を埋め込 みます。
- DM - IRE2共焦点レーザ走査型顕微鏡やDeltaVisionの復元のデコンボリューション顕微鏡で標本を観察。
5。代表的な結果:
GFP - チフス菌とパイエル板のループアッセイ結紮マウスの試験片の例muriumはDeltaVisionの復元のデコンボリューション顕微鏡( 図4)で観察された。 GFP -、ネズミチフス菌は、GP2 + M細胞によってtranscytosedれる。マウスパイエル板腸管ループアッセイは、M細胞によってtranscytosedすることができる共生や病原性細菌の種類を識別することができます。

図1。気化イソフルラン条件の下でマウスの麻酔。気化イソフルランは、麻酔専用装置(左側)によって提供されました。
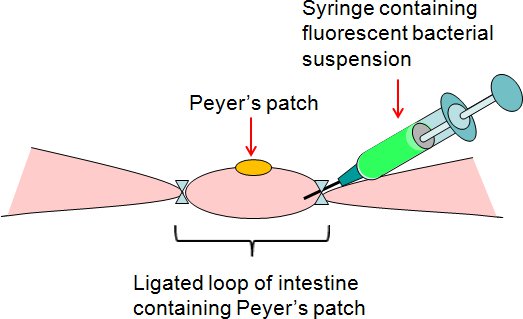
図2。結紮パイエル板腸管ループアッセイの概要。蛍光細菌懸濁液は腸の緩み側に連結されたパイエル板のループに注射器で注入した。
図3。試料のマウント。試料は穴あきプラスチックプレート(厚さ1mm)のスライドガラス上に接着剤でバインドされた特殊なスライド上にPBSでグリセロールの30%溶液に包埋した。
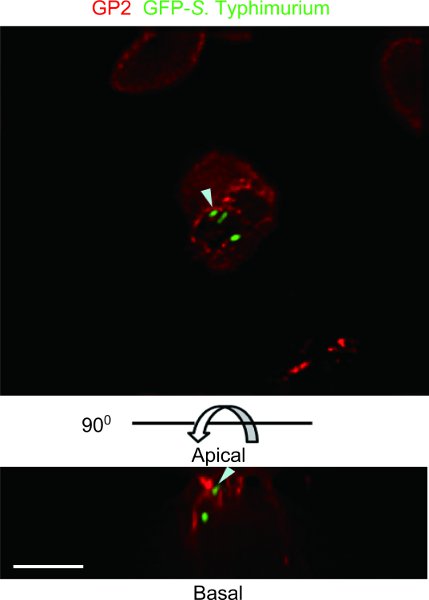
図4 GFP -、ネズミチフス菌とパイエル板のループアッセイを結紮マウスの例。 M細胞特異的マーカー5として報告されているGP2は、抗マウスGP2の抗体(赤)で染色した。試料はDeltaVision復元のデコンボリューション顕微鏡で観察した。 GFP発現、ネズミチフス菌は、M細胞の頂端部細胞膜上とapexの下にある細胞質小胞(矢頭)でGP2と共局在していた。上部、根尖ビュー。底面と側面、側面図。スケールバー:10μmである。
ディスカッション
細菌懸濁液と連結パイエル板のインキュベーション時間は、M細胞への細菌の混入を観察するために1時間通常です。 4時間のインキュベーションの場合には、細菌は多くの場合、パイエル板のT細胞領域に検出されます。気化イソフルラン吸入麻酔は、マウスを安定に保つことができるように、細菌懸濁液と連結パイエル板のインキュベーション時間は、パイエル板のT細胞領域に移動する?...
開示事項
利害の衝突は宣言されません。
謝辞
著者らはこの手法を開発するためのすべてのEIBのメンバーに感謝したいと思います。この研究は、特定領域研究"膜輸送"(HO)、および(KH)、若手研究(SFとKH)、および科学研究"感染現象のマトリックス"(HOによって部分的にサポートされていました)、および革新的な領域研究日本の教育、文化、スポーツ、科学技術省から"細胞内ロジスティクス"(HO)、。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| LB寒天アンピシリン 100 | SIGMA | L5667 | |
| Cy3のモノ反応 染料パック | GEヘルスケア | PA23001 | |
| のAlexa Fluor ® 350 カルボン酸、 スクシンイミジルエステル | インビトロジェン | A10168 | |
| 吸入麻酔 装置 | 信濃製作所 | SN - 487 | |
| 固定と 透過化 ソリューション | BD | 554722 | |
| 抗マウス 糖タンパク質2 抗体を | MBL | D278 - 3 | 200倍希釈(5μg/ml) |
| ヤギ抗ラットIgG、 F(ab')2断片 具体的 | ジャクソン イムノ | 112-505-006 | 200倍希釈(20μg/ml) |
| のAlexa Fluor ® 633 ファロイジン | 分子プローブ | A22284 | 50倍希釈 |
| 共焦点レーザー 走査型顕微鏡 | ライカマイクロシステムズ | DMIRE2 | |
| DeltaVision 修復 デコンボリューション 顕微鏡 | アプライドプレシジョン | DeltaVisionコア |
参考文献
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved