È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Applicazione di un mouse legatura Patch Peyer Assay intestinale Loop per valutare assorbimento da parte delle cellule batteriche M
In questo articolo
Riepilogo
Cellule M specializzato in un follicolo-associato epitelio che copre le placche di Peyer svolgono un ruolo importante per la immunosorveglianza mucosa intestinale in tessuto linfoide associato. Qui abbiamo descritto il metodo di valutazione per transcitosi batterica da parte delle cellule M In vivo. Questo metodo fornisce un metodo per capire M-funzione delle cellule del sistema immunitario.
Abstract
L'interno del nostro intestino è abitato con un numero enorme di batteri commensali. La superficie mucosa del tratto gastrointestinale è continuamente esposto a loro e, occasionalmente, agli agenti patogeni. L'intestino tessuto linfoide associato (GALT) svolgono un ruolo chiave per l'induzione della risposta immunitaria della mucosa di questi microbi 1, 2. Per iniziare la risposta immunitaria delle mucose, gli antigeni della mucosa deve essere trasportato dal lume dell'intestino attraverso la barriera epiteliale organizzato in follicoli linfoidi come le placche di Peyer. Questo transcitosi antigene è mediata da cellule specializzate M epiteliali 3, 4. Cellule M sono atipici cellule epiteliali che attivamente fagocitare macromolecole e microbi. A differenza delle cellule dendritiche (DC) e macrofagi, che gli antigeni target lisosomi per la degradazione, le cellule M principalmente transcytose gli antigeni interiorizzato. Questo transcitosi macromolecolari vigoroso attraverso le cellule M fornisce l'antigene al sottostante follicoli linfoidi organizzato unod si crede di essere indispensabile per l'avvio della mucosa risposte immunitarie antigene-specifiche. Tuttavia, i meccanismi molecolari alla promozione di questo assorbimento dell'antigene da parte delle cellule M sono in gran parte sconosciuti. Abbiamo già riferito che la glicoproteina 2 (Gp2), in particolare espressi sulla membrana plasmatica apicale delle cellule M tra enterociti, serve come un recettore transcytotic per un sottoinsieme di commensale e di enterobatteri patogeni, tra cui l'Escherichia coli e Salmonella enterica sierotipo Typhimurium (S. Typhimurium ), riconoscendo FimH, un componente di tipo I pili sulla membrana batterica esterna 5. Qui vi presentiamo un metodo per l'applicazione di test patchare una Peyer mouse ad anello per valutare l'assorbimento intestinale batterica da parte delle cellule M. Questo metodo è una versione migliorata del test intestinale ciclo del mouse descritto in precedenza 6, 7. I punti migliori sono le seguenti: 1. Isoflurano è stato usato come agente anestetico. 2. Circa 1 cm legatura compresi anse intestinalipatch di ING Peyer è stato istituito. 3. I batteri captata dalle cellule M sono state marcate da reagente etichettatura fluorescenza o con iperespressione delle proteine fluorescenti, come la proteina fluorescente verde (GFP). 4. Cellule M nel follicolo-associato epitelio che copre patch di Peyer sono stati rilevati in diretta integrale con montaggio immunostainig con anticorpi anti GP2. 5. Fluorescenti transcitosi batterica da parte delle cellule M sono stati osservati da analisi al microscopio confocale. La patch di Peyer mouse test ciclo intestinale potrebbe fornire la risposta che tipo di batteri patogeni o commensali transcytosed da parte delle cellule M, e può portarci a comprendere il meccanismo molecolare di come stimolare il sistema immunitario della mucosa attraverso le cellule M.
Protocollo
1. Preparazione delle cellule batteriche
- Glicerolo Streak fornito batteri fluorescente (GFP che esprimono come S. Typhimurium) su una piastra di agar LB contenente 100 mg / ml di ampicillina.
- La cultura di una singola colonia da agar-agar LB durante la notte in 2 ml di terreno LB nuovo.
- Aggiungere 0,5 ml di coltura batterica a 4,5 ml di terreno LB ed incubare nuove fino densità ottica di 1,0 a 600 nm è raggiunto.
- Cellule raccolta batterica mediante centrifugazione (3.000 xg, 5 min, 4 ° C).
- Eliminare il surnatante e lavare due volte con 5,0 ml di soluzione fisiologica sterile tampone fosfato (PBS).
- Risospendere il pellet batterico con 5 ml di PBS, e utilizzare il 50 microlitri della sospensione contenente circa 10 7 unità che formano colonie (CFU) come l'inoculo.
- In caso di utilizzo di batteri fluorescente, le cellule batteriche sono stati etichettati da reagente etichettatura fluorescenza secondo il protocollo standard.
2. Anesthesia
- Riempire una piccola scatola di plastica (10 x 10 x 5 cm) con il 5% (v / v) vaporizzato isoflurano miscelato con aria (portata: 200 ml / min).
- Anestetizzare otto a topi maschi o femmina di sedici deboli-vecchi nella casella.
- Spostate il mouse a un tavolo dell'autopsia dopo l'anestesia.
- Continuamente anestetizzare i topi del 2% (v / v) vaporizzato isoflurano miscelato con aria (portata: 200 ml / min) (Figura 1). Questa è una procedura terminale.
3. Patch di legatura di Peyer ciclo di analisi
- Incise 1 centimetro della pelle del ventre e poi tagliare il peritoneo addominale di un topo anestetizzato ed estrarre il piccolo intestino contiene la patch di Peyer.
- Legare l'intestino con il filo da cucire, avendo cura di evitare i vasi sanguigni. Nota: solo legare una parte dell'intestino, e lasciare l'altra libera.
- Iniettare 50 ml di sospensione batterica o PBS (controllo) con una siringa nel ciclo di patch legatura di Peyer sulla s scioltiide dell'intestino (Figura 2).
- Legare parte sciolti, e chiudere l'addome del mouse con una clip.
- Dopo 1 ora, rimuovere la legatura di Peyer ciclo di patch, e l'eutanasia con il mouse da dislocazione cervicale.
- Peyer accise di patch da ciclo di patch di Peyer legatura.
- Lampeggiante sul lato apicale di patch di Peyer da 1 ml di PBS con l'utilizzo di siringa collegata ad un ago per rimuovere l'eccesso di liquidi delle mucose e batteri. Lampeggiante di patch di Peyer altre due volte.
4. Montare colorazione intero e analisi al microscopio confocale di patch di Peyer
- Fix patch di Peyer in BD Cytofix / Cytoperm soluzione in ghiaccio per 1 ora.
- Lavare patch di Peyer tre volte con 1 ml di BD Perm / Tampone di lavaggio per 5 minuti, e poi blocco con 1 ml di tampone di bloccaggio contenente 0,1% (w / v) di saponina, 0,2% (w / v) di BSA in PBS per 30 min a ghiaccio.
- Aggiungere 200 volte diluito anti-topo GP2 anticorpo monoclonale (5 mg / ml) al modello per rilevareM cellule.
- Incubare per 2 ore a temperatura ambiente o una notte a 4 ° C.
- Lavare tre volte con 1 ml di PBS freddo, poi aggiungere 200 volte diluito anti-topo IgG coniugato con DyLight549 (20 mcg / ml) per il campione.
- Incubare campione in ghiaccio per 2 ore.
- Lavare tre volte con 1 ml di PBS freddo, quindi si aggiungono 50 volte diluito Alexa 633 falloidina coniugato al modello per rilevare F-actina.
- Incubare in ghiaccio per 2 ore.
- Lavare delicatamente con 1 ml di PBS freddo. Poi tre a quattro pezzi di copertura in vetro circolare in una diapositiva, e incorporare i campioni in una soluzione 30% di glicerolo in PBS sul vetrino (Figura 3).
- Osservare i campioni con un DM-IRE2 microscopio confocale a scansione laser o un microscopio Restauro DeltaVision deconvoluzione.
5. Rappresentante dei risultati:
L'esempio esemplare di un mouse legatura ciclo di Peyer test patch con GFP-S. typhimurium è stato osservato con un microscopio deconvoluzione Restauro DeltaVision (Figura 4). GFP-S. Typhimurium è transcytosed da GP2 + cellule M. Una patch di Peyer mouse test anse intestinali in grado di identificare il tipo di batteri commensali o patogeni che possono essere transcytosed dalle cellule M.

Figura 1. Anestesia dei topi sotto vaporizzato condizione isoflurano. Vaporizzato isoflurano è stato fornito da una anestesia-apparato dedicato (lato sinistro).
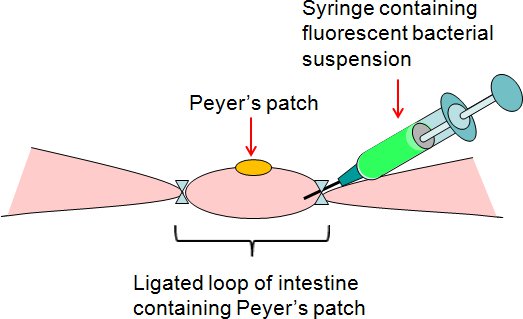
Figura 2. Sintesi dei test di loop di Peyer legatura La patch intestinale. La sospensione fluorescente batterica è stato iniettato con la siringa nel ciclo di patch legatura di Peyer nella parte libera del intestino.
Figura 3. Monte dei campioni. I campioni sono stati integrati in una soluzione al 30% di glicerolo in PBS su un vetrino speciale in cui era tenuto un piatto di plastica forato (spessore 1mm) da un agente adesivo su un vetrino.
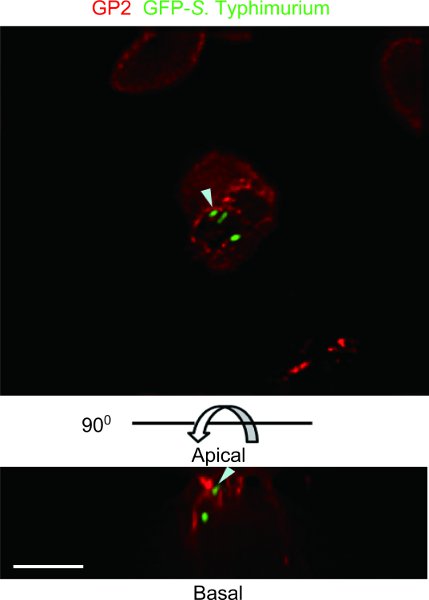
Figura 4. Esempio di un mouse legatura ciclo di Peyer test patch con GFP-S. Typhimurium. GP2, che viene segnalato come marcatore specifico di cellule M 5, era macchiata di anti-topo GP2 (rosso). Il campione è stato osservato con un microscopio DeltaVision deconvoluzione Restaurazione. GFP che esprimono S. Typhimurium è stato co-localizzato con GP2 sulla membrana plasmatica apicale delle cellule M e nelle vescicole subapical citoplasmatica (punte di freccia). In alto, vista apicale. Fondo e laterali, viste laterali. Scala grafica: 10 micron.
Discussione
Il tempo di incubazione di patch di legatura di Peyer con sospensione batterica è di solito per 1 ora di osservare l'incorporazione batterica in cellule M. In caso di 4 ore di incubazione, i batteri sono spesso rilevate nella zona delle cellule T di placche di Peyer. Come l'anestesia vaporizzato inalanti isoflurano potrebbe mantenere stabili i topi, il tempo di incubazione della patch di Peyer legatura con sospensione batterica è estendibile a osservare i batteri che si muovono in cellule T nella zona di...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare tutti i membri della BEI per lo sviluppo di questa tecnica. Questa ricerca è stata sostenuta in parte da Grant-in-Aid per la ricerca scientifica sulle aree prioritarie "traffico di membrana" (HO), e "Matrix dei fenomeni infettive" (KH), giovani scienziati (SF e KH), e della Ricerca Scientifica (HO ), e della Ricerca Scientifica in settori innovativi "Logistica intracellulare" (HO), dal Ministero della Pubblica Istruzione, Cultura, Sport, Scienza e Tecnologia del Giappone.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| LB-agar ampicillina 100 | SIGMA | L5667 | |
| Cy3 mono-reattiva Dye pack | GE Healthcare | PA23001 | |
| Alexa Fluor 350 carbossilico, succinimidile estere | Invitrogen | A10168 | |
| L'anestesia per inalazione apparato | Shinano Seisakusho | SN-487 | |
| Fissazione e Permeabilizzazione Soluzione | BD | 554722 | |
| Topo anti Glicoproteina 2 anticorpo | MBL | D278-3 | 200-diluizione (5μg/ml) |
| Capra anti-IgG di ratto, F (ab ') 2 frammento specifico | Jackson ImmunoResearch | 112-505-006 | 200-diluizione (20μg/ml) |
| Alexa Fluor 633 Falloidina | Molecular Probes | A22284 | 50-diluizione |
| Laser confocale microscopio a scansione | Leica Microsystems | DMIRE2 | |
| DeltaVision Restauro deconvoluzione microscopio | Applied Precision | DeltaVision core |
Riferimenti
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon