JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스의 응용은 M 세포에 의해 박테리아 이해를 평가하는 Peyer의 패치 장 루프 분석 출혈도 잡았
요약
Peyer의 패치를 다루는 전문 뿌리 - 관련 상피의 M 세포는 창자 - 관련 림프 조직에서 점막 immunosurveillance을위한 중요한 역할을한다. 여기 우리는 M 세포에 의해 세균 transcytosis에 대한 평가 방법을 설명 생체내에. 이 방법은 면역 시스템에 M - 세포 기능을 이해하는 방법을 제공합니다.
초록
우리의 창자의 안쪽은 공생 박테리아의 거대한 숫자 살고 있습니다. 위장관의 점막 표면은 지속적으로 그들과 때때로 병원균에 노출됩니다. 인내심을 관련 림프 조직 (갈트)는 이러한 미생물 1, 2에 대한 점막 면역 반응의 유도에 중요한 역할을한다. 점막 면역 반응을 시작하려면, 점막 항원이 같은 Peyer의 패치로 구성 림프 모공에 상피 장벽을 가로질러 내장 루멘에서 이송해야합니다. 이 항원 transcytosis는 전문 상피 세포 M 3, 4에 의해 중재됩니다. M 세포가 적극적으로 macromolecules과 미생물을 phagocytose 비정형 상피 세포 있습니다. 돌기 세포 (DCS)와 macrophages, 저하에 대한 lysosomes에 대상 항원과는 달리, M 세포는 주로 내면 항원을 transcytose. M 세포를 통해이 활발한 macromolecular의 transcytosis는 기본 구성 림프 모공에 항원을 제공합니다D는 항원에 특정한 점막 면역 반응을 시작을위한 필수적인 것으로 생각됩니다. 그러나, M 세포하여 항원 이해를 촉진 분자 메커니즘은 대부분 알 수 있습니다. 우리는 이전에 특별히 enterocytes 간의 M 세포의 꼭대기의 플라즈마 막에 표현 당단백질 2 (Gp2)는, 대장균과 살모넬라균 enterica serovar Typhimurium (S. Typhimurium을 포함하여 공생과 enterobacteria 병원성의 하위 집합에 대한 transcytotic 수용체로 역할을보고있다 ), FimH, 내가 세균성 외부 멤브레인 5 pili 유형의 구성 요소를 인식하여. 여기, 우리는 M 세포에 의해 박테리아 이해를 평가하기 위해 마우스 Peyer의 패치 장 루프 분석의 응용 프로그램에 대한 방법을 제시한다. 이 방법은 이전에 6, 7 장의 설명 마우스 루프 분석의 향상된 버전입니다. 개선된 점은 다음과 같습니다 : 1. Isoflurane은 마취제로 사용되었다. 2. 약 1cm 출혈도 잡았 장 루프 includING Peyer의 패치를 설치했습니다. 3. M 세포에 의해 촬영 박테리아는 찬란 형광 라벨 시약이나 녹색 형광 단백질 (GFP) 같은 형광 단백질 overexpressing로 분류되었습니다. 4. Peyer의 패치를 덮고 뿌리 - 관련 상피의 M 세포는 안티 Gp2 항체와 전체 마운트 immunostainig에 의해 발견되었다. 5. M 세포에 의해 형광 박테리아 transcytosis은 공촛점 현미경 분석에 의해 관찰되었다. 마우스 Peyer의 패치 장 루프 분석은 답변을 공급 수 어떤 종류의 공생 또는 M 세포에 의해 transcytosed 병원성 세균 및 M 세포를 통해 점막 면역 체계를 자극하는 방법의 분자 메커니즘을 이해로 우리를 이끌 수 있습니다.
프로토콜
1. 세균성 세포의 준비
- 줄무늬의 글리세롤는 LB에 (예 : GFP 표현 S. Typhimurium)에 형광 박테리아를 꽉찬 100 μg / 암피실린의 ML이 포함된 한천 플레이트.
- 새로운 LB 매체 2 ML에서 하룻밤 LB 한천 배지에서 문화는 하나의 식민지.
- 600 NM에서 1.0의 광학 밀도에 도달할 때까지 새로운 LB 매체와 부화 4.5 ML에 세균성 문화의 0.5 ML을 추가합니다.
- 원심 분리하여 세포를 수확 세균 (3,000 XG, 5 분, 4 ° C).
- 뜨는을 취소하고 멸균 인산 완충 식염수 (PBS)의 5.0 ML로 두 번 씻는다.
- PBS 5 ML과 박테리아 펠렛을 Resuspend하고 inoculum로 약 10 7 콜로니 형성 단위 (CFU)이있는 정지 50 μl를 사용합니다.
- 찬란 분류 박테리아를 사용하는 경우에는 세균성 세포는 표준 프로토콜에 따라 형광 라벨 시약에 의해 분류되었다.
2.nesthesia
- 5 % (V / V)와 함께 작은 플라스틱 상자 (10 × 10 × 5cm)를 기입하면 증발 isoflurane 공기 (유량 : 200 ML / 분)와 혼합.을
- 마취 여덟에있는 상자에 열여섯 - 약한 세의 남성 또는 여성 쥐.
- 마취 후 부검 테이블에 마우스를 이동합니다.
- 지속 2퍼센트 (V / V)에 의해 생쥐를 마취하는 것은 증발 isoflurane 공기 (유량 : 200 ML / 분)와 함께 혼합 (그림 1).를 이것은 터미널 절차입니다.
3. 출혈도 잡았 Peyer의 패치 루프 분석
- 복부 피부와 다음의 절개 1cm가 anesthetized 마우스의 복부 복막을 잘라 Peyer의 패치를 포함하고있는 작은 창자를 꺼내.
- 혈관을 피하기 위해 간병, 봉제 원사와 대장을 Ligate. 참고 : 대장만이 바인딩 한쪽, 그리고 느슨한 반대편 두십시오.
- 느슨한의에서 출혈도 잡았 Peyer의 패치 루프에 세균 현탁액 또는 주사기로 PBS (제어) 50 μl를 주입대장의 IDE (그림 2).
- 느슨한 측면을 바인딩, 그리고 클립과 마우스의 복부를 닫습니다.
- 1 H 후, 출혈도 잡았 Peyer의 패치 루프를 제거하고 경추 전위에 의한 마우스를 안락사.
- 출혈도 잡았 Peyer의 패치 루프에서 소비세 Peyer의 패치.
- 초과 점막 액체와 세균을 제거 바늘에 연결된 주사기를 이용한 PBS의 1ml에 의해 Peyer의 패치의 혀끝의 측면을 번쩍. Peyer의 패치에게 추가로 두 번 깜박임.
4. 전체 마운트 얼룩과 Peyer의 패치 공촛점 현미경 분석
- 1 시간을위한 얼음 BD Cytofix / Cytoperm 솔루션에 Peyer의 패치를 수정.
- 30 분 0.1 % (W / V) 사포닌, 0.2 % (W / V) PBS에 BSA를 포함 차단 버퍼 1 ML과 블록 다음 BD 페름 / 5 분 버퍼를 세척 1ml와 Peyer의 패치 세 번 씻고, 그리고 얼음.
- 200 배 희석이 방지 마우스를 표본으로 GP2 단클론 항체 (5 μg / ML)는 검색에 추가M 세포.
- 4 2 실온에서 시간이나 야간을위한 품어 ° C.
- 차가운 PBS 1 ML로 세 번 씻어 다음 표본에 DyLight549 (20 μg / ML)와 복합 200 배 희석 안티 쥐 IgG 항체를 추가합니다.
- 2 시간을위한 얼음에 샘플을 품어.
- 차가운 PBS 1 ML로 세 번 씻어 다음, F - 굴지을 감지하기 위해 시편 50 배 희석 알렉사 633 복합 Phalloidin를 추가합니다.
- 2 시간을위한 얼음 알을 품다.
- 차가운 PBS 1 ML로 가볍게 씻으십시오. 그런 다음 슬라이드에 원형 커버 유리 3-4 조각을 배치하고, 슬라이드 (그림 3)에서 PBS에서 글리세롤의 30 % 용액에 표본 포함.
- DM - IRE2 공촛점 레이저 스캐닝 현미경이나 DeltaVision 복원 deconvolution 현미경과 표본을 관찰.
5. 대표 결과 :
마우스의 표본 예제는 GFP - S. 균과 Peyer의 패치 루프 분석 출혈도 잡았murium은 DeltaVision 복원 deconvolution 현미경 (그림 4)와 함께 관찰되었다. GFP - S. Typhimurium은 GP2 + M 세포에 의해 transcytosed 있습니다. 마우스 Peyer의 패치 장 루프 분석은 M 세포에 의해 transcytosed 수 있습니다 공생이나 병원성 세균의 종류를 식별할 수 있습니다.

그림 1. 증발 isoflurane 조건하에 생쥐의 아나스타샤. 증발 isoflurane는 마취 - 전용 장치 (왼쪽)가 제공되었습니다.
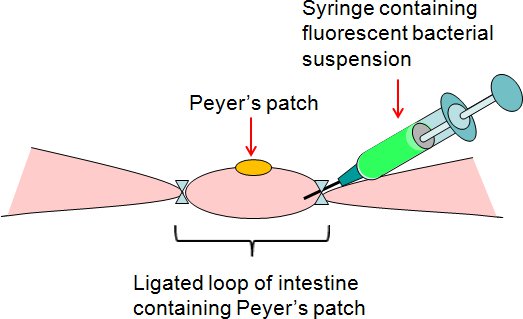
그림 2. 출혈도 잡았 Peyer의 패치 장 루프 분석의 요약. 형광 박테리아 정지는 대장의 느슨한 측면에 출혈도 잡았 Peyer의 패치 루프에 주사기로 주입했다.
그림 3. 표본의 마운트합니다. 표본은 구멍 플라스틱 플레이트는 (두께 1mm) 유리 슬라이드에 접착제 에이전트에 의해 묶여있는 특별한 슬라이드에 PBS에서 글리세롤의 30 % 용액에 포함되었습니다.
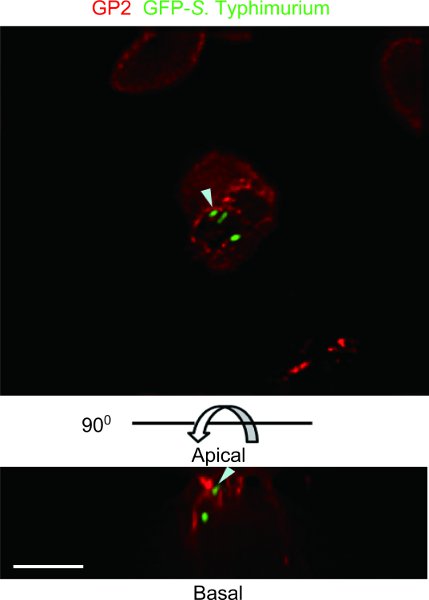
그림 4. GFP - S. Typhimurium과 Peyer의 패치 루프 분석 출혈도 잡았 마우스의 예. M 세포 특정 마커 5보고 GP2는, 안티 - 마우스 GP2 항체 (적색)와 스테인드했습니다. 표본은 DeltaVision 복원 deconvolution의 현미경으로 관찰했다. GFP - 표현 S. Typhimurium은 M 세포의 꼭대기의 플라즈마 막과 subapical 세포질 vesicles (화살촉)에 GP2와 함께 공동화된되었습니다. 탑, 혀끝의 볼 수 있습니다. 하단과 측면, 측면 전망이 있습니다. 스케일 바 : 10 μm의.
토론
세균 현탁액과 출혈도 잡았 Peyer의 패치의 부화 시간은 M 세포에 박테리아 정관을 준수하기 위해 1 시간을 위해 일반적이다. 4 시간 보육의 경우, 박테리아가 자주 Peyer의 패치의 T 세포 영역에 감지됩니다. 증발 isoflurane 흡입 마취는 마우스가 안정적으로 지킬 수로서, 세균 현탁액과 출혈도 잡았 Peyer의 패치의 배양 시간은 Peyer의 패치에 T - 세포 영역으로 이동 박테리아를 관찰 확장 가능합니다...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
저자는이 기술을 개발하기위한 모든 EIB 회원 감사드립니다. 이 연구는 우선 지역 "막 트래픽"(호) 및 "감염성 현상 매트릭스"(KH), 젊은 과학자 (SF와 KH) 및 학술 연구 (호에 대한 과학 연구 보조금에 의해 부분적으로 지원되었다 혁신 분야 교육부, 문화, 스포츠, 과학 및 일본의 기술에서 "세포내 물류"(호)에), 그리고 과학 연구.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| LB 한천 암피실린 - 100 | 시그마 | L5667 | |
| Cy3 모노 반응 염색약 | GE 헬스케어 | PA23001 | |
| 알렉사 형석 350 카르복실산, succinimidyl 에스테르 | Invitrogen | A10168 | |
| 흡입 마취 기구 | 시나 제작소 | SN - 487 | |
| 고정 및 Permeabilization 용액 | BD | 554,722 | |
| 안티 마우스 당단백질이 항독소 | MBL | D278 - 3 | 200 배 희석 (5μg/ml) |
| 염소 방지 쥐 IgG, F (AB ') 2 조각 구체적인 | 잭슨 ImmunoResearch | 112-505-006 | 200 배 희석 (20μg/ml) |
| 알렉사 형석 633 Phalloidin | 분자 프로브 | A22284 | 50 배 희석 |
| 공촛점 레이저 현미경 스캐닝 | Leica 마이크로 시스템즈 | DMIRE2 | |
| DeltaVision 복구 deconvolution 현미경 | 응용 정밀 | DeltaVision 코어 |
참고문헌
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유