Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application d'une souris ligaturés Assay Peyer Patch anse intestinale pour évaluer absorption par les cellules bactériennes M
Dans cet article
Résumé
Cellules M spécialisées dans un follicule associée épithélium couvrant les plaques de Peyer jouer un rôle important pour l'immunosurveillance des muqueuses dans l'intestin du tissu lymphoïde associé. Ici, nous avons décrit la méthode d'évaluation de transcytose bactérienne par les cellules M In vivo. Cette méthode fournit une méthode pour comprendre la fonction des cellules M dans le système immunitaire.
Résumé
L'intérieur de notre intestin est habité avec un nombre énorme de bactéries commensales. La surface de la muqueuse du tractus gastro-intestinal est continuellement exposé à eux et occasionnellement à des agents pathogènes. Le tissu lymphoïde associé intestin (GALT) jouent un rôle clé pour l'induction de la réponse immunitaire muqueuse de ces microbes 1, 2. Pour initier la réponse immunitaire muqueuse, les antigènes des muqueuses doivent être transportés de la lumière intestinale à travers la barrière épithéliale dans les follicules lymphoïdes organisés tels que les plaques de Peyer. Cette transcytose antigène est médiée par des cellules spécialisées épithéliales M 3, 4. Cellules M sont atypiques des cellules épithéliales qui ont activement phagocyter macromolécules et les microbes. Contrairement aux cellules dendritiques (CD) et les macrophages, les antigènes cibles pour la dégradation des lysosomes, les cellules M transcytose essentiellement des antigènes internalisés. Cette transcytose macromoléculaires vigoureuse à travers les cellules M délivre antigène aux sous-jacente a organisé une follicules lymphoïdesD est considérée comme essentielle pour initier antigène spécifique la réponse immunitaire muqueuse. Cependant, les mécanismes moléculaires favorisant cette absorption d'antigène par les cellules M sont largement inconnus. Nous avons précédemment rapporté que la glycoprotéine 2 (GP2), spécifiquement exprimé sur la membrane plasmique apicale des cellules M des entérocytes, sert de récepteur transcytotiques pour un sous-ensemble de commensaux et entérobactéries pathogènes, dont Escherichia coli et Salmonella enterica sérotype Typhimurium (S. Typhimurium ), en reconnaissant FimH, un composant de type I pili sur la membrane bactérienne externe 5. Ici, nous présentons une méthode pour l'application de doser un Peyer souris correctif anse intestinale afin d'évaluer l'absorption par les cellules bactériennes M. Cette méthode est une version améliorée du test en boucle intestinale de souris précédemment décrites 6, 7. Les points sont améliorés comme suit: 1. L'isoflurane a été utilisé comme un agent anesthésique. 2. Environ 1 cm ligaturé y anse intestinalePatch ING Peyer a été mis en place. 3. Les bactéries absorbées par les cellules M ont été marquées par fluorescence par le réactif de marquage par fluorescence ou par surexpression de la protéine fluorescente comme la protéine fluorescente verte (GFP). 4. Cellules M dans l'épithélium du follicule associée couvrant les plaques de Peyer ont été détectées par l'ensemble de montage immunostainig avec Gp2 anticorps anti. 5. Fluorescent transcytose bactérienne par les cellules M ont été observées par l'analyse microscopique confocale. Le dosage de Peyer souris correctif anse intestinale pourrait fournir la réponse quel genre de bactéries pathogènes ou commensales transcytosed par les cellules M, et peut nous amener à comprendre le mécanisme moléculaire de la façon de stimuler le système immunitaire muqueux à travers les cellules M.
Protocole
1. Préparation des cellules bactériennes
- Glycérol Streak stockés bactéries fluorescentes (GFP, comme exprimant S. Typhimurium) sur une plaque de gélose LB contenant 100 ug / ml d'ampicilline.
- Culture d'une seule colonie d'agar LB nuit dans 2 ml de milieu LB nouvelles.
- Ajouter 0,5 ml de culture bactérienne à 4,5 ml de milieu LB et incuber de nouvelles jusqu'à ce densité optique de 1,0 à 600 nm est atteint.
- Récolte des cellules bactériennes par centrifugation (3000 xg, 5 min, 4 ° C).
- Jeter le surnageant et laver deux fois avec 5,0 ml de solution stérile tampon phosphate salin (PBS).
- Resuspendre culot bactérien avec 5 ml de PBS, et utiliser 50 pl de la suspension contenant environ 10 7 unités formant colonie (UFC) que l'inoculum.
- En cas d'utilisation de bactéries marquées par fluorescence, les cellules bactériennes ont été marqués par réactif de marquage par fluorescence selon le protocole standard.
2. Unenesthesia
- Remplissez un petite boîte en plastique (10 x 10 x 5 cm) avec 5% (v / v) vaporisé isoflurane mélangé à l'air (débit: 200 ml / min).
- Anesthetize de huit à seize faibles, âgé de souris mâles ou femelles dans la boîte.
- Déplacez la souris à une table d'autopsie après l'anesthésie.
- Continuellement anesthésier la souris de 2% (v / v) vaporisé isoflurane mélangé à l'air (débit: 200 ml / min) (figure 1). Ceci est une procédure terminale.
3. Ligaturé Peyer de dosage de patch en boucle
- Inciser 1cm de la peau abdominale, puis couper le péritoine abdominal d'une souris anesthésiée et de prendre le petit intestin contenant plaques de Peyer.
- Ligaturer l'intestin avec un fil à coudre, en prenant soin d'éviter les vaisseaux sanguins. Remarque: ne lient d'un côté de l'intestin, et laissez l'autre côté lâche.
- Injecter 50 ul de suspension bactérienne ou PBS (contrôle) avec une seringue dans la boucle de patch ligaturé Peyer sur la s lâcheside de l'intestin (figure 2).
- Bind côté lâche, et fermer l'abdomen de la souris avec un clip.
- Après 1 h, retirez la boucle de patch ligaturé Peyer, et euthanasier la souris par dislocation cervicale.
- Peyer accise du correctif de la boucle de plaques de Peyer ligaturé.
- Flasher le côté apical des plaques de Peyer par 1ml de PBS avec l'aide de la seringue attachée à une aiguille pour enlever l'excès de liquide muqueux et les bactéries. Clignotant plaques de Peyer deux autres fois.
4. Coloration monter ensemble et une analyse microscopique confocale d'plaques de Peyer
- Fixer les plaques de Peyer de BD Cytofix / Cytoperm solution sur la glace pendant 1 heure.
- Laver les plaques de Peyer trois fois avec 1ml de BD Perm / Wash buffer pendant 5 min, puis bloquer avec 1 ml de tampon de blocage contenant 0,1% (p / v) de saponine, de 0,2% (p / v) de BSA dans du PBS pendant 30 min sur glace.
- Ajouter 200 fois diluée anti-souris GP2 anticorps monoclonal (5 pg / ml) à l'échantillon pour détecterCellules M.
- Incuber pendant 2 heures à température ambiante ou une nuit à 4 ° C.
- Laver trois fois avec 1 ml de PBS froid, puis ajouter 200 fois diluée anti-rat IgG conjugué avec DyLight549 (20 pg / ml) à l'échantillon.
- Incuber l'échantillon sur la glace pendant 2 heures.
- Laver trois fois avec 1 ml de PBS froid, puis ajouter 50 fois diluée Alexa 633 phalloïdine conjugué à l'échantillon pour détecter la F-actine.
- Incuber sur la glace pendant 2 heures.
- Laver doucement avec 1 ml de PBS froid. Ensuite lieu trois à quatre morceaux de verre couvercle circulaire sur une lame, et d'intégrer les spécimens dans une solution de 30% de glycérol dans du PBS sur la lame (figure 3).
- Observez les échantillons avec un microscope DM-IRE2 confocale à balayage laser ou un microscope déconvolution DeltaVision Restauration.
5. Les résultats représentatifs:
L'exemple spécimen d'une souris ligaturé test de Peyer correctif boucle avec GFP-S. Typhityphimurium a été observée avec un microscope DeltaVision déconvolution Restauration (figure 4). GFP-S. Typhimurium est transcytosed par GP2 cellules M +. Un dosage de Peyer souris correctif anse intestinale peut identifier le type de bactéries commensales ou pathogènes qui peuvent être transcytosed par les cellules M.

Figure 1. Anesthésie de souris sous condition isoflurane vaporisé. Vaporisé isoflurane a été fourni par un appareil d'anesthésie-dédié (côté gauche).
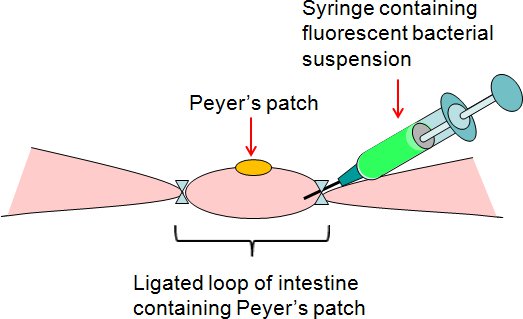
Figure 2. Résumé du dosage de Peyer ligaturé correctif anse intestinale. La suspension bactérienne fluorescente a été injectée par seringue dans la boucle de patch ligaturé Peyer sur le côté lâche de l'intestin.
Figure 3. Mont des spécimens. Les spécimens ont été intégrés dans une solution à 30% de glycérol dans du PBS sur une lame spéciale dans laquelle une plaque de plastique perforé (1mm d'épaisseur) a été lié par agent adhésif sur une lame de verre.
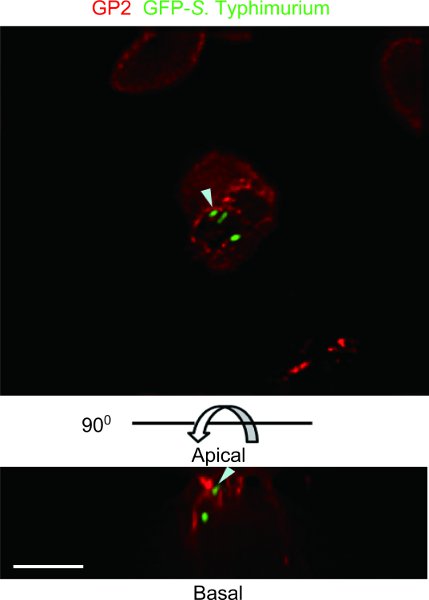
Figure 4. Exemple d'une souris ligaturé test de Peyer correctif boucle avec GFP-S. Typhimurium. GP2, qui est signalé comme marqueur de cellule spécifique M 5, a été coloré avec des anticorps anti-souris GP2 (rouge). Le spécimen a été observé avec un microscope DeltaVision déconvolution Restauration. Exprimant la GFP S. Typhimurium a été co-localisé avec GP2 sur la membrane plasmique apicale des cellules M et dans les vésicules cytoplasmiques subapicale (flèches). Haut, vue apicale. Fond et les côtés, des vues latérales. Barre d'échelle: 10 um.
Discussion
Le temps d'incubation du patch ligaturé Peyer avec suspension bactérienne est habituellement pendant 1 heure pour observer l'incorporation dans les cellules bactériennes M. Dans le cas de 4 h d'incubation, les bactéries sont souvent détectées dans la zone de cellules T des plaques de Peyer. Comme l'anesthésie par inhalation d'isoflurane vaporisée pourrait garder les souris stable, le temps d'incubation de plaques de Peyer ligaturé avec suspension bactérienne est extensible à obse...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier tous les membres de la BEI pour développer cette technique. Cette recherche a été financée en partie par Grant-in-Aid pour la recherche scientifique sur les domaines prioritaires "Trafic membranaire» (HO), et «Matrice des phénomènes infectieux" (KH), les jeunes scientifiques (SF et KH), et de la Recherche Scientifique (HO ), et de la recherche scientifique sur les domaines innovants "Logistique intracellulaire" (HO), du ministère de l'Éducation, Culture, Sports, Science et Technologie du Japon.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| LB Agar à l'ampicilline 100 | SIGMA | L5667 | |
| Cy3 mono-réactive Dye pack | GE Healthcare | PA23001 | |
| Alexa Fluor 350 d'acides carboxyliques, succinimidyl ester | Invitrogen | A10168 | |
| L'anesthésie par inhalation un appareil | Shinano Seisakusho | SN-487 | |
| Fixation et Perméabilisation Solution | BD | 554722 | |
| Souris anti Glycoprotéine 2 d'anticorps | MBL | D278-3 | 200-dilution (5μg/ml) |
| Chèvre anti-IgG de rat, F (ab ') 2 fragment de spécifiques | Jackson ImmunoResearch | 112-505-006 | 200-dilution (20μg/ml) |
| Alexa Fluor 633 Phalloïdine | Molecular Probes | A22284 | 50-dilution |
| Confocale au laser microscope à balayage | Leica Microsystems | DMIRE2 | |
| DeltaVision Restauration déconvolution microscope | Applied Precision | DeltaVision base |
Références
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon